文章信息
- 石晓倩, 申长卫, 刘慧冉, 李岩, 谢昶琰, 杨晗, 徐阳春, 董彩霞
- SHI Xiaoqian, SHEN Changwei, LIU Huiran, LI Yan, XIE Changyan, YANG Han, XU Yangchun, DONG Caixia
- ‘黄冠梨’钾转运体基因PbKT8的克隆与表达分析
- Cloning and expression analysis of potassium transporter gene PbKT8 in 'Huangguan'pear
- 南京农业大学学报, 2019, 42(4): 706-712
- Journal of Nanjing Agricultural University, 2019, 42(4): 706-712.
- http://dx.doi.org/10.7685/jnau.201812039
-
文章历史
- 收稿日期: 2018-12-24
2. 河南科技学院资源与环境学院, 河南 新乡 453003
2. School of Resources and Environmental Sciences, Henan Institute of Science and Technology, Xinxiang 453003, China
钾离子(K+)是植物体内含量最丰富的阳离子[1], 广泛分布于各组织和器官, 约占植物干质量的2%~10%, 被称为“品质元素”[2]。施钾可以促进叶柄和果柄的发育, 增强叶片和果实中养分和糖的分配[3-4]。植物重要的生理过程, 如光合作用、光呼吸等, 均受到钾素的影响[5-6]。植物对于钾素的吸收主要依赖体内2种不同类型的钾吸收系统, 分别是在低钾浓度下起作用的“高亲和性钾吸收系统”和高钾浓度下起作用的“低亲和性钾吸收系统”[7]。根据钾离子转运体功能和结构, 将其分为4个亚家族:KUP/HAK/KT家族、Trk/HKT家族、KEA家族和CHX家族, 其中, KUP/HAK/KT家族是最早被发现的钾转运蛋白家族, 被认为在介导植物内钾的积累及维持植物生长发育方面尤为重要[8-10]。迄今为止, 对KUP/HAK/KT家族研究比较透彻的模式作物为拟南芥, 有13个家族成员已被鉴定[11]。在水稻[12]和玉米[13]中也分别分离到27个KUP/HAK/KT家族基因。各家族成员在介导植物体内钾转运等各个方面发挥着重要的钾营养生理功能[14]。如拟南芥AtKUP6参与渗透胁迫的响应[15], AtKUP2、AtKUP4介导根部吸收的K+向地上部转运或分配[16-17]。
目前, 关于钾素对果实的影响主要集中在生理方面的研究, 而果实中关于响应钾离子吸收分子机制的报道较少。已有研究表明在‘砀山酥梨’中PbKUP/HAK/KT家族参与果实发育[18]。‘黄冠梨’是中熟品种, 广泛种植于河北、河南和山东等地区。由于其产量高、抗虫性好、食用品质优良, ‘黄冠梨’在梨中占有优势地位[19]。本课题组通过高通量测序从‘黄冠梨’中发现在果实成熟期叶片和果实中强烈响应钾素胁迫的差异表达基因KUP/HAK/KT8(以下简称PbKT8, 登录号为:LOC103963935)[3], 该基因与拟南芥AtKUP/HAK/KT8同源性较高。我们从‘黄冠梨’果实中克隆得到PbKT8基因, 通过对其基因特征、蛋白结构预测和亚细胞定位及酵母异源表达, 对该基因进行初步分析, 为揭示梨树对K+的吸收和转运机制提供理论依据。
1 材料与方法 1.1 试验材料及处理供试材料为7年生长势基本一致的‘黄冠梨’树, 砧木为杜梨, 试验地为南京农业大学牌楼科研教学基地(32°02′N和118°86′E), 种植于塑料盆(上直径42 cm, 下直径38 cm, 高42 cm)中, 每个处理15棵树, 1次重复为5棵树。试验设置3个处理:K0处理, 不施K2O; K0.4处理, 每千克土施0.4 g K2O; K0.8处理, 每千克土施0.8 g K2O。硫酸钾(含51% K2O)分3次施入:基肥20%, 于花芽萌动期施40%, 于膨大一期施40%。在成熟期(花后129 d)采集果实和叶片样品, 每棵树采集8片叶片和4个果实, 贮存于-70 ℃冰箱备用。
1.2 PbKT8基因的克隆与载体构建‘黄冠梨’叶片和果实总RNA提取采用RNA Prep Pure Plant Kit试剂盒(TIANGEN), 通过NCBI数据库对PbKT8基因进行搜索, 得到PbKT8基因的全长序列, 根据序列设计特异引物(表 1)。采用反转录试剂盒(GodenstarTM RT6 cDNA Synthesis Mix)将检验合格后的样品反转录成cDNA, -20 ℃保存备用。PCR反应体系:10 μL 2×Phanta Max Buffer, 0.5 μL dNTP Mi, 0.5 μL Phanta Max Super-Fidelity DNA Polymerase高保真聚合酶, 正、反向引物各1 μL, 模版cDNA 1 μL, ddH2O补至20 μL。反应程序:95 ℃ 3 min; 95 ℃ 15 s, 56 ℃ 15 s, 72 ℃ 2 min, 共35个循环; 72 ℃ 5 min。特异性RT-PCR产物回收, 连接至pEASY Trans1-T1载体上(全式金, 北京), 转化大肠杆菌感受态细胞, 挑选阳性克隆进行测序验证[20]。
| 引物Primer | 序列(5'→3')Sequence | 用途Usage |
| PbKT8-F/R | ATGGATCTGGAGGGTGTGAT/TTATACGTGGTAGACCATCCC | PbKT8基因克隆Cloning of PbKT8 gene |
| PbKT8C-F/R | TCAGATCTCGAGCTCAAGCTTGGATGGATCTGGAGGGTGTGAT/ GACTCTAGACTAGGTGGATCCTTATACGTGGTAGACCATCCC |
亚细胞定位Subcellular localization |
| PbKT8N-F/R | AGAGATCTCGAGCTCAAGCTTATGGATCTGGAGGGTGTGAT/ CCTTGCTCACCATCAGGATCCGTACGTGGTAGACCATCCC |
亚细胞定位Subcellular localization |
| PbKT8-2288-F/R | ACCACCCATAATACCCATAAACCGGTCAACATGTGGAGCA/ GCGATGGCAAACAGCTATTATGCGTCACTGGATTTTGGTTT |
亚细胞定位Subcellular localization |
| qRT-F/R | TCCGCAGCCATCCAATCAAGAA/CAGCGTCAGCGTCCAGAACA | PbKT8实时荧光定量PCR qRT-PCR of PbKT8 |
| Actin-F/R | CTCCCAGGGCTGTGTTTCCTA/CTCCATGTCATCCCAGTTGCT | 实时荧光定量内参基因Reference gene in qRT-PCR |
| pYES2-KT8-F/R | ACTATAGGGAATATTAAGCTTATGGATCTGGAGGGTGTGAT/ AGTGGATCCG AGCTCGGTACCTTATACGTGGTAGACCATCCC |
酵母表达载体构建pYES2 expression |
使用MEGA 5.0软件对来自11个物种的KT8同源氨基酸序列构建系统进化树, 校验参数BootStrap设定为1 000, 进一步使用DNAMAN 5.0软件中的多重比对功能对蔷薇科植物的氨基酸序列进行多重比对, 其他参数保持不变。
1.4 PbKT8基因的亚细胞定位对测序正确的pEASY-KT8阳性克隆提取质粒, 经HindⅢ和BamHⅠ双酶切后连接到具有相同酶切位点的中间载体pSAT6A-EGFP-C1和pSAT6A-EGFP-N1中, 利用同源重组技术将获得的重组阳性克隆经PI-PstⅠ(NEB公司)单酶切后连接到最终表达载体pRCS2上, 挑取阳性单克隆进行测序验证。采用电击法将验证正确的表达载体进行农杆菌转化, 以35S为对照, 通过农杆菌侵染法对烟草叶片进行侵染, 使其进入细胞内部, 避光培养2~3 d后于激光共聚焦下观察并拍照。
1.5 PbKT8基因酵母异源回补试验对pEASY-KT8进行质粒提取, 质粒经PCR扩增后利用同源重组技术将目的基因连接到具有HindⅢ和KpnⅠ双酶切位点的表达载体pYES2中, 利用R5421酵母突变体作为感受态细胞, 将含有PbKT8基因的转化子和空载酵母菌株在K+浓度分别为0.05、0.1、0.5、1、5、10、20和50 mmol · L-1的酵母AP培养基上培养, 稀释菌液倍数分别为1、10、100和1 000倍, 于29 ℃暗培养3~5 d后拍照观察。
1.6 PbKT8基因的表达测定与分析通过RT-qPCR分析PbKT8基因在不同钾水平处理(K0、K0.4、K0.8)下‘黄冠梨’叶片和果实中的表达特性。使用Step One Plus荧光定量仪, 采用TransStart® Tip Green qPCR Super Mix试剂盒进行RT-qPCR。反应体系:正、反引物各0.4 μL, 2×TransStart® Tip Green qPCR Super Mix 10 μL, Passive Reference Dye 0.4 μL, ddH2O补齐20 μL。反应条件:94 ℃ 30 s; 94 ℃ 5 s, 60 ℃ 30 s, 共40个循环。梨Actin作为内参基因, 每个样品3次重复, 采用2-ΔΔCT法[20]分析基因表达量。
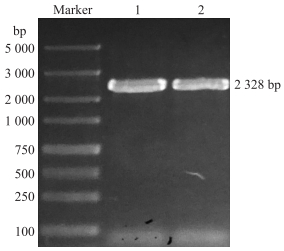
2 结果与分析 2.1 ‘黄冠梨’果实中PbKT8基因的克隆与理化性质分析克隆的‘黄冠梨’PbKT8基因测序与NCBI数据库搜索得到的白梨(Potassium transporter 8-like)序列结果一致, 全长为2 328 bp(图 1), 编码775个氨基酸。通过Expasy网站(http://web.expasy.org/protparam/)在线分析PbKT8蛋白的相对分子质量为86 945.80, 理论等电点(pI)为8.33。负电荷的氨基酸残基数(Asp+Glu)为68, 正电荷的氨基酸残基数(Arg+Lys)为73。该蛋白质的不稳定系数为40.18, 归为不稳定蛋白; 脂溶指数为104.97, 平均亲水系数为0.330。通过在线软件TMHMM分析PbKT8蛋白跨膜结构域(图 2), 符合钾转运蛋白KUP/HAK/KT家族的跨膜结构特性。
|
图 1 PbKT8基因在‘黄冠梨’果实中的扩增结果 Fig. 1 The PCR product of PbKT8 gene in'Huangguan'pear 1, 2. PbKT8基因PCR产物The PCR production of PbKT8 gene. |

|
图 2 PbKT8蛋白跨膜结构域预测 Fig. 2 Prediction of transmembrane structures of PbKT8 protein |
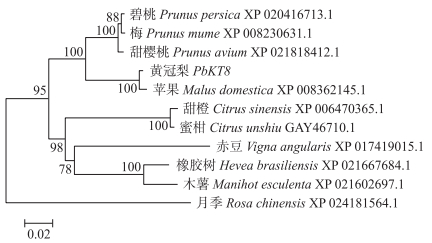
对‘黄冠梨’PbKT8基因编码蛋白和同源物种的氨基酸序列进行比对, 碧桃(Prunus persica)、梅(Prunus mume)、甜樱桃(Prunus avium)、苹果(Malus domestica)、甜橙(Citrus sinensis)、蜜柑(Citrus unshiu)、赤豆(Vigna angularis)、橡胶树(Hevea brasiliensis)、木薯(Manihot esculenta)、月季(Rosa chinensis)与PbKT8蛋白的氨基酸序列相似性分别为93.03%、92.90%、93.29%、99.10%、84.65%、84.77%、83.48%、85.81%、85.03%和90.72%(图 3), 表明从‘黄冠梨’果实中克隆得到的PbKT8基因所编码的蛋白与其他物种的KT8蛋白具有较高的保守性。其中, 梨与苹果均为蔷薇科植物, 进化关系最相近, 同源序列相似性高达99.10%;碧桃、梅、樱桃等也属蔷薇科植物, 进化关系也比较接近(图 4)。
|
图 3 PbKT8与其他植物KT8氨基酸序列进化分析 Fig. 3 Phylogenetic analysis of amino acid sequences encoded by PbKT8 and other plants KT8 |

|
图 4 PbKT8与其他植物KT8蛋白同源序列比对 Fig. 4 Comparison of homology between PbKT8 and other plant KT8 protein |
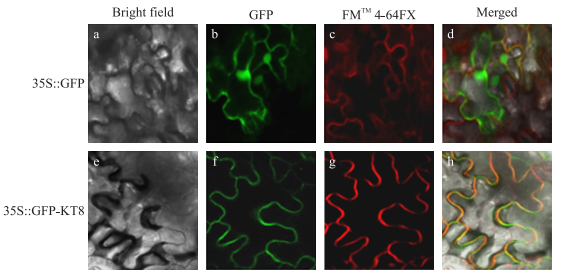
为验证基因定位特征, 将构建成功的含GFP表达载体的农杆菌注射到烟草叶片表皮细胞, 观察GFP表达情况。结果(图 5)显示:FMTM4-64FX为质膜特异性染料, 在激发光下呈现红色, PbKT8-GFP融合蛋白在质膜上呈明显的绿色荧光, 说明PbKT8基因在质膜上发挥作用。
|
图 5 PbKT8蛋白的亚细胞定位 Fig. 5 Subcellular localization of PbKT8 protion a, e.明场图片Bright field images; b, f. GFP荧光图片GFP fluorescence green images; c, g. FMTM4-64FX(质膜特异性定位染料)染色图片FMTM4-64FX dye (red) images(FMTM4-64FX is a membrane-selective fluorescent vital dye); d, h. GFP和FMTM4-64FX重叠图片Superposition of the GFP and FMTM4-64FX fluorescence images. |
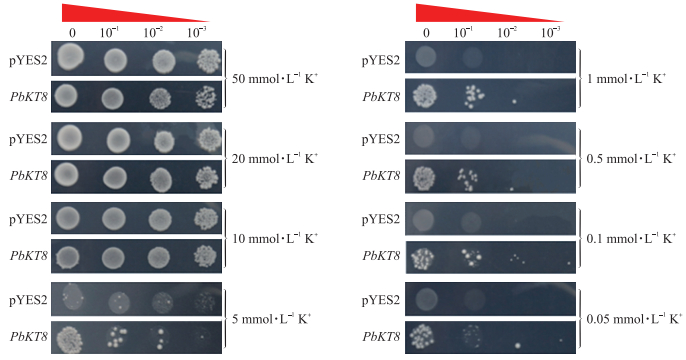
酵母异源回补试验结果(图 6)显示, 当K+浓度在10~50 mmol · L-1时, 空载菌株和PbKT 8 转化子长势基本一致, 随着K+浓度降低, 长势逐渐减弱。在5 mmol · L-1的K+浓度下, PbKT 8 酵母转化子长势明显优于空载, K+浓度低于5 mmol · L-1时, 酵母空载转化子几乎停止生长, PbKT 8 酵母转化子长势虽然受到抑制, 但仍然可以生长。酵母异源回补试验结果表明:PbKT8能够恢复K+吸收缺陷型酵母突变体在低钾培养基的生长。
|
图 6 PbKT8蛋白对K+吸收缺陷型酵母菌株R5421的回补作用 Fig. 6 Functional complementation test of PbKT8 in yeast R5421 for absorbing K+ from culture medium containing different levels of K+ |
由图 7可知:在果实成熟期, PbKT8基因在叶片和果实中均有表达, 叶片表达量相对于果实总体较高, 表明PbKT8基因在不同器官中具有表达特异性; 随着施钾量的增加, PbKT8基因的相对表达量也上调。
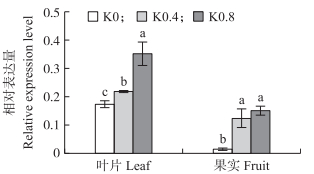
|
图 7 不同钾水平处理下PbKT8基因在‘黄冠梨’叶片和果实中的相对表达量
Fig. 7 The relative expression of PbKT8 gene in leaf and fruit of'Huangguan'pear under different potassium levels
1)K0:不施K2O No applied fertilize of K2O; K0.4:每千克土施0.4 g K2O Treatment with 0.4 g K2O of 1 kg soil; K0.8:每千克土施0.8 g K2O Treatment with 0.8 g K2O of 1 kg soil. 2)不同小写字母表示处理间在0.05水平差异显著。The different letters in the same column indicate significant difference among treatments at 0.05 level. |
梨是我国栽培面积及产量较大的水果, 而果园中钾肥对果树生长发育、果实风味品质和产量密切相关[19]。已有报道证明施钾肥促进‘黄冠梨’果实中SPS1、SUS、SUT基因显著上调[3]。因此, 提高植物自身的钾营养效率是解决作物生产中钾资源短缺的重要途径之一。
在植物体内钾转运体KT/HAK/KUP家族在响应低钾胁迫中发挥重要作用, 对于维持植物体内阳离子动态平衡具有重要意义[21]。目前, 利用分子生物学手段在模式作物拟南芥中已经明确了植物中KT/HAK/KUP钾转运体基因的功能。例如:吸收动力学研究表明AtKUP1介导拟南芥根部对K+的吸收[22]; 拟南芥突变体遗传研究表明, AtHAK5在控制根毛区伸长和细胞扩增方面起重要作用, 介导根部吸收K+向地上部转运[23]。然而, 在果实中关于钾转运体KT/HAK/KUP家族基因研究较少。目前已知桃钾转运体KT/HAK/KUP家族基因在‘霞脆桃’果实发育成熟不同时期的表达水平存在显著差异, 如:PpeKUP1基因在‘霞脆桃’果实发育初期至硬核期的表达量极高, PpeKUP7基因在‘霞脆桃’果实中表达量极低, 但对喷施钾肥较为敏感[24]。本试验通过qRT-PCR分析在‘黄冠梨’果实成熟期PbKT8基因表达特征, 发现在果实成熟期该基因在果实和叶片中的表达量随施钾量增加而上升, 为钾素响应基因。
为进一步研究PbKT8基因的功能, 本试验从‘黄冠梨’果实中对其进行克隆, 其生物信息学分析显示PbKT8基因与同为蔷薇科的苹果同源序列相似性高达99.10%, 基因具有13个跨膜结构域, 符合KT/HAK/KUP家族跨膜结构特征[9], 说明该基因在进化过程中具有较高的保守性。植物对K+的吸收主要通过细胞上的载体和能量, 已有结果显示大部分钾转运体蛋白定位于质膜, 参与钾素的吸收, 如拟南芥AtKUP6及水稻OsHAK1、OsHAK5[15, 25-26]。本研究以烟草叶片表皮细胞为材料证实PbKT8蛋白定位于质膜。基因的功能往往与其表达部位有关, 因此推测该基因在细胞膜上发挥钾离子的吸收与转运功能。R5421酵母突变体菌株为钾素缺陷型菌株, 其在缺少该营养的培养基上不能生长, 可用来验证基因在钾营养转运与吸收方面的功能[27]。已证实AtKUP1在高、低供钾条件下均可介导酵母和拟南芥悬浮细胞的K+吸收[22], 水稻OsHAK1、OsHAK5等基因也在酵母突变体中得到验证[25-26]。本研究将外源基因PbKT8转入R5421酵母突变体菌株, 试验结果显示在缺钾的培养基中PbKT8基因可恢复突变体菌株的生长, 表明其具有获取利用钾素的能力, 预示该基因可能在梨中发挥类似的功能。
| [1] |
李廷强, 王昌全. 植物钾素营养研究进展[J]. 四川农业大学学报, 2001, 19(3): 281-285. Li T Q, Wang C Q. Advances in plant potassium nutrition[J]. Journal of Sichuan Agricultural University, 2001, 19(3): 281-285 (in Chinese with English abstract). DOI:10.3969/j.issn.1000-2650.2001.03.025 |
| [2] |
Pettigrew W T. Potassium influences on yield and quality production for maize, wheat, soybean and cotton[J]. Physiologia Plantarum, 2008, 133: 670-681. DOI:10.1111/ppl.2008.133.issue-4 |
| [3] |
Shen C W, Wang J, Shi X Q, et al. Transcriptome analysis of differentially expressed genes induced by low and high potassium levels provides insight into fruit sugar metabolism of pear[J]. Frontiers in Plant Science, 2017, 8: 938. DOI:10.3389/fpls.2017.00938 |
| [4] |
王英珍, 张虎平, 黄小三, 等. 钾在梨树内的分配及对梨树生长和叶片光合能力的影响[J]. 南京农业大学学报, 2017, 40(1): 60-67. Wang Y Z, Zhang H P, Huang X S, et al. Effect of potassium supply on plant potassium distribution and growth and leaf photosynthetic capacity of Pyrus pyrifolia[J]. Journal of Nanjing Agricultural University, 2017, 40(1): 60-67 (in Chinese with English abstract). DOI:10.7685/jnau.201603054 |
| [5] |
Gattward J N, Almeida A A F, Souza J O, et al. Sodium-potassium synergism in Theobroma cacao:stimulation of photosynthesis, wateruse efficiency and mineral nutrition[J]. Physiologia Plantarum, 2012, 146: 350-362. DOI:10.1111/ppl.2012.146.issue-3 |
| [6] |
Grabov A. Plant KT/KUP/HAK potassium transporters:single family-multiple functions[J]. Annals of Botany, 2007, 99: 1035-1041. DOI:10.1093/aob/mcm066 |
| [7] |
Epstein E, Rains D W, Elzam O E. Resolution of dual mechanisms of potassium absorption by barley roots[J]. Proc Natl Acad Sci USA, 1963, 49: 684-692. DOI:10.1073/pnas.49.5.684 |
| [8] |
Li W H, Xu G H, Abdel A, et al. Plant HAK/KUP/KT K+transporters:function and regulation[J]. Seminars in Cell & Developmental Biology, 2018, 74: 133-141. |
| [9] |
Wang Y, Wu W H. Genetic approaches for improvement of the crop potassium acquisition and utilization efficiency[J]. Curr Opin Plant Biol, 2015, 25: 46-52. DOI:10.1016/j.pbi.2015.04.007 |
| [10] |
Véry A A, Sentenac H. Molecular mechanisms and regulation of K+transport in higher plants[J]. Annual Review of Plant Biology, 2003, 54: 575-603. DOI:10.1146/annurev.arplant.54.031902.134831 |
| [11] |
Rubio F, Santa-Maria G E, Rodriguez-Navarro A. Cloning of Arabidopsis and barley cDNAs encoding HAK potassium transporters in root and shoot cells[J]. Physiologia Plantarum, 2000, 109(1): 34-43. DOI:10.1034/j.1399-3054.2000.100106.x |
| [12] |
Gupta M, Qiu X H, Wang L, et al. KT/HAK/KUP potassium transporters gene family and their whole-life cycle expression profile in rice(Oryza sativa)[J]. Molecular Genetics and Genomics, 2008, 280(5): 437-452. DOI:10.1007/s00438-008-0377-7 |
| [13] |
Zhang Z, Zhang J, Chen Y, et al. Genome-wide analysis and identification of HAK potassium transporter gene family in maize(Zea mays L.)[J]. Molecular Biology Reports, 2012, 39(8): 8465-8473. DOI:10.1007/s11033-012-1700-2 |
| [14] |
Wang Y, Wu W H. Regulation of potassium transport and signaling in plants[J]. Current Opinion in Plant Biology, 2017, 39: 123-128. DOI:10.1016/j.pbi.2017.06.006 |
| [15] |
Osakabe Y, Arinaga N, Umezawa T, et al. Osmotic stress responses and plant growth controlled by potassium transporters in Arabidopsis[J]. The Plant Cell, 2013, 25(2): 609-624. DOI:10.1105/tpc.112.105700 |
| [16] |
Elumalai R P, Nagpal P, Reed J W. A mutation in the Arabidopsis KT2/KUP2 potassium transporter gene affects shoot cell expansion[J]. The Plant Cell, 2002, 14: 119-131. DOI:10.1105/tpc.010322 |
| [17] |
Lebaudy A, Véry A A, Sentenac H. K+channel activity in plants:genes, regulations and functions[J]. FEBS Letters, 2007, 581(12): 2357-2366. DOI:10.1016/j.febslet.2007.03.058 |
| [18] |
Wang Y G, Lü J H, Chen D, et al. Genome-wide identification, evolution, and expression analysis of the KT/HAK/KUP family in pear[J]. NRC Research Press, 2018, 61: 755-765. |
| [19] |
武晓, 申长卫, 丁易飞, 等. '黄冠梨'果实和叶片钾素积累特征及其对施钾的响应[J]. 植物营养与肥料学报, 2016, 22(5): 1425-1432. Wu X, Shen C W, Ding Y F, et al. Potassium accumulation in 'Huangguan' pear fruits and leaves and their response to different potassium application[J]. Journal of Plant Nutrition and Fertilizers, 2016, 22(5): 1425-1432 (in Chinese with English abstract). |
| [20] |
金昕, 刘娜, 申长卫, 等. 杜梨IRT1基因的克隆及表达分析[J]. 农业生物技术学报, 2017, 25(5): 739-749. Jin X, Liu N, Shen C W, et al. Cloning and expression analysis of IRT1 gene in Pyrus betulaefolia[J]. Journal of Agricultural Biotechnology, 2017, 25(5): 739-749 (in Chinese with English abstract). |
| [21] |
陈光, 高振宇, 徐国华, 等. 植物响应缺钾胁迫的机制及提高钾利用效率的策略[J]. 植物学报, 2017, 52(1): 89-101. Chen G, Gao Z Y, Xu G H, et al. Adaption of plants to potassium deficiency and strategies to improve potassium use efficiency[J]. Chinese Bulletin of Botany, 2017, 52(1): 89-101 (in Chinese with English abstract). |
| [22] |
Fu H H, Sheng L. AtKUP1:a dual-affinity K+ transporter from Arabidopsis[J]. The Plant Cell, 1998, 10(1): 63-73. |
| [23] |
Qi Z, Hampton C R, Shin R, et al. The high affinity K+transporter AtHAK5 plays a physiological role in planta at very low K+ concentrations and provides a caesium uptake pathway in Arabidopsis[J]. Journal of Experimental Botany, 2008, 59(3): 595-607. DOI:10.1093/jxb/erm330 |
| [24] |
宋志忠, 许建兰, 张斌斌, 等. 叶面喷施钾肥对霞脆桃果实品质及KUP基因表达的影响[J]. 江苏农业学报, 2018, 34(5): 1107-1112. Song Z Z, Xu J L, Zhang B B, et al. Effect of foliar spraying of potassium fertilizer on Xiacui peach quality and expression of KUP transporter family genes[J]. Jiangsu Journal of Agricultural Sciences, 2018, 34(5): 1107-1112 (in Chinese with English abstract). DOI:10.3969/j.issn.1000-4440.2018.05.020 |
| [25] |
Chen G, Hu Q D, Luo L, et al. Rice potassium transporter OsHAK1 is essential for maintaining potassium-mediated growth and functions in salt tolerance over low and high potassium concentration ranges[J]. Plant, Cell and Environment, 2015, 38(12): 2747-2765. DOI:10.1111/pce.12585 |
| [26] |
Yang T Y, Zhang S, Hu Y B, et al. The role of a potassium transporter OsHAK5 in potassium acquisition and transport from roots to shoots in rice at low potassium supply levels[J]. Plant Physiol, 2014, 166(2): 945-959. DOI:10.1104/pp.114.246520 |
| [27] |
Ko C H, Gaber R F. TRKI and TRK2 encode structurally related K+ transporters in Saccharomy cescerevisiae[J]. Molecular and Cellular Biology, 1991, 11(8): 4266-4273. DOI:10.1128/MCB.11.8.4266 |




