文章信息
- 李敏, 屈欢, 刘建利, 代秀秀, 司海丽, 张琇, 杨国平
- LI Min, QU Huan, LIU Jianli, DAI Xiuxiu, SI Haili, ZHANG Xiu, YANG Guoping
- 不动杆菌K7对酚酸类化合物的降解效能
- Degradation efficiency of Acinetobacter sp. K7 to the phenolic acids
- 南京农业大学学报, 2019, 42(4): 689-696
- Journal of Nanjing Agricultural University, 2019, 42(4): 689-696.
- http://dx.doi.org/10.7685/jnau.201809036
-
文章历史
- 收稿日期: 2018-09-22
2. 北方民族大学宁夏特殊生境微生物资源开发与利用重点实验室, 宁夏 银川 750021
2. Ningxia Key Laboratory of Microbial Resources Development and Applications in Special Environment, North Minzu University, Yinchuan 750021, China
近年来, 多种作物表现出的连作障碍问题是农业科学研究领域的热点。在连作障碍的众多成因中, 部分化感活性物质导致的作物自毒作用是主要因素之一[1-2]。化感自毒物质主要包括萜类和酚类。酚酸是一类苯环上带有活性羧基的有机酸, 是目前研究最多、活性较强的一类自毒物质[3-6]。
在农业生产实践中, 酚酸类化合物对次年作物生长和土壤活性具有破坏性的影响, 可造成作物品质下降、产量降低、病虫害频发等, 即导致连作障碍[7-10]。随着现代农业集约化的发展和土地资源的减少, 连作障碍已严重影响农田生态系统的可持续发展, 成为一个亟待解决的农业问题。在自毒作用导致的作物连作障碍治理领域, 与增施有机肥、无土栽培等方法相比, 接种有益微生物分解连作土壤中累积的化感自毒物质, 有利于农田生态系统的保护和农业的可持续发展[8], 有望成为一项经济有效的措施。
诸多报道以自然环境中多年连作土壤作为微生物来源, 采用酚酸类物质作为唯一碳源的培养基筛选得到多种可降解酚酸类化合物的菌株, 并对降解效率、底物广谱性等降解行为进行研究[4, 6, 8, 11]。然而, 已有研究多局限于1种微生物对个别酚酸类物质的降解行为探究, 未能充分考虑到自然界1种作物的根系土壤中, 往往是几种乃至十几种酚酸类物质共存, 也即对作物产生的毒害是多种酚酸共同作用的结果。因此, 挖掘可同时有效降解多种酚酸化合物的微生物, 对于酚酸类自毒物质的生物防治更具有现实意义。
1 材料与方法 1.1 材料与仪器咖啡酸、阿魏酸、肉桂酸、香草醛、香草酸、没食子酸、水杨酸、苯甲酸、香豆酸、丁香酸、4-羟基苯甲酸, 购自阿拉丁试剂(上海)有限公司, 均为分析纯(≥98%)。甲醇和乙酸均为色谱纯, 购自天津市大茂化学试剂厂。
采用美国Agilent 1200型高效液相色谱仪, HPLC-DAD分析系统, 二极管阵列检测器(DAD)为G1315B型。HPLC-MS分析系统采用岛津SHIMADZU 2010EV, 色谱柱:Agilent ZORBAX RX-C18(4.6 mm×150 mm, 5 μm)。
1.2 菌株筛选及鉴定采用含100 mg · L-1酚酸(苯甲酸、香豆酸、肉桂酸和咖啡酸)为唯一碳源的培养基[11]进行菌种筛选, 以宁夏中卫硒砂瓜种植区多年连作土壤为微生物来源, 菌种经多次纯化后甘油保存。采用扫描电镜观察菌株的细胞形态, 委托青岛科创检测有限公司完成电镜拍摄。采用16S rRNA基因序列分析法对菌株进行分子生物学鉴定。采用细菌基因组DNA提取试剂盒(唐为世纪生物科技有限公司)提取菌株总DNA, 采用通用引物27F(AGAGTTTGATCCTGGCTCAG)和1492R(GGTTACCTTGTTACGACTT)进行PCR扩增, 委托上海生工生物工程公司测序。测序结果提交到GenBank网站, 采用BLAST软件进行同源性比较, 采用MEGA 6.0软件构建系统进化树。
1.3 菌株K7降解酚酸的效能检测降解培养基:MgSO4 · 7H2O 0.15 g · L-1, CaCl2 · 6H2O 0.10 g · L-1, (NH4)2SO4 0.30 g · L-1, K2HPO4 · 3H2O 0.66 g · L-1, 酵母粉0.50 g · L-1, 酚酸0.10 g · L-1。降解培养基灭菌后加入无菌水制备的菌悬液, 控制降解培养基中菌初始浓度为(1~5)×107CFU · mL-1。放入30 ℃、150 r · min-1摇床培养, 定时取样测定降解液中菌密度(D600)和酚酸残留率。残留率=ct/c0×100%。式中:ct为t时刻酚酸浓度(mg · L-1); c0为初始酚酸浓度(mg · L-1)。
采用高效液相色谱串联DAD检测器检测降解体系中的酚酸化合物, 采用外标法进行定量。除肉桂酸外其他酚酸的液相色谱条件:流动相为甲醇和0.5%乙酸(体积比为50 : 50)的混合液, 流速0.5 mL · min-1, 进样量10 μL; 肉桂酸的色谱条件:流动相为甲醇和0.5%乙酸(体积比为80 : 20)的混合液, 其他条件不变。酚酸类化合物的检测波长及保留时间分别为:阿魏酸, 320 nm、4.136 min; 肉桂酸, 270 nm、3.812 min; 咖啡酸, 320 nm、3.478 min; 香草醛, 279 nm、3.892 min; 香草酸, 260 nm、3.559 min; 没食子酸, 273 nm、2.935 min; 水杨酸, 300 nm、5.830 min; 苯甲酸, 230 nm、5.682 min; 香豆酸, 306 nm、4.041 min; 丁香酸, 285 nm、3.520 min; 4-羟基苯甲酸, 211 nm、3.529 min。
1.4 不同降解条件下菌株K7降解咖啡酸的效能检测采用0.10 mol · L-1 HCl或NaOH调节降解液的初始pH值, 分别在降解液初始pH值为5、6、7、8、9和10的条件下, 于30 ℃考察不同初始pH值对菌株K7降解特性的影响; 在初始pH值为7的条件下, 设置温度分别为10、15、20、25、30、35、40、45和50 ℃, 考察不同温度对菌株K7降解特性的影响; 在初始pH7、培养温度为30 ℃条件下, 将降解液中咖啡酸浓度设置为0.1、1、10、100和500 mg · L-1, 考察不同初始酚酸浓度对菌株K7降解特性的影响。
1.5 HPLC-MS验证菌株K7降解咖啡酸的性能对典型降解条件(pH7、30 ℃、咖啡酸初始浓度100 mg · L-1)下的降解效能进行HPLC-MS分析。色谱条件采用二元高压梯度洗脱, 流动相A为甲醇, 流动相B为0.1%甲酸水溶液, 流速0.5 mL · min-1; 洗脱程序:0~8 min, 20%A; 8.01~30 min, 20%A线性过渡到100%A; 30.01~38 min, 20%A; 进样量10 μL。质谱主要参数为ESI电离源负离子模式, 接口(interface)温度250 ℃, 典型脱溶剂装置(CDL)温度230 ℃, 加热块(heat block)温度200 ℃, 雾化气1.5 L · min-1, 质荷比(m/z)扫描范围50~1 000。
2 结果与分析 2.1 酚酸类物质降解菌的筛选及鉴定分别以苯甲酸、香豆酸、肉桂酸和咖啡酸作为唯一碳源, 经多次筛选分离最终获得1株在4种酚酸筛选培养基平板上均长势良好的菌株, 命名为K7。该菌菌落呈白色微黄, 圆形, 边缘整齐, 表面光滑湿润; 扫描电镜结果(图 1)显示, 该菌呈杆状。经16S rRNA基因序列测定, 与NCBI数据库比对, 该菌为不动杆菌属(Acinetobacter sp.)细菌, GenBank登录号为MG732928。基于菌株K7基因序列构建的系统进化树(图 2)显示, 菌株K7与醋酸钙不动杆菌亲缘关系最近。

|
图 1 菌株K7扫描电镜图 Fig. 1 The scanning electron microscope image of strain K7 |

|
图 2 基于菌株K7构建的系统进化树 Fig. 2 Phylogenetic tree of strain K7 |
以连作土壤中检出频率高和化学分子结构式具有代表性为筛选依据, 选用11种酚酸化合物作为目标化合物, 其分子结构和CAS编号等信息如表 1所示。
| 项目Item | 苯甲酸 Benzoic acid |
香豆酸 Coumalic acid |
水杨酸 Salicylic acid |
4-羟基苯甲酸 4-hydroxybenzoic acid |
没食子酸 Gallic acid |
丁香酸 Syringic acid |
| CAS编号 CAS number |
65-85-0 | 500-05-0 | 69-72-7 | 99-96-7 | 149-91-7 | 530-57-4 |
| 分子结构 Molecular structure |
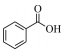 |
 |
 |
 |
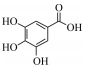 |
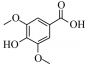 |
| 项目Item | 香草酸 Vanillic acid |
香草醛 Vanillic aldehyde |
肉桂酸 Cinnamic acid |
咖啡酸 Caffeic acid |
阿魏酸 Ferulic acid |
|
| CAS编号 CAS number |
121-34-6 | 121-33-5 | 140-10-3 | 331-39-5 | 537-98-4 | |
| 分子结构 Molecular structure |
 |
 |
 |
 |
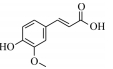 |
|
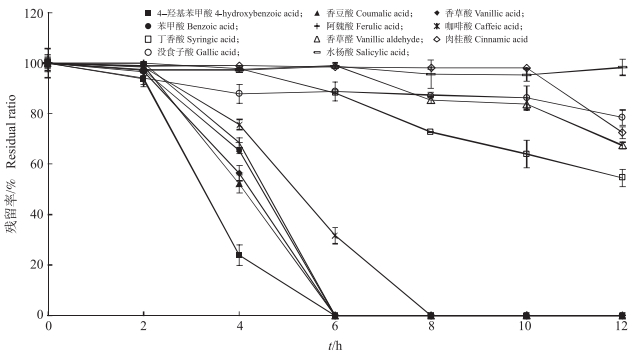
30 ℃、pH7条件下菌株K7对不同酚酸的降解效能如图 3所示。菌株K7可有效降解4-羟基苯甲酸、香豆酸、香草酸、苯甲酸、阿魏酸和咖啡酸, 前5种化合物在6 h内降解完全, 咖啡酸在8 h内降解完全。对菌体的生长情况(图 4)监测发现, 从降解伊始至酚酸类化合物母体完全降解之前, 降解体系中菌密度(D600)随降解时间的延长均呈上升趋势。降解体系中上述6种化合物的残留率与菌密度呈负相关关系。因此, 推测菌株K7在生长过程中可有效利用上述酚酸类化合物作为其新陈代谢的能源物质。
|
图 3 菌株K7对不同酚酸底物的降解效能 Fig. 3 The degradation efficiency of K7 strain to different phenolic acids |

|
图 4 菌株K7在不同酚酸底物降解体系中的生长情况 Fig. 4 The growth status of strain K7 in different phenolic acid substrates |
菌株K7对丁香酸、香草醛、肉桂酸及没食子酸转化利用速率较低, 降解12 h后残留率分别为54.52%、67.40%、72.44%和78.44%(图 3)。对比体系中菌株K7的生长情况(图 4)发现, 上述酚酸类化合物虽未降解完全, 但菌株K7的D600值仍呈上升趋势, 因此推测, 菌株K7对上述酚酸化合物的降解效能较弱。
菌株K7降解12、24 h后水杨酸的残留率分别为98.36%、98.52%(降解24 h后水杨酸残留率数据图 4未显示), 表明其对水杨酸无降解效能; 降解体系中菌株K7的D600值略有增加, 可能由于降解液中存在少量添加的酵母粉(酵母粉主要起生长因子作用)。在降解体系中, 酵母粉除起生长因子的作用外, 还是良好的碳源来源, 因此本研究检测不添加酚酸底物的体系中菌株K7的生长情况。结果发现:降解伊始, 是否添加酚酸底物对降解液中菌株K7的生长情况影响较小, 但随着降解时间的延长, 大部分添加酚酸底物的降解体系中菌株K7的生长情况优于不添加酚酸底物的体系, 表明菌株K7对酚酸类物质的代谢利用促进菌株K7的生长。
2.3 不同降解条件对菌株K7降解效能的影响根据菌株K7对11种酚酸类化合物的降解情况, 选择降解率居中的咖啡酸作为代表化合物, 深入研究不同降解条件对菌株K7降解效能的影响。
2.3.1 不同初始pH值对菌株K7降解效能的影响从图 5可知:在pH7和pH8条件下, 降解5 h后咖啡酸残留率分别为56.65%和59.03%, 7 h后残留率均为0;pH9条件下, 前6 h内的降解行为与pH7和pH8条件下相似, 但6 h后降解进入停滞期。在pH5和pH10的条件下, 菌株K7不生长, 也不降解咖啡酸(图 5未显示)。

|
图 5 不同初始pH值对菌株K7降解效能的影响 Fig. 5 Effects of initial pH values on the degradation efficiency of strain K7 |
对比不同初始pH值条件下菌体生长情况可知, pH7和pH8条件下该菌生长趋势大致相同, 在12 h后D600值均为0.42, 且菌株的D600值随降解时间的延长而升高, 与咖啡酸的残留率呈相反的变化趋势。pH9条件下, 降解前期(10 h内)菌体生长情况与pH7和pH8类似, 11 h后菌D600值呈下降趋势。由此推测, 菌株K7在一定时间范围内可以耐受强碱(pH9)环境, 但随着时间的延长菌体受损, 降解咖啡酸的功能下降。在pH6条件下, 菌株K7的生长情况显著劣于pH7和pH8;在pH6条件下达到完全降解需要12 h。综上, 在中性偏碱的环境中, 菌株K7生长良好并能高效降解咖啡酸。
2.3.2 不同温度对菌株K7降解效能的影响从图 6可知:在10和15 ℃条件下菌株K7对咖啡酸的降解效能较弱, 降解10 h后咖啡酸残留率分别为61.29%和31.90%, 达到完全降解分别需要22和13 h(完全降解数据图 6未显示)。在20 ℃条件下, 降解效能显著增强, 降解7 h后咖啡酸残留率为51.54%, 10 h后降解完全。随温度升高, 降解效能继续增强。在40 ℃条件下, 2 h即表现出显著的降解效果, 4 h后咖啡酸残留率为1.15%, 5 h后降解完全。然而, 随着温度的继续升高, 菌株K7对咖啡酸的降解能力迅速减弱, 45 ℃需10 h才能达到完全降解; 50 ℃未观察到菌株K7生长或降解咖啡酸的现象(图 6未显示)。菌株K7降解咖啡酸的效能与温度的关系呈倒钟型曲线。

|
图 6 不同温度对菌株K7降解效能的影响 Fig. 6 Effects of different temperatures on the degradation efficiency of strain K7 |
观察不同温度下菌体的生长情况发现:在10~35 ℃, 随培养温度升高, 菌株K7生长加速明显; 然而在35~45 ℃, 随温度升高菌株K7生长不再显著加速。在10~40 ℃范围内升温有利于提高菌株K7降解咖啡酸的效能; 45 ℃高温下菌株K7可以生长, 但其对咖啡酸的降解效能却减弱。综上, 菌株K7在30~40 ℃条件下具有高效降解咖啡酸的功能。
2.3.3 不同初始浓度咖啡酸对菌株K7降解效能的影响从图 7可知:在咖啡酸浓度过低(0.1 mg · L-1)的降解体系中, 未观察到降解现象。1 mg · L-1咖啡酸在菌株K7的作用下很快降解完全, 降解2 h后残留率为99.19%, 3 h后残留率为0, 降解完全时菌株D600值为0.13;当咖啡酸初始浓度为10和100 mg · L-1时, 分别经过4和7 h才能完全降解, 降解完全时菌株D600值分别为0.14和0.29;当咖啡酸初始浓度为500 mg · L-1时, 7 h内咖啡酸残留率及菌株D600值均未发生变化, 表明在500 mg · L-1咖啡酸培养液中没有降解行为发生, 由此推测高浓度咖啡酸对菌株K7的正常生长代谢产生抑制作用。

|
图 7 不同咖啡酸初始浓度对菌株K7降解效能的影响 Fig. 7 Effects of different initial concentrations of caffeic acid on the degradation efficiency of strain K7 |
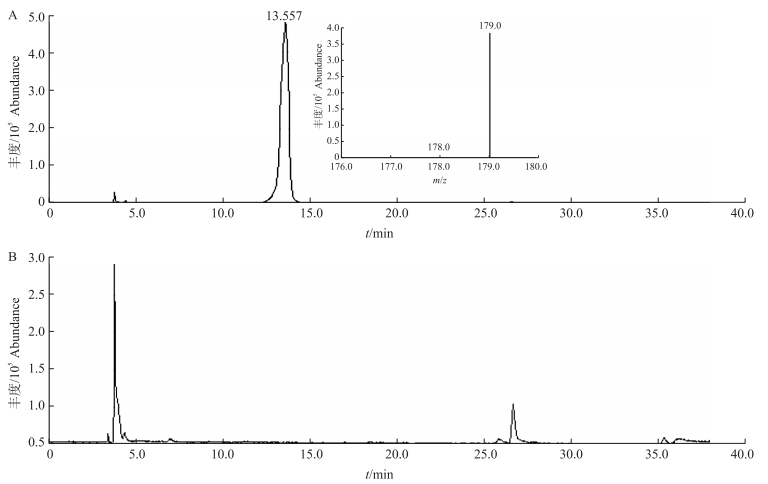
从总离子流图(TIC)发现, 降解0 h样品(图 8-A)在13.557 min附近检测到咖啡酸分子离子峰, 即母体化合物保留时间为13.557 min; 降解8 h后样品(图 8-B)在13.557 min附近处的色谱峰完全消失; B图色谱基线较A图稍有起伏, 但信号十分微弱。以上HPLC-MS分析结果验证菌株K7可有效降解转化咖啡酸。
|
图 8 菌株K7降解咖啡酸的HPLC-MS分析 Fig. 8 HPLC-MS for caffeic acid degradation by strain K7 A.降解0 h样品Degradation 0 h sample; B.降解8 h样品Degradation 8 h sample. |
不动杆菌广泛分布于自然界土壤、水体、植物等介质, 其中, 醋酸钙不动杆菌主要存在于土壤中, 而临床致病菌鲍曼不动杆菌(Acinetobacter baumannii)不是主要存在于自然环境的菌株[12]。目前, 对于不动杆菌属细菌的研究, 主要集中在两方面, 一是其致病性和耐药性, 二是其在降解有机污染物[13-14]、水华藻类[15]等环境污染治理与修复领域的应用。其中, 多株不动杆菌被报道具有高效降解苯酚[16]、4-氯酚[16]、芘[17]和石油[18]等有机污染物的生物活性。对降解机制研究发现, 在苯系物双加氧酶、单加氧酶等关键酶的催化作用下, 不动杆菌可氧化芳烃化合物, 使苯环结构彻底开环裂解, 中间降解产物最终汇入三羧酸循环[18-19]。酚酸类化合物与上述苯酚等物质同属苯系物, 结构具有一定的共性。本研究发现的不动杆菌属细菌K7对4-羟基苯甲酸、香豆酸、香草酸等多种酚酸类物质表现出良好的降解效能。
酚酸类化合物分子结构的共性为富含苯环和活性羧酸基团, 苯环上羟基、羧基、甲氧基等多种取代基类型及位置造成酚酸化合物结构的多样性。本研究发现, 菌株K7对酚酸类化合物分子结构上的微小差异代谢转化的难易程度产生显著影响。首先, 菌株K7对香草酸的降解效能高于香草醛, 推测活性羧基的存在有利于降解的发生; 其次, 菌株K7对4-羟基苯甲酸、香豆酸、香草酸的降解效能高于苯甲酸, 推测苯环上活性羧基对位、间位具有羟基、甲氧基官能团时有利于降解; 菌株K7对阿魏酸、咖啡酸的降解效能高于肉桂酸也支撑此结论; 然而, 菌株K7对苯甲酸的降解效能高于丁香酸、没食子酸, 可能是由于活性羧基对位的羟基(苯环上4位羟基)邻位存在甲氧基或羟基官能团产生空间位阻效应, 导致该苯环4位羟基的有效利用度降低。本研究中, 菌株K7对水杨酸无降解效能, 推测可能由于水杨酸活性羧基的邻位含有羟基, 二者相互影响, 导致羧基和羟基参与生化反应的活性都降低。目前, 已有研究筛选和分离到大量水杨酸降解菌, 而且微生物代谢水杨酸的分子机制也得到深入研究[20]。然而, 本研究结果与已有报道存在较大差异, 揭示菌株K7对水杨酸的作用机制有别于已揭示的水杨酸生物降解途径。
目前, 虽然多株不动杆菌属细菌被发现在有机污染物环境治理领域具有应用或潜在应用价值, 但还未见其降解酚酸类自毒物质等在农业土壤修复领域的报道。本研究结果揭示, 该菌在酚酸类物质积累的连作土壤修复领域具有潜在应用价值, 但其降解机制、降解构效关系等还需深入探究。
| [1] |
孔垂华, 胡飞. 植物化感作用及其应用[M]. 北京: 中国农业出版社, 2001. Kong C H, Hu F. Plant Allelopathy and Its Application[M]. Beijing: China Agriculture Press, 2001 (in Chinese). |
| [2] |
薛启, 王康才, 梁永富, 等. 藿香不同部位浸提液对其种子萌发及幼苗生长的化感作用[J]. 南京农业大学学报, 2017, 40(4): 611-617. Xue Q, Wang K C, Liang Y F, et al. Allelopathy effect of aqueous extracts from different parts of Agastache rugosa on its seed germination and seedling growth[J]. Journal of Nanjing Agricultural University, 2017, 40(4): 611-617 (in Chinese with English abstract). DOI:10.7685/jnau.201610008 |
| [3] |
Rice E L. Allelopathy[M]. 2nd ed. Orlando: Academic Press, 1984.
|
| [4] |
谢越, 肖新, 周毅, 等. 5种酚酸物质对滁菊扦插幼苗生长及酶活性的影响[J]. 南京农业大学学报, 2012, 35(6): 19-24. Xie Y, Xiao X, Zhou Y, et al. Effects of five phenolic allelochemicals on growth and enzymes activity of Chuzhou chrysanthemum cutting seedling[J]. Journal of Nanjing Agricultural University, 2012, 35(6): 19-24 (in Chinese with English abstract). DOI:10.7685/j.issn.1000-2030.2012.06.004 |
| [5] |
Chomel M, Fernandez C, Bousquet-Mélou A, et al. Secondary metabolites of Pinus halepensis alter decomposer organisms and litter decomposition during afforestation of abandoned agricultural zones[J]. Journal of Ecology, 2014, 102(2): 411-424. DOI:10.1111/1365-2745.12205 |
| [6] |
谢星光, 陈晏, 卜元卿, 等. 酚酸类物质的化感作用研究进展[J]. 生态学报, 2014, 34(22): 6417-6428. Xie X G, Chen Y, Bu Y Q, et al. A review of allelopathic researches on phenolic acids[J]. Acta Ecologica Sinica, 2014, 34(22): 6417-6428 (in Chinese with English abstract). |
| [7] |
王兴祥, 张桃林, 戴传超. 连作花生土壤障碍原因及消除技术研究进展[J]. 土壤, 2010, 42(4): 505-512. Wang X X, Zhang T L, Dai C C. Advance in mechanism and countermeasures of peanut succession monocropping obstacles[J]. Soils, 2010, 42(4): 505-512 (in Chinese with English abstract). |
| [8] |
Gauri S S, Mandal S M, Dey S, et al. Biotransformation of p-coumaric acid and 2, 4-dichlorophenoxy acetic acid by Azotobacter sp. strain SSB81[J]. Bioresource Technology, 2012, 126(4): 350-353. |
| [9] |
王延平, 王华田, 许坛, 等. 酚酸对杨树人工林土壤养分有效性及酶活性的影响[J]. 应用生态学报, 2013, 24(3): 667-674. Wang Y P, Wang H T, Xu T, et al. Effects of exogenous phenolic acid on soil nutrient availability and enzyme activities in a poplar plantation[J]. Chinese Journal of Applied Ecology, 2013, 24(3): 667-674 (in Chinese with English abstract). |
| [10] |
Wang Y, Li C, Wang Q, et al. Environmental behaviors of phenolic acids dominated their rhizodeposition in boreal poplar plantation forest soils[J]. Journal of Soils & Sediments, 2016, 16(7): 1858-1870. |
| [11] |
马元元, 陈向向, 李敏, 等. 微小杆菌(Exiguobacterium sp.)对肉桂酸降解行为[J]. 微生物学通报, 2017, 44(9): 2079-2088. Ma Y Y, Chen X X, Li M, et al. Degradation of cinnamic acid by Exiguobacterium sp. strain[J]. Microbiology China, 2017, 44(9): 2079-2088 (in Chinese with English abstract). |
| [12] |
Peleg A Y, Seifert H, Paterson D L. Acinetobacter baumannii:emergence of a successful pathogen[J]. Clinical Microbiology Reviews, 2008, 21(3): 538-582. DOI:10.1128/CMR.00058-07 |
| [13] |
王虎, 吴玲玲, 周立辉, 等. 陕北地区石油污染土壤中不动杆菌属的筛选、鉴定及降解性能[J]. 生态学报, 2014, 34(11): 2907-2915. Wang H, Wu L L, Zhou L H, et al. Identification and oil-degrading performance of Acinetobacter sp. isolated from North Shaanxi oilcontaminated soil[J]. Acta Ecologica Sinica, 2014, 34(11): 2907-2915 (in Chinese with English abstract). |
| [14] |
刘玉华, 王慧, 胡晓珂. 不动杆菌属(Acinetobacter)细菌降解石油烃的研究进展[J]. 微生物学通报, 2016, 43(7): 1579-1589. Liu Y H, Wang H, Hu X K. Recent advances in the biodegradation of hydrocarbons by Acinetobacter species[J]. Microbiology China, 2016, 43(7): 1579-1589 (in Chinese with English abstract). |
| [15] |
王赟, 张业猛, 李佩佩. 醋酸钙不动杆菌的分离鉴定及溶藻特性[J]. 生物技术通报, 2015(3): 140-145. Wang Y, Zhang Y M, Li P P. Isolation, identification and algicidal activity of Acinetobacter calcoaceticus[J]. Biotechnology Bulletin, 2015(3): 140-145 (in Chinese with English abstract). |
| [16] |
Hao O J, Kim M H, Seagren E A, et al. Kinetics of phenol and chlorophenol utilization by Acinetobacter species[J]. Chemosphere, 2002, 46(6): 797-807. DOI:10.1016/S0045-6535(01)00182-5 |
| [17] |
Yuan H, Yao J, Masakorala K, et al. Isolation and characterization of a newly isolated pyrene-degrading Acinetobacter strain USTB-X[J]. Environmental Science & Pollution Research International, 2014, 21(4): 2724-2732. |
| [18] |
周婷, 陈吉祥, 杨智, 等. 一株嗜油不动杆菌(Acinetobacter oleivorans)的分离鉴定及石油降解特性[J]. 环境工程学报, 2015, 9(11): 5626-5632. Zhou T, Chen J X, Yang Z, et al. Isolation and characterization of an oil-degrading Acinetobacter oleivorans[J]. Chinese Journal of Environmental Engineering, 2015, 9(11): 5626-5632 (in Chinese with English abstract). DOI:10.12030/j.cjee.20151178 |
| [19] |
Ghosal D, Dutta A, Chakraborty J, et al. Characterization of the metabolic pathway involved in assimilation of acenaphthene in Acinetobacter sp. strain AGAT-W[J]. Research in Microbiology, 2013, 164(2): 155-163. DOI:10.1016/j.resmic.2012.11.003 |
| [20] |
Sun Y, Wang Z L, Zhang C Y. Advances in molecular mechanism of microbiological degradation of salicylate[J]. Agricultural Science & Technology, 2017, 18(3): 435-437. |




