文章信息
- 胡晓, 刁保卫, 李杰, 王卉, 梁未丽
- HU Xiao, DIAO Baowei, LI Jie, WANG Hui, LIANG Weili
- 河弧菌中群体感应系统相关基因及信号分子检测
- Prevalence of quorum sensing (QS) systems and its signal molecules production in Vibrio fluvialis
- 南京农业大学学报, 2019, 42(4): 682-688
- Journal of Nanjing Agricultural University, 2019, 42(4): 682-688.
- http://dx.doi.org/10.7685/jnau.201810032
-
文章历史
- 收稿日期: 2018-10-29
2. 中国疾病预防控制中心传染病预防控制所, 北京 102206
2. National Institute for Communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China
河弧菌(Vibrio fluvialis)是一种氧化酶阳性, 顶端单鞭毛、无芽胞、嗜盐的革兰氏阴性兼性厌氧细菌, 广泛分布于海洋、海口和近海岸, 是海洋中常见的弧菌[1]。河弧菌主要引起人类急性胃肠炎, 也时有出血性蜂窝组织炎、脑炎、菌血症、急性耳炎及腹膜炎等肠道外感染[2-5]。国际上河弧菌散发或暴发的报道屡见不鲜。在美国, 河弧菌所引起的病例数占弧菌致病数的10%[6]。1982年, 河弧菌已被日本列为食物中毒病原菌[7]。我国沿海地区海水中河弧菌的检出率约为6%~15%[8], 在海产品中的检出率约为4%~5%[9], 因此在我国沿海地区河弧菌成为公共卫生安全的潜在威胁。
群体感应(quorum sensing, QS)是指细菌通过感应细胞密度变化来进行细胞间的信息交流。Nealson等[10]在1970年首次报道了海洋费氏弧菌(Vibrio fischeri)的菌体密度与其生物发光呈正相关, 并证实了这种群体感应现象。费氏弧菌基因组中luxI基因编码自体诱导物合成酶, 可以催化合成N-酰基高丝氨酸内酯类自诱导信号分子(N-acyl-homoserine lactones, AHL):N-(3-氧代-己酰)-高丝氨酸内酯(3-oxo-C6-HSL)[11]。进入20世纪90年代后, 科学家们发现很多细菌存在群体感应现象[12]。霍乱弧菌包括2套密度感应系统:CqsA/S系统和LuxS/PQ系统。CAI-1(cholera autoinducer-1)信号分子最先在霍乱弧菌中被发现, 后来陆续发现于其他弧菌中。Higgins等[13]和Kelly等[14]证实CAI-1是(S)-3-羟基十三烷-4-酮[(S)-3-hydroxytridecan-4-one], 在生物学上是一个新的分子。AI-2型信号分子是上下对称的双五圆环结构的呋喃酮酰硼酸二酯, 其合成起始底物与合成AHL信号分子的底物一致, 均是腺苷甲硫氨酸[15]。
本实验室前期对1株分离自病人体内的河弧菌菌株VF85003进行了全基因组测序, 并进行群体感应系统组成的研究, 发现VF85003中存在2种QS系统[16]:一种是基于N-酰基高丝氨酸内酯(AHL)的群体感应系统; 另一种是基于CA1-1/AI-2的群体感应系统。AHL信号分子由VflI合成酶产生并由VflR受体识别; CqsA负责合成信号分子CAI-1, CqsS是其特异性受体; LuxS负责合成信号分子AI-2, LuxPQ是其特异性受体。与霍乱弧菌和哈氏弧菌相似的是, 河弧菌产生的CAI-1和AI-2信号分子, 通过LuxU、LuxO信号通路激活霍乱弧菌同源物HapR的表达, HapR特异性激活潜在毒力因子金属蛋白酶(HapA)的产生。
虽然对河弧菌群体感应的调控机制已经有了一定的认知, 但对河弧菌的致病机制和其流行病学特征的了解仍然有限。本研究中, 我们检测了30和37 ℃条件下河弧菌参考菌株VF85003培养上清液中CAI-1、AI-2和AHL信号分子的动态变化水平, 随后对不同来源的70株河弧菌菌株进行了群体感应系统组成相关基因的检测, 为探索河弧菌群体中群体感应系统的分布特征及其致病性与环境生存能力提供理论依据。
1 材料与方法 1.1 菌株及培养条件菌株VF85003:Vibrio fluvialis, 野生型, SmR, 为本实验室保存的河弧菌参考菌株; 菌株MM920:V.harveyi(ΔcqsA, ΔluxQ, TcR), 为CAI-1信号分子检测菌株[17]; 菌株BB170:V.harveyi(ΔluxS, ΔcqsS), 为AI-2信号分子检测菌株[18]; 菌株KYC55(pJZ372, TcR)(pJZ384, SpeR)(pJZ410, GmR):根癌农杆菌(Agrobacterium tumefaciens), 为AHL信号分子检测菌株[19]。不同来源的70株河弧菌菌株, 其中43株菌株来源于人体粪便样本, 24株菌株来源于环境样本, 其余3株没有菌株来源信息, 菌株分离年份见图 1。以上菌株均来自中国疾控中心传染病所腹泻病研究室。河弧菌菌株VF85003于30 ℃或37 ℃培养, 其他河弧菌于30 ℃培养, 根癌农杆菌于28 ℃培养。AT培养基[18]用于AHL信号分子的检测, AB培养基[20]用于AI-2信号分子的检测, 除特殊说明外菌株均使用LB培养基培养。
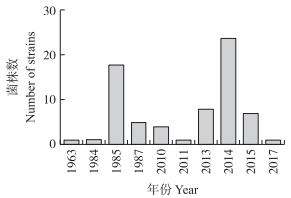
|
图 1 不同年份河弧菌菌株的数量 Fig. 1 Number of Vibrio fluvialis strains in different years |
将河弧菌菌株从-80 ℃保存的甘油冻存管接种于LB固体培养基上, 37 ℃培养12~18 h; 用接种环挑取单菌落于60 μL灭菌去离子水中, 置沸水浴中10 min后, 冰浴10 min, 高速离心后取上清液, 保存于-20 ℃待用。
群体感应系统组成相关基因vflI、vflR、cqsA、cqsS、luxS、luxP、luxQ、luxU、luxO和hapR的引物见表 1。其中vflI、vflR、cqsA、cqsS、luxS、luxP、luxQ分别是与AHL、CAI-1及AI-2信号分子合成与识别相关的基因, luxU和luxO是CAI-1/AI-2密度感应系统下游通路上的关键基因, hapR则是重要的群体感应调节蛋白HapR的编码基因。PCR扩增条件:94 ℃ 5 min; 94 ℃ 30 s, 50~60 ℃ 30 s, 72 ℃ 1~2 min, 30个循环; 72 ℃ 5 min。
| 引物名称Primers name | 序列Sequences(5′→3′) |
| vflI-F/R | TGTCTCGGTAACGTTCAT/CGATGAGTATCTCAATCC |
| vflR-F/R | GGAATTCCATATGCAGAAAATTCTCCGTC/CCGCTCGAGTCAGACGTAAGGATTAATG |
| cqsS-F/R | CCAGTATGCTGAGCCTAA/GCGGGTTTAACGATGTAG |
| cqsA-F/R | TCGCTTCTGTTTACCGCA/CTGACTTTATTCAGGACCG |
| luxS-F/F | ACATTGACTCTGGCAGTG/TTAGACAGTTTTACCGTCG |
| luxO-F/R | CTGCTGATGGTCGAAGAT/ACCTTCTCGTTCCAGGTT |
| luxU-F/R | GGAACTGATGAATCTCAGC/GCGATTAACTGCGAATAGC |
| luxP-F/R | GCCTCTGTTTTGCTCCTT/GATCGGAATAACGAAATGC |
| luxQ-F/R | GGCATCAGATCAAGCACA/CTTGCTGAGTTTCCACCA |
| hapR-F/R | GGAATTCCATATGGACGCATCTATAGAG/CCGCTCGAGTTAGTGATCGCGTTTATAG |
于30和37 ℃培养菌株VF85003, 取D600值分别为0.5、1.0、1.5、2.0及大于2.5(过夜培养)的菌液1.8 mL, 8 000 r · min-1离心2 min, 过滤除菌后于-20 ℃保存。其他河弧菌及阳性对照VF85003于30 ℃过夜培养后收集上清液用于后续试验。
1.2.3 CAI-1及AI-2信号分子检测根据Miller等[21]和Surette等[22]的方法适当修改。将MM920菌株于含3 μg · mL-1四环素的LB液体培养基中30 ℃、180 r · min-1振荡培养。取菌株过夜培养物1 : 10稀释于新鲜的含四环素LB液体培养基中, 每孔70 μL于96孔板中。将1.2.2节中制备的上清液各取30 μL加于96孔板里的MM920菌株稀释培养液中, 以加入无菌LB液体培养基作为阴性对照, 每孔30 μL。175 r · min-1、30 ℃振荡培养, 每隔1 h测定其冷光值(LUX), 连续检测8 h。以LUX(检测菌株)/LUX(阴性对照)比值的最大值代表被检测菌株产生的CAI-1水平。AI-2信号分子检测方法同上, 不同的是将BB170菌株于AB液体培养基中活化, 并以1 : 5 000稀释后加于96孔板, 每孔90 μL, 1.2.1节制备的上清液每孔加10 μL。每组试验3个重复。
1.2.4 AHL信号分子检测根据Joelsson等[23]的方法适当修改。制备菌株KYC55的诱导前细胞:将AHL高效检测菌株KYC55接种于含有2 μg · mL-1四环素、100 μg · mL-1壮观霉素、100 μg · mL-1庆大霉素的LB液体培养基中28 ℃活化过夜。1%(体积分数)转接至含有相同浓度抗生素的50 mL AT液体培养基中振荡培养至指数中期。12 000 r · min-1离心去除上清液, 用2.5 mL 20%无菌甘油重悬菌体, 分装至无菌PCR管中, 于-80 ℃保存。按1 : 1 000的比例将检测菌株KYC55的诱导前细胞加入到AT培养基中充分混合后, 分装至1.5 mL无菌试管中。分别取150 μL各待测菌株的上清液至分装有KYC55的试管中(包括阳性对照菌株VF85003的上清液和阴性对照LB培养基), 28 ℃、180 r · min-1振荡培养过夜。在2 mL离心管中分别加入800 μL Z-buffer、20 μL 0.5% SDS、30 μL三氯甲烷和200 μL的过夜培养菌液, 充分振荡10 s; 加入100 μL 4 mg · mL-1的邻硝基苯-β-D-半乳吡喃糖苷(ONPG)水溶液, 振荡并开始计时; 至溶液显黄色, 加入600 μL 1 mol · L-1的Na2CO3溶液终止反应, 并记录时间; 若2 h后仍没有变黄则终止反应。离心后测定上清液的D420值, 同时检测KYC55菌液D600值。通过检测β-半乳糖苷酶活性来反映AHL水平。β-半乳糖苷酶活性(Miller Units)=1 000×D420/(D600×t×V)。式中:t为时间(min); V为菌液体积(0.2 mL)。每组试验3个重复。
1.2.5 HapA蛋白活性检测将100 μL偶氮酪蛋白(5 mg · mL-1)在100 mmol · L-1 Tris-HCl(pH8.0)中与200 μL细胞培养物上清液于37 ℃孵育1 h。加入400 μL 10% TCA溶液终止反应。13 000 r · min-1离心15 min, 离心后取600 μL上清液加入含700 μL 0.525 mol · L-1 NaOH溶液的离心管中, 在442 nm测定光密度值, 以偶氮酪蛋白为底物测定HapA蛋白活性(Azocasein Unit), 计算公式为:HapA蛋白活性=100×D442/D600。式中:D442=D442(菌液)-D442(空白对照)。
2 结果与分析 2.1 河弧菌模式菌株VF85003中CAI-1、AI-2和AHL信号分子的产生水平由图 2可知:30 ℃培养条件下河弧菌参考菌株VF85003的CAI-1水平随菌体密度的增加而升高, 在过夜培养的菌液(D600>2.5)中CAI-1水平达到高峰; 37 ℃培养条件下当D600为2.0时CAI-1水平达到高峰, 并且37 ℃培养菌株上清液中的CAI-1水平明显高于30 ℃。AI-2信号分子水平与CAI-1相似, 随菌体密度的增加而升高, 当D600为0.5、1.0和1.5时, 37 ℃培养菌株上清液中的AI-2略高于30 ℃, 但在过夜培养的上清液(D600>2.5)中, 二者达相同水平; AHL信号分子水平在30 ℃条件下随菌体密度增高而升高, 且当D600为1.5时达到高峰, 而AHL水平在37 ℃时明显低于D600为2.0的水平。综上, 30 ℃条件下CAI-1和AI-2信号分子水平整体低于37 ℃, 但AHL水平在30 ℃却高于37 ℃。
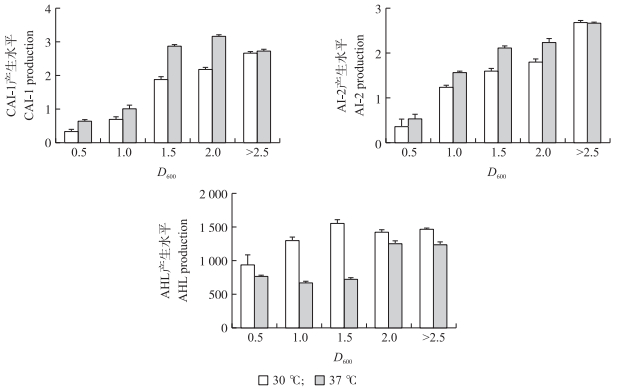
|
图 2 不同菌体密度河弧菌VF85003在30和37 ℃培养条件下CAI-1、AI-2和AHL信号分子的产生水平 Fig. 2 CAI-1, AI-2 and AHL signal molecular production in different cell density of Vibrio fluvialis VF85003 at 30 and 37 ℃ CAI-1和AI-2产生水平均以对数值表示。 Level of CAI-1 and AI-2 production were showed in logarithmic form. The same as follows. |
对不同来源70株河弧菌群体感应相关的10个基因(vflI、vflR、cqsA、cqsS、luxS、luxP、luxQ、luxU、luxO和hapR)进行了PCR检测(表 2)。来源于人粪便样本的43株菌株中有23株群体感应组成相关基因为阳性, 来源于环境样本的24株菌株中20株为阳性, 未知来源的3株菌株中2株为阳性。结果表明在不同来源的70株河弧菌中, 共有45株河弧菌菌株含有以上全部群体感应相关基因。
| 基因 Gene |
具有该基因菌株的比例/% Rate of strains with this gene |
相关信号分子 Correlation signal molecule |
| vflI vflR |
72.86 75.71 |
AHL |
| cqsA cqsS |
80.00 72.86 |
CAI-1 |
| luxS luxP luxQ |
82.86 70.00 70.00 |
AI-2 |
| luxU luxO hapR |
88.57 78.57 85.71 |
为了解河弧菌群体感应系统的功能活性, 根据PCR检测的结果, 我们对具有群体感应系统组成全部基因的45株菌株进行了CAI-1、AI-2和AHL信号分子活性的检测。同时, 我们还对受群体感应系统激活的HapA金属蛋白酶活性进行了检测。
2.3.1 CAI-1信号分子的检测结果在45株河弧菌中, 有23株河弧菌产生CAI-1信号分子的水平高于或接近于阳性对照菌株VF85003;除1株河弧菌产生较低水平的CAI-1外, 其余菌株CAI-1水平整体分布于100~1 000(图 3)。
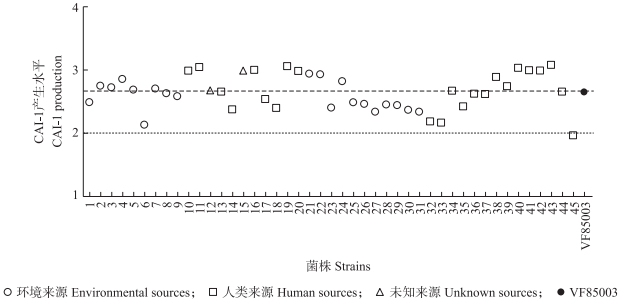
|
图 3 45株河弧菌CAI-1信号分子检测结果 Fig. 3 CAI-1 signal molecular detection in 45 strains of V. fluvialis |
在45株河弧菌中, 有10株河弧菌产生AI-2的水平高于VF85003;而其中有3株菌株产生AI-2的水平低于100, 其中39号菌株AI-2检测值与阴性对照的比值小于10;其余检测菌株的AI-2水平分布于100~1 000(图 4)。
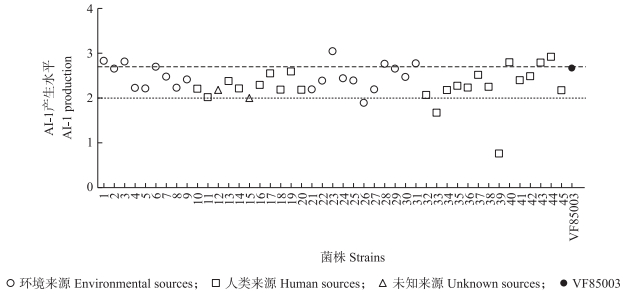
|
图 4 45株河弧菌AI-2信号分子检测结果 Fig. 4 AI-2 signal molecular detection in 45 strains of V. fluvialis |
在45株河弧菌中, 有4株菌株AHL水平高于河弧菌VF85003;2株菌株产生AHL水平低于100;其他检测菌株的AHls水平分布于100~1 000(图 5)。
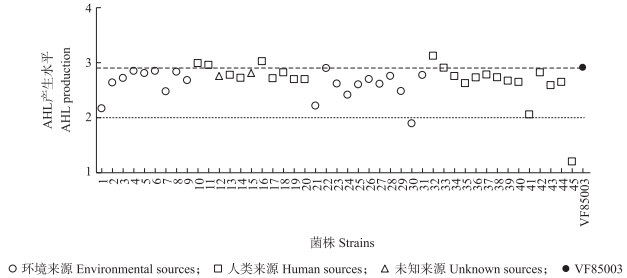
|
图 5 45株河弧菌AHL信号分子检测结果 Fig. 5 AHL signal molecular detection in 45 strains of V. fluvialis |
45株河弧菌中48.89%的菌株HapA活性检测为阳性, 51.11%的菌株检测结果为阴性。VF85003相对于其他阳性菌株的HapA活性处于较低水平(图 6)。

|
图 6 45株河弧菌HapA活性检测结果 Fig. 6 Detection of HapA activity in 45 strains of V. fluvialis |
对以上具有HapA蛋白酶活性的22株菌株进行样本来源分析, 来自人源样本的菌株HapA蛋白酶活性阳性比例(63.6%)高于来源自环境的菌株(36.4%)。
3 讨论本研究中, 我们检测30和37 ℃培养条件下河弧菌参考菌株VF85003不同菌体密度上清液中的信号分子, 发现在30 ℃培养条件下河弧菌的CAI-1、AI-2整体水平低于37 ℃, 但30 ℃时AHL的产生水平整体高于37 ℃, 并且30 ℃的培养条件下AHL相较于37 ℃更早达到最大值。已有研究表明, 霍乱弧菌中金属蛋白酶在肠道定殖过程中对细菌的释放起重要作用[24-25], 在铜绿假单胞菌模型中也具有重要作用[26]。与外界水体环境相比, 37 ℃的宿主环境可能更有利于河弧菌提高CAI-1/AI-2水平来激活HapR蛋白表达, 从而激活金属蛋白酶HapA的表达促进其从定殖的宿主肠道解离, 随粪便排泄物进入外环境开始新的生活感染周期。虽然VFH溶血素在河弧菌致病过程中发挥重要作用[27], 但由于vfh基因表达受HapR蛋白抑制[15], 我们推测在感染后期(高细胞密度)VFH毒力因子的表达较感染初期(低细胞密度)下调, 这一调控机制符合河弧菌在感染宿主体内和外环境水体存活的双向生活模式和策略。
本研究中大多数菌株的CAI-1、AI-2和AHL水平都分布于100~1 000的范围内, 但并非所有菌株都能检测到高水平的QS信号分子, 这可能与其菌株个体差异、基因表达及底物结合等方面有关。值得注意的是, CAI-1信号分子水平较高的菌株(11号)AI-2水平却很低, CAI-1信号分子水平较低的菌株(6号)AI-2水平却很高。CAI-1、AI-2同属于一套密度感应系统, 这种信号分子水平的差异对其调控毒力表达或者适应环境生存是否存在重要意义还有待进一步研究。河弧菌中金属蛋白酶由hapA基因编码, 它的表达能被HapR特异性激活, 这表明具有金属蛋白酶HapA活性的菌株其HapR可以正常表达且具有功能活性。本研究中, 来自人源样本的菌株HapA蛋白酶活性阳性比例更高, 提示群体感应功能性表达的菌株可能具有更强的宿主致病性。河弧菌产生的CAI-1和AI-2信号分子激活HapR的表达, 但从检测结果来看并不是所有检测到CAI-1和AI-2信号分子活性的菌株(3号)都能检测到HapA蛋白活性。这可能是由于hapR基因或者hapA基因的表达出现问题导致HapR不具有活性, 或者虽然具有活性, 但HapA蛋白酶不能被激活, 从而导致检测不到HapA蛋白酶活性。这需要我们对基因相关信息进行更深入的分析。
综上所述, 河弧菌在30和37 ℃时CAI-1/AI-2及AHL 2套QS系统信号分子表达水平不同, 通过对不同来源河弧菌菌株的CAI-1/AI-2及AHL 2套QS系统信号分子及金属蛋白酶HapA检测, 发现具有全部QS系统组成基因的河弧菌不一定具有QS功能活性。在处于不同环境时, 河弧菌QS系统功能的正常行使是否有利于其竞争生存, 这有待于进一步研究。本研究为进一步认识河弧菌群体感应系统功能与菌株致病及引起流行之间存在的相关性提供了研究基础。
| [1] |
Mcnicol L A, Kaper J B, Lockman H A, et al. R-factor carriage in a group F Vibrio isolated from Bangladesh[J]. Antimicrob Agents Chemother, 1980, 17(3): 512-515. DOI:10.1128/AAC.17.3.512 |
| [2] |
Huang K C, Hsu R W. Vibrio fluvialis hemorrhagic cellulitis and cerebritis[J]. Clin Infect Dis, 2005, 40(9): 75-77. DOI:10.1086/429328 |
| [3] |
Lai C H, Hwang C K, Chin C, et al. Severe watery diarrhoea and bacteraemia caused by Vibrio fluvialis[J]. J Infect, 2006, 52(3): 95-98. DOI:10.1016/j.jinf.2005.05.023 |
| [4] |
Lee J Y, Park J S, Oh S H, et al. Acute infectious peritonitis caused by Vibrio fluvialis[J]. Diagn Microbiol Infect Dis, 2008, 62(2): 216-218. DOI:10.1016/j.diagmicrobio.2008.05.012 |
| [5] |
Chen P J, Tseng C C, Chan H T, et al. Acute otitis due to Vibrio fluvialis after swimming[J]. Case Rep Emerg Med, 2012, 2012: 838-904. |
| [6] |
Levine W C, Griffin P M. Vibrio infections on the Gulf Coast:results of first year of regional surveillance[J]. J Infect Dis, 1993, 167(2): 479-483. DOI:10.1093/infdis/167.2.479 |
| [7] |
郑鹏然, 周树南. 食品卫生全书[M]. 北京: 红旗出版社, 1996. Zheng P R, Zhou S N. Encyclopedia of Food Safety[M]. Beijing: Hongqi Press, 1996 (in Chinese). |
| [8] |
韩善桥, 马骢, 陆晓白, 等. 我国沿海地区海水中致病性弧菌的调查[J]. 海军总医院学报, 2003, 16(4): 238-240. Han S Q, Ma C, Lu X B, et al. Survey of pathogenic Vibrio in sea water of Chinese coastal areas[J]. Journal of Naval General Hospital, 2003, 16(4): 238-240 (in Chinese). DOI:10.3969/j.issn.1009-3427.2003.04.016 |
| [9] |
吴斌, 马杰, 林维宣. 水产品中致病性弧菌的分离与鉴定[J]. 大连轻工业学院学报, 2003, 22(1): 48-50. Wu B, Ma J, Lin W X. Ioslation and identification of causative Vibrio in sea products[J]. Journal of Dalian Institute of Light Industry, 2003, 22(1): 48-50 (in Chinese). |
| [10] |
Nealson K H, Platt T, Hastings J W. Cellular control of the synthesis and activity of the bacterial luminescent system[J]. J Bacteriol, 1970, 104(1): 313-322. |
| [11] |
Engebrecht J, Silverman M. Identification of genes and gene products necessary for bacterial bioluminescence[J]. Proc Natl Acad Sci USA, 1984, 81(13): 4154-4158. DOI:10.1073/pnas.81.13.4154 |
| [12] |
Fuqua W C, Winans S C, Greenberg E P. Quorum sensing in bacteria:the LuxR-LuxI family of cell density-responsive transcriptional regulators[J]. J Bacteriol, 1994, 176(2): 269-275. DOI:10.1128/jb.176.2.269-275.1994 |
| [13] |
Higgins D A, Pomianek M E, Kraml C M, et al. The major Vibrio cholera autoinducer and its role in virulence factor production[J]. Nature, 2007, 450(7171): 883-886. DOI:10.1038/nature06284 |
| [14] |
Kelly R C, Bolitho M E, Higgins D A, et al. The Vibrio cholerae quorum-sensing autoinducer CAI-1:analysis of the biosynthetic enzyme CqsA[J]. Nat Chem Biol, 2009, 5(12): 891-895. DOI:10.1038/nchembio.237 |
| [15] |
Schauder S, Shokat K, Surette M G, et al. The LuxS family of bacterial autoinducers:biosynthesis of a novel quorum-sensing signal molecule[J]. Mol Microbiol, 2001, 41: 463-476. DOI:10.1046/j.1365-2958.2001.02532.x |
| [16] |
Wang Y D, Wang H, Liang W L, et al. Quorum sensing regulatory cascades control Vibrio fluvialis pathogenesis[J]. J Bacteriol, 2013, 195(16): 3583-3589. DOI:10.1128/JB.00508-13 |
| [17] |
Miller M B, Skorupski K, Lenz D H, et al. Parallel quorum sensing systems converge to regulate virulence in Vibrio cholerae[J]. Cell, 2002, 110(3): 303-314. DOI:10.1016/S0092-8674(02)00829-2 |
| [18] |
Bassler B L, Wright M, Showalter R E, et al. Intercellular signalling in Vibrio harveyi:sequence and function of genes regulating expression of luminescence[J]. Mol Microbiol, 1993, 9(4): 773-786. DOI:10.1111/mmi.1993.9.issue-4 |
| [19] |
Zhu J, Chai Y, Zhong Z, et al. Agrobacterium bioassay strain for ultrasensitive detection of N-acylhomoserine lactone-type quorum-sensing molecules:detection of autoinducers in Mesorhizobium huakuii[J]. Appl Environ Microbiol, 2003, 69(11): 6949-6953. DOI:10.1128/AEM.69.11.6949-6953.2003 |
| [20] |
Bassler, B L, Wright M, Silverman M R. Multiple signaling systems controlling expression of luminescence in Vibrio harveyi:sequence and function of genes encoding a second sensory pathway[J]. Mol Microbiol, 1994, 13(2): 273-286. DOI:10.1111/mmi.1994.13.issue-2 |
| [21] |
Miller M B, Skorupski K, Lenz D H, et al. Parallel quorum sensing systems converge to regulate virulence in Vibrio cholerae[J]. Cell, 2002, 110(3): 303-314. DOI:10.1016/S0092-8674(02)00829-2 |
| [22] |
Surette M G, Bassler B L. Quorum sensing in Escherichia coli and Salmonella typhimurium[J]. Proc Natl Acad Sci USA, 1998, 95(12): 7046-7050. DOI:10.1073/pnas.95.12.7046 |
| [23] |
Joelsson A C, Zhu J. LacZ-based detection of acyl-homoserine lactone quorum-sensing signals[J]. Curr Protoc Microbiol, 2006, 3(1): 1-9. |
| [24] |
Zhu J, Miller M B, Vance R E, et al. Quorum-sensing regulators control virulence gene expression in Vibrio cholerae[J]. Proc Natl Acad Sci USA, 2002, 99(5): 3129-3134. DOI:10.1073/pnas.052694299 |
| [25] |
Silva A J, Pham K, Benitez J A. Haemagglutinin/protease expression and mucin gel penetration in El Tor biotype Vibrio cholerae[J]. Microbiology, 2003, 149(7): 1883-1891. DOI:10.1099/mic.0.26086-0 |
| [26] |
Vaitkevicius K, Lindmark B, Ou G, et al. A Vibrio cholerae protease needed for killing of Caenorhabditis elegans has a role in protection from natural predator grazing[J]. Proc Natl Acad Sci USA, 2006, 103(24): 9280-9285. DOI:10.1073/pnas.0601754103 |
| [27] |
Song L, Huang Y, Zhao M, et al. A critical role for hemolysin in Vibrio fluvialis-induced IL-1beta secretion mediated by the NLRP3 inflammasome in macrophages[J]. Front Microbiol, 2015, 6: 510. |




