文章信息
- 汤雨洁, 田祥瑞, 胡波, 黄河, 薛圆, 苏建亚
- TANG Yujie, TIAN Xiangrui, HU Bo, HUANG He, XUE Yuan, SU Jianya
- 甜菜夜蛾黄素单加氧酶的原核表达及其对杀虫剂的代谢作用
- Prokaryotic expressions of Spodoptera exigua flavin-dependent monooxygenases and the role in insecticide metabolism
- 南京农业大学学报, 2019, 42(4): 672-681
- Journal of Nanjing Agricultural University, 2019, 42(4): 672-681.
- http://dx.doi.org/10.7685/jnau.201811016
-
文章历史
- 收稿日期: 2018-11-12
甜菜夜蛾(Spodoptera exigua)是重要的经济作物害虫, 在我国严重危害十字花科蔬菜等。在生产上针对该害虫的防治使用化学杀虫剂是最主要的手段。但由于过度依赖化学农药, 近年来某些地区田间种群对多种杀虫剂产生高水平的多药抗性[1-4]。对甜菜夜蛾抗性机制的初步研究发现, 解毒代谢能力的提高是导致抗药性的重要机制[1-2, 5]。作者所在实验室前期在研究广东惠州地区甜菜夜蛾抗药性时, 发现该地区甜菜夜蛾种群已对多种杀虫剂产生极高水平的抗药性, 如对毒死蜱、三氟氯氰菊酯、氰氟虫腙等[2]; 其高水平抗性与P450、酯酶活性上升有一定的关系, 但并不能解释其全部抗性机制, 田间种群中电压门控钠离子通道基因的点突变可能与拟除虫菊酯的击倒抗性有关[6]。在深入分析抗性种群的解毒代谢基因表达变化后, 发现抗性种群黄素单加氧酶(FMO)基因的表达显著高于敏感种群, 抗性种群的FMO活性也显著高于敏感种群, FMO抑制剂(甲巯咪唑)对抗性种群具有增效作用, 说明FMO可能与甜菜夜蛾的代谢抗性有关[7]。从甜菜夜蛾幼虫体内FMO基因的组织表达特征来看, 甜菜夜蛾FMO基因主要在幼虫的肠道与脂肪体中高水平表达[5, 7], 这种组织表达特征暗示FMO可能参与对外源物的代谢过程, 也可能对杀虫剂具有解毒代谢能力, 从而与害虫的抗药性有关。
FMO广泛存在于从植物到哺乳动物的各类真核生物中, 其主要功能是将分子氧添加到亲脂性化合物上使底物水溶性增加从而能快速被排出体外[8]。FMO是脊椎动物对外源化合物解毒的重要酶系, 在人体内对药物解毒代谢的贡献仅次于P450, 它催化很多含氮、含硫亲核药物的氧化代谢, 如吩噻嗪、麻黄碱、甲基安非他明、苄达明、它莫西芬、三氮唑席夫碱、甲巯咪唑等[9-10], 在哺乳动物体内多种杀虫剂也能被FMO氧化解毒[11]。Hodgson等[12]曾推测昆虫FMO可能参与杀虫剂的解毒代谢, 并可能与代谢抗性有关, 但30年来一直未受重视。FMO引起人们的关注源自德国Hartmann教授研究团队的发现, 他们在研究一种单食性灯蛾(辰砂蛾Tyria jacobaeae)与其寄主植物千里光(Jacobaea vulgaris)的协同进化中, 发现该单食性昆虫仅取食这种含有大量有毒吡咯生物碱(千里光碱)的植物, 其对千里光碱的适应机制是由于该种昆虫表达具有对该生物碱强代谢能力的氧化酶[13], 对这种氧化酶进行序列分析后鉴定为FMO[14-15], 他们认为FMO是昆虫体内重要的外源物解毒酶[16]。虽然哺乳动物FMO代谢杀虫剂过去有报道[11], 但目前还未见昆虫FMO代谢杀虫剂的报道。因此, 本研究试图在前期已克隆得到甜菜夜蛾3个FMO基因全长的基础上[7], 开展对甜菜夜蛾FMO的原核表达及对杀虫剂代谢研究, 以揭示昆虫FMO与杀虫剂解毒代谢及抗药性的关系。
1 材料与方法 1.1 试剂与药剂FMO的模式底物甲巯咪唑、苄达明以及NADPH购自Sigma-Aldrich公司, NADPH最好现配现用, 存于-80 ℃, 保存最多1周。Tricine、FAD、氨苄青霉素、卡那霉素、庆大霉素、四环素、X-gal和IPTG均购自北京索莱宝科技有限公司。杀虫剂均采用原药, 其来源与含量分别是:96%毒死蜱、92%氯氰菊酯、98%溴氰菊酯, 南京红太阳集团; 85%三唑磷, 湖北仙隆化工; 90.8%丙溴磷, 江苏宝灵化工; 95%噻虫胺, 河北威远化工; 98%溴虫腈, 南京艾森精细化工; 95%硫双威, 江苏常隆化工。杀虫剂原药用DMSO配成40 mmol · L-1的母液, 置于-20 ℃备用。
ClonExpress一步法定向无缝克隆试剂盒、大肠杆菌DH5α等均购自南京诺维赞生物科技有限公司; 凝胶回收试剂盒、质粒DNA提取试剂盒购自美国OMEGE公司; BL21(DE3)感受态细胞购自南京全式金有限公司; 限制性内切酶EcoRⅠ与XhoⅠ购自TaKaRa公司; 原核表达载体pET-32a由南京农业大学昆虫生理生化与分子生物学实验室提供; 其余产品来自南京寿德生物科技有限公司; 引物合成和测序服务由南京金斯瑞和南京金唯智生物技术公司提供。
1.2 主要仪器全自动样品快速研磨仪, 上海净信科技; PCR扩增仪、微量移液器, 德国Eppendorf公司; 高速冷冻离心机Biofoge strato, 德国Heraeus公司; 凝胶成像系统VersaDoc MP4000, 美国Bio-Rad公司; 水平式核酸电泳仪, 北京六一仪器厂; 核酸蛋白定量仪NanoDrop 1000, 美国Thermo公司; 超声破碎仪Soniprep 150, 英国SANYO MSE公司; 低温摇床, 上海晶坦仪器制造有限公司; 多功能酶标仪, 美国Molecular Device公司; 高效液相色谱仪1260, 安捷伦科技有限公司; 串联质谱仪Triple TOF 5600+, AB Sciex Instruments。
1.3 SeFMO原核表达载体的构建根据前期已克隆得到的SeFMO基因mRNA序列(MF465793、MF465794、MF465795)、pET-32a载体序列以及所采用的限制性内切酶(EcoRⅠ、XhoⅠ), 设计扩增SeFMO开放阅读框的引物(表 1)。用Trizol试剂盒提取甜菜夜蛾幼虫总RNA, 经反转录合成cDNA。采用高保真Taq酶利用表 1中引物分别扩增甜菜夜蛾3个FMO的ORF。PCR反应体系包括:2×Phanta Max Master Mix 25 μL, 正向与反向引物(20 pmol)各2 μL, cDNA 1 μL, 加双蒸水至50 μL。反应条件:94 ℃ 5 min; 94 ℃ 40 s, 55 ℃ 30 s, 72 ℃ 2 min, 循环30次; 72 ℃ 10 min。扩增产物经10 g · L-1琼脂糖凝胶电泳分析, 切胶回收。
| 引物名称Primer name | 引物序列Sequence of primer(5′→ 3′) |
| pET-32a-SeFMO1-F | GCTGATATCGGATCCGAATTCATGGCGTGCCGATCGTGCGT |
| pET-32a-SeFMO1-R | GTGGTGGTGGTGGTGCTCGAGTTTATACTTCGATGGGACA |
| pET-32a-SeFMO2-F | GCTGATATCGGATCCGAATTCATGTTTCGAAAATATTCATTT |
| pET-32a-SeFMO2-R | GTGGTGGTGGTGGTGCTCGAGTTTACAGCGTTAATCCTCT |
| pET-32a-SeFMO3-F | GCTGATATCGGATCCGAATTCATGGTTCGTGTATGCGTTAT |
| pET-32a-SeFMO3-R | GTGGTGGTGGTGGTGCTCGAGTTCAACAAATAACTTCTCGTTTC |
在37 ℃用EcoRⅠ与XhoⅠ酶对pET-32a原始质粒进行双酶切30 min, 反应结束后对酶产物进行电泳分析, 切胶回收线性化的质粒, 并测定回收后的DNA浓度。按照一步法定向无缝克隆试剂盒的操作说明对线性化质粒与SeFMO克隆产物进行连接。反应体系如下:5×CE缓冲液4 μL, 线性化载体50~200 ng, SeFMO克隆片段20~200 ng, Exnase Ⅱ 2 μL, 最后用双蒸水补足体系至20 μL。37 ℃反应30 min后, 立即放在冰上5 min。取2~5 μL连接产物转化50 μL DH5α大肠杆菌感受态细胞, 转化后涂在含氨苄的LB平板上, 16 h后对克隆进行测序鉴定。
1.4 SeFMO蛋白的表达和纯化经测序验证过的pET-32a-SeFMO质粒转化BL21(DE3)感受态细胞, 再次涂在含氨苄的LB平板上, 16 h后挑斑用1 mL含氨苄的LB培养基摇菌培养, 12 h后转入20 mL氨苄培养基中摇菌培养3 h, 出现浑浊后按照1 : 100的稀释比例接种到相同的氨苄培养基中进行诱导表达。当菌液D595值达到0.6时加入IPTG(终浓度0.5或1 mmol · L-1)进行诱导, 同时加入FAD(终浓度10 μmol · L-1)。细菌培养分别在不同组合条件下进行, 条件包括培养温度(16、25、37 ℃)、IPTG浓度(0.5和1 mmol · L-1)、摇床转速(130、160、200 r · min-1)以及培养时间(2~24 h), 以优化诱导表达的条件。摇菌过程中每隔2 h收集菌液2 mL, 分析目标蛋白表达情况。对收集的菌液8 000 g离心10 min, 用600 μL PBS重悬沉淀后对细菌进行超声破碎, 破碎3 s后暂停6 s, 如此循环共破碎8 min。破碎后12 000 g离心15 min, 收集上清液, 沉淀用600 μL PBS冲洗2次后重悬。上清液和沉淀重悬液各取15 μL加入5 μL加样缓冲液, 100 ℃煮沸10 min后进行SDS-PAGE分析。先在50 V电压下电泳1 h, 再在120 V电压下电泳1.5 h, 电泳结束后将凝胶置考马氏亮蓝染色液中, 脱色摇床上染色2 h, 再用脱色液洗脱3次, 每次3 h, 结束后进行成像分析。以未加IPTG进行诱导的为对照。
根据上述试验确定诱导表达条件后, 选取能得到可溶表达的试验条件, 如菌液D595值、培养温度、转速、培养时间、诱导剂浓度等对菌液进行扩大培养。对菌液按上述操作进行离心、破碎, 收集上清液中的可溶性表达蛋白, 采用SDS-PAGE进行验证, 以未插入基因片段的pET-32a质粒为空白对照。
得到上清液后利用表达蛋白N末端的His标签对目的蛋白进行纯化。首先将0.22 μm滤膜安装在镍柱(无锡天演生物技术有限公司)上, 用注射器吸取平衡缓冲液10 mL, 缓慢推入镍柱中, 使镍柱平衡后, 再用注射器吸取待纯化的上清液, 并缓慢推入镍柱中。用5 mL不同浓度咪唑(10、50、100、200、300、500 mmol · L-1)洗脱液对镍柱进行顺序洗脱(由低到高每个咪唑浓度洗2次), 收集洗脱液对目标蛋白进行SDS-PAGE分析, 再进行透析脱咪唑, 最后得到纯化的目标蛋白。纯化蛋白浓度采用Bradford蛋白测定试剂盒(北京索来宝公司)进行测定。使用过的镍柱复活后可重复使用, 复活方法是用500 mmol · L-1咪唑洗脱液对用过的镍柱洗脱2次, 再用平衡缓冲液洗脱2次, 最后将复活的镍柱保存在20%乙醇溶液中供下次使用。
1.5 SeFMO对模式底物与杀虫剂的氧化活性测定FMO对底物的氧化需要消耗NADPH, NADPH消耗的速度可反映FMO酶对底物的氧化活性[17]。在500 μL 2×Tricine/KOH缓冲液(pH8.5)中, 加入20 μg酶液和10 μL 10 mmol · L-1 NADPH溶液, 补双蒸水至990 μL, 添加10 μL不同浓度的底物(甲巯咪唑或苄达明), 迅速将反应液200 μL分装到多孔板(科林公司)中开启反应, 每处理4孔。用酶标仪测定37 ℃下样品中340 nm吸光值的连续变化, 每隔15 s记录1个数据值, 共测定10 min。以不添加底物为对照。NADPH的氧化活性计算利用比尔定律:A=ε · c · l。式中:A为吸光值; c为样品浓度; l为光程; 当浓度采用摩尔浓度时, ε为摩尔吸收系数。使用Origion 8.0软件对数据进行非线性回归分析, 拟合出SeFMO催化模式底物反应的米氏方程, 计算相应的米氏常数(Km)和最大反应速度(Vmax)。
对杀虫剂氧化活性的测定方法同上, 最后加杀虫剂触发反应。测定340 nm吸光值的连续变化。以不加杀虫剂的处理为对照。所有测定均重复3次。
1.6 HPLC法分析SeFMO对杀虫剂的代谢作用将原核表达的SeFMO2、SeFMO3酶分别与NADPH循环再生系统混合进行温育反应, 通过添加毒死蜱、溴虫腈和硫双威启动氧化反应, 以不加NADPH循环再生系统的处理为阴性对照。在250 μL 2×Tricine/KOH缓冲液(pH8.5)中加入200 μg酶液、100 μL 10 mmol · L-1 NADPH溶液, 补双蒸水至498 μL水, 37 ℃孵育5 min后加入2 μL 40 mmol · L-1杀虫剂启动反应, 整个反应在恒温水浴锅中进行3 h。反应结束后, 硫双威、溴虫腈与毒死蜱分别使用有机溶剂进行萃取。样品处理与HPLC分析条件见表 2。所有处理均重复3次。
| 杀虫剂 Insecticide |
萃取溶剂 Extraction solvent |
溶解溶剂 Solution solvent |
流动相体积比 Volume ratio of mobile phase |
波长/nm Wavelenth |
| 硫双威 Indoxacarb |
乙腈+氯化钠 Acetonitrile+NaCl |
甲醇 Methanol |
V(甲醇):V(水)=60:40 V(Methanol):V(water)=60:40 |
232 |
| 溴虫腈 Chlorfenapyr |
乙腈+氯化钠 Acetonitrile+NaCl |
甲醇 Methanol |
V(甲醇):V(水)=80:20 V(Methanol):V(water)=80:20 |
230 |
| 毒死蜱 Chlorpyrifos |
乙酸乙酯 Ethyl acetate |
甲醇 Methanol |
V(甲醇):V(水)=80:20 V(Methanol):V(water)=80:20 |
289 |
硫双威与FMO酶反应条件同1.6节。反应结束按上述条件萃取后液相色谱串联质谱进行产物结构分析。液相色谱条件为:安捷伦1260高效液相色谱仪串联紫外检测器, 并连接TripleTOF® 5600+系统; 色谱柱:Zorbax-SB-C18色谱柱(150 mm×4.6 mm, 5 μm); 流动相:甲醇/水(体积比为5 : 95)0~2 min→甲醇/水(体积比为95 : 5)2~12 min→甲醇/水(体积比为95 : 5)12~16 min→甲醇/水(体积比为5 : 95)16~26 min, 流速:0.3 mL · min-1; 检测波长:254 nm, 柱温:40 ℃。TripleTOF® 5600+系统数据采集方法:TOF-MS预扫描, IDA后进行2个TOF-MS/MS扫描, 使用校正液传输系统(CDS)自动完成外部质量校正。
2 结果与分析 2.1 SeFMO的原核表达将甜菜夜蛾的3个FMO基因ORF分别克隆连接到pET-32a载体上, 采用不同培养条件进行摇菌培养。图 1-A泳道1与2在60×103左右有较深的蛋白带, 与SeFMO基因预测的蛋白相对分子质量接近(SeFMO2与SeFMO3的预测蛋白相对分子质量分别是50×103与48×103), 表达蛋白的相对分子质量大于预测值是由于表达蛋白中含有His标签与助溶的Trx标签; 而泳道3没有明显可见的目标蛋白带, 说明SeFMO2与SeFMO3在上清液中有可溶性目标蛋白的表达。

|
图 1 甜菜夜蛾黄素单加氧酶(SeFMO)的原核表达
Fig. 1 The prokaryotic expressions of flavin-dependent monooxygenase of Spodoptera exigua(SeFMO)
A:1、2分别为pET-32a-SeFMO2 与pET-32a-SeFMO3 ; 3为pET-32a质粒菌株在上清液中的表达; 4为蛋白分子质量标记。 B:pET-32a-SeFMO1 在16 ℃、110 r · min-1下培养24 h后的表达情况。1与4分别采用0.2和0.5 mmol · L-1 IPTG诱导下在沉淀中的表达情况; 2与3分别是采用0.2和0.5 mmol · L-1 IPTG诱导下上清液中的表达情况; 5是蛋白分子质量标记。 A:The expression of pET-32a-SeFMO2 (lane 1), pET-32a-SeFMO3 (lane 2)and pET-32a in supernant(lane 3), lane 4 is the protein molecular marker. B:The expression of pET-32a-SeFMO1 at the condition of 16 ℃, 110 r · min-1 for 24 h. Lane 1 and 4 represent the expression in sediment when IPTG is 0.2 or 0.5 mmol · L-1, respectively; lane 2 and 3 represent the expression in supernant when IPTG is 0.2 or 0.5 mmol · L-1, respectively; lane 5 is the protein molecular marker. |
SeFMO1在各种培养及诱导条件下的表达均在沉淀中, 在上清液中未见可溶蛋白的表达(图 1-B), 说明SeFMO1主要以包涵体的形式表达。我们试图对包涵体中表达的SeFMO1蛋白用尿素进行变性促溶解, 但复性后的SeFMO1蛋白没有酶活性。我们又尝试更换其他原核表达载体对SeFMO1进行表达, 如采用pCold载体等, 但仍未能成功获得可溶性SeFMO1蛋白。在对SeFMO1的预测蛋白结构进行分析后发现, SeFMO1在N末端有信号肽, 而SeFMO2与SeFMO3却没有, 我们在切除SeFMO1的N末端信号肽后, 再对该蛋白进行表达, 依然未取得成功(图略)。
2.2 SeFMO2与SeFMO3原核表达蛋白的纯化利用pET-32a表达载体上的His标签, 可用镍柱对表达蛋白进行纯化, 用含10、50、100、200、300与500 mmol · L-1咪唑的缓冲液对加载表达蛋白的镍柱进行梯度洗脱, 柱中SeFMO2(图 2-A)与SeFMO3(图 2-B)蛋白主要被含100和200 mmol · L-1咪唑的洗脱液洗脱下来(图 2中的3、4泳道)。原核表达的SeFMO2与SeFMO3蛋白均可用200 mmol · L-1咪唑洗脱, 并得到单一的目标蛋白, 因此在对这2种酶进行制备时可用200 mmol · L-1咪唑进行洗脱, 收集洗出液后再进行透析脱咪唑处理即得到纯化的SeFMO酶。经蛋白浓度测定, 所制备的原核表达SeFMO2与SeFMO3酶液的蛋白含量分别为1.06和2.35 mg · mL-1。将蛋白分装于EP管中, 冻存在-80 ℃待用。

|
图 2 SeFMO2(A)与SeFMO3(B)原核表达蛋白柱纯化 Fig. 2 The purification of prokaryotically expressed SeFMO2(A)and SeFMO3(B) 1~6分别代表 10、50、100、200、300、500 mmol · L-1咪唑洗脱液的蛋白条带; 泳道7为蛋白分子质量标记。 The 1-6 lanes represent protein eluted with 10, 50, 100, 200, 300, and 500 mmol · L-1 imidazole from right to left, and lane 7 represents protein molecular marker. |
FMO酶对含氮、含硫亲核化合物具有氧化活性, 一般分别用苄达明与甲巯咪唑做模式底物测定其N-氧化活性与S-氧化活性。采用NADPH吸光度变化法测定出SeFMO2与SeFMO3对N-氧化活性与S-氧化活性, 根据反应动力学计算得出, SeFMO2对甲巯咪唑与苄达明的米氏常数Km值分别为(37.59±8.28)μmol · L-1(图 3-A)与(165.98±10.45)μmol · L-1(图 3-B), 而SeFMO3对甲巯咪唑与苄达明的Km值为(3.00±0.87)μmol · L-1(图 3-C)与(17.71±2.47)μmol · L-1(图 3-D)。SeFMO3的S-氧化活性与N-氧化活性均高于SeFMO2, 2种SeFMO酶均为S-氧化活性高于N-氧化活性。

|
图 3 SeFMO2与SeFMO3对模式底物的反应动力学 Fig. 3 The reaction kinetics of SeFMO2 and SeFMO3 on mode substrates A与B分别是SeFMO2对甲巯咪唑与苄达明的反应动力学曲线; C与D分别是SeFMO3对甲巯咪唑与苄达明反应动力学曲线。图中数据为3次重复测定数据的平均值。 A and B:Enzymatic activity kinetics of SeFMO2 to methimazol and benzydamine; C and D:Enzymatic activity kinetics of SeFMO3 to methimazol and benzydamine. The data are the mean of three replicate measurements. |
采用NADPH氧化法测定SeFMO2与SeFMO3对8种杀虫剂的氧化活性。SeFMO2对丙溴磷、硫双威、溴虫腈、毒死蜱的氧化活性分别是4.7、4.6、7.6和12.4 nmol · mg-1 · min-1; SeFMO3对丙溴磷、硫双威、溴虫腈、毒死蜱的氧化活性分别是4.2、7.1、12.8和26.9 nmol · mg-1 · min-1。对其他4种杀虫剂(氯氰菊酯、溴氰菊酯、噻虫胺、三唑磷)的氧化活性较低或没有(图 4)。2种酶对丙溴磷、硫双威、溴虫腈、毒死蜱氧化活性的大小顺序是一致的, 均表现出对毒死蜱具较高的活性, 其次是溴虫腈, 再其次是硫双威。

|
图 4 SeFMO2(A)和SeFMO3(B)对杀虫剂的氧化活性 Fig. 4 The oxidation activities of SeFMO2(A)and SeFMO3(B)on insecticides 1.氯氰菊酯Cypermethrin; 2.溴氰菊酯Deltamethrin; 3.三唑磷Triazophos; 4.噻虫胺Clothianidin; 5.丙溴磷Profenofos; 6.硫双威Thiodicarb; 7.溴虫腈Chlorfenapyr; 8.毒死蜱Chlorpyrifos. |
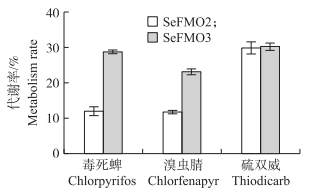
由图 5可见, SeFMO2对毒死蜱、溴虫腈和硫双威的代谢率依次是11.8%、11.5%和27.8%, SeFMO3对这3种杀虫剂的代谢率依次是28.8%、23.1%和30.2%(图 5), 表明在SeFMO酶催化下反应体系中底物消耗明显, 杀虫剂的量减少了, 证明2种SeFMO具有对毒死蜱、溴虫腈和硫双威的解毒代谢能力, 并且以对硫双威的代谢能力最强。研究结果为证明甜菜夜蛾黄素单加氧酶对杀虫剂具有氧化代谢与解毒代谢能力提供了证据。
|
图 5 SeFMO2与SeFMO3对杀虫剂的代谢清除率 Fig. 5 The insecticides ' clearance rate metabolized by SeFMO2 and SeFMO3 |
为了鉴定硫双威被FMO氧化后的产物, 对氧化产物用HPLC-MS/MS进行分析, 硫双威及其氧化产物的总离子色谱图如图 6所示。由于研究中采用的是硫双威原药(含量95%), 总离子色谱图中峰很多。根据硫双威的分子式(C10H18N4O4S3)与总离子色谱中不同峰的质荷比分析(图 6), 表 3列出了其母体及4个可能代谢产物的质谱数据(M1~M5), 其相对分子质量依次为354.049、370.043、386.038、402.033和418.028, 其出峰时间分别为9.74、8.87、10.29、9.24和10.65 min。对于高分辨率质谱通常要求仪器的质量测量误差小于10 mg · kg-1才能满足定性分析要求, 对质子化分子离子的分析得知, M1、M2、M3与M5的质量偏差值分别为1.0、7.0、0.5与0.7 mg · kg-1, 均小于10 mg · kg-1, 表明其质荷比测量值较为精准可信。从其相对分子质量来看, M2、M3与M5分别是在硫双威母体(M1)分子上加单氧、双氧及4个氧的产物。M6~M10则分别是上述分子对应的钠加合离子, 其测量的质量误差仅M6、M8、M9在10 mg · kg-1以下, 较为准确可信, M6、M8与M9分别是硫双威、硫双威加2个氧与硫双威加4个氧后的钠加合离子。

|
图 6 FMO对硫双威代谢产物质谱分析的总离子色谱图 Fig. 6 The total ion chromatogram of metabolic productions from thiodicarb by FMO |
| 代号 Code |
结构式 Formula |
相对分子质量 mass |
离子化 Adduct |
提取离子质量 Extraction mass |
保留时间/min Retain time |
离子强度 Intensity |
质量误差/(mg·kg-1) Error |
| M1 | C10H18N4O4S3 | 354.049 | +H | 355.056 | 9.74 | 680 194 | 1.0 |
| M2 | C10H18N4O5S3 | 370.043 | +H | 371.051 | 8.87 | 592 | 7.0 |
| M3 | C10H18N4O6S3 | 386.038 | +H | 387.046 | 10.29 | 161 582 | 0.5 |
| M4 | C10H18N4O7S3 | 402.033 | +H | 403.041 | 9.24 | 765 | 474.1 |
| M5 | C10H18N4O8S3 | 418.028 | +H | 419.035 | 10.65 | 25 020 | 0.7 |
| M6 | C10H18N4O4S3 | 354.049 | +Na | 377.038 | 9.74 | 1 817 169 | 1.5 |
| M7 | C10H18N4O5S3 | 370.043 | +Na | 393.033 | 9.51 | 5 504 | -51.0 |
| M8 | C10H18N4O6S3 | 386.038 | +Na | 409.028 | 10.29 | 733 897 | 3.5 |
| M9 | C10H18N4O8S3 | 418.028 | +Na | 441.017 | 10.65 | 96 689 | 1.9 |
| M10 | C10H18N4O9S3 | 434.023 | +Na | 457.012 | 10.34 | 670 | -10.1 |
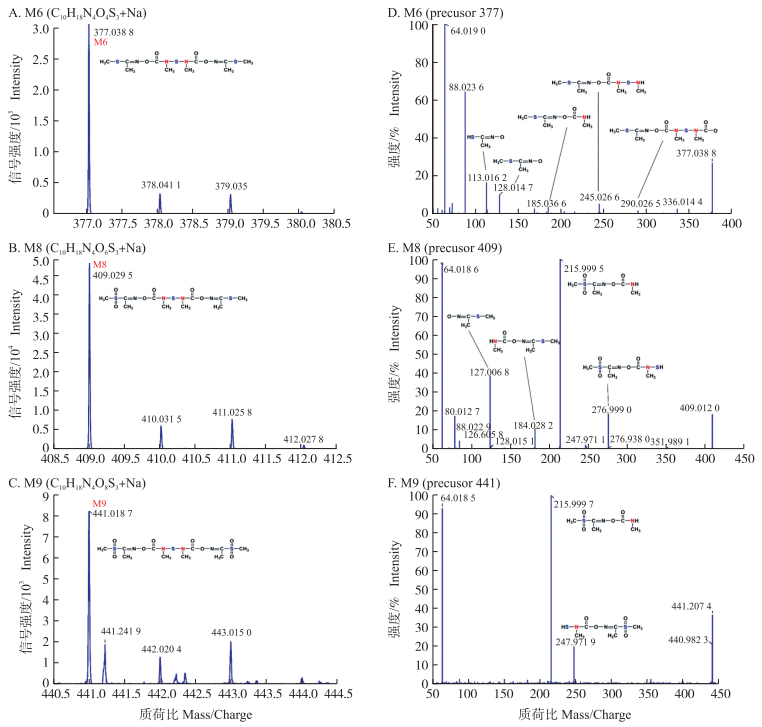
在对硫双威及可能氧化产物进行串联质谱分析时, 由于质子化分子离子的二级质谱过于碎片化, 无法进行分析, 而钠加合离子的二级质谱具有较好的碎片, 所以本研究中仅对钠加合离子的二级质谱进行分析(图 7)。
|
图 7 硫双威及硫双威FMO代谢产物的一级质谱与二级质谱图 Fig. 7 The tandem mass spectrometry of thiodicarb and its oxidative products by FMO A、B与C分别为硫双威、硫双威加2个氧以及硫双威加4个氧产物的一级质谱图; D、E与F分别为对应左侧一级质谱中物质的二级质谱图。 A, B and C are the fragment patterns of thiodicarb, thiodicarb with 2 oxygens and with 4 oxygens respectively; D, E and F are the tandem mass spectrometry of substance corresponding to mass spectrometry in the left of this figure. |
硫双威钠加合离子([M6+Na]+)在一级质谱的质荷比(m/z)为377.038(图 7-A), 其二级质谱图中出现多个碎片, 其质荷比分别为:113.016、128.014、185.036、245.026、290.026, 结构式如图 7-D所示。[M8+Na]+在一级质谱的质荷比为409.029(图 7-B), 比[M6+Na]+多2个氧的质量, 其二级质谱图中有4个主要碎片, 其质荷比分别为:127.006、184.028、215.999、276.999, 结构式如图 7-E所示。[M9+Na]+在一级质谱的质荷比为441.018, 比[M6+Na]+多4个氧的质量(图 7-C), 其二级质谱图中有2个碎片, 其质荷比分别为:215.999与247.971, 这2个碎片应是中间硫断裂形成, 碎片结构式如图 7-F所示。
根据质谱分析, FMO对硫双威的氧化主要是S-氧化, 未发现N-氧化物。硫双威是2分子灭多威经S连接形成的两侧对称分子, FMO对硫双威的S-氧化主要针对两侧的硫醚, 氧化形成砜或亚砜化合物, 主要氧化产物是加2个氧的单砜与加4个氧的双砜化合物, 以及部分亚砜化合物。
3 讨论甜菜夜蛾幼虫共表达3个FMO, 主要集中在中肠与脂肪体中, 其组织表达特征说明其功能与对外源物的解毒有关[7]。本研究利用原核表达载体pET32a, 经过表达条件的优化, 成功得到了原核表达的SeFMO2与SeFMO3酶, 为研究其代谢与解毒功能提供了物质条件, 但对SeFMO1的原核表达未成功, 表达蛋白一直在包涵体中, 无法得到可溶性的表达蛋白, 尚需要进行更多的尝试, 如更换其他可溶表达的原核表达载体等。
FMO主要对含S或含N的化合物发动亲核攻击, 对S-氧化活性与N-氧化活性的评价一般采用甲巯咪唑与苄达明为模式底物进行测定[17-18]。甜菜夜蛾FMO2与FMO3对甲巯咪唑与苄达明均具有氧化活性, FMO2对2种底物的Km值分别为37.59与165.98 μmol · L-1, SeFMO3对甲巯咪唑与苄达明的Km值分别为3.00与17.71 μmol · L-1。通过原核表达获得的SeFMO2与SeFMO3酶活性与通过真核表达获得的兔FMO1—FMO3对甲巯咪唑的活性(Km值在2~34 μmol · L-1)相当[19], 也与人FMO对甲巯咪唑与苄达明的活性类似[9, 20], 说明通过原核表达得到的SeFMO2与SeFMO3具有正常的S-氧化活性与N-氧化活性。
人FMO对药物的解毒代谢已有很多的研究报道, 许多含S或含N药物会被FMO氧化代谢, 对含S药物的代谢主要发生在硫醚或硫脲结构上, 对含N药物的氧化主要针对胺基(伯胺、仲胺或叔胺)[9, 21-23]。人FMO 3 基因突变会导致对三甲胺氧化能力的丧失, 会引起鱼腥病[24]。哺乳动物FMO对杀虫剂的代谢也常有报道, 如对有机磷杀虫剂甲拌磷、乙拌磷、内吸磷、倍硫磷、地虫磷以及氨基甲酸酯类杀虫剂涕灭威、甲硫威、甲萘威等FMO都能代谢[9, 12]。鱼类FMO对这些杀虫剂也有一定代谢能力[25], 昆虫FMO对杀虫剂的代谢尚未见研究报道, 但辰砂蛾幼虫可将有毒的千里光碱氧化生成无毒的千里光碱N-氧化物, 使该种昆虫能以千里光这种植物为食[23]。本研究发现甜菜夜蛾FMO2与FMO3对毒死蜱、溴虫腈以及硫双威具有氧化活性, HPLC分析也说明这2种FMO能催化3种杀虫剂的降解, 对硫双威代谢产物的鉴定证实FMO对该杀虫剂具有S-氧化活性, 氧化生成硫双威的砜化合物。甜菜夜蛾FMO对其他杀虫剂的代谢活性及代谢产物的鉴定还有待于进一步研究。
前期研究发现甜菜夜蛾抗性种群具有较高的FMO基因表达水平与FMO酶活性水平, 预示FMO与杀虫剂的代谢抗性有关[5, 7]。本研究首次证明甜菜夜蛾FMO具有对杀虫剂的解毒代谢能力, 是昆虫重要的解毒酶系成员, 也是害虫对杀虫剂产生代谢抗性的重要机制之一。
| [1] |
Che W N, Shi T, Wu Y D, et al. Insecticide resistance status of field populations of Spodoptera exigua(Lepidoptera:Noctuidae)from China[J]. Journal of Economic Entomology, 2013, 106(4): 1855-1862. DOI:10.1603/EC13128 |
| [2] |
Su J Y, Sun X X. High level of metaflumizone resistance and multiple insecticide resistance in field populations of Spodoptera exigua(Lepidoptera:Noctuidae)in Guangdong Province, China[J]. Crop Protection, 2014, 61: 58-63. DOI:10.1016/j.cropro.2014.03.013 |
| [3] |
Lai T C, Li J, Su J Y. Monitoring of beet armyworm Spodoptera exigua(Lepidoptera:Noctuidae)resistance to chlorantraniliprole in China[J]. Pesticide Biochemistry and Physiology, 2011, 101(3): 198-205. DOI:10.1016/j.pestbp.2011.09.006 |
| [4] |
Wang X G, Xiang X, Yu H L, et al. Monitoring and biochemical characterization of beta-cypermethrin resistance in Spodoptera exigua(Lepidoptera:Noctuidae)in Sichuan Province, China[J]. Pesticide Biochemistry and Physiology, 2018, 146: 71-79. DOI:10.1016/j.pestbp.2018.02.008 |
| [5] |
Tian X R, Sun X X, Su J Y. Biochemical mechanisms for metaflumizone resistance in beet armyworm, Spodoptera exigua[J]. Pesticide Biochemistry and Physiology, 2014, 113: 8-14. DOI:10.1016/j.pestbp.2014.06.010 |
| [6] |
Tian X R, Liu J D, Guo Z M, et al. The characteristics of voltage-gated sodium channel and the association with lambda cyhalothrin resistance in Spodoptera exigua[J]. Journal of Asia-Pacific Entomology, 2018, 21(3): 1020-1027. DOI:10.1016/j.aspen.2018.07.013 |
| [7] |
Tian X, Zhao S, Guo Z, et al. Molecular characterization, expression pattern and metabolic activity of flavin-dependent monooxygenases in Spodoptera exigua[J]. Insect Molecular Biology, 2018, 27(5): 533-544. DOI:10.1111/imb.v27.5 |
| [8] |
Ziegler D M. An overview of the mechanism, substrate specificities, and structure of FMOs[J]. Drug Metabolism Reviews, 2002, 34(3): 503-511. DOI:10.1081/DMR-120005650 |
| [9] |
Krueger S K, Williams D E. Mammalian flavin-containing monooxygenases structure function, genetic polymorphisms and role in drug metabolism[J]. Pharmacology & Therapeutics, 2005, 106: 357-387. |
| [10] |
Poulsen L L, Ziegler D M. Multisubstrate flavin-containing monooxygenases:applications of mechanism to specificity[J]. Chemico-Biological Interactions, 1995, 96(1): 57-73. DOI:10.1016/0009-2797(94)03583-T |
| [11] |
Hajjar N P, Hodgson E. Flavin adenine dinucleotide-dependent monooxygenase:its role in the sulfoxidation of pesticides in mammals[J]. Science, 1980, 209(4461): 1134-1136. DOI:10.1126/science.7403873 |
| [12] |
Hodgson E, Rose R L. Metabolic interactions of agrochemicals in humans[J]. Pest Management Science, 2008, 64(6): 617-621. DOI:10.1002/(ISSN)1526-4998 |
| [13] |
Lindigkeit R, Biller A, Buch M, et al. The two faces of pyrrolizidine alkaloids the role of the tertiary amine and its N-oxide in chemical defense of insects with acquired plant alkaloids[J]. European Journal of Biochemistry, 1997, 245: 626-636. DOI:10.1111/ejb.1997.245.issue-3 |
| [14] |
Naumann C, Hartmann T, Ober D. Evolutionary recruitment of a flavin-dependent monooxygenase for the detoxification of host plant-acquired pyrrolizidine alkaloids in the alkaloid-defended arctiid moth Tyria jacobaeae[J]. Proc Natl Acad Sci USA, 2002, 99(9): 6085-6090. DOI:10.1073/pnas.082674499 |
| [15] |
Langel D, Ober D. Evolutionary recruitment of a flavin-dependent monooxygenase for stabilization of sequestered pyrrolizidine alkaloids in arctiids[J]. Phytochemistry, 2011, 72(13): 1576-1584. DOI:10.1016/j.phytochem.2010.12.014 |
| [16] |
Sehlmeyer S, Wang L Z, Langel D, et al. Flavin-dependent monooxygenases as a detoxification mechanism in insects:new insights from the arctiids(Lepidoptera)[J]. PLoS One, 2010, 5(5): e10435. DOI:10.1371/journal.pone.0010435 |
| [17] |
Rose R L. Measurements of flavin-containing monooxygenase (FMO) activities[J]. Current Protocols in Toxicology, 2002, 4: 9.1-4.9.11. |
| [18] |
Störmer E, Roots I, Brockmöller J. Benzydamine N-oxidation as an index reaction reflecting FMO activity in human liver microsomes and impact of FMO3 polymorphisms on enzyme activity[J]. British Journal of Clinical Pharmacology, 2000, 50: 553-561. |
| [19] |
Duescher R J, Lawton M P, Philpot R M, et al. Flavin-containing monooxygenase(FMO)-dependent metabolism of methionine and evidence for FMO3 being the major FMO involved in methionine sulfoxidation in rabbit liver and kidney microsomes[J]. Journal of Biological Chemistry, 1994, 269(26): 17525-17530. |
| [20] |
Kawaji A, Ohara K, Takabatake E. An assay of flavin-containing monooxygenase activity with benzydamine N-oxidation[J]. Analytical Biochemistry, 1993, 214: 409-412. |
| [21] |
Cashman J R. Human and plant flavin-containing monooxygenase N-oxygenation of amines:detoxication vs. bioactivation[J]. Drug Metabolism Reviews, 2002, 34(3): 513-521. DOI:10.1081/DMR-120005651 |
| [22] |
Henderson M C, Siddens L K, Krueger S K, et al. Flavin-containing monooxygenase S-oxygenation of a series of thioureas and thiones[J]. Toxicology and Applied Pharmacology, 2014, 278(2): 91-99. DOI:10.1016/j.taap.2014.04.002 |
| [23] |
Phillips I R, Shephard E A. Drug metabolism by flavin-containing monooxygenases of human and mouse[J]. Expert Opinion on Drug Metabolism & Toxicology, 2017, 13(2): 167-181. |
| [24] |
Treacy E P, Akerman B R, Chow L M L, et al. Mutations of the flavin-containing monooxygenase gene (FMO3) cause trimethylaminuria, a defect in detoxication[J]. Human Molecular Genetics, 1998, 7(5): 839-845. DOI:10.1093/hmg/7.5.839 |
| [25] |
Lavado R, Aparicio-Fabre R, Schlenk D. Effects of salinity acclimation on the pesticide-metabolizing enzyme flavin-containing monooxygenase (FMO) in rainbow trout(Oncorhynchus mykiss)[J]. Comparative Biochemistry and Physiology:Part C, 2013, 157(1): 9-15. |




