文章信息
- 刘壮, 慕春龙, 彭宇, 彭燮, 车炼强, 朱伟云
- LIU Zhuang, MU Chunlong, PENG Yu, PENG Xie, CHE Lianqiang, ZHU Weiyun
- 极低蛋白日粮补充不同形式氮营养素对生长猪回肠食糜菌群、代谢产物和屏障功能的影响
- Effects of extremely-low-protein diets supplemented with different nitrogen source on ileal microbial communities, metabolites profiles and barrier function of growing pigs
- 南京农业大学学报, 2019, 42(3): 526-534
- Journal of Nanjing Agricultural University, 2019, 42(3): 526-534.
- http://dx.doi.org/10.7685/jnau.201806015
-
文章历史
- 收稿日期: 2018-06-13
2. 四川农业大学动物营养研究所, 四川 成都 611130
2. Institute of Animal Nutrition, Sichuan Agricultural University, Chengdu 611130, China
当前, 我国养猪业面临蛋白质资源紧缺和氮污染等问题的巨大挑战。因此在养猪生产中, 低蛋白质平衡氨基酸(AA)日粮被广泛使用, 以提高氮营养素利用效率, 降低氮排放[1]。然而, 当日粮蛋白质水平降至极低时(低于NRC标准4%), 尽管补充赖氨酸、蛋氨酸、苏氨酸、色氨酸4种必需AA, 机体的生长性能和免疫功能仍会受到不利影响[2-3]。此外, 日粮蛋白质水平过低还会对猪的小肠形态结构、大肠菌群组成和微生物发酵产生不利影响[4-5]。考虑到极低蛋白质日粮中酪蛋白(又称完整蛋白)的缺乏以及酪蛋白及其释放的小肽在机体中的重要作用, Che等[2]研究发现, 使用酪蛋白替代13%粗蛋白(极低蛋白, ELP)日粮中的单体AA虽不能维持正常的生长, 却对机体的氮代谢起到部分改善作用。另有研究者发现, 与单体AA相比, 酪蛋白能更好地支持机体的蛋白质合成[6]。以上研究均证实酪蛋白对机体生长和代谢的潜在作用。
肠道微生物在机体营养物质消化和肠道健康方面扮演十分重要的角色, 它的组成和代谢活动主要受日粮影响。除了参与营养素的消化和代谢之外, 肠道微生物也能够参与肠道上皮屏障功能的调节[7]。此外, 微生物代谢产物, 如短链脂肪酸(SCFA)和生物胺也与肠道屏障功能相关[8-9]。有研究表明, 饲喂ELP日粮并使用酪蛋白部分替代单体AA时, 猪回肠黏膜中IL-1β和TNF-α的浓度以及肠固有免疫相关基因(TLR 4、NF-κB和TOLLIP)的表达均得到恢复[2]。然而, 目前关于ELP日粮中氮营养素补充形式(AA或酪蛋白)对回肠微生物和屏障功能的影响研究较少。
Che等[2]发现, 极低蛋白质(13%CP, ELP)日粮中补充酪蛋白替代部分单体AA, 可以部分改善生长性能和免疫功能。为此, 本试验假设, ELP日粮补充AA仍会降低微生物的数量和活动, 造成回肠屏障功能损伤, 而补充酪蛋白能够部分缓解上述不利影响。因此, 本试验通过测定生长猪回肠微生物组成、细菌代谢物浓度和屏障功能相关基因的表达, 旨在探究极低蛋白质水平下, 氮营养素补充形式对微生物活动和回肠屏障功能的影响。
1 材料与方法 1.1 试验设计与日粮组成在四川农业大学国家级动物试验教学示范中心选取80头48日龄PIC阉公猪, 体质量(15.57±0.13)kg, 随机分为4个处理组:中等蛋白(MP)组、低蛋白(LP)组、极低蛋白+氨基酸(ELP-AA)组和极低蛋白+酪蛋白(ELP-CAS)组, 日粮粗蛋白(CP)水平分别为17%、15%、13%和13%(质量分数)。每个处理5个重复, 每个重复4头仔猪。试验期28 d。
试验日粮参照美国国家科学院(NRC, 2012)[10]营养标准(11~25 kg仔猪)进行配制, 日粮组成和营养成分参见文献[2]。为满足仔猪营养需求, MP组补充添加Lys、Met、Thr、Trp、Val、Ile、Arg、His和Cys; LP组在MP组基础上添加Phe、Leu和Tyr; 为了提供足够的非必需AA, ELP-AA组补充所有AA, 使其与LP组日粮的回肠标准可消化(SID)非必需AA相一致; 考虑到完整蛋白质的缺乏, ELP-CAS组补充3%酪蛋白以部分替代ELP-AA组中的合成AA, 并通过调整其他AA的添加水平, 使所有组的SID AA水平均满足NRC(2012)推荐需要量。
1.2 饲养管理与样品采集试验前清扫圈舍并进行熏蒸消毒。试验期内, 每天观察试验猪健康状况并打扫圈舍, 圈舍温度控制在22~24 ℃, 猪自由采食和饮水。在试验第29天, 各处理每栏选取一头质量接近平均值的仔猪, 按照80 mg · kg-1剂量注射戊巴比妥钠并屠宰, 采集回肠中段组织, 液氮速冻, 并尽快保存于-80 ℃, 用于测定屏障功能基因表达; 采集回肠中段食糜保存于-20 ℃, 用于分析微生物和细菌代谢产物。
1.3 回肠食糜微生物DNA提取和细菌的荧光定量PCR检测参照Zoetendal等[11]的方法, 称取回肠解冻食糜0.3 g, 采用珠磨法配合CTAB(十六烷基三甲基溴化铵)和酚、氯仿、异戊醇混合液提取食糜总DNA。使用Nanodrop 2000分光光度计测定DNA浓度以及D260与D280比值(1.8~2.0), -20 ℃保存备用。
构建20 μL反应体系(10 μL SYBR GREEN, 0.4 μL ROX, 上、下游引物各0.4 μL, 6.8 μL双蒸水, 2 μL模板), 从代表菌群单克隆的16S rRNA基因克隆制备质粒, 梯度稀释后进行标准曲线的建立。使用Step One PlusTM Real-time PCR(Life Technologies, USA)系统对回肠食糜中总细菌(total bacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、双歧杆菌属(Bifidobacterium)、大肠杆菌(Escherichia coli)、乳酸杆菌属(Lactobacillus)、消化链球菌属(Peptostreptococcus)、普氏菌属(Prevotella)和瘤胃球菌属(Ruminococcus)进行菌群定量分析。引物序列见表 1。
| 目标细菌Target organisms | 引物序列(5′→3′) Primer pairs sequences | 参考文献References |
| 总细菌Total bacteria | GTGSTGCAYGGYYGTCGTCA/ACGTCRTCCMCNCCTTCCTC | [12] |
| 厚壁菌门Firmicutes | GGAGYATGTGGTTTAATTCGAAGCA/AGCTGACGACAACCATGCAC | [13] |
| 拟杆菌门Bacteroidetes | GGARCATGTGGTTTAATTCGATGAT/AGCTGACGACAACCATGCAG | [13] |
| 双歧杆菌属Bifidobacterium | TCGCGTCYGGTGTGAAAG/GGTGTTCTTCCCGATATCTACA | [14] |
| 大肠杆菌Escherichia coli | CATGCCGCGTGTATGAAGAA/CGGGTAACGTCAATGAGCAAA | [15] |
| 乳酸杆菌属Lactobacillus | AGCAGTAGGGAATCTTCCA/ATTCCACCGCTACACATG | [16] |
| 消化链球菌属Peptostreptococcus | AACTCCGGTGGTATCAGATG/GGGGCTTCTGAGTCAGGTA | [17] |
| 普氏菌属Prevotella | CACRGTAAACGATGGATGCC/GGTCGGGTTGCAGACC | [18] |
| 瘤胃球菌属Ruminococcus | GAAAGCGTGGGGAGCAAACAGG/GACGACAACCATGCACCACCTG | [19] |
参照Makkar等[20]方法, 称取0.1 g食糜样品, 加入0.5 mL双蒸水, 涡旋振荡混匀后1 000 g离心8 min。吸取上清液, 13 000 g离心15 min后。取沉淀, 加入NaOH溶液(0.25 mol · L-1), 涡旋混匀后, 100 ℃水浴10 min。13 000 g离心30 min。吸取上清液0.02 mL, 加入当天配好的0.2 mL的考马斯亮蓝溶液, 测定吸光值(A595)。
1.4.2 氨态氮(NH3-N)含量测定参照Weatherburn[21]方法, 称取0.1 g食糜样品, 使用氯化铵作为标准品, 利用比色法测定氨态氮含量。
1.4.3 短链脂肪酸(SCFA)含量测定参照Wang等[22]方法, 称取0.3 g样品于2 mL离心管中, 加入1.2 mL双蒸水。涡旋混匀后3 000 g离心10 min, 吸取0.8 mL上清液加入新的离心管中, 加入0.16 mL偏磷酸巴豆酸(250 g · L-1), 置于-20 ℃保存过夜。解冻后, 12 000 g离心5 min。取上清液通过0.22 μm针式滤器过滤, 取滤液按1 : 2(体积比)使用乙醚萃取, 萃取后使用气相色谱仪(7890A, Agilent Technologies Inc., USA)测定挥发性脂肪酸含量。进样口温度220 ℃, 柱箱温度150 ℃, 柱温110 ℃, 检测器温度180 ℃, 分流比30 : 1。
1.4.4 生物胺含量测定参照Yang等[23]的方法, 称取0.5 g样品, 加入1 mL三氯乙酸(50 g · L-1), 涡旋混匀10 min, 3 000 g离心10 min。吸取1 mL上清液加入1 mL正己烷, 涡旋混匀后取0.5 mL下层溶液, 加入1.5 mL饱和碳酸氢钠溶液、1 mL 2 mmol · L-1 NaOH溶液和1 mL丹磺酰氯衍生溶液, 涡旋混匀10 min, 放置于60 ℃水浴锅中反应45 min, 期间重复2次, 加入体积分数为2.8%的氨水100 μL终止反应。在40 ℃水浴下, 持续通入氮气吹干, 加入乙醚3 mL, 涡旋2 min, 吸取上清有机相至新的离心管中, 重复多次, 合并上清液后再用氮气吹干, 加入1 mL乙腈溶解样品, 用0.22 μm有机相滤膜过滤, 取滤液上机检测。使用安捷伦1100高效液相色谱仪(Agilent Technologies, USA), A相为双蒸水, B相为乙腈, 流速1.0 mL · min-1, 柱温30 ℃, 检测波长254 nm。
1.5 回肠组织的RNA提取、反转录和荧光定量PCR检测使用Trizol试剂提取回肠组织RNA:称取约100 mg回肠组织样品至预冷的研钵, 加入液氮进行研磨, 加入1 mL RNAiso Plus(9108, TaKaRa, Japan), 并将匀浆转移至RNA酶灭活的1.5 mL Eppendorf管中, 加入0.2 mL氯仿, 涡旋混匀, 4 ℃、12 000 r · min-1离心15 min。吸取上清液0.6 mL于新的1.5 mL Eppendorf管, 加入等体积的异丙醇(-20 ℃), 冰上静置10 min, 4 ℃、12 000 r · min-1离心15 min。取沉淀, 加入1 mL冰乙醇(75%, -20 ℃), 4 ℃、12 000 r · min-1离心15 min。取沉淀, 室温晾干, 加入50 μL无RNA酶DE buffer进行溶解, 置于-80 ℃保存备用。
采用Nanodrop微量分光光度计(ND-1000UV0Vis, Thermo Fisher Scientific)测定RNA浓度, 并将其稀释至1 μg · μL-1, 根据试剂盒说明书合成cDNA(Prime ScriptTM RT reagent Kit和gDNA Eraser kit, RR047A, TaKaRa, Japan)并进行反转录(RT)。RT步骤:37 ℃ 15 min, 85 ℃ 15 s, 将cDNA置于-20 ℃保存备用。使用cDNA为模板, 选取7个屏障功能相关基因进行荧光定量PCR(qPCR), 特异性引物见表 2。qPCR反应体系(20 μL):SYBR Premix Ex Taq 10 μL, 上、下游引物各0.4 μL, ROX Reference Dye 0.4 μL, 双蒸水6.8 μL, cDNA模板2 μL。反应条件:95 ℃ 30 s; 95 ℃ 5 s, 60 ℃ 34 s, 共40个循环; 95 ℃ 15 s, 60 ℃ 1 min, 95 ℃ 15 s。定量结果以β-actin作为内参基因, 每个样品重复3次, 以2-ΔΔCT法分析基因表达量。
| 目的基因Target genes | 引物序列(5′→3′) Primer pairs sequences | 参考文献References |
| Claudin-1 | TGGCTCCGCGTCTCAGTCC/TGCGAGGGGTGCAGGTCTAA | [24] |
| Claudin-2 | CTCGTTGGCCTGTATCATCACC/CAGGGGGGAGTAGAAGTCCC | [24] |
| MUC-1 | ACACCCATGGGCGCTATGT/GCCTGCAGAAACCTGCTCAT | [25] |
| MUC-2 | CAACGGCCTCTCCTTCTCTGT/GCCACACTGGCCCTTTGT | [25] |
| Occludin | ATGCTTTCTCAGCCAGCGTA/AAGGTTCCATAGCCTCGGTC | [26] |
| ZO-1 | GAGGATGGTCACACCGTGGT/GGAGGATGCTGTTGTCTCGG | [26] |
| ZO-2 | GCAGAGACAACCCCCACTTT/CGTTAACCATGACCACCCGA | [24] |
| β-actin | ATGCTTCTAGACGGACTGCG/GTTTCAGGAGGCTGGCATGA | [25] |
| Note:MUC-1:Mucin-1;MUC-2:Mucin-2;ZO-1:Zonula occludens-1;ZO-2:Zonula occludens-2. | ||
数据用Excel 2016软件初步处理后, 使用SPSS 20.0软件进行单因素方差分析(One-way ANOVA), 采用Duncan ’ s法进行多重比较。使用GRAPHPAD软件(GRAPHPAD Software, USA), 对回肠细菌数量、代谢产物浓度和屏障功能相关基因表达量进行Spearman相关性分析。
2 结果与分析 2.1 极低蛋白日粮补充不同形式氮营养素对生长猪回肠食糜菌群数量的影响由图 1可知; 降低日粮蛋白质水平至极低并补充AA或酪蛋白后, 回肠食糜中细菌总数和2种主要细菌门(Firmicutes和Bacteroidetes)的数量并未受到显著影响(P>0.05)。属水平上, 与MP组相比, 日粮蛋白质水平降至LP时, E.coli数量显著上升(P < 0.05), Peptostreptococcus数量显著下降(P < 0.05);进一步降低至ELP并补充AA(ELP-AA)时, 除上述相同变化外, Bifidobacterium和Lactobacillus数量均显著降低(P < 0.05)。补充酪蛋白组(ELP-CAS)回肠食糜Bifidobacterium、E.coli和Peptostreptococcus的数量显著提高(P < 0.05), 且与MP组相比, Bifidobacterium和Peptostreptococcus数量无显著差异(P>0.05)。Prevotella和Ruminococcus的数量在所有处理组中均无显著差异(P>0.05)。
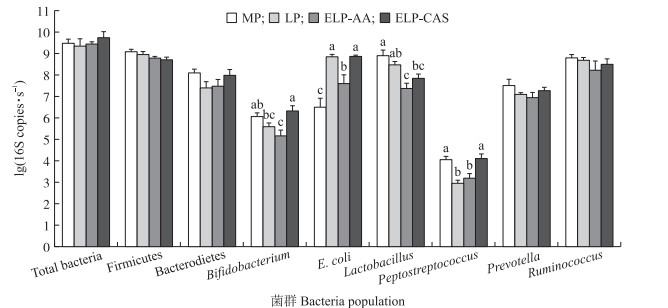
|
图 1 极低蛋白日粮补充不同形式氮营养素对生长猪回肠食糜菌群数量的影响 Fig. 1 Effects of extremely-low-protein(ELP)diets supplemented with different nitrogen source on the populations of bacteria in the ileal digesta of growing pigs 1)MP:中等蛋白(17%粗蛋白(CP))组; LP:低蛋白(15% CP)组; ELP-AA:极低蛋白(13% CP)+AA组; ELP-CAS:极低蛋白(13% CP)+酪蛋白组。下同。2)同一菌群不同小写字母表示差异显著(P < 0.05)。 1)MP:17% crude protein(CP)group; LP:15% CP group; ELP-AA:13% CP+AA group; ELP-CAS:13% CP+casein group. The same as below. 2)Columns within one bacteria with different superscripts significantly differ(P < 0.05). |
由表 3可知:与MP组相比, 日粮蛋白质水平降至LP时, 回肠食糜中总SCFA、乙酸和丙酸浓度显著增加(P < 0.05);进一步降低至ELP并补充AA时, 总SCFA、乙酸和丁酸浓度显著降低(P < 0.05)。与ELP-AA组相比, 补充酪蛋白组(ELP-CAS组)总SCFA、乙酸和丁酸浓度显著提高(P < 0.05), 且与MP组相比无显著差异(P>0.05)。此外, 日粮蛋白质水平对各组之间戊酸、异丁酸和异戊酸浓度均无显著影响(P>0.05)。
| μmol · g-1 | ||||
| 指标Items | 分组Groups | |||
| MP | LP | ELP-AA | ELP-CAS | |
| 总短链脂肪酸Total SCFA | 10.11±0.24b | 13.96±1.09a | 7.35±0.59c | 10.37±0.45b |
| 乙酸Acetate | 7.25±0.26b | 10.59±1.13a | 4.68±0.56c | 7.61±0.44b |
| 丙酸Propionate | 1.05±0.02b | 1.52±0.28a | 1.05±0.02b | 1.01±0.01b |
| 丁酸Butyrate | 0.72±0.01ab | 0.74±0.01a | 0.57±0.02c | 0.69±0.01b |
| 戊酸Valerate | 0.36±0.01 | 0.37±0.01 | 0.36±0.01 | 0.36±0.01 |
| 异丁酸Isobutyrate | 0.38±0.01 | 0.38±0.00 | 0.37±0.01 | 0.36±0.00 |
| 异戊酸Isovalerate | 0.35±0.00 | 0.36±0.00 | 0.35±0.01 | 0.35±0.01 |
| 注:同行肩标不同小写字母表示差异显著(P < 0.05)。下同。 Note:Means within a row with different superscripts significantly differ(P < 0.05). The same as below. |
||||
由表 4可知:梯度降低日粮蛋白质水平至ELP并补充AA显著降低了回肠食糜中氨态氮和MCP含量(P < 0.05);与ELP-AA组相比, 补充酪蛋白(ELP-CAS组)未影响MCP浓度(P>0.05), 但显著提高了氨态氮含量(P < 0.05), 且仍显著低于其他两组(P < 0.05)。ELP-AA和ELP-CAS组的总生物胺含量显著低于MP和LP组(P < 0.05)。与MP组相比, 日粮蛋白质水平降至LP时, 除尸胺和酪胺之外的5种生物胺含量均显著下降(P < 0.05);进一步降低至ELP并补充AA时, 除精胺之外的6种生物胺含量均显著下降(P < 0.05)。与ELP-AA组相比, 补充酪蛋白(ELP-CAS)色胺含量显著降低(P < 0.05), 腐胺和精胺浓度显著提高, 且精胺含量显著高于其余3组(P < 0.05)。
| 项目Items | 分组Groups | |||
| MP | LP | ELP-AA | ELP-CAS | |
| 氨态氮含量/(μmol·g-1) Content of ammonia | 8.90±0.22a | 8.72±0.20a | 7.07±0.11c | 8.16±0.17b |
| 微生物蛋白含量/(μg·g-1) Content of microbial protein | 203.20±7.39a | 168.20±5.14b | 164.60±3.37b | 178.40±3.19b |
| 总生物胺含量/(μmol·g-1) Content of total amines | 10.64±0.44a | 9.44±0.53b | 2.97±0.09c | 3.75±0.11c |
| 尸胺Cadaverine | 5.52±0.24a | 5.74±0.33a | 1.08±0.03b | 1.54±0.04b |
| 酪胺Tyramine | 2.11±0.11a | 1.96±0.13a | 0.49±0.02b | 0.15±0.01b |
| 腐胺Putrescine | 1.52±0.07a | 1.19±0.05b | 0.65±0.02c | 1.31±0.04b |
| 色胺Tryptamine | 0.68±0.04a | 0.24±0.02c | 0.33±0.01b | 0.23±0.01c |
| 精胺Spermine | 0.23±0.01b | 0.17±0.01c | 0.23±0.01b | 0.32±0.01a |
| 亚精胺Spermidine | 0.37±0.02a | 0.14±0.01c | 0.17±0.01b | 0.17±0.01b |
| 甲胺Methylamine | 0.20±0.01a | 0.01±0.00b | 0.02±0.00b | 0.02±0.00b |
由图 2可知:日粮蛋白质水平降至LP并不影响回肠组织屏障功能相关基因的表达(P>0.05);进一步降至ELP并补充AA时, 与LP组相比, MUC- 1、MUC-2、Occludin基因的表达量显著下调(P < 0.05), 补充酪蛋白后, MUC- 1 基因的表达量与MP和LP组相比差异不显著(P>0.05)。4个处理组间, Claudin- 1、Claudin-2、ZO-1和ZO-2的表达量未出现显著差异。
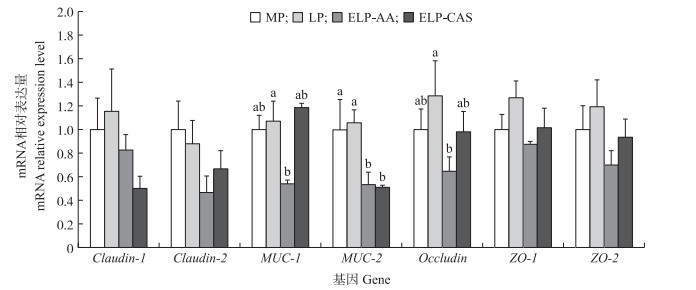
|
图 2 极低蛋白日粮补充不同形式氮营养素对生长猪回肠组织紧密连接蛋白基因表达的影响 Fig. 2 Effects of ELP diets supplemented with different nitrogen source on mRNA relative abundance of tight junction proteins genes in the ileum tissue of growing pigs |
由图 3可知:丁酸、尸胺和总生物胺含量与MUC- 1、MUC-2和Occludin基因的表达量和Lactobacillus数量显著正相关(P < 0.05);腐胺和MUC- 1 、Occludin基因的表达量显著正相关(P < 0.05); Lactobacillus数量和MUC- 2 基因表达量和腐胺含量呈显著正相关关系(P < 0.05)。
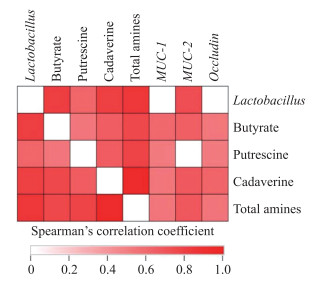
|
图 3 回肠食糜中主要细菌数、代谢产物含量和回肠组织屏障功能相关基因表达量的相关性 Fig. 3 Spearman ' s rank correlation analysis between bacteria, metabolites profile and expression level of barrier function related genes in the ileum |
肠道微生物的组成和数量主要受到日粮组成的影响。本研究发现, 日粮蛋白质水平和氮营养素补充形式都对回肠微生物组成产生显著的影响, 表明日粮确实是影响肠道细菌组成的主要因素。虽然回肠中总细菌和2个最主要的细菌门类(Firmicutes和Bacteroidetes)没有受到日粮蛋白水平和酪蛋白补充的影响, 定量结果还发现, 肠道中主要的有益菌(Bifidobacterium和Lactobacillus)和Peptostreptococcus的数量随着日粮蛋白质水平降低而降低, 并在ELP-AA组中降至最低。Rist等[27]也发现, 日粮蛋白质水平与仔猪回肠食糜中的Bifidobacterium和Lactobacillus数量呈线性效应。此外, 日粮AA是小肠微生物合成自身蛋白的重要原料, 对小肠微生物生长具有十分重要的意义[28]。因此, 推断极低蛋白日粮中氮营养素的缺乏是导致部分细菌生长受阻的重要原因, 这也能部分解释极低蛋白日粮对生长猪生长性能和免疫功能的不利影响[2]。
然而, 当向ELP日粮中补充酪蛋白后, Bifidobacterium、Lactobacillus和Peptostreptococcus的数量得到恢复。类似地, Liepke等[29]也发现, 由蛋白质消化产生的小肽有益于婴儿Bifidobacterium的生长。之前研究表明, Bifidobacterium和Lactobacillus优先利用酪蛋白用于自身的生长, 而Peptostreptococcus是肠道中的主要AA代谢菌[30-31]。因此, 酪蛋白生成的小肽有可能促进这些细菌的生长。普遍认为, Lactobacillus和Bifidobacterium能通过竞争性抑制肠道病原菌、调节宿主免疫反应从而保护宿主的肠道和机体健康[32]。此外, 也有报道指出, Peptostreptococcus的某些种细菌能代谢色氨酸生成吲哚丙烯酸, 后者有益于小肠上皮屏障功能并能减轻小鼠的炎症反应[33]。以上结果表明, 小肠微生物尤其是有益菌更倾向于利用完整蛋白或其产生的小肽, 这与本实验室之前的研究结果一致[34]。
3.2 极低蛋白日粮补充酪蛋白对生长猪回肠微生物代谢活动的影响肠道细菌能产生多种代谢产物, 它们能够反映微生物代谢活动。本试验结果显示, 当日粮蛋白质水平极低时, 补充AA降低了食糜中总SCFA、乙酸和丁酸的含量。乳酸是肠道细菌产生乙酸的前体物质, 而乙酸是丁酸产生菌产生丁酸的主要前体物质。乙酸和丁酸的减少可能是由于产乳酸或乙酸的细菌(如Bifidobacterium和Lactobacillus)数量下降引起的[35]。有意思的是, 补充酪蛋白使食糜中总SCFA、乙酸和丁酸的含量得到恢复。结合微生物的变化结果, 与单体AA相比, 酪蛋白更能促进微生物SCFA的生成。同时, 乙酸和丁酸能在调节肠道健康中发挥重要作用[8]。因此, 在极低蛋白质水平下, 酪蛋白对维持微生物活动和肠道健康十分必要。
氨氮是微生物脱氨基作用的产物, 也是肠腔中AA代谢的标志物。本研究结果表明, 与饲喂MP或LP的猪相比, 饲喂ELP-AA的猪回肠食糜中氨氮浓度显著降低, 而饲喂ELP-CAS显著增加了回肠食糜中的氨氮含量, 这与本实验室之前的研究结果[4]一致。有研究表明, 氨可以刺激大鼠上皮细胞的增殖[36]。上述结果提示, 酪蛋白能更好地被微生物利用产生氨氮并可能促进回肠上皮细胞增殖。
生物胺主要来源于微生物的脱羧基作用。本研究结果显示, 与饲喂MP或LP的猪相比, 饲喂ELP-AA的猪回肠食糜中除精胺以外的其他生物胺浓度均显著降低, 这与之前研究结果[37]一致。然而, 饲喂ELP-CAS恢复了回肠腐胺和精胺含量, 表明酪蛋白能更好地支持AA的脱羧基作用。研究表明, 生物胺对维持细胞正常生理功能具有重要作用, 并能通过提高紧密连接蛋白的基因表达保护肠道屏障[9]。此外, 腐胺和精胺具有抗炎功能, 并在肠道的先天性免疫应答中发挥重要作用[38]。因此, 酪蛋白可能促进生物胺的生成, 进而保护肠道屏障。此外, Lactobacillus和Bifidobacterium等肠道细菌也能生成生物胺[39]。相关性分析也表明, 食糜中生物胺含量与Lactobacillus数量存在正相关关系。
3.3 极低蛋白日粮补充酪蛋白对生长猪回肠屏障功能相关基因表达的影响肠道屏障对维持机体生理稳态有重要作用, 它主要由紧密连接蛋白(Claudin-1、Claudin-2、Occludin、ZO-1和ZO-2)和黏蛋白(MUC-1和MUC-2)参与调控。本试验发现, 与饲喂MP或LP的猪相比, 饲喂ELP-AA猪的回肠组织中MUC- 1、MUC-2和Occludin基因表达量显著下降, 表明回肠屏障功能受损。同时, 极低蛋白质水平下, 猪的生长性能严重受损, 结合之前微生物和代谢产物的结果, 我们推测15%CP可能是生长猪日粮蛋白质水平的关键点, 当CP进一步降低时会引起菌群失衡和上皮损伤, 并影响猪的正常生长。
然而, ELP-CAS组的MUC- 1和Occludin基因表达量与MP和LP组无差别, 表明酪蛋白或其释放的小肽对维持肠道屏障功能是必不可少的。Fan等[37]发现, Occludin和Claudin的基因和蛋白质表达可能受日粮蛋白水平的影响。除此之外, 作为主要的SCFA之一, 丁酸可作为结肠上皮细胞的能量来源, 而生物胺对于Toll样受体的表达也是必需的[8-9], 因此, SCFA和生物胺都在调节上皮屏障功能中发挥重要作用。TNF-α和Toll样受体均能参与调节肠上皮屏障并保持肠道稳态。同时, 相关性分析结果也表明, 丁酸、生物胺含量与MUC- 1、MUC-2和Occludin基因表达量正相关。微生物也可以直接影响肠道屏障功能。研究发现, Bifidobacterium和Lactobacillus的许多种, 如B. longum和L. acidophilus, 均可促进小鼠肠道上皮中Occludin的表达[40]。同时, 乳酸杆菌还可以提高人肠上皮细胞MUC- 2 基因的表达量[41]。本试验相关性分析也表明, Lactobacillus和MUC- 2的表达呈正相关。总之, 这些结果表明, 酪蛋白或其释放的小肽可能对维持正常的肠道屏障功能必不可少, 其中Lactobacillus、丁酸和生物胺可能起重要作用。
综上所述, 极低蛋白质日粮下补充AA, 回肠Lactobacillus和Bifidobacterium等有益菌数量、有益代谢物(SCFA)含量以及回肠屏障功能都受到不良影响。然而, 补充酪蛋白后, Lactobacillus和Bifidobacterium数量得到提高, 丁酸和生物胺等细菌代谢产物浓度上升, 回肠部分受损的紧密连接蛋白表达得到恢复。提示在极低蛋白质水平下, 酪蛋白对维持机体正常氮利用、肠道微生物活动和肠道屏障功能具有重要作用。
| [1] |
Gloaguen M, Le Floc'h N, Corrent E, et al. The use of free amino acids allows formulating very low crude protein diets for piglets[J]. Journal of Animal Science, 2014, 92(2): 637-644. DOI:10.2527/jas.2013-6514 |
| [2] |
Che L Q, Peng X, Hu L, et al. The addition of protein-bound amino acids in low-protein diets improves the metabolic and immunological characteristics in fifteen-to thirty-five-kg pigs[J]. Journal of Animal Science, 2017, 95(3): 1277-1287. |
| [3] |
Peng X, Hu L, Liu Y, et al. Effects of low-protein diets supplemented with indispensable amino acids on growth performance, intestinal morphology and immunological parameters in 13 to 35 kg pigs[J]. Animal, 2016, 10(11): 1812-1820. DOI:10.1017/S1751731116000999 |
| [4] |
Peng Y, Yu K, Mu C, et al. Progressive response of large intestinal bacterial community and fermentation to the stepwise decrease of dietary crude protein level in growing pigs[J]. Applied Microbiology and Biotechnology, 2017, 101(13): 5415-5426. DOI:10.1007/s00253-017-8285-6 |
| [5] |
Guay F, Donovan S M, Trottier N L. Biochemical and morphological developments are partially impaired in intestinal mucosa from growing pigs fed reduced-protein diets supplemented with crystalline amino acids[J]. Journal of Animal Science, 2006, 84(7): 1749-1760. DOI:10.2527/jas.2005-558 |
| [6] |
Daenzer M, Petzke K J, Bequette B J, et al. Whole-body nitrogen and splanchnic amino acid metabolism differ in rats fed mixed diets containing casein or its corresponding amino acid mixture[J]. Journal of Nutrition, 2001, 131(7): 1965-1972. DOI:10.1093/jn/131.7.1965 |
| [7] |
Ivanov I I, Littman D R. Modulation of immune homeostasis by commensal bacteria[J]. Current Opinion in Microbiology, 2011, 14(1): 106-114. DOI:10.1016/j.mib.2010.12.003 |
| [8] |
Ma X, Fan P X, Li L S, et al. Butyrate promotes the recovering of intestinal wound healing through its positive effect on the tight junctions[J]. Journal of Animal Science, 2012, 90(Suppl 4): 266-268. |
| [9] |
Chen J, Rao J N, Zou T, et al. Polyamines are required for expression of Toll-like receptor 2 modulating intestinal epithelial barrier integrity[J]. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2007, 293(3): 568-576. DOI:10.1152/ajpgi.00201.2007 |
| [10] |
NRC. Nutrient Requirements of Swine[M]. 11th ed. Washington, DC: National Academic Press, 2012.
|
| [11] |
Zoetendal E G, Akkermans A D L, de Vos W M. Temperature gradient gel electrophoresis analysis of 16S rRNA from human fecal samples reveals stable and host-specific communities of active bacteria[J]. Applied and Environmental Microbiology, 1998, 64(10): 3854-3859. |
| [12] |
Maeda H, Fujimoto C, Haruki Y, et al. Quantitative real-time PCR using TaqMan and SYBR Green for Actinobacillus actinomycetemcomitans, Porphyromonas gingivalis, Prevotella intermedia, tetQ gene and total bacteria[J]. FEMS Immunology & Medical Microbiology, 2003, 39(1): 81-86. |
| [13] |
Guo X, Xia X, Tang R, et al. Development of a real-time PCR method for Firmicutes and Bacteroidetes in faeces and its application to quantify intestinal population of obese and lean pigs[J]. Letters in Applied Microbiology, 2008, 47(5): 367-373. DOI:10.1111/lam.2008.47.issue-5 |
| [14] |
Walker A W, Ince J, Duncan S H, et al. Dominant and diet-responsive groups of bacteria within the human colonic microbiota[J]. The ISME Journal, 2011, 5(2): 220-230. DOI:10.1038/ismej.2010.118 |
| [15] |
Huijsdens X W, Linskens R K, Mak M, et al. Quantification of bacteria adherent to gastrointestinal mucosa by real-time PCR[J]. Journal of Clinical Microbiology, 2002, 40(12): 4423-4427. DOI:10.1128/JCM.40.12.4423-4427.2002 |
| [16] |
Khafipour E, Li S, Plaizier J C, et al. Rumen microbiome composition determined using two nutritional models of subacute ruminal acidosis[J]. Applied and Environmental Microbiology, 2009, 75(22): 7115-7124. DOI:10.1128/AEM.00739-09 |
| [17] |
Rani R, Murthy R S, Bhattacharya S, et al. Changes in bacterial profile during amebiasis:demonstration of anaerobic bacteria in ALA pus samples[J]. The American Journal of Tropical Medicine and Hygiene, 2006, 75(5): 880-885. DOI:10.4269/ajtmh.2006.75.880 |
| [18] |
Matsuki T, Watanabe K, Fujimoto J, et al. Development of 16S rRNA-gene-targeted group-specific primers for the detection and identification of predominant bacteria in human feces[J]. Applied and Environmental Microbiology, 2002, 68(11): 5445-5451. DOI:10.1128/AEM.68.11.5445-5451.2002 |
| [19] |
Harmsen H J, Raangs G C, He T, et al. Extensive set of 16S rRNA-based probes for detection of bacteria in human feces[J]. Applied and Environmental Microbiology, 2002, 68(6): 2982-2990. DOI:10.1128/AEM.68.6.2982-2990.2002 |
| [20] |
Makkar H P S, Sharma O P, Dawra R K, et al. Simple determination of microbial protein in rumen liquor[J]. Journal of Dairy Science, 1982, 65(11): 2170-2173. DOI:10.3168/jds.S0022-0302(82)82477-6 |
| [21] |
Weatherburn M W. Phenol-hypochlorite reaction for determination of ammonia[J]. Analytical Chemistry, 1967, 39: 791-794. |
| [22] |
Wang X F, Mao S Y, Liu J H, et al. Effect of the gynosaponin on methane production and microbe numbers in a fungus-methanogen co-culture[J]. Journal of Animal and Feed Sciences, 2011, 20(2): 272-284. DOI:10.22358/jafs/66184/2011 |
| [23] |
Yang Y X, Mu C L, Zhang J F, et al. Determination of biogenic amines in digesta by high performance liquid chromatography with precolumn dansylation[J]. Analytical Letters, 2014, 47(8): 1290-1298. DOI:10.1080/00032719.2013.871550 |
| [24] |
Alizadeh A, Braber S, Akbari P, et al. Deoxynivalenol impairs weight gain and affects markers of gut health after low-dose, short-term exposure of growing pigs[J]. Toxins, 2015, 7(6): 2071-2095. DOI:10.3390/toxins7062071 |
| [25] |
Pieper R, Kröger S, Richter J F, et al. Fermentable fiber ameliorates fermentable protein-induced changes in microbial ecology, but not the mucosal response, in the colon of piglets[J]. Journal of Nutrition, 2012, 142(4): 661-667. DOI:10.3945/jn.111.156190 |
| [26] |
Zhou X L, Kong X F, Lian G Q, et al. Dietary supplementation with soybean oligosaccharides increases short-chain fatty acids but decreases protein-derived catabolites in the intestinal luminal content of weaned Huanjiang mini-piglets[J]. Nutrition Research, 2014, 34(9): 780-788. DOI:10.1016/j.nutres.2014.08.008 |
| [27] |
Rist V T S, Weiss E, Sauer N, et al. Effect of dietary protein supply originating from soybean meal or casein on the intestinal microbiota of piglets[J]. Anaerobe, 2014, 25: 72-79. DOI:10.1016/j.anaerobe.2013.10.003 |
| [28] |
Libao-Mercado A J O, Zhu C L, Cant J P, et al. Dietary and endogenous amino acids are the main contributors to microbial protein in the upper gut of normally nourished pigs[J]. Journal of Nutrition, 2009, 139(6): 1088-1094. DOI:10.3945/jn.108.103267 |
| [29] |
Liepke C, Adermann K, Raida M, et al. Human milk provides peptides highly stimulating the growth of bifidobacteria[J]. European Journal of Biochemistry, 2002, 269(2): 712-718. DOI:10.1046/j.0014-2956.2001.02712.x |
| [30] |
Dai Z L, Wu G, Zhu W Y. Amino acid metabolism in intestinal bacteria:links between gut ecology and host health[J]. Frontiers in Bioscience, 2011, 16: 1768-1786. DOI:10.2741/3820 |
| [31] |
Qi H, Xiang Z, Han G, et al. Effects of different dietary protein sources on cecal microflora in rats[J]. African Journal of Biotechnology, 2013, 10(19): 3704-3708. |
| [32] |
Wang W, Chen L, Zhou R, et al. Increased proportions of Bifidobacterium and the Lactobacillus group and loss of butyrate-producing bacteria in inflammatory bowel disease[J]. Journal of Clinical Microbiology, 2014, 52(2): 398-406. DOI:10.1128/JCM.01500-13 |
| [33] |
Wlodarska M, Luo C, Kolde R, et al. Indoleacrylic acid produced by commensal peptostreptococcus species suppresses inflammation[J]. Cell Host & Microbe, 2017, 22(1): 25-37. |
| [34] |
刘靖, 慕春龙, 余凯凡, 等. 体外法探究不同氨基酸形式酪蛋白水解物对猪小肠微生物的影响[J]. 微生物学报, 2018, 58(1): 63-72. Liu J, Mu C L, Yu K F, et al. Effect of two different casein hydrolysates on small intestinal bacteria of growing pigs[J]. Acta Microbiologica Sinica, 2018, 58(1): 63-72 (in Chinese with English abstract). |
| [35] |
Koh A, de Vadder F, Kovatcheva-Datchary P, et al. From dietary fiber to host physiology:short-chain fatty acids as key bacterial metabolites[J]. Cell, 2016, 165(6): 1332-1345. DOI:10.1016/j.cell.2016.05.041 |
| [36] |
Ichikawa H, Sakata T. Stimulation of epithelial cell proliferation of isolated distal colon of rats by continuous infusion of ammonia or short-chain fatty acids is nonadditive[J]. Journal of Nutrition, 1998, 128(5): 843-847. DOI:10.1093/jn/128.5.843 |
| [37] |
Fan P, Liu P, Song P, et al. Moderate dietary protein restriction alters the composition of gut microbiota and improves ileal barrier function in adult pig model[J]. Scientific Reports, 2017, 7: 43412. DOI:10.1038/srep43412 |
| [38] |
Ramani D, de Bandt J P, Cynober L. Aliphatic polyamines in physiology and diseases[J]. Clinical Nutrition, 2014, 33(1): 14-22. DOI:10.1016/j.clnu.2013.09.019 |
| [39] |
Rist V T, Weiss E, Eklund M, et al. Impact of dietary protein on microbiota composition and activity in the gastrointestinal tract of piglets in relation to gut health:a review[J]. Animal, 2013, 7(7): 1067-1078. DOI:10.1017/S1751731113000062 |
| [40] |
Wang H, Gong J, Wang W, et al. Are there any different effects of Bifidobacterium, Lactobacillus and Streptococcus on intestinal sensation, barrier function and intestinal immunity in PI-IBS mouse model?[J]. PLoS One, 2014, 9(3): e90153. DOI:10.1371/journal.pone.0090153 |
| [41] |
Mattar A F, Teitelbaum D H, Drongowski R A, et al. Probiotics up-regulate MUC-2 mucin gene expression in a Caco-2 cell-culture model[J]. Pediatric Surgery International, 2002, 18(7): 586-590. DOI:10.1007/s00383-002-0855-7 |




