文章信息
- 姚晓磊, 孟繁星, 王书婷, 刘孜斐, 王锋
- YAO Xiaolei, MENG Fanxing, WANG Shuting, LIU Zifei, WANG Feng
- GALNTL5基因在不同月龄湖羊附睾中的表达模式及其miRNA的预测
- Expression pattern of GALNTL5 and its target miRNA screening in epididymis at different ages of Hu sheep
- 南京农业大学学报, 2019, 42(3): 519-525
- Journal of Nanjing Agricultural University, 2019, 42(3): 519-525.
- http://dx.doi.org/10.7685/jnau.201808015
-
文章历史
- 收稿日期: 2018-08-13
2. 南京学业大学动物科学类国家级实验教学示范中心, 江苏 南京 210095
2. National Experimental Teching Demonstration Center for Animal Science, Nanjing Agricultural University, Nanjing 210095, China
O-糖基化在生物体转录、翻译、核运输、细胞骨架的形成以及调节细胞器功能中发挥着重要作用[1]。多肽N-乙酰氨基半乳糖转移酶(UDP-N-acetyl-D-galactosamine:polypeptide N-acetylgalactosa minyltransferase, pp-GalNAc-T, EC 2.4.1.41)能以尿苷二磷酸-半乳糖酰胺(UDP-GalNAc)为供体, 以黏蛋白(mucin)上的丝氨酸(Ser)或苏氨酸(Thr)为底物, 形成GalNAc α1-O-Ser/Thr结构。pp-GalNAc-T是介导O-糖基起始反应的关键酶[1]。2014年, Takasaki等[2]发现了pp-GalNAc-T家族中又一新成员, 即GALNTL5(polypeptide N-acetylgalactosaminyltransferase-like protein 5)[2]与弱精症密切相关, 有研究者将其命名为pp-GalNAc-T19[3]或GalNAc-T20[4]。
已有研究表明, GALNTL5广泛表达于小鼠[2, 5]、人[2, 4]、牛[6]的睾丸中。本课题组Yao等[7-8]研究发现其在绵羊睾丸、子宫、输卵管、卵巢中也有表达。Takasaki等[2]和Kierszenbaum等[5]研究报道, GALNTL5表达于小鼠睾丸长形精子和圆形精子中。同时, Takasaki等[2]发现GALNTL5定位于小鼠附睾尾精子头-尾连接处的颈部区域, 这提示GALNTL5可能与雄性动物的精子发生和精子成熟有关。
附睾作为精子成熟的靶器官, 而GALNTL5在附睾头、体、尾中是如何发挥作用的, 目前还未见报道。Yao等[8]研究发现, GALNTL5在绵羊附睾尾精子和新鲜精液中表达部位有差异[8], 提示其在精子成熟过程中可能发挥着不同作用。因此, 本试验以不同发育阶段的湖羊附睾为研究对象, 采用RT-qPCR和Western blot技术检测GALNTL5 在附睾头、体、尾中mRNA和蛋白的表达规律, 并采用免疫组化技术对其进行定位; 同时, 初步筛选GALNTL5 对应的microRNA(miRNA), 为后续研究GALNTL5在精子成熟过程中如何发挥作用奠定基础。
1 材料与方法 1.1 试验动物及样品采集分别从泰州海伦羊业有限公司选取不同月龄[3月龄(3 M):约16 kg; 9月龄(9 M):约40 kg; 24月龄(24 M):约76 kg]健康湖羊各5只, 常规饲养管理。屠宰前禁食12 h, 给予正常饮水, 屠宰后采集湖羊单侧附睾头、体、尾组织, 迅速置于液氮中, -80 ℃冰箱保存; 另一侧附睾头、体、尾的相同部位采集组织样品(0.5 cm×0.5 cm×0.2 cm), 多聚甲醛固定。
1.2 生物信息学分析从miRBase(http://www.mirbase.org/)下载绵羊(Ovis aries)miRNA数据库, 分别利用RNAhybrid和miRanda软件筛选GALNTL5 基因对应的miRNA并取其交集。RNAhybrid参数设置:|自由能|>10 kcal · mol-1, P < 0.08;miRanda参数设置:|自由能|>41.9 kJ · mol-1, 评分>120。
1.3 总RNA提取及质量鉴定按照Trizol Reagent试剂盒(Invitrogen公司)说明书分别提取不同发育阶段湖羊附睾头、体、尾的总RNA, DEPC水溶解, ND-2000核酸蛋白测定仪(NanoDrop Technologies)测定总RNA浓度和纯度, 调整其质量浓度为1 μg · μL-1左右。
1.4 引物合成与设计根据NCBI绵羊相关基因序列, 用Primer Premier 5.0软件设计引物(表 1), 由南京擎科生物有限公司合成。以miRBase(http://www.mirbase.org/)中绵羊miRNA数据库的已知序列为基础, 设计miR-487a-5p、miR-485-5p、miR-329b-5p、miR-27a、miR-16b的茎环引物(表 1)。反转录(RT)引物由上海吉玛制药生物有限公司合成。
| 目的基因 Target gene |
引物对序列(5′→3′) Primer pairs sequences |
产物大小/bp Product size |
GenBank登录号 GenBank accession No. |
| GALNTL5 | F:TTTTCCACTCCCAAGACTGCC/R:AGGTAGCAAAGACCCTCAC | 145 | XM_012177375.2 |
| GAPDH | F:GTCAAGGCAGAGAACGGGAA/R:GGTTCACGCCCATCACAAAC | 232 | XM_012166462.1 |
| miR-487a-5p | F:GGTGGCTATCCCTGCTG/R:GTGCAGGGTCCGAGGT | 66 | MI0016946 |
| miR-485-5p | F:ATAAGAGGCTGGCCGTG/R:GTGCAGGGTCCGAGGT | 67 | MI0016950 |
| miR-329b-5p | F:GAATGAGGTTTTCTGGGTTTC/R:GTGCAGGGTCCGAGGT | 67 | MI0016925 |
| miR-27a | F:GGCGTTCACAGTGGCTAAG/R:GTGCAGGGTCCGAGGT | 65 | MI0025275 |
| miR-16b | F:GGCAATAGCAGCACGTAAA/R:GTGCAGGGTCCGAGGT | 64 | MI0025257 |
按照PrimeScript® RT reagent Kit With gDNA Eraser试剂盒(TaKaRa, 大连)说明书进行反转录(RT); 应用Hairpin-it miRNAs反转录试剂盒(上海吉玛)将RNA反转录为cDNA。分别以上述cDNA为模板, 采用SYBR法(qPCR)检测各基因的表达量。反应体系(20 μL)包括:SYBR Green Master mix(Roche, 德国)10 μL, 上、下游引物(10 μmol · L-1)各0.6 μL, cDNA 1 μL, ddH2O 7.8 μL。反应条件:95 ℃ 10 min; 95 ℃ 15 s, 60 ℃ 30 s, 72 ℃ 30 s, 共40个循环; 72 ℃ 10 min。每个样品3个重复。
1.6 Western blot检测按照组织蛋白抽提操作说明提取不同月龄湖羊附睾组织蛋白, BCA法测定蛋白浓度, 蛋白变性条件为98 ℃ 10 min。SDS-PAGE电泳:蛋白上样量为60 μg, 采用50 g · L-1浓缩胶80 V 30 min, 120 g · L-1分离胶120 V 1.5 h, 转膜条件为100 V 1.5 h, 50 g · L-1脱脂奶粉封闭1 h。加GALNTL5兔单克隆抗体(Biorbyt, UK, 1 : 500)和β-actin兔多克隆抗体(博奥森, 北京, 1 : 1 000), 4 ℃过夜; TBST洗3次, 加二抗(HRP标记的山羊抗兔IgG, Millipore, Billerica, 1 : 1000)室温孵育1 h; TBST洗3次, ECL曝光, 观察, 用Image J对其灰度值进行分析。
1.7 免疫组化检测采用石蜡对已固定好的组织进行包埋, 然后切片, 切片厚度6 μm, 37 ℃烤片24 h。免疫组化检测参照张谊等[9]的方法并加以改进。改进部分:GALNTL5兔单克隆抗体(1 : 100), 4 ℃过夜, PBS洗3次; 加二抗(HRP标记的山羊抗兔IgG, 1 : 500), 37 ℃ 30 min, PBS洗3次; 加入SABC(链霉亲和素-过氧化物酶复合物, 1 : 100, 武汉博士德), 37 ℃ 30 min, PBS洗3次。同时设置阴性对照, 用PBS代替一抗。生物显微镜观察。
1.8 数据处理与统计分析各目的基因相对表达量采用ΔΔCT法计算, 相对表达水平为2-ΔΔCT, GALNTL5 mRNA相对表达量均经GAPDH校正, miRNA相对表达量均经miR-16b校正。结果表示为平均值±标准误(x±SE)。数据采用SPSS 24.0软件进行分析, 差异显著性比较采用One-way ANOVA法, 相关性分析采用双变量法进行。
2 结果与分析 2.1 不同月龄湖羊附睾中GALNTL5 mRNA和蛋白的表达模式采用RT-qPCR和Western blot技术对不同发育阶段湖羊附睾头、体、尾中GALNTL5 mRNA和蛋白表达规律进行检测, 结果如图 1所示。GALNTL5 mRNA在附睾体和尾中表现为性成熟后(9 M和24 M)显著高于性成熟前(3 M)(P < 0.05), 但9 M与24 M之间差异不显著(P>0.05, 图 1-A); GALNTL5 mRNA在附睾头中则表现为24 M显著高于3 M和9 M(P < 0.05), 但3 M与9 M差异不显著(图 1-A)。GALNTL5蛋白在不同发育阶段湖羊附睾头和体中的表达规律一致, 均表现为:性成熟后(9 M和24 M)显著高于性成熟前(3 M)(P < 0.05), 但9 M与24 M之间差异不显著(P>0.05, 图 1-B、C); GALNTL5蛋白在附睾尾中表达水平随着月龄的增长而升高, 且各组之间差异显著(P < 0.05, 图 1-B、C)。
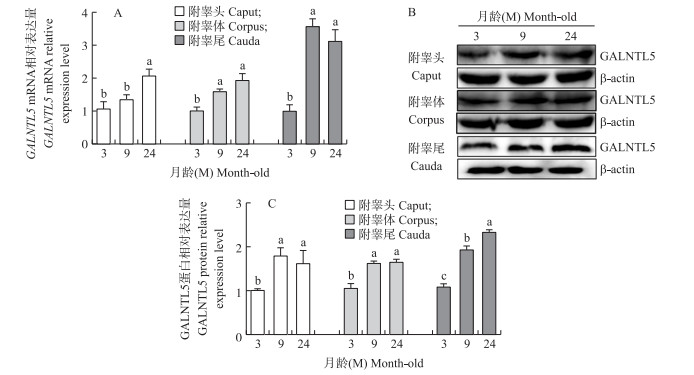
|
图 1 不同月龄湖羊附睾中GALNTL5 mRNA(A)和蛋白(B、C)表达模式 Fig. 1 The mRNA(A)and protein(B, C)expression patterns of GALNTL 5 in epididymis at different developmental stages of Hu sheep 相同部位不同小写字母表示差异显著(P < 0.05)。下同。 The different lowercase letters in the same tissue mean significant difference at 0.05 level. The same as follows. |
如图 2所示:GALNTL5定位于不同发育阶段湖羊附睾头(图 2-A、D、G)、体(图 2-B、E、H)、尾(图 2-C、F、I)中的基细胞和主细胞。同时, 在附睾体和附睾尾的精子中也检测到了GALNTL5的阳性信号(图 2-E、F、I)。
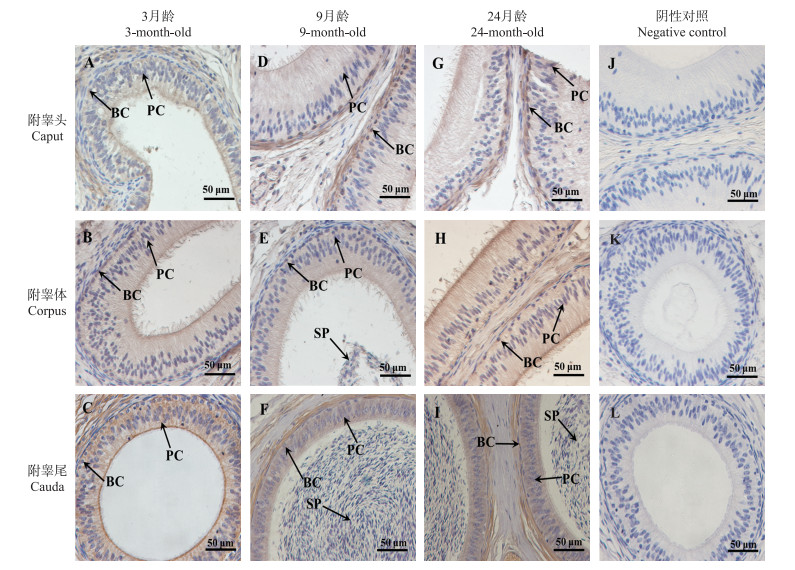
|
图 2 GALNTL5在不同月龄湖羊附睾头、体和尾中的定位 Fig. 2 The immunohistochemical location of GALNTL5 in epididymis caput, corpus and cauda at different ages of Hu sheep BC:基细胞Basal cell; PC:主细胞(上皮细胞)Principal cell; SP:精子Spermatozoa. |
如图 3-A所示:分别采用2种软件预测GALNTL5 对应的miRNA, 其中RNAhybrid软件预测到40个miRNA, 而miRanda软件预测得到38个miRNA, 2种软件交集共有11个miRNA。按照评分的高低对其进行排序, 选取前4个为研究对象, 即miR-487a-5p、miR-485-5p、miR-329b-5p和miR-27a;这4个候选miRNA与绵羊GALNTL5 基因3′-UTR的结合位置如图 3-B、C、D、E所示。
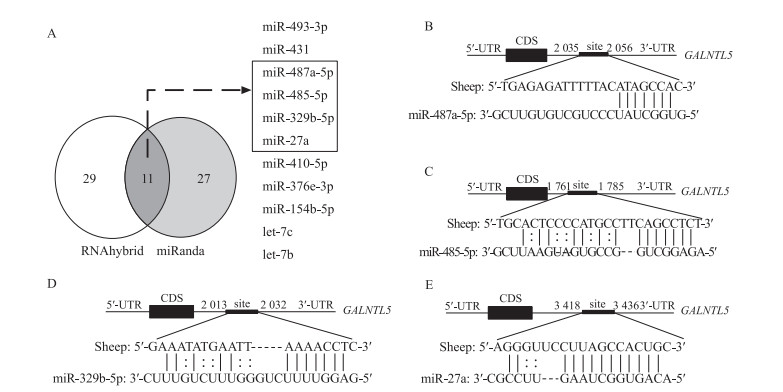
|
图 3 RNAhybrid和miRanda软件预测GALNTL5 的miRNA Fig. 3 Prediction of miRNA targeting GALNTL5 gene by RNAhybrid and miRanda software A.韦恩图展示RNAhybrid和miRanda 2种软件预测miRNA交集; B—E. 4个候选miRNA与靶基因3′-UTR区域的结合位置示意图。 A. Venn diagram showing two software of RNAhybrid and miRanda to predict the intersection of miRNA; B-E. Schematic diagram of binding sites of 4 candidate miRNA to the 3′-UTR region of the target gene. |
如图 4所示:miR-487a-5p表达水平表现为性成熟后(9 M和24 M)显著高于性成熟前(3 M)(P < 0.05), 但9 M和24 M之间差异不显著(P>0.05);而miR-485-5p呈现相反趋势, 表现为性成熟前(3 M)显著高于性成熟后(9 M和24 M)(P < 0.05), 但9 M与24 M之间差异不显著(P>0.05);miR-27a表达水平随着日龄的增加而显著下降(P < 0.05);miR-329b-5p不同月龄之间差异不显著(P>0.05)。
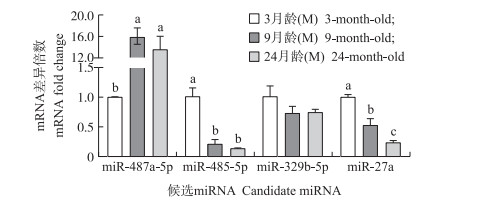
|
图 4 4个候选miRNA在不同月龄附睾尾组织中的表达水平 Fig. 4 The expression level of four candidate miRNA in the cauda epididymidis of Hu sheep at different ages |
由表 2可知:附睾尾中GALNTL5 mRNA表达量与miR-487a-5p极显著正相关(P < 0.01), 而与miR-485-5p和miR-27a极显著负相关(P < 0.01);miR-329b-5p表达量与GALNTL5 表达量负相关, 但未达到显著水平(P>0.05)。
| 项目Items | miR-487a-5p | miR-485-5p | miR-329b-5p | miR-27a |
| GALNTL5 | 0.884** | -0.922** | -0.348 | -0.796** |
| Note:**P < 0.01. | ||||
众所周知, 糖蛋白参与细胞识别、分化、发育、信号转导、免疫应答等各种重要的生命活动。而pp-GalNAc-T家族作为催化合成糖蛋白的起始酶, 提示其在动物机体中扮演着重要的角色[10-11]。人类全基因组中共发现该家族中有20个成员, 其中, 已证实17个成员在动物机体中具有独特的组织分布[3-4]。前期研究发现, pp-GalNAc-T1、-T2、-T3、-T4、-T7和-T8广泛分布于人的组织中[12-15], 而该家族其他成员则表现为特异性组织分布[2-3, 16-20]。已有研究证实pp-GalNAc-T2、-T3、-T12、-T20在雄性动物睾丸中表达; pp-GalNAc-T10和-T15在雌性动物卵巢和胎盘中表达。研究者也对pp-GalNAc-T家族中的新成员pp-GalNAc-T19(GALNTL5)进行了研究, 发现GALNTL5存在于睾丸、卵巢、子宫、输卵管和精子中[2, 4-8]。综上表明, pp-GalNAc-T家族在动物的繁殖性能方面起关键作用。
附睾作为精子成熟的靶器官, GALNTL5是否存在于附睾中以及如何变化, 目前还未见报道。本试验首先检测了GALNTL5在不同发育阶段湖羊附睾头、体、尾中mRNA和蛋白的表达规律。GALNTL5 mRNA和蛋白在性成熟后(9 M和24 M)的表达量显著高于性成熟前(3 M), 这一现象与在成年牛睾丸中GALNTL 5 mRNA的表达量显著高于犊牛睾丸的表达趋势一致[6]。同时, 本课题组前期对性成熟前、后湖羊睾丸的研究结果也证实了这一点[7]。本试验进一步定位研究结果显示, GALNTL5存在于不同发育阶段湖羊附睾头、体、尾中, 且定位于基细胞、主细胞和精子中。GALNTL5在精子中的表达在一定程度上解释了上述性成熟后GALNTL5表达量显著升高的现象。
GALNTL5存在于主细胞和基细胞是值得注意的现象。这是由于主细胞和基细胞主要功能是分泌一些糖蛋白、甘油磷酸胆碱、肉毒碱及多种酶类, 参与精子的成熟、代谢, 维持附睾管腔的特殊微环境[21]。因为GALNTL5作为催化合成糖蛋白的起始酶, 其可能通过参与附睾糖蛋白的合成, 进而影响精子的成熟, 但具体机制还需要进一步研究。同时, 从免疫组化结果也可以发现, 在性成熟后(9 M和24 M)附睾体和附睾尾精子中也检测到GALNTL5的阳性信号。这一结果与前期试验结果一致[2, 8]。前期我们研究发现, GALNTL5在采集的新鲜精液和附睾尾精子中的表达存在一定差异, GALNTL5主要定位于新鲜精液的中段和头部, 而在附睾尾精子中则存在于头颈结合部位和顶体[8], 提示GALNTL5在精子成熟过程中起不同作用。
研究者对附睾[22]、睾丸[23]和精子[24]中miRNA表达谱进行系统研究, 发现大量miRNA在调控精子成熟和精子发生过程中扮演重要角色。本试验结果表明, miR-487a-5p在附睾尾中表达水平与GALNTL5 的表达趋势极显著正相关; 而miR-485-5p和miR-27a表达水平与GALNTL5 表达水平极显著负相关。miRNA主要在转录水平调控靶基因, 通过与mRNA的3′UTR或者CDS区互补序列特异性结合而识别靶标, 进而阻遏靶基因的翻译[25]。据此我们推测miR-485-5p和miR-27a可能与GALNTL5 之间存在靶向关系, 这还需要进一步采用双荧光素酶报告基因的技术对其进行验证。
总之, GALNTL5定位于湖羊附睾中的主细胞、基细胞和精子中, 且GALNTL5 mRNA和蛋白在湖羊附睾头、体、尾中表现为性成熟后(9 M和24 M)显著高于性成熟前(3 M), 提示GALNTL5 在精子成熟过程中发挥重要作用。miR-485-5p和miR-27a在附睾尾中的表达趋势和GALNTL5 相反, 提示miR-485-5p和miR-27a可能与GALNTL5 之间存在靶向关系, 这将为后续探究miRNA如何调控GALNTL5 奠定基础。
| [1] |
Bennett E P, Mandel U, Clausen T A, et al. Control of mucin-type O-glycosylation:a classification of the polypeptide GalNAc-transferase gene family[J]. Glycobiology, 2012, 22: 736-756. DOI:10.1093/glycob/cwr182 |
| [2] |
Takasaki K, Tachibana S O, Matsuzaki H, et al. A heterozygous mutation of GALNTL5 affects male infertility with impairment of sperm motility[J]. Proc Natl Acad Sci USA, 2014, 111: 1120-1125. DOI:10.1073/pnas.1310777111 |
| [3] |
Peng C, Togayachi A, Kwon Y D, et al. Identification of a novel human UDP-GalNAc transferase with unique catalytic activity and expression profile[J]. Biochem Bioph Res Commun, 2010, 402: 680-686. DOI:10.1016/j.bbrc.2010.10.084 |
| [4] |
Raman J, Guan Y, Perrine C L, et al. UDP-N-acetyl-alpha-D-galactosamine:polypeptide N-acetylgalactosaminyltransferases:completion of the family tree[J]. Glycobiology, 2012, 22: 768-777. DOI:10.1093/glycob/cwr183 |
| [5] |
Kierszenbaum A L, Rivkin E, Tres L L. Acroplaxome, an F-actin-keratin-containing plate, anchors the acrosome to the nucleus during shaping of the spermatid head[J]. Mol Biol Cell, 2003, 14: 4628-4640. DOI:10.1091/mbc.e03-04-0226 |
| [6] |
Li H, Jiang Q, Ju Z H, et al. A novel splice variant of the bovine GALNTL 5 gene identified in Chinese Holstein bull testis tissue and its mRNA expression[J]. Genet Mol Res, 2016, 15(2): 15027723. |
| [7] |
Yao X, Yang H, Zhang Y, et al. Characterization of GALNTL 5 gene sequence and expression in ovine testes and sperm[J]. Theriogenology, 2017, 95: 54-61. DOI:10.1016/j.theriogenology.2017.02.018 |
| [8] |
Yao X L, Ei-samahy M A, Feng X, et al. Expression and localization of polypeptide N-acetylgalactosaminyltransferase-like protein 5 in the reproductive organs and sperm of Hu sheep[J]. Anim Reprod Sci, 2017, 187: 159-166. DOI:10.1016/j.anireprosci.2017.10.020 |
| [9] |
张谊, 黄晨, 李俄然, 等. FSHR、PGR在建昌黑山羊睾丸和附睾中的分布和发育性表达研究[J]. 畜牧与兽医, 2016, 48(6): 35-40. Zhang Y, Huang C, Li E R, et al. Localization, distribution and developmental expression of follicle-stimulating hormone receptor and progesterone receptor in the testis and epididymis of Jianchang black goat[J]. Animal Husbandry & Veterinary Medicine, 2016, 48(6): 35-40 (in Chinese). |
| [10] |
Tenhagen B G, Hagen F K, Balys M M, et al. Cloning and expression of a novel, tissue specifically expressed member of the UDP-GalNAc:polypeptide N-acetylgalactosaminyltransferase family[J]. J Biol Chem, 1998, 273: 27749-27754. DOI:10.1074/jbc.273.42.27749 |
| [11] |
Cheng L M, Tachibana K, Iwasaki H, et al. Characterization of a novel human UDP-GalNAc transferase, pp-GalNAc-T15[J]. FEBS Letter, 2004, 566: 17-24. DOI:10.1016/j.febslet.2004.03.108 |
| [12] |
Bennett E P, Hassan H, Hollingsworth M A, et al. A novel human UDP-N-acetyl-D-galactosamine:polypeptide N-acetylgalactosaminyltransferase, GalNAc-T7, with specificity for partial GalNAc-glycosylated acceptor substrates[J]. FEBS letter, 1999, 460: 226-230. DOI:10.1016/S0014-5793(99)01268-5 |
| [13] |
White K E, Lorenz B, Evans W E, et al. Molecular cloning of a novel human UDP-GalNAc:polypeptide N-acetylgalactosaminyltransferase, GalNAc-T8, and analysis as a candidate autosomal dominant hypophosphatemic rickets(ADHR)gene[J]. Gene, 2000, 246: 347-356. DOI:10.1016/S0378-1119(00)00050-0 |
| [14] |
Niang B, Jin L, Chen X, et al. GalNAc-T4 putatively modulates the estrogen regulatory network through FOXA1 glycosylation in human breast cancer cells[J]. Mol Cell Biochem, 2015, 411: 393-402. |
| [15] |
Wandall H H, Hassan H, Mirgorodskaya E, et al. Substrate specificities of three members of the human UDP-N-acetyl-alpha-D-galactosamine:polypeptide N-acetylgalactosaminyltransferase family, GalNAc-T1, -T2, and -T3[J]. J Biol Chem, 1997, 272: 23503-23514. DOI:10.1074/jbc.272.38.23503 |
| [16] |
Banford S, Timson D J. UDP-N-acetyl-D-galactosamine:polypeptide N-acetylgalactosaminyltransferase-6(pp-GalNAc-T6):role in cancer and prospects as a drug target[J]. Curr Cancer Drug Tar, 2017, 17: 53-61. |
| [17] |
Kubota T, Shiba T, Sugioka S, et al. Structural basis of carbohydrate transfer activity by human UDP-GaINAc:polypeptide alpha-N-acetylgalactosaminyltransferase(pp-GaINAc-T10)[J]. J Mol Biol, 2006, 359: 708-727. DOI:10.1016/j.jmb.2006.03.061 |
| [18] |
Boskovski M T, Yuan S A, Pedersen N B, et al. The heterotaxy gene GALNT 11 glycosylates Notch to orchestrate cilia type and laterality[J]. Nature, 2013, 504(7480): 456. DOI:10.1038/nature12723 |
| [19] |
Lorca V, Rueda D, Martin-morales L, et al. Role of GALNT12 in the genetic predisposition to attenuated adenomatous polyposis syndrome[J]. PLoS One, 2017, 12(11): e0187312. DOI:10.1371/journal.pone.0187312 |
| [20] |
Hussain M R, Nasir J, Al-aama J Y. Clinically significant missense variants in Human GALNT 3, GALNT8, GALNT12, and GALNT 13 genes:intriguing in silico findings[J]. J Cell Biochem, 2014, 115(2): 313. DOI:10.1002/jcb.24666 |
| [21] |
Voglmayr J K, Fairbanks G, Lewis R G. Surface glycoprotein changes in ram spermatozoa during epididymal maturation[J]. Biol Reprod, Biol Reprod, 29(3): 767-775. |
| [22] |
Qing X R, Shi J, Dong T T, et al. Dysregulation of an X-linked primate-specific epididymal microRNA cluster in unexplained asthenozoospermia[J]. Oncotarget, 2017, 8: 56839-56849. |
| [23] |
Wu S R, Guo W, Li Y L, et al. miRNA and piRNA expression profiles of breeder cock testes detected by next-generation sequencing[J]. Reprod Domest Anim, 2017, 52(2): 203-213. DOI:10.1111/rda.12880 |
| [24] |
Stowe H M, Calcatera S M, Dimmick M A, et al. The bull sperm micrornaome and the effect of fescue toxicosis on sperm microRNA Expression[J]. PLoS One, 2014, 9(12): e113163. DOI:10.1371/journal.pone.0113163 |
| [25] |
Vicentini C, Fassan M, Angelo E D, et al. Clinical application of microRNA testing in neuroendocrine tumors of the gastrointestinal Tract[J]. Molecules, 2014, 19: 2458-2468. DOI:10.3390/molecules19022458 |




