文章信息
- 王永恒, 张恩, 黄璐璐, 王佳璐, 杨倩
- WANG Yongheng, ZHANG En, HUANG Lulu, WANG Jialu, YANG Qian
- 口服灭活猪流行性腹泻病毒后仔猪消化道特异性SIgA检测及相关性分析
- Detection and correlation analysis of digestive tract specific SIgA by oral inactivated porcine epidemic diarrhea virus
- 南京农业大学学报, 2019, 42(3): 499-504
- Journal of Nanjing Agricultural University, 2019, 42(3): 499-504.
- http://dx.doi.org/10.7685/jnau.201804032
-
文章历史
- 收稿日期: 2018-04-19
猪流行性腹泻(porcine epidemic diarrhea, PED)是由猪流行性腹泻病毒(porcine epidemic diarrhea virus, PEDV)引起的急性、高度接触传染性消化道疾病, 主要症状为呕吐、水样腹泻和脱水[1]。目前, PED在全世界广泛流行和迅速传播, 已给全世界养猪业带来巨大的经济损失。目前, 国内预防PED主要采用传统的肌肉注射或皮下注射进行免疫[2], 但该方法不能产生较好的免疫保护, 致使PED在我国养猪场肆虐蔓延。
PEDV主要通过消化道进行传播。口服免疫可以产生局部黏膜免疫反应, 从而抑制病原通过黏膜入侵机体[3-4], 有效防止疾病的发生。此外, 相较于传统免疫, 口服免疫不仅方便、安全, 而且可有效刺激肠道局部黏膜免疫和全身免疫[5]。因此, 口服免疫一直受到国内外专家的重视。但口服免疫因缺乏评价标准(如肠道黏液分泌的抗体难以获取和检测)长期以来得不到广泛推广[6]。因此, 建立口服免疫的评价标准已成为亟待解决的问题。
分泌型IgA(secretory immunoglobulin A, SIgA)是黏膜分泌物中主要的免疫球蛋白, 也是黏膜免疫的主要效应因子[7]。肠道黏膜固有层中IgA分泌细胞分泌的IgA单体和J链连接形成二聚体, 到达上皮细胞间隙时与上皮细胞的分泌成分(secretory component, SC)结合形成SIgA[8]。SIgA从游离面释放进入肠腔, 与黏液一起分布在肠道黏膜表面。SIgA具有多种生物学功能, 如具有抑制病原体黏附、抗病毒感染、免疫清除、抗过敏、促进天然抗菌因子产生等[9]。SIgA因通过与病毒结合可防止病毒入侵而受到高度关注, 因此, SIgA已成为检测和判断黏膜免疫和抗病毒的重要指标。本试验应用灭活PEDV给仔猪口服免疫, 通过iELISA检测消化道不同部位和血清中特异性SIgA水平, 应用空斑减少中和试验和荧光定量PCR(qPCR)方法对消化道不同部位抗PEDV水平做进一步检测, 并对消化道不同部位的SIgA水平进行相关性分析, 为建立口服免疫评价标准提供试验依据。
1 材料与方法 1.1 细胞、病毒和动物Vero E6细胞株(ATCC CRL-1586)和PEDV Zhejiang08株由大北农兽医研究中心提供; 5日龄新生仔猪(PEDV检测阴性)由江苏省农业科学院兽医研究所提供。
1.2 试验材料DMEM培养基、2.5 g · L-1胰蛋白酶购于维森特生物技术有限公司; 12孔细胞培养板购于南京菲尔特生物公司; 辣根过氧化物酶标记的羊抗猪IgA购于Abcam公司; TMB底物显色液、硫酸终止液购于索莱宝生物科技有限公司; 96孔酶标板为依科赛生物科技(太仓)有限公司产品; 全自动吸光度/荧光多功能酶标仪购于伯乐生命医学产品(上海)有限公司; 其他化学试剂为分析纯, 购于南京杰汶达生物科技有限公司; RNA提取试剂盒、反转录试剂盒和SYBR Green Mix为TaKaRa公司产品; 96型荧光定量PCR仪为BIOER公司产品; 微量分光光度计为美国Thermo公司产品; BCA蛋白检测试剂盒为Thermo公司产品。
1.3 试验分组与免疫选取12头5日龄新生仔猪随机分为2组, 每组6头, 自由饮水、采食, 常规饲养管理。试验组口服免疫2 mL灭活PEDV(PEDV whole inactivated virus, PEDV WIV)。108 PFU · mL-1, 100 ℃水浴15 min灭活, 并经过空斑试验检测灭活完全, 未见空斑形成); 对照组口服2 mL 0.01 mol · L-1 PBS, 7 d后二次免疫, 免疫后28 d处死并采样。
1.4 引物设计根据GenBank中登录的PEDV基因序列设计1对特异性引物, 对PEDV的N基因保守序列进行扩增。引物对序列:5′-CACCTCCTGCTTCACGTACA-3′/5′-AGCTCCACGACCCTGGTTAT-3′。设计内参基因GAPDH引物对序列:5′-TCATCATCTCTGCCCCTTCT-3′/5′-GTCATGAGTCCCTCCACGAT-3′。以上引物均由南京金斯瑞公司合成。
1.5 样品的采集与处理分别采集免疫后28 d试验组和对照组仔猪血清、唾液、粪便及小肠黏液、大肠黏液。
血清采集与处理:前腔静脉无菌采集全血, 4 ℃、3 000 r · min-1离心5 min, 取上清液分装于无菌EP管中, -70 ℃保存备用; 唾液采集与处理:无菌棉签在仔猪口腔内停留15 s, 取出浸入盛有0.8 mL预冷PBS的EP管中, 涡旋1 min, 4 ℃、10 000 r · min-1离心10 min, 取上清液分装于无菌EP管中, -70 ℃保存备用; 粪便采集与处理:无菌棉签在仔猪肛门处采集粪便, 取出约0.1 g浸入盛有0.8 mL预冷PBS的EP管中, 涡旋1 min, 4 ℃、10 000 r · min-1离心10 min, 取上清液分装于无菌EP管中, -70 ℃保存备用; 小肠、大肠黏液采集与处理:取3 cm肠段, 刮取肠腔黏液层, 浸入盛有0.8 mL预冷PBS的EP管中, 涡旋1 min, 4 ℃、10 000 r · min-1离心10 min, 取上清液分装于无菌EP管中, -70 ℃保存备用。
1.6 间接ELISA(iELISA)检测抗PEDV特异性SIgA抗体水平通过Vero E6细胞扩培病毒, 反复冻融3次, 收集病毒悬液, 4 ℃ 100 000 g超速离心2.5 h, 0.1 mol · L-1无菌PBS重悬沉淀。通过空斑试验检测病毒滴度为3×108 PFU · mL-1, BCA蛋白检测试剂盒检测蛋白浓度为5.7 mg · mL-1, 纯度为5.2×107 PFU · mg-1。
以纯化的PEDV全病毒作为抗原包被96孔ELISA反应板(每孔100 μL, 2 μg · mL-1), 4 ℃包被过夜; 用含30 g · L-1牛血清白蛋白(BSA)的PBST(每孔100 μL)37 ℃封闭2 h; 加入含1 g · L-1 BSA的PBST稀释样品(每孔100 μL), 其中血清1 : 100稀释, 其余均1 : 2稀释。每个样品3个平行, 封膜后37 ℃孵育1.5 h; 加入1 : 1 000稀释的HRP标记羊抗猪IgA二抗(每孔100 μL), 封膜后37 ℃孵育1 h; 加TMB显色液(每孔100 μL), 37 ℃避光显色10 min; 加终止液(每孔50 μL), 5 min内用酶标测定仪测定每孔的吸光值(A450)。阴、阳性值判定标准:计算阴性样品A450的平均值(x)和标准差(SD)。当样品A450>x+3SD, 表示阳性, 反之为阴性。
1.7 空斑减少中和试验检测黏液样品抗PEDV水平应用空斑减少中和试验(plaque reduction neutralization test, PRNT)检测消化道不同部位抗PEDV水平。取20 PFU · μL-1 PEDV病毒稀释液50 μL, 与50 μL消化道不同部位黏液样品或0.1 mol · L-1 PBS混合, 37 ℃孵育1 h。DMEM培养基补足1 mL, 混合物通过0.22 μm滤膜过滤除菌, 加入到含有单层Vero E6细胞的12孔细胞培养板中, 37 ℃、5% CO2培养箱培养1 h。弃去上层液体, 将含有中性红的营养琼脂添加到细胞板中(每孔1 mL), 3 d内可视化斑块形成。经4%(体积分数)多聚甲醛固定后, 加入10 g · L-1结晶紫染色, 然后进行空斑计数。
1.8 荧光定量PCR(qPCR)检测PEDV N基因(mRNA)的相对表达量取20 PFU · μL-1 PEDV病毒稀释液50 μL, 与50 μL消化道不同部位黏液样品或0.1 mol · L-1 PBS混合, 37 ℃孵育1 h。DMEM培养基补足1 mL, 混合物通过0.22 μm滤膜过滤除菌, 加入到含有单层Vero E6细胞的12孔细胞培养板中, 37 ℃、5% CO2培养箱培养1 h。弃上层液, 加入含2%胎牛血清的DMEM培养基, 培养24 h。按照RNA提取试剂盒说明书提取RNA。将提取的RNA通过反转录试剂盒进行反转录(RT), 获得cDNA。荧光定量PCR(qPCR)检测PEDV N mRNA相对表达量。qPCR反应体系:SYBR Green Mix 10 μL, PEDV N基因和GAPDH引物对各0.4 μL, cDNA模板2 μL, 去离子水7.2 μL。反应条件: 95 ℃ 30 s; 95 ℃ 5 s, 60 ℃ 30 s, 40个循环。每个基因3个平行, 采用2-ΔΔCT法计算PEDV N mRNA的相对表达量。
1.9 数据处理与统计数据均采用平均值±标准差(x±SD)表示。应用SPSS 16.0软件对试验数据进行统计分析, 采用单因素方差分析(One-way ANOVA)和t测验进行差异显著性分析。采用Spearman相关系数法进行相关性分析。
2 结果与分析 2.1 血清及消化道不同部位黏液中的PEDV特异性SIgA抗体水平试验采用iELISA方法检测免疫28 d后仔猪唾液、肠道黏液(小肠黏液和大肠黏液)、粪便、血清样品。以对照组为阴性样本, 计算唾液、肠道黏液、粪便、血清特异性SIgA水平(A450)的x和SD, 根据阴、阳性临界值(x+3SD)计算唾液、小肠黏液、大肠黏液、粪便、血清的阴、阳性临界值分别为0.181、0.203、0.204、0.212、0.241。如图 1所示:唾液、肠道黏液、粪便、血清样本中特异性SIgA值均大于对应的阴、阳性临界值, 试验结果显示口服灭活PEDV疫苗28 d后仔猪唾液、肠道黏液、粪便、血清具有抗体阳性水平, 且与对照组相比差异显著。其中小肠黏液SIgA水平相对较高, 大肠黏液次之, 唾液、粪便中SIgA均低于肠道中SIgA水平。
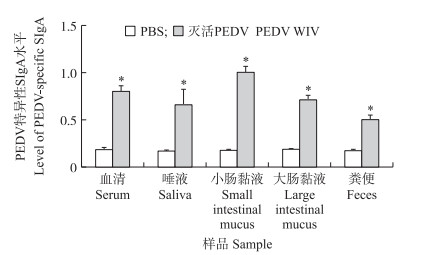
|
图 1 免疫后28 d仔猪唾液、小肠黏液、大肠黏液、粪便及血清中特异性SIgA水平(n=6) Fig. 1 Specific SIgA levels in saliva, small intestinal mucus, large intestine mucus, feces and serum of piglets 28 days after immunization with PEDV whole inactivated virus(WIV) 与对照(PBS)组相比, *P < 0.05。 Compared with the PBS control, *P < 0.05. The same as follows. |
有文献报道, SIgA可以通过与病毒结合而防止病毒入侵[10]。本试验通过PRNT检测黏膜处样品抗PEDV水平。如图 2所示:消化道不同部位黏液样品均具有一定的抗PEDV水平, 且PBS对照组抗病毒水平为55%~60%, 这可能与黏膜处存在大量的抗菌抗病毒物质有关, 如各种细胞因子、酶、抗菌肽等; 免疫后仔猪肠道黏膜处样品抗病毒效果显著高于对照组; 而唾液样品抗病毒效果与对照组相近, 粪便样品抗病毒效果高于对照组但差异不显著。结合图 1中仔猪各部位黏膜处SIgA水平, 消化道样品的抗病毒水平可能与其SIgA水平的高低有关。
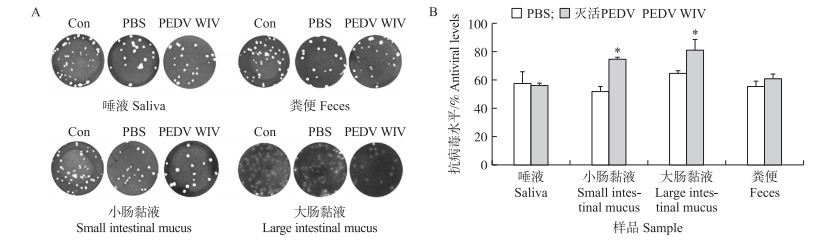
|
图 2 免疫后28 d仔猪唾液、小肠黏液、大肠黏液、粪便抗PEDV水平观察与统计
Fig. 2 Plaque picture and levels statistical of anti-PEDV in saliva, small intestinal mucus, large intestinal mucus, and feces of piglets 28 days after immunization
A.唾液、粪便、小肠黏液、大肠黏液抗PEDV空斑图片; B.消化道不同部位抗PEDV统计结果(n=6)。 Con代表PEDV与0.1 mol · L-1 PBS孵育组; PBS代表PEDV与口服PBS仔猪黏液孵育组; PEDV WIV代表PEDV与口服免疫灭活PEDV仔猪黏液孵育组。 A. Saliva, feces, small intestinal mucus, large intestinal mucus anti-PEDV plaque pictures; B. Different parts of the digestive tract anti-PEDV statistical results(n=6). Con represents PEDV and 0.1 mol · L-1 PBS incubation; PBS represents PEDV and mucus of oral PBS piglets; PEDV WIV represents PEDV and mucus of oral immunization inactivated PEDV piglets. |
荧光定量PCR检测PEDV N基因mRNA相对表达量, 如图 3所示, 口服免疫灭活PEDV仔猪小肠黏液、大肠黏液处理后PEDV N基因mRNA相对表达量显著降低, 即PEDV感染复制量降低, 结果提示, 小肠、大肠黏液具有显著抗PEDV的作用。而唾液和粪便处理后PEDV N基因mRNA相对表达量与对照组没有显著差异, 表明两者没有显著抗PEDV作用。且这些试验结果与图 2空斑减少中和试验结果相一致。
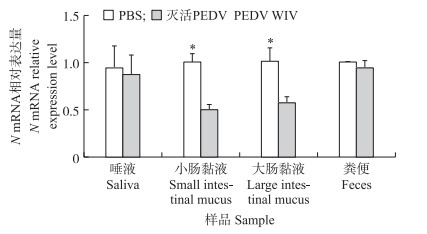
|
图 3 免疫后28 d唾液、小肠黏液、大肠黏液、粪便处理后PEDV N基因mRNA相对表达量(n=6) Fig. 3 Levels of PEDV N gene mRNA relative expression level after administrating saliva, small intestine mucus, large intestine mucus, and feces of piglets 28 days after immunization(n=6) |
肠道黏膜处样本可评估局部黏膜免疫力, 然而, 肠道黏膜处样品的采集比较困难, 相比之下, 消化道其他部位, 如口腔唾液、肛门粪便的采集较为方便简单。但是, 唾液、粪便样品的SIgA水平能否代替肠道黏膜处样品SIgA水平, 目前还不清楚。因此, 本试验通过SPSS 16.0软件, 使用Spearman相关系数法评估唾液、粪便中特异性SIgA水平与相应小肠黏液、大肠黏液特异性SIgA水平之间的相关性。结果如表 1所示:肠道黏膜样品小肠黏液与大肠黏液SIgA水平显著相关(r=0.943, P < 0.05);粪便和小肠黏液、大肠黏液SIgA水平均显著相关(r=0.771、0.829, P < 0.05);唾液和小肠黏液、大肠黏液SIgA水平显著相关(r=0.766、0.771, P < 0.05);而血清与小肠黏液SIgA水平具有一定相关性(r=0.714, P=0.111)。
| 因子Factors | 唾液Saliva | 粪便Feces | 血清Serum | 小肠黏液Small intestinal mucus |
| 小肠黏液Small intestinal mucus | 0.766* | 0.771* | 0.714 | — |
| 大肠黏液Large intestinal mucus | 0.771* | 0.829* | — | 0.943* |
| Note:*P < 0.05. | ||||
猪的整个消化道(从口腔到大肠)黏膜下均分布大量相关淋巴组织和淋巴细胞[11], 其中小肠中分布数量最多, 尤其是空肠和回肠含有散在或连续分布的集合淋巴结(即派尔氏斑)。因此, 在仔猪小肠中SIgA水平相对较高。大肠黏膜下也分布有IgA分泌细胞[11], 所以大肠黏液中也有较高水平的SIgA, 但低于小肠中SIgA水平。由于肠道中消化酶的存在, 随着SIgA在肠道中不断降解, 粪便中SigA水平也相应降低。唾液中的SIgA主要来源于扁桃体, 猪口腔后部分布有会厌扁桃体、软腭扁桃体和舌扁桃体[3, 12], 这使得唾液中也能检测出SIgA, 但低于肠道中SIgA水平。
SIgA可以与病毒结合从而防止病毒入侵小肠上皮细胞[13]。黏膜表面SIgA与肠黏膜上皮间杯状细胞分泌的黏液能一起更有效防止病毒入侵。为了解口服灭活PEDV免疫后SigA水平的变化, 我们应用空斑减少中和试验和荧光定量PCR方法检测了唾液、小肠黏液、大肠黏液、粪便中SIgA的抗病毒效果, 发现免疫后SIgA的抗病毒效果显著增加, 表明口服灭活PEDV可阻止PEDV对肠道的入侵, 进而预防猪流行性腹泻的发生。从本研究结果还发现正常猪黏液也具有抗病毒的作用, 这与Lieleg等[14]报道猪胃肠黏液具有抗病毒作用的观点一致。
通常认为口服PEDV效果不太好, 短期内不能产生较好的保护效果。本试验结果表明免疫28 d后仔猪唾液、小肠黏液、大肠黏液、粪便中特异性SIgA等达到一定水平, 这可能与试验选用新生仔猪有关。其消化道结构功能还不够完善, 分泌胃酸能力较弱, 灭活的PEDV可以更多地通过胃到达肠道并刺激免疫反应; 因此, 免疫后28 d依旧有抗体产生。而陈振波[15]通过对仔猪口服免疫灭活PEDV, 发现免疫后35 d仍具有一定的抗体水平。
传统的免疫接种通过检测血液中IgG水平判定动物体内免疫效果。而口服免疫后其肠道黏膜处样品采集困难, 评估黏膜处产生的抗体水平也相应较难。与肠道黏膜处黏液相比, 唾液和粪便则采集方便, 易于操作。Haneberg等[16]通过Pearson相关系数法比较不同免疫途径SIgA水平的相关性。Gerber等[17]通过Spearman相关系数法比较发现仔猪样品中血清与粪便SIgA水平具有显著相关性。本试验利用Spearman相关系数法对不同黏膜部位特异性SIgA水平进行了相关性分析, 发现肠道黏液(小肠和大肠黏液)与粪便、唾液中PEDV特异性SIgA水平具有显著的相关性, 表明通过检测粪便或唾液中特异性SIgA水平可以评估猪群中口服PEDV的效果, 这是首次证明仔猪口服免疫后消化道中各段黏膜中SIgA水平的相关性, 也为建立口服免疫评价标准提供试验依据。
此外, 我们还发现血液中的特异性SIgA水平与肠道黏膜处特异性SIgA水平也具有相关性, 提示血液中的特异性SIgA水平可部分代表肠黏膜的特异性抗体水平。
| [1] |
Collin E A, Anbalagan S, Okda F, et al. An inactivated vaccine made from a U.S. field isolate of porcine epidemic disease virus is immunogenic in pigs as demonstrated by a dose-titration[J]. BMC Veterinary Research, 2015, 11(1): 1-9. DOI:10.1186/s12917-014-0312-6 |
| [2] |
杨德全, 鞠厚斌, 葛菲菲, 等. 猪流行性腹泻病毒研究现状[J]. 畜牧与兽医, 2013, 45(8): 110-113. Yang D Q, Ju H B, Ge F F, et al. Research status of porcine epidemic diarrhea virus[J]. Animal Husbandry and Veterinary Medicine, 2013, 45(8): 110-113 (in Chinese). |
| [3] |
杨倩. 猪黏膜免疫:前景与挑战[J]. 南京农业大学学报, 2018, 41(2): 218-222. Yang Q. Mucosal immunity in pigs:prospects and challenges[J]. Journal of Nanjing Agricultural University, 2018, 41(2): 218-222 (in Chinese with English abstract). DOI:10.7685/jnau.201712003 |
| [4] |
Song D, Park B. Porcine epidemic diarrhoea virus:a comprehensive review of molecular epidemiology, diagnosis, and vaccines[J]. Virus Genes, 2012, 44(2): 167-175. DOI:10.1007/s11262-012-0713-1 |
| [5] |
蔡汝健, 张乐宜, 宋长绪. 2010-2013年华南地区猪流行性腹泻病流行情况调查及防控效果[J]. 广东农业科学, 2013, 40(11): 104-105, 114. Cai R J, Zhang L Y, Song C X. Epidemiological survey of epidemic diarrhoea in South China and its prevention and control effect in 2010-2013[J]. Guangdong Agricultural Science, 2013, 40(11): 104-105, 114 (in Chinese with English abstract). DOI:10.3969/j.issn.1004-874X.2013.11.030 |
| [6] |
许宝华, 袁俊, 何锡忠, 等. 猪黏膜免疫系统的重要性及其检测方法的研究[J]. 上海畜牧兽医通讯, 2012(5): 12-13. Xu B H, Yuan J, He X Z, et al. The importance of the mucosal immune system in pigs and the study of its detection methods[J]. Shanghai Journal of Animal Surveillance, 2012(5): 12-13 (in Chinese). DOI:10.3969/j.issn.1000-7725.2012.05.006 |
| [7] |
Fagarasan S, Honjo T. Regulation of IgA synthesis at mucosal surfaces[J]. Current Opinion in Immunology, 2004, 16(3): 277-283. DOI:10.1016/j.coi.2004.03.005 |
| [8] |
Woof J M, Kerr M A. The function of immunoglobulin A in immunity[J]. Gut, 2000, 208(2): 751-752. |
| [9] |
Panda S, Ding J L. Natural antibodies bridge innate and adaptive immunity[J]. Journal of Immunology, 2015, 194(1): 13-20. DOI:10.4049/jimmunol.1400844 |
| [10] |
Terauchi Y, Sano K, Ainai A, et al. IgA polymerization contributes to efficient virus neutralization on human upper respiratory mucosa after intranasal inactivated influenza vaccine administration[J]. Human Vaccines & Immunotherapeutics, 2018, 14(6): 1351-1361. |
| [11] |
车传燕, 杨倩. 断奶仔猪胃肠道中IgA和IgG分泌细胞的分布[J]. 畜牧兽医学报, 2010, 41(5): 615-620. Che C Y, Yang Q. Distribution of IgA and IgG secretion cells in the gastrointestinal tract of weaned piglets[J]. Journal of Animal Husbandry and Veterinary, 2010, 41(5): 615-620 (in Chinese with English abstract). |
| [12] |
Liu Z, Yu Q, Li P, et al. Histological and ultrastructural examinations of porcine tonsils[J]. Anatomical Record, 2012, 295(4): 686-690. DOI:10.1002/ar.21534 |
| [13] |
Wang H, Deng X, Zhou T, et al. The in vitro immunomodulatory activity of a polysaccharide isolated from Kadsura marmorata[J]. Carbohydrate Polymers, 2013, 97(2): 710-715. DOI:10.1016/j.carbpol.2013.05.042 |
| [14] |
Lieleg O, Lieleg C, Bloom J, et al. Mucin biopolymers as broad-spectrum antiviral agents[J]. Biomacromolecules, 2012, 13(6): 17-24. |
| [15] |
陈振波.猪流行性腹泻病毒YX株的分离鉴定及其灭活疫苗免疫效力试验研究[D].广州: 华南农业大学, 2016. Chen Z B. Isolation and identification of porcine epidemic diarrhea virus YX strain and study on its immune efficacy[D]. Guangzhou.: South China Agricultural University, 2016(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10564-1016922771.htm |
| [16] |
Haneberg B, Kendall D, Amerongen H M, et al. Induction of specific immunoglobulin A in the small intestine, colon-rectum, and vagina measured by a new method for collection of secretions from local mucosal surfaces[J]. Infection & Immunity, 1994, 62(1): 15-23. |
| [17] |
Gerber P F, Opriessnig T. Detection of immunoglobulin(Ig)A antibodies against porcine epidemic diarrhea virus(PEDV)in fecal and serum samples[J]. MethodsX, 2015, 2: 368-373. DOI:10.1016/j.mex.2015.10.001 |




