文章信息
- 赵丹, 邱冬, 韩德敏, 刘永杰
- ZHAO Dan, QIU Dong, HAN Demin, LIU Yongjie
- H3N2亚型犬流感病毒鼠/犬嵌合抗体scFv-Fc的制备与活性分析
- Preparation and activity of murine/canine chimeric antibody scFv-Fc against H3N2canine influenza virus
- 南京农业大学学报, 2019, 42(3): 474-481
- Journal of Nanjing Agricultural University, 2019, 42(3): 474-481.
- http://dx.doi.org/10.7685/jnau.201810024
-
文章历史
- 收稿日期: 2018-10-24
2. 江苏省动物疫病预防控制中心, 江苏 南京 210036
2. Jiangsu Provincial Animal Disease Control Center, Nanjing 210036, China
犬流感是由犬流感病毒(canine influenza virus, CIV)引起的犬的一种高度接触性传染病, 表现为呼吸困难、发热、喷嚏、肺炎, 甚至死亡。CIV属甲型流感病毒属(Influenzavirus A, IAV), 不仅对犬类的生存和健康带来严重危害, 同时也给人类健康带来了巨大风险。长期以来, IAV易感染人、马、猪、禽等宿主, 而犬不是其易感动物, 但近年来发现多种亚型的流感病毒也可感染犬。2004年, 在美国佛罗里达州赛犬中首次发现并分离到H3N8亚型流感病毒, 经遗传演化分析显示该病毒来源于马流感病毒, 被命名为H3N8犬流感病毒[1]; 2007年, 韩国爆发了H3N2亚型的犬流感病毒, 随后在中国和泰国等亚洲国家[2]和美国[3]也相继报道。尽管在犬体内还检测到H5N1[4]、H5N2[5]、H1N1[6]、H3N1[7]等亚型流感病毒, 但这些均属个例。
本课题组前期成功制备了针对H3N2亚型CIV的单克隆抗体(McAb), 并证实其具有较好的中和活性[8]。由于缺少合适的犬骨髓瘤细胞系, 目前临床上应用的McAb均为鼠源, 它的异源性限制了其在犬病治疗中的应用。近年来, 单链抗体(scFv)由于其免疫刺激小, 穿透力强, 相较单抗制备工艺简单而发展为目前研究最多的基因工程抗体之一[9]。邱冬等[10]在H3N2亚型CIV免疫小鼠的基础上, 利用基因工程技术制备了scFv, 并证实其具有一定的中和活性。然而, 与天然抗体不同, scFv的最大缺陷就是与靶抗原属于单价结合, 尽管单价结合具有较高的亲和力, 但也容易解离, 这使得scFv不能在体内长时间存留[11]。如将scFv基因片段与本动物源抗体恒定区(Fc)相连, 则既能减少单链抗体对机体的异源性, 又有助于二聚体的形成, 延长单链抗体在体内的半衰期。目前已有学者对犬细小病毒的scFv进行犬源化改造[12], 但在犬流感病毒scFv的犬源化上尚未见报道。
本试验在前期制备的具有良好中和活性CIV单抗的鼠源杂交瘤细胞株11E3基础上, 扩增小鼠重链可变区(VH)和轻链可变区(VL)基因, 构建H3N2 CIV特异性的scFv, 将其与犬源抗体Fc片段结合, 构建鼠/犬嵌合抗体scFv-Fc, 并分析其免疫学活性, 为进一步临床应用提供物质基础。
1 材料与方法 1.1 试验毒株、菌株及质粒H3N2亚型CIV毒株A/Canine/Jiangsu/06/2010(JS/10), GenBank序列号为JN247616—JN247623, 由本课题组Lin等[2]分离; 大肠杆菌DH5α、BL21(DE3)感受态细胞和原核表达质粒pET-32a(+), 均购自北京康为世纪生物科技有限公司; H3N2 CIV小鼠阳性血清、阴性血清及单克隆抗体细胞株11E3, 均由本课题组制备。
1.2 主要试剂与仪器总RNA提取试剂盒、质粒提取试剂盒、胶回收试剂盒, Omega公司; 片段回收试剂盒, TaKaRa公司; 19T连接试剂盒pClone007, 南京擎科生物技术有限公司; Taq酶、Primer Star HS高保真酶、反转录试剂盒、同源重组试剂盒, 南京诺唯赞公司; His鼠单抗、辣根过氧化物酶(HRP)标记羊抗鼠IgG、HRP标记羊抗犬IgG、增强型TMB显色剂, 北京鼎国昌盛生物技术有限公司; DMEM培养基、胎牛血清(FBS), 赛默飞世尔公司; His蛋白纯化柱, GE公司; T25细胞瓶、细胞培养板、酶标板, Corning公司。
台式离心机、低温高速离心机、低温超速离心机, Beckman公司; CO2恒温培养箱, 赛默飞世尔公司; 倒置显微镜、荧光显微镜, Nikon公司; 酶标仪、凝胶成像仪, Bio-Rad公司。
1.3 小鼠可变区基因的克隆与鉴定参照文献[13]设计并合成鼠源单克隆抗体可变区基因扩增通用引物对VH-F/R和VL-F/R, 用于扩增McAb的VH和VL基因。引物由上海英骏生物技术有限公司合成, 序列如表 1所示。将McAb细胞株11E3复苏, 为保证细胞纯度和较好的抗体分泌活性, 采用常规方法对复苏后的细胞进行3次亚克隆。提取细胞中总RNA, 使用反转录试剂盒进行反转录(RT), 以其cDNA为模板, 使用VH-F/R和VL-F/R引物对分别扩增VH与VL基因。将回收的VH和VL片段分别连接至克隆载体pMD19-T, 转化大肠杆菌DH5α感受态细胞, 挑取单菌落, 采用表 1中的载体鉴定引物对T7/T7t进行PCR鉴定。将PCR阳性菌送至苏州金唯智公司测序, 以确定抗体可变区基因序列。根据测序结果, 将符合抗体可变区序列特征的阳性菌分别命名为19T-VH和19T-VL。
| 引物对名称 Names of prime pairs |
引物对序列(5′→3′) Sequences of prime pairs(5′→3′) |
用途 Functions |
| VH-F/R | SAGGTSMARCTGCAGSAGTCWGG/GAGGAGACKGTGACHGTGGTSCC | 扩增小鼠抗体VH基因Amplify mouse antibody VH gene |
| VL-F/R | GACATTCAGCTGACCCAGTCTCCA/ CCGTTTGATCTCCAGCTTGGTCCC | 扩增小鼠抗体VL基因Amplify mouse antibody VL gene |
| P1/P2 | GCTGATATCGGATCCGAATTCTCAGGTGCAGCTGCAGGAGT/ GGAGCCGCCGCCGCCAGAACCACCACCACCAGAACCACCACCACC- AGGAGACGGTGACAGTGGT | 扩增VH-Linker基因Amplify VH-Linker gene |
| P3/P4 | GGCGGCGGCGGCTCCGGTGGTGGTGGATCCGACATTCAGCTGACCCAGTC/ TTGTCGACGGAGCTCGAATTCTCCGTTTGATCTCCAGCTTG | 扩增Linker-VL基因Amplify Linker-VL gene |
| T7/T7t | TAATACGACTCACTATAGGG/GCTAGTTATTGCTCAGCGG | 鉴定重组载体Identify recombinant vectors |
| Fc-F/R | GCTGATATCGGATCCGAATTCTACCGTCTCCTCAGCCTCCACCACGGCCCCCT/ TTGTCGACGGAGCTCGAATTCTTCATTTACCCGGAGAATG | 扩增犬抗体Fc基因Amplify canine antibody Fc gene |
| P5/P6 | GCTGATATCGGATCCGAATTCTCAGGTGCAGCTGCAGGAGT/ AGGAGACGGTCCGTTTGATCTCCAGCTTG | 扩增scFv基因Amplify scFv gene |
| P7/P8 | GATCAAACGGACCGTCTCCTCAGCCTCCA/ TTGTCGACGGAGCTCGAATTCTCATTTACCCGGAGAATGGG | 扩增Fc基因Amplify Fc gene |
| 注:表中符号S(G, C), M(A, C), R(A, G), W(A, T), K(G, T), H(A, T, C)代表简并碱基The symbols S(G, C), M(A, C), R(A, G), W(A, T), K(G, T)and H(A, T, C)represent degenerate bases; 斜体表示Linker(Gly4Ser)3序列Italic indicates the Linker(Gly4Ser)3sequence; 下划线为EcoRⅠ识别位点The underline is the EcoRⅠrecognition site. | ||
将符合小鼠重链、轻链可变区序列特征的VH和VL, 设计将二者进行连接的重叠延伸PCR(SOE-PCR)引物对P1/P2和P3/P4, Linker(Gly4Ser)3分别连接在VH的下游和VL的上游, 序列如表 1所示。从19T-VH和19T-VL中提取质粒, 以质粒为模板, 使用引物对P1/P2和P3/P4分别扩增得到VH-Linker和Linker-VL片段, 回收目的片段, 根据SOE-PCR反应原理, 使用P1/P4引物对, 将VH-Linker和Linker-VL扩增并融合得到VH-Linker-VL走向的scFv基因。将pET-32a(+)载体使用EcoRⅠ限制酶进行单酶切, 回收线性载体与scFv同源重组并转化BL21(DE3)感受态, 构建scFv的表达载体, 经T7/T7t引物对PCR验证以及测序无误后, 命名为pET-32a-scFv。
1.5 犬源抗体恒定区基因(Fc)表达载体的构建参照文献[14]设计犬源抗体Fc基因引物对Fc-F/R(表 1)。分离比格犬(7周龄, 由南京市安立默实验动物有限公司提供)外周血淋巴细胞, 提取细胞总RNA, 以反转录产物cDNA为模板, 使用Fc-F/R引物对扩增得到的犬抗体Fc片段与pET-32a(+)载体经EcoRⅠ限制酶单酶切回收的线性片段同源重组, 转化大肠杆菌BL21(DE3)感受态, 使用T7/T7t引物对经PCR验证以及测序无误后, 将犬源抗体Fc片段阳性菌命名为pET-32a-Fc。
1.6 嵌合抗体scFv-Fc表达载体的构建根据1.4节和1.5节已构建H3N2 CIV scFv基因和Fc基因的测序结果, 设计将这2个片段相融合的引物对P5/P6和P7/P8, 序列如表 1所示。以pET-32a-scFv和pET-32a-Fc质粒为模板, 分别扩增并回收scFv和Fc基因, 以P5/P8为连接引物对, 将回收的片段scFv与Fc采用SOE-PCR法融合并回收。回收的融合片段与EcoRⅠ限制酶单酶切后的pET32a(+)载体同源重组, 转化BL21(DE3)感受态, 经PCR鉴定以及测序无误后, 阳性菌命名为pET-32a-scFv-Fc。
1.7 scFv与scFv-Fc蛋白的原核表达及Western blot验证将pET-32a-scFv、pET-32a-scFv-Fc阳性菌以及pET-32a(+)空载菌于100 mL锥形瓶扩大培养, 待菌液A600为0.4~0.8时, 加IPTG至终浓度0.01 mmol · L-1, 37 ℃、180 r · min-1诱导3~5 h。将菌液离心, 取菌体沉淀用1/10表达体系体积的结合缓冲液重悬, 超声破碎, 4 ℃、10 000 r · min-1离心10 min后保留上清液, 包涵体用包涵体结合缓冲液溶解过夜。分别取40 μL原菌液、上清液以及包涵体, 加10 μL 5×SDS上样缓冲液, 沸水煮10 min后, 采用SDS-PAGE以及Western blot检测蛋白表达情况[10]。
1.8 scFv与scFv-Fc蛋白的ELISA和血凝抑制效价检测根据scFv与scFv-Fc的预表达结果观察蛋白表达量以及表达位置, 对其进行大量表达, 经SDS-PAGE验证后, 对菌体破碎后上清液或者包涵体用His标记Ni柱纯化。上清液纯化蛋白经PBS透析后测定浓度, 4 ℃保存备用。包涵体纯化蛋白则需要经过复性及经PBS透析后方可使用。
将纯化的H3N2 CIV全病毒以5 μg · mL-1包被酶标板[10], 用间接ELISA法测定单链抗体以及嵌合抗体的效价。将纯化抗体调整初浓度为1 mg · mL-1, 用PBS从左到右按照1 : 10、1 : 20、1 : 40、1 : 80、1 : 160、1 : 320、1 : 640、1 : 1 280、1 : 2 560稀释, 每孔100 μL加入到酶标板中, 并设立小鼠阳性血清、阴性血清以及PBS空白对照。37 ℃孵育1.5 h后, 检测孔加入1 : 5 000稀释的His鼠单抗。阳性血清、阴性血清以及PBS对照孔每孔加入100 μL PBS, 37 ℃孵育1.5 h。最后加入1 : 5 000稀释的羊抗鼠IgG孵育1 h, 经TMB显色并以2 mol · L-1 H2SO4终止反应后, 用酶标仪读取A450值, 以检测孔与阴性对照孔比值(P/N)大于2.1时抗体的最大稀释度为准, 判定scFv与scFv-Fc抗体的ELISA效价。需要说明的是, 检测孔添加His鼠单抗的目的是scFv和scFv-Fc缺少与抗鼠二抗结合的Fc片段, 但含有His标签蛋白, 故可通过加His鼠单抗将表达的抗体与随后加入的抗鼠二抗结合起来。
按照常规血凝抑制(HI)试验测定scFv与scFv-Fc的HI效价。scFv与scFv-Fc抗体的HI效价判定以病毒凝集红细胞的作用完全被抗体抑制时抗体的最大稀释度表示。
1.9 单链抗体scFv与嵌合抗体scFv-Fc的细胞中和活性鉴定在MDCK细胞上对scFv与scFv-Fc抗体的细胞中和活性进行测定, 当细胞汇合率达60%~80%进行中和试验。在96孔细胞板上稀释抗体, 稀释液为含1 μg · mL-1的TPCK-Trypsin的DMEM基础培养基, 抗体初始浓度为1 mg · mL-1。从第1列到第10列按照1 : 1、1 : 10、1 : 20、1 : 40、1 : 80、1 : 160、1 : 320、1 : 640、1 : 1 280、1 : 2 560稀释, 每个稀释度4个重复, 每孔100 μL, 第11列和12列分别设置阴性对照和纯病毒阳性对照。在上述已稀释好的抗体孔中, 每孔分别加入100 μL CIV病毒液(200 TCID50), 即病毒终浓度为每孔100 TCID50[10]。混匀后放入37 ℃细胞培养箱孵育2 h, 使抗原、抗体充分反应。用DMEM基础培养基洗涤细胞2次, 将抗原、抗体混合液加入至细胞孔, 37 ℃培养细胞48~72 h。在病毒阳性对照的MDCK细胞发生100%病变时, 观察检测孔细胞病变(CPE), 同时检测各孔的血凝(HA)活性。中和效价以抗体不能中和病毒的稀释度表示。
2 结果与分析 2.1 小鼠可变区基因的扩增及scFv表达载体的构建以McAb细胞株总RNA反转录得到的cDNA为模板, 通过小鼠抗体VH-F/R和VL-F/R引物对分别进行PCR扩增, 获得VH基因片段359 bp, VL基因片段327 bp(图 1-A)。测序并经GenBank数据库数据比对, 所得scFv基因序列符合小鼠抗体重链和轻链可变区序列特征。根据所得序列全长, 设计SOE-PCR引物, 将Linker分别连入VH与VL, 获得VH-Linker基因片段450 bp, Linker-VL基因片段400 bp(图 1-B)。将VH-Linker片段与Linker-VL片段融合, 获得VH-Linker-VL方向的scFv全长基因789 bp(图 1-C)。与pET-32a载体同源重组构建scFv表达载体pET-32a-scFv, 经T7/T7t引物对扩增得到大小约1 300 bp的基因片段(图 1-D), 测序结果显示无密码子突变, 表明scFv表达载体构建成功。
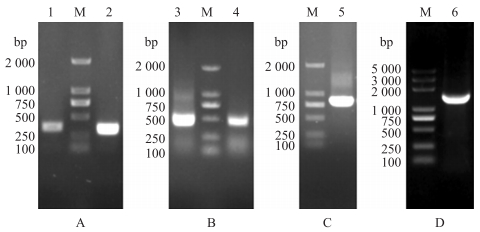
|
图 1 小鼠抗体可变区基因的扩增及单链抗体表达载体的鉴定
Fig. 1 Amplification of mouse antibody variable region genes and identification of scFv expression vector
A. VH和VL的PCR产物鉴定; B. VH-Linker和Linker-VL的PCR产物鉴定; C. VH-Linker-VL的PCR产物鉴定; D.表达载体pET-32a-scFv的PCR产物鉴定。
A. Identification of VH and VL PCR product; B. Identification of VH-Linker and Linker-VL PCR product; C. Identification of the VH-Linker-VL PCR product; D. Identification of the expression vector pET-32a-scFv PCR product. M. DNA marker; 1. VH; 2. VL; 3. VH-Linker; 4. Linker-VL; 5. VH-Linker-VL; 6. pET-32a-scFv. |
以犬外周血淋巴细胞总RNA反转录cDNA为模板, 扩增得到Fc基因片段1 020 bp(图 2-A), 与pET-32a(+)载体连接构建犬抗体恒定区(Fc)基因表达载体pET-32a-Fc。试验结果表明, 以重组载体鉴定引物对扩增得到大小1 500 bp基因片段(图 2-B), 测序结果表明犬源Fc基因表达载体构建成功。
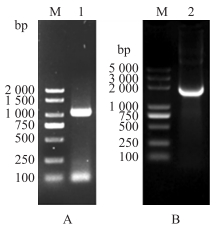
|
图 2 犬抗体Fc基因(A)及其表达载体(B)PCR产物的电泳鉴定 Fig. 2 PCR products identification of canine antibody Fc gene(A) and its expression vector(B) M. DNA marker; 1. Fc; 2. pET-32a-Fc. |
根据菌株pET-32a-scFv和pET-32a-Fc测序结果设计引物对, 分别扩增得到scFv基因片段775 bp, Fc基因片段1 051 bp(图 3-A)。采用SOE-PCR将这2个片段进行连接, 获得融合片段scFv-Fc, 大小为1 806 bp(图 3-B)。构建嵌合抗体scFv-Fc的pET-32a(+)表达载体, 经载体鉴定引物对PCR扩增得到约2 300 bp基因片段(图 3-C)的测序结果显示, scFv与Fc成功拼接并连入pET-32a(+), 嵌合抗体表达载体pET-32a-scFv-Fc构建成功。
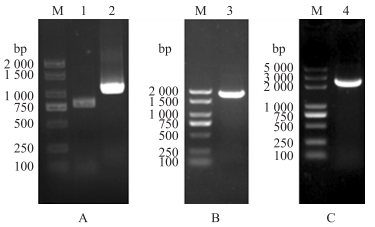
|
图 3 嵌合抗体scFv-Fc基因及原核表达载体的鉴定
Fig. 3 Identification of chimeric antibody scFv-Fc gene and its expression vector
A. scFv和Fc的PCR产物鉴定; B. scFv-Fc的PCR产物鉴定; C.表达载体pET-32a-scFv-Fc的PCR产物鉴定。
A. Identification of scFv and Fc PCR products; B. Identification of the scFv-Fc PCR product; C. Identification of the expression vector pET-32a-scFv-Fc PCR product. M. DNA marker; 1. scFv; 2. Fc; 3. scFv-Fc; 4. pET-32a-scFv-Fc. |
对scFv和scFv-Fc分别进行IPTG诱导表达, SDS-PAGE显示2种蛋白主要为可溶性表达, 蛋白相对分子质量分别为45×103(图 4-A)和80×103(图 4-B)。蛋白纯化后SDS-PAGE图(图 4-C)经Image-Pro Plus 6.0软件分析, 表明scFv与scFv-Fc蛋白纯度达90%以上, 纯化效果良好。
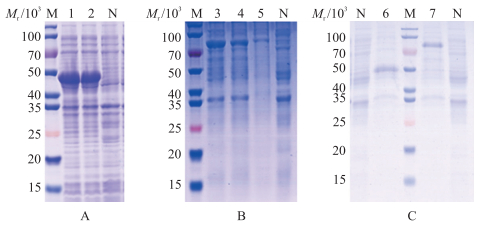
|
图 4 scFv与scFv-Fc蛋白表达的SDS-PAGE验证
Fig. 4 SDS-PAGE verification of scFv and scFv-Fc protein expression
A. scFv蛋白表达分析; B. scFv-Fc蛋白表达分析; C. scFv与scFv-Fc蛋白纯化分析。 M.蛋白标准品; 1. pET-32a-scFv阳性菌; 2. scFv表达上清液; 3. pET-32a-scFv-Fc阳性菌; 4. scFv-Fc表达上清液; 5. scFv-Fc表达包涵体; 6.纯化的scFv蛋白; 7.纯化的scFv-Fc蛋白; N. pET-32a(+)对照菌。 A. Expression analysis of scFv protein; B. Expression analysis of scFv-Fc protein; C. Purification analysis of scFv and scFv-Fc proteins. M. Protein marker; 1. pET-32a-scFv positive bacteria; 2. scFv expression in supernatant; 3. pET-32a-scFv-Fc positive bacteria; 4. scFv-Fc expression in supernatant; 5. scFv-Fc expression in inclusion body; 6. Purified scFv protein; 7. Purified scFv-Fc protein; N. pET-32a(+)negative bacteria. |
对scFv进行His标签的Western blot验证, 结果显示单链抗体表达无误(图 5-A)。scFv-Fc经His标签抗体(图 5-B)以及羊抗犬抗体(图 5-C)的Western blot验证, 表明嵌合抗体scFv-Fc表达成功, 且具有良好的种属性。

|
图 5 scFv与scFv-Fc抗体的Western blot验证
Fig. 5 Western blot verification of scFv and scFv-Fc antibodies
A. scFv抗体的His标签验证; B. scFv-Fc抗体的His标签验证; C. scFv-Fc抗体的羊抗犬IgG验证。 M.蛋白标准品; 1. scFv蛋白; 2, 3. scFv-Fc蛋白; N. pET-32a(+)对照菌。 A. His-tag verification of scFv antibodies; B. His-tag verification of scFv-Fc antibodies; C. Goat anti-canine IgG verification of scFv-Fc antibodies. M. Protein marker; 1. scFv protein; 2, 3. scFv-Fc protein; N. pET-32a(+)negative bacteria. |
用纯化CIV JS/10株全病毒包被酶标板, 间接ELISA测定scFv和scFv-Fc抗体的效价。抗原包被浓度为5 μg · mL-1, 以小鼠阴性血清以及PBS分别作为阴性及空白对照, 经TMB染色并读取A450值。结果见表 2。scFv和scFv-Fc抗体的初浓度均为1 mg · mL-1。当scFv稀释至640倍时, P/N大于2.1, 表明纯化单链抗体scFv的ELISA效价为1 : 640(1.56 μg · mL-1); 同样测得嵌合抗体scFv-Fc的ELISA效价为1 : 2 560(0.39 μg · mL-1)。
| 抗体 Antibody |
检测批次 Test batch |
稀释度 Dilution |
阴性对照 Negative control |
|||||||||
| 1:10 | 1:20 | 1:40 | 1:80 | 1:160 | 1:320 | 1:640 | 1:1 280 | 1:2 560 | 1:5 120 | |||
| 1 | 0.758 7 | 0.795 8 | 0.653 2 | 0.602 1 | 0.484 2 | 0.350 8 | 0.235 1 | 0.170 6 | 0.125 8 | 0.074 2 | 0.052 2 | |
| scFv | 2 | 0.825 9 | 0.789 5 | 0.628 7 | 0.538 9 | 0.375 4 | 0.274 8 | 0.200 5 | 0.150 3 | 0.130 5 | 0.075 4 | 0.060 3 |
| 3 | 0.725 5 | 0.684 8 | 0.679 8 | 0.598 2 | 0.435 7 | 0.340 8 | 0.230 5 | 0.160 2 | 0.090 6 | 0.084 7 | 0.061 2 | |
| 1 | 0.839 8 | 0.806 4 | 0.753 2 | 0.712 1 | 0.635 5 | 0.558 9 | 0.480 1 | 0.387 6 | 0.315 7 | 0.185 2 | 0.065 4 | |
| scFv-Fc | 2 | 0.780 6 | 0.794 2 | 0.795 4 | 0.728 9 | 0.648 8 | 0.570 5 | 0.441 9 | 0.305 1 | 0.225 5 | 0.120 4 | 0.054 2 |
| 3 | 0.890 7 | 0.862 2 | 0.778 9 | 0.750 8 | 0.684 8 | 0.590 7 | 0.459 8 | 0.287 6 | 0.245 9 | 0.198 8 | 0.056 3 | |
按照常规方法进行抗体HI检测, 测得scFv抗体的HI效价为1 : 160(6.25 μg · mL-1), scFv-Fc抗体的HI效价为1 : 640(1.56 μg · mL-1)。
2.7 scFv与scFv-Fc抗体的中和活性当阳性对照出现明显细胞病变(图 6-A), 与阴性对照(图 6-B)相比, scFv稀释160倍时(图 6-C), MDCK细胞无明显细胞病变; 而当单链抗体稀释320倍时(图 6-D), 部分细胞发生病变。与之相对应, 感染细胞上清血凝试验中, 1 : 160稀释度时呈现血凝阴性, 而1 : 320出现部分血凝, 3次试验结果一致, 因此确定scFv的中和效价为1 : 160(6.25 μg · mL-1)。
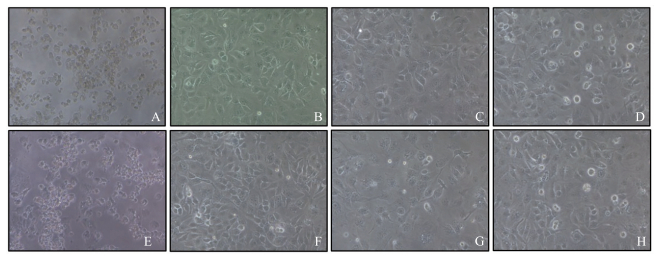
|
图 6 scFv与scFv-Fc抗体的中和活性检测(×100) Fig. 6 Detection of neutralizing activity of scFv and scFv-Fc A、E.阳性对照; B、F.阴性对照; C、G.分别为加入1 : 160 scFv抗体和1 : 40 scFv-Fc抗体的MDCK细胞; D、H.分别为加入1 : 320 scFv抗体和1 : 80 scFv-Fc抗体的MDCK细胞。 A, E. Positive control; B, F. Negative control; C, G. MDCK cells after added 1 : 160 scFv antibodies or 1 : 40 scFv-Fc antibodies; D, H. MDCK cells after added 1 : 320 scFv antibodies or 1 : 80 scFv-Fc antibodies. |
scFv-Fc的中和试验结果显示:当阳性对照出现明显细胞病变(图 6-E), 与阴性对照(图 6-F)相比, scFv-Fc稀释40倍时(图 6-G), MDCK细胞无明显细胞病变, 且感染细胞上清血凝试验结果阴性; 当嵌合抗体稀释80倍时(图 6-H), 部分细胞发生病变, 血凝结果与之对应, 红细胞部分凝集。试验重复3次, 结果一致, 表明嵌合抗体scFv-Fc的中和效价为1 : 40(25 μg · mL-1)。
3 讨论犬流感是近年新发传染病, 目前受到广泛关注。流感病毒通过在犬等哺乳动物体内的适应, 可能会更容易获得感染人的能力, 而犬是人类最亲密的伴侣动物, 与人密切接触机会较多, 犬有可能会作为中间宿主将流感病毒传播给人类。有研究表明, 当犬感染2种以上的流感病毒时, 流感病毒可能会在犬体内经过基因重配形成能够感染人的重组流感病毒[15]。因此对犬流感制定切实可行的防控措施具有重要的公共卫生学意义。
在流感的防控方面, 疫苗是比较有效的手段, 美国和韩国已分别开发出H3N8和H3N2亚型犬流感灭活疫苗, 但灭活疫苗需要多次接种, 且在幼年、老年及免疫力低下的犬群中接种疫苗, 不足以刺激机体产生免疫力, 而具有中和活性的抗体可通过抑制病毒对宿主细胞的吸附或复制过程达到清除病毒的目的。因此, 研制并开发出能够用于治疗犬流感的高效中和抗体非常必要。
单克隆抗体以其特异性强、质量均一、可大量制备等优势已经广泛应用于许多传染病的诊断和治疗。但目前现有的单克隆抗体主要是鼠源, 其在体内应用时会对机体有较强的异源性和免疫原性, 容易引起宿主的免疫排斥反应, 甚至对患病机体造成严重后果, 极大限制了该抗体的临床应用[16]。因此, 对鼠源单克隆抗体进行改造很有必要。经过改造的鼠源单抗降低了动物对其的免疫排斥反应, 可以更加有效应用于临床。具体操作上, 可利用基因工程手段以单克隆抗体最小功能片段Fab构建单链抗体, 并对单链抗体进行同源改造, 构建嵌合抗体。在人源化抗体研究中, 目前已有学者成功构建针对白血病的人-鼠嵌合抗体3A4(Hm3A4), 并证实该嵌合抗体具有良好的生物学活性[17]。抗体的犬源化研究尚不多见, 仅有1篇文献报道对犬细小病毒鼠源抗体进行犬源化改造[12]。本试验在犬流感特异性单链抗体上融合犬抗体Fc片段, 不仅可削弱鼠源抗体对犬的异源性, 而且可充分发挥Fc片段激活补体依赖的细胞毒作用(CDC)、抗体依赖的细胞介导的细胞毒作用(ADCC)以及抗体依赖的细胞介导的吞噬作用(ADCP)等免疫学功能。在本研究中, 所用的犬源Fc片段来自比格犬, 该犬种是国际通用实验犬, 遗传背景清晰。从比格犬外周血淋巴细胞中扩增得到犬源抗体Fc片段, 将scFv基因片段与Fc片段连接, 对单链抗体进行犬源化改造, 获得鼠/犬嵌合抗体scFv-Fc。免疫学活性测定表明, scFv-Fc的ELISA效价和HI效价均比scFv略高, 说明Fc片段的嵌入提高了抗体与H3N2亚型CIV的结合活性。但嵌合抗体中和效价略低于单链抗体, 可能是因为嵌合抗体在拼接了Fc片段后, 抗体结构改变, 对抗体的中和位点形成空间位阻或者包裹, 从而降低了嵌合抗体的中和活性。未来将进一步考虑将嵌合抗体进行真核表达, 并在犬体内评估嵌合抗体的临床治疗效果。
本试验中, scFv基因片段来自本课题组前期制备的单克隆抗体11E3, 其针对的抗原表位位于血凝素HA2亚基。HA2是血凝素蛋白的部分茎部区域, 相对保守, 国内外学者已将血凝素茎部区域作为研制广谱抗体和疫苗的重要靶标[18-20]。因此, 本试验制备的嵌合抗体也可能具备与H3N2亚型流感病毒不同毒株甚至不同亚型流感病毒结合的潜力, 后续试验将验证制备的嵌合抗体是否具有广谱中和活性。
| [1] |
Crawford P C, Dubovi E J, Castleman W L, et al. Transmission of equine influenza virus to dogs[J]. Science, 2005, 310(5747): 482-485. DOI:10.1126/science.1117950 |
| [2] |
Lin Y, Zhao Y B, Zeng X J, et al. Genetic and pathobiologic characterization of H3N2 canine influenza viruses isolated in the Jiangsu Province of China in 2009-2010[J]. Veterinary Microbiology, 2012, 158: 247-258. DOI:10.1016/j.vetmic.2012.02.016 |
| [3] |
Voorhees I E, Glaser A L, Kathy T K, et al. Spread of canine influenza A(H3N2)virus, United States[J]. Emerging Infectious Diseases, 2017, 23(12): 1950-1957. DOI:10.3201/eid2312.170246 |
| [4] |
Songserm T, Amonsin A, Jamon R, et al. Fetal avian influenza A H5N1 in a dog[J]. Emerging Infectious Diseases, 2006, 12(11): 1744-1747. DOI:10.3201/eid1211.060542 |
| [5] |
Zhan G J, Ling Z, Zhu Y L, et al. Genetic characterization of a novel influenza A virus H5N2 isolated from a dog in China[J]. Veterinary Microbiology, 2012, 155(2/3/4): 409-416. |
| [6] |
Lin D, Sun S, Du L, et al. Natural and experimental infection of dogs with pandemic H1N1/2009am influenza virus[J]. Journal of General Virology, 2012, 93: 119-123. DOI:10.1099/vir.0.037358-0 |
| [7] |
Song D, Moon H J, An D J, et al. A novel reassortant canine H3N1 influenza virus between pandemic H1N1 and canine H3N2 influenza virus in Korea[J]. Journal of General Virology, 2012, 93: 551-554. DOI:10.1099/vir.0.037739-0 |
| [8] |
Xie X, Lin Y, Pang M, et al. Monoclonal antibody specific to HA2 glycopeptide protects mice from H3N2 influenza virus infection[J]. Veterinary Research, 2015, 46(1): 33. DOI:10.1186/s13567-015-0146-7 |
| [9] |
Holliger P, Hudson P J. Engineered antibody fragments and the rise of single domains[J]. Nature Biotechnology, 2005, 23(9): 1126. DOI:10.1038/nbt1142 |
| [10] |
邱冬, 赵丹, 刘永杰. H3N2亚型犬流感病毒单链抗体的制备[J]. 中国兽医科学, 2018, 48(5): 574-579. Qiu D, Zhao D, Liu Y J. Preparation of single-chain antibody against H3N2 subtype canine influenza virus[J]. Chinese Journal of Veterinary Sciences, 2018, 48(5): 574-579 (in Chinese with English abstract). |
| [11] |
Weisser N E, Hall J C. Applications of single-chain variable fragment antibodies in therapeutics and diagnostics[J]. Biotechnology Advances, 2009, 27(4): 502-520. DOI:10.1016/j.biotechadv.2009.04.004 |
| [12] |
王正阳.鼠源单克隆抗体犬源化的研究[D].贵州: 贵州大学, 2016: 34-50. Wang Z Y. Study on canineization of murine monoclonal antibodies[D]. Guizhou: Guizhou University, 2016: 34-50(in Chinese with English abstract). |
| [13] |
Griffiths A D, Duncan A R. Strategies for selection of antibodies by phage display[J]. Current Opinion in Biotechnology, 1998, 9(1): 102. DOI:10.1016/S0958-1669(98)80092-X |
| [14] |
赵翠, 刘玲红, 郭树源, 等. 乌苏里貉IgG Fc片段克隆表达及免疫交叉源性分析[J]. 中国兽医学报, 2016, 36(11): 1864-1868. Zhao C, Liu L H, Guo S Y, et al. Cloning, expression and immunological cross-linking analysis of ugulin IgG fragment of Ussuri[J]. Chinese Journal of Veterinary Science, 2016, 36(11): 1864-1868 (in Chinese with English abstract). |
| [15] |
Lyoo K S, Na W, Yeom M, et al. Virulence of a novel reassortant canine H3N2 influenza virus in ferret, dog and mouse models[J]. Archives of Virology, 2016, 161(7): 1915-1923. DOI:10.1007/s00705-016-2868-x |
| [16] |
Morrison S L, Johnson M J, Herzenberg L A, et al. Chimeric human antibody molecules:mouse antigen-binding domains with human constant region domains[J]. Proceedings of the National Academy of Sciences of the United States of America, 1984, 81(21): 6851-6855. DOI:10.1073/pnas.81.21.6851 |
| [17] |
Li S, Shen D, Guo X, et al. Construction, expression, and characterization of a novel human-mouse chimeric antibody, Hm3A4:a potential therapeutic agent for B and myeloid lineage leukemias[J]. DNA and Cell Biology, 2018, 37(9): 778-785. DOI:10.1089/dna.2018.4199 |
| [18] |
Wrammert J, Koutsonanos D, Li G M, et al. Broadly cross-reactive antibodies dominate the human B cell response against 2009 pandemic H1N1 influenza virus infection[J]. Journal of Experimental Medicine, 2011, 208(1): 181-193. DOI:10.1084/jem.20101352 |
| [19] |
Dunand C J H, Leon P E, Kaval K, et al. Preexisting human antibodies neutralize recently emerged H7N9 influenza strains[J]. Journal of Clinical Investigation, 2015, 125(3): 1255-1268. DOI:10.1172/JCI74374 |
| [20] |
Zhao C, Xu J. Toward universal influenza virus vaccines:from natural infection to vaccination strategy[J]. Current Opinion in Immunology, 2018, 53: 1-6. DOI:10.1016/j.coi.2018.03.020 |




