文章信息
- 谢昶琰, 金昕, 李岩, 石晓倩, 刘慧冉, 徐阳春, 董彩霞
- XIE Changyan, JIN Xin, LI Yan, SHI Xiaoqian, LIU Huiran, XU Yangchun, DONG Caixia
- 缺铁胁迫对杜梨幼苗生理及铁吸收和转运相关基因表达的影响
- Effects of iron deficiency stress on physiology and gene expression of iron absorption and transpotation in Pyrus betulaefolia
- 南京农业大学学报, 2019, 42(3): 465-473
- Journal of Nanjing Agricultural University, 2019, 42(3): 465-473.
- http://dx.doi.org/10.7685/jnau.201810006
-
文章历史
- 收稿日期: 2018-10-08
缺铁是果树生产上突出的生理病害之一[1]。果树属于机理Ⅰ植物, 其应对缺铁逆境可能有2种途径:一种是加强根系铁吸收, 主要由H+-ATPase质子泵系统、Fe3+还原系统和Fe2+转运系统组成; 另一种是根质外体或细胞器中铁元素再利用加强[2-3]。左元梅等[4]研究表明质外体铁能够不断供给易被花生还原吸收的铁, 可改善花生的铁营养缺乏状况。在缺铁时, 植物通常也会在根、茎、叶中分泌有机酸(主要是柠檬酸和苹果酸), 这些有机酸物质作为铁的主要螯合物, 与铁在吸收位点的结合和长距离运输中发挥重要作用[5-6]。Han等[7-8]发现小金海棠MxCS1基因表达量的上调能够提高转基因烟草和拟南芥植株的耐缺铁能力, 山定子MdCS1基因转拟南芥后能够促进柠檬酸的合成, 促进植株生长, 提高铁含量和叶绿素含量。
杜梨(Pyrus betulaefolia)因其根系发达、抗寒、抗旱、耐盐性强, 在我国北方地区分布广泛, 是梨树栽培的主要砧木类型[9]。由于我国华北、西北及华东地区土壤pH值偏高等原因, 梨树缺铁现象较普遍, 严重影响树体生长导致减产。铁在土壤中移动性差且分布不均匀, 梨树根系处在铁养分浓度差异较大的环境中, 其根系和地上部适应性反应与调节的研究较少。分根试验提供了一种模拟根系处在不同营养状态、具有统一地上部的情况下研究根系对养分供给的响应方法。因此, 本研究以杜梨幼苗为材料, 采用水培法研究杜梨在全根和分根处理下缺铁对根系形态的影响及缺铁胁迫下质外体铁含量、有机酸含量和铁吸收与转运相关基因表达量的变化情况, 为在缺铁胁迫下杜梨根系和地上部的生理及分子响应机制提供了理论依据, 并为进一步研究梨树缺铁的调节部位奠定理论基础。
1 材料与方法 1.1 试验材料杜梨(Pyrus betulaefolia)种子由河南省农业科学院园艺研究所提供。
1.2 方法试验于温室内进行。取适量种子先浸泡24 h, 然后用5%(体积分数)次氯酸钠溶液消毒15 min, 与高压灭菌处理过的湿砂搅拌混匀后于4 ℃冷柜进行层积处理(层积时间约50 d, 期间每隔3 d翻搅并喷水以保持湿度)。待种子露白取出移至基质(蛭石与营养土质量比为1 : 1)中, 培养至5~7片真叶时, 选取长势均匀一致的幼苗移栽至装有6 L 1/2浓度的营养液周转箱中培养, 每箱种植12株, 7 d后更换为完全营养液。营养液配方[10]:0.75 mmol · L-1K2SO4, 0.65 mmol · L-1MgSO4 · 7H2O, 0.25 mmol · L-1 KH2PO4, 0.1 mmol · L-1KCl, 2 mmol · L-1 Ca(NO3)2 · 4H2O, 0.1 mmol · L-1 FeNa-EDTA, 0.01 mmol · L-1 H3BO3, 1 μmol · L-1MnSO4 · H2O, 1 μmol · L-1 ZnSO4 · 7H2O, 0.5 μmol · L-1 CuSO4 · 5H2O, 0.005 μmol · L-1(NH4)6Mo7O24 · 4H2O, 初始pH值用NaOH或HCl调节至6.0±0.1。培养14 d后开始处理(苗高约15~16 cm), 处理期间不更换营养液, 每天定时通气2 h, 温室温度控制在(25±2)℃, 相对湿度60%~70%, 光照/黑暗时间为16 h/8 h。
试验设计:将所选梨苗根系进行简单修剪, 所有梨苗具有相同的根数。设置处理分别为:1)正常植株供铁(40 μmol · L-1 FeNa-EDTA)处理(+Fe)和缺铁(0 μmol · L-1 FeNa-EDTA)处理(-Fe); 2)分根植株供铁(40 μmol · L-1 FeNa-EDTA)处理(+Fe SR)和缺铁(0 μmol · L-1 FeNa-EDTA)处理(-Fe SR)。其中, 分根处理参照张恒涛等[1]方法。于0、12 d进行根系形态指标的测定, 于0、2、4、6、8、10和12 d测定根际pH值、根系Fe3+还原酶活性。正常植株处理组于0、4、8和12 d取样测定有机酸含量, 于0、2、4、6、8、10和12 d测定质外体pH值、质外体铁含量和各基因表达量。每个处理3次重复, 每个重复3株幼苗。其中用于质外体汁液提取的样品于4 ℃保存备用; 测定有机酸含量的样品由液氮速冻后于-20 ℃保存备用; 用于RNA提取的样品由液氮速冻后于-80 ℃保存备用。
1.3 测定方法用根系扫描仪自带软件WinRHIZO(2007版)对相关指标根总长、根表面积、根体积、根平均直径及根尖数进行分析; 每日上午9:30—11:00采用标准型PB-10 pH计监测营养液pH值, 初始pH值用NaOH或HCl调节至6.0±0.1, 测定时探头靠近根表, 监测期间不更换营养液; 采用2, 2′-联吡啶法测定Fe3+还原酶活性, 采用琼脂染色定位技术, 参照Gogorcena等[11]的方法对各处理根系处理12 d时进行Fe3+还原酶(FCR)活性定位; 根系质外体汁液的提取参照崔美香等[12]的方法测定质外体pH值和铁元素含量, 将根系鲜样在4 ℃环境下1 500 g离心5 min, 去掉上清液, 然后2 500 g离心15 min, 所得汁液即为质外体汁液。收集的质外体汁液, 一部分用于测定质外体pH值, 另称取质外体汁液1.00 g于三角瓶中, 加入8 mL浓硝酸, 过夜, 在电热板上加热至少量且黏稠状, 冷却, 加入5 mL混酸, 继续加热至液体快要蒸干后冷却, 加入20 mL去离子水, 微热溶解; 过滤转移至50 mL容量瓶中, 定容摇匀, 使用电感耦合等离子体发射光谱仪(ICP-AES)测定铁元素含量。每个处理重复3次。参照Karkacier等[13]方法用HPLC法测定根系和叶片柠檬酸和苹果酸含量, 以柠檬酸和苹果酸标准样品(Sigma公司)作为内参。
1.4 总RNA提取与cDNA第1链合成采用改良的CTAB法[14]提取各处理杜梨幼苗不同部位的总RNA, 使用TaKaRa公司生产的DNase Ⅰ试剂去除总RNA中的基因组DNA, 用1.2 g · L-1琼脂糖凝胶和紫外分光光度计检测RNA质量及浓度。以总RNA为模板, 使用5×HiScript Ⅱ Q RT SuperMix反转录酶(Vazyme)进行cDNA第1链合成。
1.5 根系和叶片铁相关基因的Real-time PCR分析根据在GenBank登录的杜梨基因二价铁转运基因IRT1 (KX355331)、Fe3+还原酶基因FRO2 (KM369971.1)、质子泵基因HA7 (KM369975.1)、Fe2+转运基因NRAMP1 (KT987229.1)、Fe2+铁转运基因NRAMP3 (KT962097.1)、柠檬酶转运基因FRD3(KT962095.1)、柠檬酸合成酶基因CS1 (KT962099.1)、柠檬酸合成酶基因CS2 (KT962100.1)、尼克酰胺合成酶基因NAS1 (KT987221.1)、尼克酰胺合成酶基因NAS2(KT987222.1)和尼克酰胺铁转运基因YSL3(Chinese white pear)(XM_009353665.1)的核苷酸序列, 利用Primer Premier 5.0软件设计Real-time qPCR引物(表 1), 使用全式金公司的TransStart Tip Green qPCR SuperMix荧光定量试剂盒进行操作。Real-time-qPCR反应体系:2×Tip Green qPCR SuperMix 10 μL, 上、下游引物(10 μmol · L-1)各0.4 μL, cDNA模板2 μL, 50×Passive Reference Dye 0.4 μL, 用ddH2O补齐至20 μL。反应条件:94 ℃ 30 s; 94 ℃ 5 s, 60 ℃ 30 s, 72 ℃ 30 s, 共40个循环; 72 ℃3 min。
| 基因Gene | 引物对序列(5′→3′) Primer pairs sequence |
| IRT1 | TTCCATACCAGCCTTCCA/TAGCCACAAAGCCAGAAA |
| FRO2 | GCTTTCTTTCCTGGTGAT/ATGCTTGCCTCTGATGTG |
| HA7 | TGATTGTGTGCATGAAAATGGCCAT/CAGGGTGGAAGGCTGGTATGGAACG |
| CS2 | ATTCAAACGCAGACCACC/GCAACCCTGTCATTCCTC |
| CS1 | AGGGTCTTCTGTGGCTGCTT/CTGGGTCATTGGATGTGCTG |
| FRD3 | TTTTCAAATGGGATACGC/TATCTTCCTCGGCAACAA |
| NRAMP3 | ATGGATGTTCGGTGAAGC/ACTCGTCCTTTCTTGCTG |
| NRAMP1 | TGGCAACTTGGAAACTGA/GCGACTGGATTATGAGGG |
| NAS2 | GAAGCCTGGATGGAGAAA/TGGATTATGAGGGCGAAG |
| NAS1 | GACAATCCTCGGCTCATA/AGAACCCACAAAGGCAAT |
| YSL3 | GTGAGCCACAGGAGGATT/TGAACACGAAAGCGAGAA |
| Actin | CCATCCAGGCTGTTCTCTC/GCAAGGTCCAGACGAAGG |
以杜梨Actin基因作为内参基因, 采用2-ΔΔCT法分析基因相对表达量[15]。
1.6 数据处理与分析所得结果为各处理平均值, 采用SPSS 19.0软件进行多重比较和相关性分析, 其中多重比较采用Duncan’s法, 采用Excel 2016软件绘制图表。
2 结果与分析 2.1 全根及分根缺铁处理对杜梨根系形态的影响从图 1可知:处理12 d时, -Fe、+Fe、+Fe SR和-Fe SR处理的总根长分别是其0 d的1.76、1.45、3.02和3.20倍, 其中+Fe处理的总根长显著低于-Fe、+Fe SR和-Fe SR处理, 而这3个处理间均无显著差异; 根尖数也呈相似的规律, 但+Fe SR和-Fe SR处理相比-Fe处理显著提高了16.5%和15.2%, +Fe处理比-Fe处理降低了19.9%。另外, 分根处理缺铁和供铁两侧的总根长和根尖数增加量均多于不分根处理。处理12 d后, -Fe、+Fe SR和-Fe SR处理的根平均直径较0 d略有降低, 12 d时+Fe处理的根系直径相比-Fe、+Fe SR和-Fe SR处理提高了19.6%、12.2%和22.2%, 而各处理的根表面积和根体积无显著差异(图 2)。表明:-Fe、+Fe SR和-Fe SR处理显著改变杜梨幼苗的根系形态。
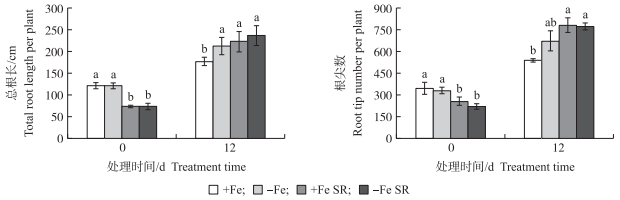
|
图 1 全根及分根缺铁处理对杜梨幼苗根系的总根长和根尖数的影响 Fig. 1 Effect of Fe-sufficient, Fe-deficient and split-root conditions on total root length and root tip number per plant of Pyrus betulaefolia seedlings +Fe:正常供铁处理(40 μmol · L-1 FeNa-EDTA); -Fe:缺铁处理(0 μmol · L-1 FeNa-EDTA); +Fe SR和-Fe SR分别表示分根供铁处理植株1/2根供40和0 μmol · L-1 FeNa-EDTA。不同字母表示处理间差异显著(P < 0.05)。下同。 +Fe:Normal iron treatment(40 μmol · L-1 FeNa-EDTA); -Fe:Iron deficiency(0 μmol · L-1 FeNa-EDTA); +Fe SR and-Fe SR indicate plant under 1/2 root for 40 and 0 μmol · L-1 FeNa-EDTA. Different letters above the bars indicate significant difference at 0.05 level. The same as follows. |
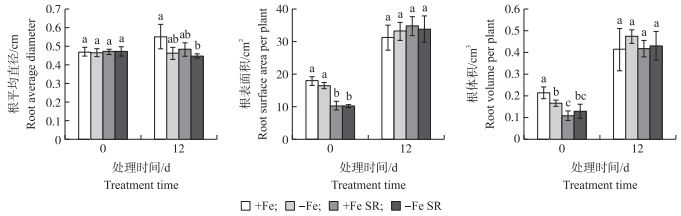
|
图 2 全根及分根缺铁处理下杜梨幼苗根系的根平均直径、根表面积和根体积 Fig. 2 Root average diameter, surface area and volume per plant under Fe-sufficient, Fe-deficient and split-root conditions of P.betulaefolia seedlings |
由于营养液中NO3-的存在, 各个处理中的根际pH值均随处理时间增加(图 3-A)。+Fe处理12 d的根际pH值较处理前增加16.2%, 与+Fe处理相比, -Fe处理的pH值上升趋势较为缓慢, 12 d时仍比+Fe处理低0.32个单位, 与0 d相比仅增加了9.77%。+Fe SR和-Fe SR处理的根际pH值整体变化趋势与-Fe处理相似, 上升趋势较+Fe处理缓慢。
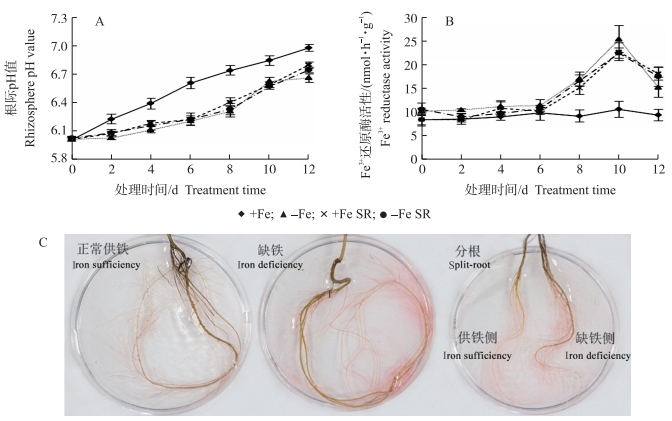
|
图 3 全根及分根缺铁处理对杜梨幼苗根际pH值(A)、Fe3+还原酶活性(B)和Fe3+还原酶活性定位(FCR)(C)的影响 Fig. 3 Effect of Fe-sufficient, Fe-deficient and split-root conditions on rhizospheric pH value(A), Fe3+ reductase activity(B)and visualization(C)in the roots of P.betulaefolia seedlings |
-Fe处理下根系Fe3+还原酶活性从6 d开始显著增强, 10 d后达到峰值(25.3 nmol · h-1 · g-1), 随后降低, 12 d时较10 d下降了39.5%。+Fe SR和-Fe SR处理Fe3+还原酶活性整体变化趋势与-Fe处理相似, 在处理前期(0~2 d)略有下降, 随后开始上升, 在10 d时达到峰值后显著下降(图 3-B)。Fe3+还原酶显色定位结果显示(图 3-C), -Fe、+Fe SR和-Fe SR处理的杜梨幼苗根系Fe3+还原酶均显红色, 但分根处理显色稍浅, +Fe处理不显红色。
2.3 缺铁胁迫对杜梨幼苗根系质外体pH值和质外体铁含量的影响+Fe处理杜梨幼苗根系质外体pH值在整个处理阶段呈上升趋势, 而-Fe处理的质外体pH值呈下降趋势(图 4-A), 且其质外体铁含量2 d时即显著下降了10.0%, 下降趋势一直持续到4 d, 之后基本保持在30 mg · kg-1左右。+Fe处理的质外体铁含量持续上升, 到12 d时比处理前增加了33.1%(图 4-B)。
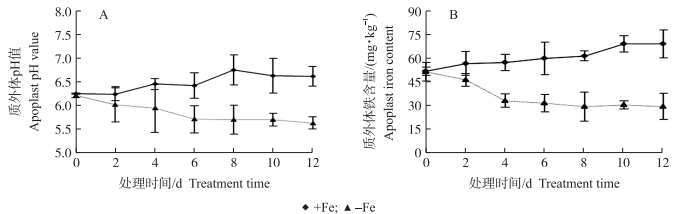
|
图 4 正常供铁及缺铁处理对杜梨幼苗根系质外体pH值(A)及质外体铁含量(B)的影响 Fig. 4 Effect of Fe-sufficient, Fe-deficient treatment on root apoplast pH value(A)and apoplast iron content(B) of P.betulaefolia seedlings |
从图 5可知:-Fe处理根系和叶片柠檬酸含量随时间的增加而升高, 根系的柠檬酸含量在4、8和12 d时显著高于+Fe处理, 12 d达到2.17 mg · g-1, 比+Fe处理高1.7倍; 缺铁时叶片中的柠檬酸含量在4 d虽与正常供铁处理无显著差异, 但8和12 d时分别为+Fe处理的1.5和1.3倍。苹果酸含量变化整体趋势与柠檬酸相似, 随着缺铁时间的增加, 根系积累越来越多的苹果酸, 12 d时根苹果酸含量较0 d增加了1.4倍, 比+Fe处理高2.1倍; 叶片苹果酸含量在8 d时达到峰值(2.04 mg · g-1), 12 d时下降到1.62 mg · g-1, 与+Fe处理相比, 4、8和12 d时-Fe处理苹果酸含量增加了21.5%、39.7%和33.3%。根系和叶片中的苹果酸含量在+Fe处理下随时间增加无明显变化趋势。
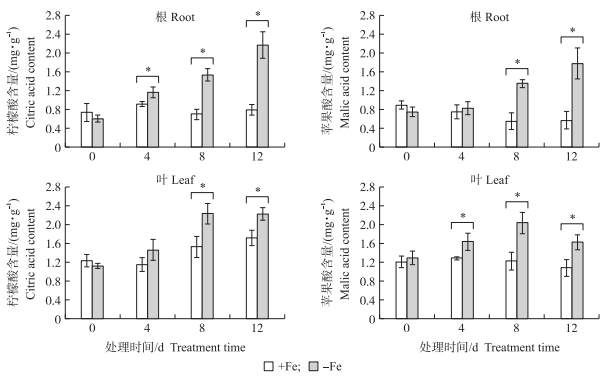
|
图 5 正常及缺铁处理对杜梨幼苗根系及叶片柠檬酸和苹果酸含量的影响 Fig. 5 Effect of Fe-sufficient, Fe-deficient treatment on citric acid and malic acid content in root and leaf of P.betulaefolia seedlings *P < 0.05. |
从图 6可知:共检测到杜梨根系有10个基因表达, 叶片有5个基因表达。-Fe处理杜梨Fe2+转运基因(IRT1)2 d时显著上调表达, 比+Fe处理高了2.6倍, 在8 d达到峰值, 比处理开始前增加了5.6倍, 随后于10、12 d下降, 但仍显著高于+Fe处理; -Fe处理Fe3+还原酶基因(FRO2)的表达量从2 d开始随处理时间的增加呈上升趋势, 4 d时显著上调表达, 于10 d时达到最大值, 12 d时下降, 受该基因调控的Fe3+还原酶活性也呈现出相似的规律; -Fe处理的质子泵基因(HA7)于2~10 d持续上调表达, 10 d时达最大值, 为+Fe处理的11.5倍。此外, -Fe处理Fe2+转运基因(NRAMP1)表达量在0~4 d无明显变化, 从6 d开始显著上调表达, 在10 d时达最大值, 12 d时下降; NRAMP3基因在根系和叶片中均有表达, -Fe处理均呈先升高后降低的趋势。
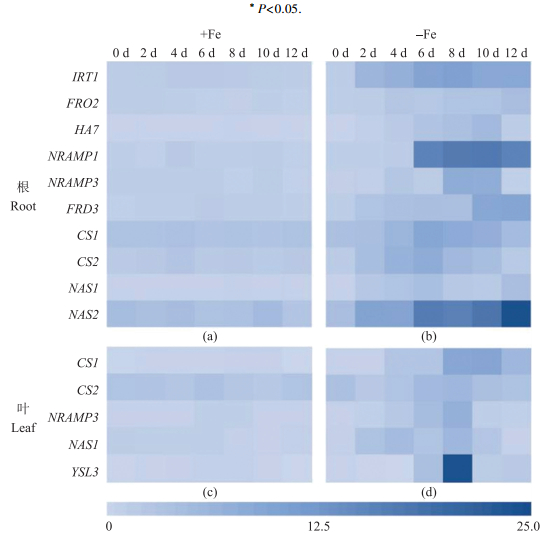
|
图 6 正常供铁及缺铁处理杜梨幼苗铁相关基因在根系(a、b)及叶片(c、d)中的表达分析 Fig. 6 Quantitative real-time PCR analysis of iron related genes in the root(a, b)and leaf(c, d) under Fe-sufficient and Fe-deficient treatment |
+Fe处理与铁螯合物转运相关的基因表达量均无明显变化; 杜梨柠檬酸转运基因FRD3仅在根系表达, 表达量随缺铁时间的增加而增加; 柠檬酸合成酶基因CS1和CS2在根系和叶片均表达, 表达量在缺铁胁迫条件下总体呈先上升后下降的趋势, 且均在6 d时达到峰值, 比+Fe处理显著上调了1.8和2.6倍; 烟酰胺合成酶基因NAS1在叶片和根中均有表达, 但NAS2仅在根系表达, 且-Fe处理的表达量始终较+Fe处理高; YSL3基因仅在叶片中表达, 在-Fe处理8 d时显著上调表达, 为+Fe处理的12.5倍。
3 讨论 3.1 缺铁改变杜梨幼苗根系形态及根系还原力根系是植物吸收养分的主要器官, 在植物生长发育过程中起着重要的作用。有效的养分吸收不仅取决于根的数量, 也取决于根系构型。植物根系在遭受逆境胁迫时, 通过调节自身构型来适应外界环境条件, 提高对养分的吸收[16]。铁在土壤中移动性较差, 根系形态决定了根系在土壤中的空间分布和接触到的土壤面积, 对植物吸收铁营养起着至关重要的作用, 同时铁营养的缺乏也会影响主根和侧根的生长发育[17]。本试验中, 杜梨幼苗根系在缺铁的刺激下形态发生显著变化, 侧根大量发生, 从而总根长、根尖数等指标变化显著。分根处理两侧的根系无论是否供铁, 均出现与缺铁处理类似的根系形态变化, 推测地上部可能存在缺铁信号物质, 使供铁侧同样能够感受到缺铁信号, 从而作出缺铁胁迫响应。与此同时, 缺铁胁迫也使杜梨的pH值、Fe3+还原酶活性发生相应的变化, 说明杜梨对缺铁做出了应激反应, 包括质子泵分泌H+和增强将Fe3+还原为Fe2+的能力, 来减缓缺铁对自身的影响; 而10 d后Fe3+还原酶活性显著降低, 这可能是由于pH值不断升高降低了杜梨的还原能力。
我们发现, 当根系完全处于缺铁环境中时地上部出现明显的黄化现象, 分根处理下地上部未出现黄化现象, 但两侧根系均表现出相类似的适应缺铁的变化。这表明部分根系正常供铁可以有效缓解部分根系缺铁造成的铁胁迫, 增强对铁的吸收, 使地上部有充足的铁供应, 而这种缓解作用的产生可能与地上部的信号传导有关。Romera等[18]的分根试验证明, 水培条件下向日葵供铁一侧会出现缺铁侧的生理响应。Giehl等[19]的研究表明, 生长素输入载体AUX1能在植物侧根尖中积累生长素, 促进侧根的伸长, 进而改变侧根长度及根系统形态结构。Romera等[18]的研究也表明低铁刺激乙烯和生长素的分泌。因此, 吲哚乙酸和乙烯等可能在杜梨受到缺铁胁迫时分泌, 作为地上部缺铁信号物质能够在杜梨植株中传导缺铁信号, 同时也能刺激侧根和根毛的发生, 并调控质子泵分泌H+和提高Fe3+还原酶活性。后续的工作中应注重分根后地上部和根系的生理与分子响应机制研究, 从整体上分析杜梨对缺铁胁迫的响应机制。
3.2 质外体铁的活化与调用质外体pH值的降低可以活化沉积在质外体中的铁, 提高铁的移动性, 且能够调控Fe3+还原酶的活性[20]。本试验中, 杜梨缺铁处理的质外体pH值呈下降趋势, 说明缺铁可能使质外体pH值降低, 在活化质外体铁中起作用; 另外, 杜梨根系质外体铁0~4 d持续被消耗下降, 之后基本无变化, 而正常供铁处理的质外体铁含量持续积累上升, 说明在缺铁的前期(0~4 d)杜梨的根系质外体铁被活化, 且随着根系H+的分泌和还原酶活性的增加, 质外体中的Fe3+氧化物被还原为Fe2+后被再次利用, 而供铁能够使质外体积累铁素。崔骁勇等[21]的研究同样表明, 根系还原力和质子分泌能力较强的突变体豌豆E107缺铁后4~6 d即消耗了70%~80%的根系质外体铁。因此, 质外体pH值与质外体铁的活化以及植物根系的还原能力有着密切的关系。
3.3 缺铁胁迫促进杜梨幼苗铁吸收相关基因的表达缺铁胁迫的前期(2 d), 杜梨的pH值、Fe3+还原酶活性及铁吸收相关基因(如HA7、FRO2、IRT1)显著增强, 说明根系加强了铁的吸收机制。而在处理后期(10 d)Fe3+还原酶活性显著降低, 这可能是由于不断上升的pH值造成的碱性环境导致杜梨还原能力下降, 进而削弱Fe2+的吸收。缺铁胁迫条件下, 苹果耐缺铁砧木品种小金海棠根际pH值显著下降, Fe3+还原酶活性增强, 相关基因的表达显著上调[22]。
NRAMP1和NRAMP3基因属于NRAMP家族, 是与Fe2+吸收相关的基因家族, 在机理Ⅰ和机理Ⅱ植物中都存在, 该家族成员基因调控铁从液泡进入到细胞质。杜梨NRAMP 1、NRAMP3基因在6~8 d才显著表达, 而Fe2+转运基因的IRT1在2 d就显著表达, IRT1较NRAMP1/3基因对缺铁的反应更迅速, 而IRT1的表达从处理中、后期开始下调, 此时NRAMP1/3基因的表达量一直维持较高的水平。这可能是由于2种基因存在一种协同作用。缺铁前期由ZIP家族的IRT1基因主导铁的吸收, 中、后期由NRAMP基因主导调控, 两者共同形成一种组成型转运体系[23]。杜梨NRAMP1基因仅在根系表达, 且随时间的增加表达量升高, 而在叶片中NRAMP1基因不表达。这可能是由于NRAMP1基因参与了金属离子在植物体内的长距离运输。拟南芥AtNRAMP1基因仅在根系表达, 且随时间的增加表达量升高[24]; AtNRAMP3基因在根系缺铁时上调表达, 且供铁处理高量表达[25]。查倩[22]对MxNRAMP3基因表达的研究结果表明其在叶片和根系均表达, 在金属离子胁迫条件下根系的表达显著上调, 而在叶片中的表达延迟。
3.4 缺铁胁迫促进杜梨幼苗铁转运相关基因的表达杜梨在缺铁胁迫下加强了铁的长距离运输机制。缺铁导致杜梨在叶片和根系中积累了更多的柠檬酸和苹果酸, 其含量的增加可以提高植物的耐缺铁能力[26]。与杜梨类似, 在铁高效豌豆品种Santi中缺铁胁迫下根系和叶片中的柠檬酸含量增加[5]; 缺铁处理番茄根系、叶片和木质部的柠檬酸含量均显著增加, 叶片和木质部的苹果酸含量也显著高于正常供铁处理[6]。同时, 杜梨根系和叶片与铁运输相关的基因也上调表达。FRD3基因是MATE家族的成员, 在根中特异表达。杜梨FRD3基因仅在根系表达, 缺铁处理下从2 d开始持续上调表达, 并促进柠檬酸的转运, 从而加强铁向地上部的转运。Durrett等[27]对非洲爪蟾卵母细胞表达的研究表明, FRD3基因可以调控柠檬酸的转运, 且能促进形成Fe3+螯合物及释放柠檬酸进入根中。
杜梨柠檬酸合成酶基因CS1和CS2虽表达量不相同, 但均在0~6 d上调表达, 并从8 d开始下调。这可能表明柠檬酸Fe3+螯合物从根系到地上部的转运从8 d有所减少。张柳霞等[28]的研究表明, 苹果属山定子MdCS1基因在根、茎、叶中均表达, 在缺铁处理下随时间增加呈先上升后下降趋势, 9 d时表达最显著, 且促进了柠檬酸的合成。小金海棠幼叶、韧皮部和根系的CS2基因随缺铁时间的增加表达量也增加; 转CS2拟南芥植株也可以促进柠檬酸的合成, 提高柠檬酸含量[23]。机理Ⅰ型植物在缺铁胁迫下, 烟酰胺可与Fe2+螯合通过韧皮部将铁转运到地上部, 缺失了烟酰胺(NA)的番茄突变体在正常供铁条件下仍然表现出缺铁症状[29]。小金海棠NAS1基因主要在根系、叶片和韧皮部表达[8]; 杜梨NAS1和NAS2基因在根系上调表达, 增加了铁在韧皮部的移动性, 有利于铁的长距离运输。OPT家族(oligopeptide transporter family)的拟南芥AtYSL3基因在根系、叶片和花中均有表达, 但在叶片中表达量最高; ysl1ysl3双突变体表现出脉间失绿等缺铁症状[30]。YSL3基因仅在杜梨叶片表达, 缺铁处理8 d时表达量急剧升高, 表明YSL3参与杜梨地上部铁的运输。
| [1] |
张恒涛, 许雪峰, 王忆, 等. 半根供铁对苹果砧木幼苗生长的影响[J]. 果树学报, 2009, 26(5): 710-713. Zhang H T, Xu X F, Wang Y, et al. Effects of the half root iron-supply on the growth of apple trees[J]. Journal of Fruit Science, 2009, 26(5): 710-713 (in Chinese with English abstract). |
| [2] |
Jin C W, You G Y, He Y F, et al. Iron deficiency-induced secretion of phenolics facilitates the reutilization of root apoplastic iron in red clover[J]. Plant Physiology, 2007, 144(1): 278-285. DOI:10.1104/pp.107.095794 |
| [3] |
Hell R, Stephan U W. Iron uptake, trafficking and homeostasis in plants[J]. Planta, 2003, 216(4): 541-551. |
| [4] |
左元梅, 张福锁. 不同禾本科作物与花生混作对花生根系质外体铁的累积和还原力的影响[J]. 应用生态学报, 2004, 15(2): 221-225. Zuo Y M, Zhang F S. Effects of peanut mixed cropping with different gramineous plants on apoplast iron accumulation and reducing capacity of peanut[J]. Chinese Journal of Applied Ecology, 2004, 15(2): 221-225 (in Chinese with English abstract). DOI:10.3321/j.issn:1001-9332.2004.02.010 |
| [5] |
Kabir A H, Paltridge N G, Able A J, et al. Natural variation for Fe-efficiency is associated with upregulation of strategy Ⅰ mechanisms and enhanced citrate and ethylene synthesis in Pisum sativum L.[J]. Planta, 2012, 235(6): 1409-1419. DOI:10.1007/s00425-011-1583-9 |
| [6] |
López-Millán A F, Morales F, Gogorcena Y, et al. Metabolic responses in iron deficient tomato plants[J]. Journal of Plant Physiology, 2009, 166(4): 375-384. DOI:10.1016/j.jplph.2008.06.011 |
| [7] |
Han D G, Yang G H, Xu K D, et al. Overexpression of a Malus xiaojinensis Nas 1 gene influences flower development and tolerance to iron stress in transgenic tobacco[J]. Plant Molecular Biology Reporter, 2013, 31(4): 802-809. DOI:10.1007/s11105-012-0551-2 |
| [8] |
Han D G, Shi Y, Yu Z, et al. Isolation and functional analysis of MdCS1:a gene encoding a citrate synthase in Malus domestica(L.)Borkh[J]. Plant Growth Regulation, 2015, 75(1): 209-218. DOI:10.1007/s10725-014-9945-5 |
| [9] |
宗宇, 孙萍, 牛庆丰, 等. 中国北方野生杜梨分布现状及其形态多样性评价[J]. 果树学报, 2013, 30(6): 918-923. Zong Y, Sun P, Niu Q F, et al. Distribution situation and assessment of morphological diversity of wild Pyrus betulaefolia in Northern China[J]. Journal of Fruit Science, 2013, 30(6): 918-923 (in Chinese with English abstract). |
| [10] |
Han Z H, Wang Q, Shen T. Comparison of some physiological and biochemical characteristics between iron-efficient and iron-inefficient species in genus Malus[J]. Journal of Plant Nutrition, 1994, 17(7): 1257-1264. DOI:10.1080/01904169409364803 |
| [11] |
Gogorcena Y, Abadia J, Abadia A. Induction of in vivo root ferric chelate reductase activity in fruit tree rootstock[J]. Journal of Plant Nutrition, 2000, 23(1): 9-21. DOI:10.1080/01904160009381993 |
| [12] |
崔美香, 台社珍, 赵志军, 等. 蚯蚓和铁处理对苹果根铁营养影响[J]. 广西植物, 2010, 30(4): 513-516. Cui M X, Tai S Z, Zhao Z J, et al. Effect of treating with earthworm and iron on iron nutrition of apple roots[J]. Guihaia, 2010, 30(4): 513-516 (in Chinese with English abstract). DOI:10.3969/j.issn.1000-3142.2010.04.017 |
| [13] |
Karkacier M, Erbas M, Uslu M K, et al. Comparison of different extraction and detection methods for sugars using amino-bonded phase HPLC[J]. Journal of Chromatographic Science, 2003, 41(6): 331-333. DOI:10.1093/chromsci/41.6.331 |
| [14] |
Gasic K, Hernandez A, Korban S S. RNA extraction from different apple tissues rich in polyphenols and polysaccharides for cDNA library construction[J]. Plant Molecular Biology Reporter, 2004, 22(4): 437-438. DOI:10.1007/BF02772687 |
| [15] |
Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [16] |
刘灵, 廖红, 王秀荣, 等. 不同根构型大豆对低磷的适应性变化及其与磷效率的关系[J]. 中国农业科学, 2008, 41(4): 1089-1099. Liu L, Liao H, Wang X R, et al. Adaptive changes of soybean genotypes with different root architectures to low phosphorus availability as related to phosphorus efficiency[J]. Scientia Agricultura Sinica, 2008, 41(4): 1089-1099 (in Chinese with English abstract). DOI:10.3864/j.issn.0578-1752.2008.04.019 |
| [17] |
Reyt G, Boudouf S, Boucherez1 J, et al. Iron- and ferritin-dependent reactive oxygen species distribution:impact on Arabidopsis root system architecture[J]. Molecular Plant, 2015, 8(3): 439-453. DOI:10.1016/j.molp.2014.11.014 |
| [18] |
Romera F J, Esteban A, de la Guardia M D. Role of roots and shoots in the regulation of the Fe efficiency responses in sunflower and cucumber[J]. Physiologia Plantarum, 1992, 85(2): 141-146. DOI:10.1111/ppl.1992.85.issue-2 |
| [19] |
Giehl R F, Lima J E, von Wirén N. Localized iron supply triggers lateral root elongation in Arabidopsis by altering the AUX1-mediated auxin distribution[J]. The Plant Cell, 2012, 24(1): 33-49. DOI:10.1105/tpc.111.092973 |
| [20] |
郭世伟, 邹春琴, 江荣凤, 等. 提高植物体内铁再利用效率的研究现状及进展[J]. 中国农业大学学报, 2000, 5(3): 80-86. Guo S W, Zou C Q, Jiang R F, et al. Advances in improving iron reutilization efficiency of higher plant[J]. Journal of China Agricultural University, 2000, 5(3): 80-86 (in Chinese with English abstract). DOI:10.3321/j.issn:1007-4333.2000.03.014 |
| [21] |
崔骁勇, 张福锁, 王贺, 等. 两种基因型豌豆根系质外体铁的积累与消耗[J]. 植物营养与肥料学报, 1999, 5(1): 67-71. Cui X Y, Zhang F S, Wang H, et al. Accumulation and depletion of apoplastic iron in roots of two pea genotypes[J]. Plant Nutrition and Fertilizer Science, 1999, 5(1): 67-71 (in Chinese with English abstract). DOI:10.3321/j.issn:1008-505X.1999.01.012 |
| [22] |
查倩.小金海棠耐低铁机制及其早期信号响应的研究[D].北京: 中国农业大学, 2014. Zha Q. Mechnisms of low iron tolerance and their early signal response in Malus xiaojinensis[D]. Beijing: China Agricultural University, 2014(in Chinese with English abstract). |
| [23] |
Thomine S, Wang R, Ward J M, et al. Cadmium and iron transport by members of a plant metal transporter family in Arabidopsis with homology to Nramp genes[J]. Proc Natl Acad Sci USA, 2000, 97(9): 4991-4996. DOI:10.1073/pnas.97.9.4991 |
| [24] |
Curie C, Alonso J M, Le J M, et al. Involvement of NRAMP1 from Arabidopsis thaliana in iron transport[J]. Biochemical Journal, 2000, 347(3): 749-755. DOI:10.1042/bj3470749 |
| [25] |
Thomine S, Lelièvre F, Debarbieux E, et al. AtNRAMP 3, a multispecific vacuolar metal transporter involved in plant responses to iron deficiency[J]. The Plant Journal, 2003, 34(5): 685-695. DOI:10.1046/j.1365-313X.2003.01760.x |
| [26] |
Kabir A H, Paltridge N G, Roessner U, et al. Mechanisms associated with Fe-deficiency tolerance and signaling in shoots of Pisum sativum[J]. Physiologia Plantarum, 2013, 147(3): 381-395. DOI:10.1111/ppl.2013.147.issue-3 |
| [27] |
Durrett T P, Gassmann W, Rogers E E. The FRD 3 -mediated efflux of citrate into the root vasculature is necessary for efficient iron translocation[J]. Plant Physiology, 2007, 144(1): 197-205. DOI:10.1104/pp.107.097162 |
| [28] |
张柳霞, 王忆, 朱斌, 等. 苹果属山定子柠檬酸合成酶基因(MbCS 1 )的克隆及表达分析[J]. 农业生物技术学报, 2012, 20(9): 1028-1034. Zhang L X, Wang Y, Zhu B, et al. Cloning and expression analysis of citrate synthase gene(MbCS 1)in apple(Malus baccata Borkh)[J]. Journal of Agricultural Biotechnology, 2012, 20(9): 1028-1034 (in Chinese with English abstract). DOI:10.3969/j.issn.1674-7968.2012.09.006 |
| [29] |
Pich A, Scholz G. Translocation of copper and other micronutrients in tomato plants(Lycopersicon esculentum Mill.):nicotianamine-stimulated copper transport in the xylem[J]. Journal of Experimental Botany, 1996, 47(1): 41-47. DOI:10.1093/jxb/47.1.41 |
| [30] |
Waters B M, Chu H S, Didonato R J, et al. Mutations in Arabidopsis yellow stripe-like1(YSL1)and yellow stripe-like3(YSL3)reveal their roles in metal ion homeostasis and loading of metal ions in seeds[J]. Plant Physiology, 2006, 141(4): 1446-1458. DOI:10.1104/pp.106.082586 |




