文章信息
- 刘珊珊, 陶成圆, 李春雨, 沈宗专, 李荣, 沈其荣
- LIU Shanshan, TAO Chengyuan, LI Chunyu, SHEN Zongzhuan, LI Rong, SHEN Qirong
- 灌溉消毒水源对香蕉植株生长和可培养微生物数量的影响
- Effects of irrigating disinfectant water on the banana plant growth and the number of cultivable microorganisms
- 南京农业大学学报, 2019, 42(3): 456-464
- Journal of Nanjing Agricultural University, 2019, 42(3): 456-464.
- http://dx.doi.org/10.7685/jnau.201809023
-
文章历史
- 收稿日期: 2018-09-15
2. 广东省农业科学院果树研究所, 广东 广州 510640
2. Institute of Fruit Tree Research, Guangdong Academy of Agricultural Sciences, Guangzhou 510640, China
香蕉枯萎病又称香蕉巴拿马病、黄叶病[1], 是由尖孢镰刀菌古巴专化型4号生理小种(Fusarium oxysporum f. sp. cubense Snyder and Hansen race 4)侵染而引起维管束坏死的一种毁灭性的真菌病害, 是一种世界范围内分布广、危害严重的植物病害[2-4]。近年来, 该病害在我国香蕉主产区持续爆发并不断扩大发生面积, 发病率为10%~40%, 严重的地区可高达90%以上[5]。我国大部分香蕉种植区实行连作, 种植模式单一, 由于对土传病害处理不当, 造成土壤微生物生态系统破坏[6], 香蕉枯萎病发生加剧, 严重威胁了我国香蕉产业的可持续发展。
香蕉枯萎病病原菌的传播是造成香蕉枯萎病蔓延的重要原因, 病蕉残体、病土、农具、雨水、线虫、带病菌的吸芽及二级苗等均可导致病原菌的传播[7], 其中含病原菌水源是造成其大规模传播的重要途径。目前, 针对香蕉枯萎病的防控措施主要有检疫、栽培管理、化学防控和生物防控, 其中生物防控环保、安全、经济[8], 且具有较好的防控效果[9], 成为当前研究热点, 但这些物理、化学和生物的防治措施都没有从传播途径入手。目前, 国内外从传播途径上进行防控香蕉枯萎病的研究较少, 因此, 研究基于传播途径的香蕉枯萎病防控措施具有创新性的意义。
有研究表明, 熏蒸剂熏蒸土壤能有效防治土传病害[10], 但熏蒸剂用于消毒灌溉水源鲜有报道。本研究从香蕉枯萎病的传播途径入手, 以草地土和香蕉连作土为供试土壤, 利用消毒剂对含有病原菌的灌溉水源进行消毒处理, 探究灌溉水源对香蕉生长和病原菌入侵的影响, 以期为有效控制病原菌的传播提供试验依据, 同时为香蕉枯萎病的防控提供新的思路和方法。
1 材料与方法 1.1 供试材料供试土样:草地土为蕉园附近未种植过香蕉的草地土壤, 经过稀释涂布确定病原菌数量为1.5×103 CFU · g-1; 连作蕉园土为多年连续种植香蕉的发病土壤, 病原菌数量为2.75×103 CFU · g-1。供试土样采集于广东省东莞市香蕉园。供试香蕉苗:巴西香牙蕉(Musa AAA cavendish cv. Brazil)组培苗, 由海南万钟实业有限公司组培厂提供。供试菌株:香蕉枯萎病病原菌尖孢镰刀菌古巴专化型4号生理小种(Fusarium oxysporum f. sp. cubense Snyder and Hansen race 4, FOC)由本实验室保存。供试消毒剂:次氯酸钠(分析纯, 活性氯含量不小于5%)、过氧化氢(分析纯, 含量不少于30%), 购自上海久亿化学试剂有限公司; 氨水(分析纯, 含量25%~28%), 购自无锡市亚盛化工有限公司。
1.2 灌溉水源消毒剂的选择与消毒灌溉水源的制备通过对蕉园附近灌溉水源进行稀释涂布平板计数得出水源中病原菌的数量为1.6×104 CFU · mL-1。根据涂布计数结果, 在室内无菌条件下用无菌水将病原菌孢子液进行稀释, 人工配制含相同病原菌数量的灌溉水源, 然后对该水源进行消毒处理:将次氯酸钠、过氧化氢、氨水3种液态消毒剂均分别稀释至100倍(100×)、500倍(500×)、1 000倍(1 000×)、2 000倍(2 000×)和4 000倍(4 000×), 即将3种液态消毒剂均分别稀释成10、2、1、0.5和0.25 g · L-1的工作液, 将5种浓度的消毒剂工作液与灌溉水按照1 : 9(体积比)混合于三角瓶中, 28 ℃静置培养24 h, 稀释涂布计数消毒前、后灌溉水中病原菌数量, 以未添加消毒剂为对照[5]。病原菌的相对消毒率计算公式为:病原菌的相对消毒率=(对照处理的病原菌数量-消毒处理的病原菌数量)/对照处理病原菌的数量×100%。根据消毒剂消毒效果选择合适浓度消毒剂制备的消毒灌溉水备用。其中, 次氯酸钠继续稀释至5 000倍(5 000×)和6 000倍(6 000×)进行试验, 验证其消毒效果。同时, 在稀释至4 000倍(4 000×)的次氯酸钠消毒后的水源中按照9 : 1(体积比)添加1.6×104 CFU · mL-1含病原菌水源, 28 ℃静置培养24 h后进行稀释涂布, 验证二次消毒作用。
1.3 盆栽试验盆栽试验于3月15日至5月15日在实验室的人工气候箱中进行, 共设置4个处理:1)草地土灌溉消毒水源(GD); 2)草地土灌溉含病原菌水源(GFOC); 3)连作蕉园土灌溉消毒水源(OD); 4)连作蕉园土灌溉含病原菌水源(OFOC)。试验设置3个重复, 每个重复3盆香蕉, 每盆种植1株苗。每个塑料花盆(外口直径、底直径、高分别为10、7和8 cm)分装250 g草地土或连作蕉园土, 移栽长有3片真叶的香蕉幼苗, 每隔3 d用注射器直接向每盆中加入50 mL消毒水源和未消毒水源进行定量灌溉。
1.4 样品采集幼苗生长60 d后, 从每个处理的3个重复中随机选取1株健康植株采集土体土壤、根际土壤和植株根部样品。移除香蕉苗后, 将土混匀, 用四分法保留20 g左右的土壤作为各处理的土体土壤样品。收集香蕉植株根系, 抖落根系表面土壤, 收集附着在根系0~2 mm的土壤作为根际土壤样品。将根系表面土壤洗净, 次氯酸钠溶液消毒根系后作为根部样品。
1.5 香蕉植株生长指标测定测量香蕉植株的株高、茎粗、叶长、叶宽、植株鲜质量和根系鲜质量, 将植株70 ℃烘干至恒质量, 称取植株干质量。
1.6 微生物数量测定采用平板稀释涂布计数法测定各处理总细菌、总真菌、尖孢镰刀菌、芽胞杆菌和假单胞菌数量。选取合适稀释梯度, 吸取100 μL土壤稀释液至相应平板, 均匀涂布。总细菌采用LB培养基, 真菌采用马丁氏培养基, 尖孢镰刀菌采用Komada培养基, 假单胞菌采用假单胞菌CFC选择性培养基, 芽胞杆菌采用添加1%多黏菌素和1%放线菌酮的LB培养基。将每克土壤形成的菌落数(colony forming unit, CFU)取对数值, 以CFU · g-1表示。各样品中每克土壤的细菌菌落数与真菌菌落数的比值即为可培养细菌与真菌的比值(B/F)。
1.7 数据分析采用Excel 2007和SPSS 21.0软件对数据进行统计分析。用SPSS 21.0进行t测验分析处理间差异的显著性。用R(version 3.2.0)语言软件进行可培养微生物间的斯皮尔曼相关性分析和主成分分析。用Excel 2007和R语言软件作图。
2 结果与分析 2.1 不同消毒剂对灌溉水源消毒效果的影响从表 1可知:不同消毒剂对灌溉水中的病原菌均有抑制作用, 不同消毒剂母液稀释500倍后, 对灌溉水中病原菌消毒率均为100.00%。母液稀释2 000倍时, 次氯酸钠对病原菌相对消毒率为100.00%, 过氧化氢的消毒率为99.98%, 而氨水的消毒率下降明显, 仅为83.75%。母液稀释4 000倍时, 次氯酸钠仍具有100.00%的消毒率, 而过氧化氢和氨水对病原菌的相对消毒率均显著下降, 分别为97.59%和52.34%, 将次氯酸钠继续稀释至5 000和6 000倍时, 对病原菌的消毒效果分别为99.99%和99.97%。稀释4 000倍的次氯酸钠具有最佳的消毒效果, 因此本研究选用稀释4 000倍的次氯酸钠消毒液对含有病原菌的水源进行消毒处理, 制备消毒水源。另外, 继续向稀释4 000倍的次氯酸钠消毒后的水源中添加相同浓度的病原菌的试验结果显示, 消毒后的水源对病原菌不再具有消毒效果。
| 处理Treatment | 不同稀释倍数处理的病原菌相对消毒率/% Relative disinfection rate of FOC in different multiple dilution treatment | ||||||
| 100× | 500× | 1 000× | 2 000× | 4 000× | 5 000× | 6 000× | |
| NaClO | 100.00 | 100.00 | 100.00 | 100.00 | 100.00 | 99.99 | 99.97 |
| H2O2 | 100.00 | 100.00 | 100.00 | 99.98 | 97.59 | ||
| 氨水Ammonia water | 100.00 | 100.00 | 99.78 | 83.75 | 52.34 | ||
由表 2可知:与灌溉含病原菌水源相比, 草地土壤(GD)和连作蕉园土壤(OD)灌溉消毒水源后, 香蕉植株的生长状况得到明显改善, 灌溉消毒水源处理香蕉植株的株高、茎粗、叶面积和生物量均明显高于含病原菌水源处理。在草地土壤中, 相比于灌溉未消毒水源, 灌溉消毒水源香蕉植株的茎粗、根鲜质量和植株干质量显著增加(P < 0.05);植株株高、茎粗、叶面积、植株鲜质量和植株干质量分别比灌溉含病原菌水源增加7.57%、15.96%、30.89%、21.36%和61.58%;在蕉园土壤中, 灌溉消毒水源处理的香蕉植株茎粗、植株鲜质量和植株干质量显著高于含病原菌水源处理(P < 0.05), 香蕉的株高、茎粗、叶面积、植株鲜质量和植株干质量分别比含病原菌水源处理高12.10%、29.58%、32.15%、51.18%和63.60%, 同时根鲜质量在灌溉消毒水源处理和含病原菌水源处理之间差异显著。以上结果表明, 对含病原菌灌溉水源进行消毒处理能有效改善香蕉植株的生长状况。
| 处理Treatment | 株高/cm Plant height | 茎粗/mm Stem diameter | 叶面积/cm2 Leaf area | 植株鲜质量/g Shoot fresh weight | 根鲜质量/g Root fresh weight | 植株干质量/g Shoot dry weight |
| GD | 6.63±0.29 | 9.53±0.43* | 42.83±2.69 | 7.50±0.12 | 3.85±0.53* | 1.02±0.12* |
| GFOC | 6.17±0.17 | 8.22±0.46 | 32.72±4.70 | 6.18±0.96 | 1.95±0.36 | 0.63±0.07 |
| OD | 9.27±0.25 | 11.02±0.50* | 107.48±7.92 | 13.45±2.10* | 4.69±1.38 | 1.36±0.22* |
| OFOC | 8.27±0.56 | 8.5±0.66 | 81.33±19.33 | 8.90±0.74 | 2.17±0.38 | 0.83±0.09 |
| 注: OD:蕉园土消毒水源灌溉; GD:草地土消毒水源灌溉; OFOC:蕉园土含病原菌水源灌溉; GFOC:草地土含病原菌水源灌溉。以上数据以均值±标准差(x±SD, n=3)表示。*P < 0.05。 Note: OD:Banana orchard soil irrigated with disinfectant water; GD:Grassland soil irrigated with disinfectant water; OFOC:Banana orchard soil irrigated with water containing FOC; GFOC:Grassland soil irrigated with water containing FOC. Values(x±SD, n=3)indicate the banana growth index. *P < 0.05. |
||||||
从图 1可知:在草地土壤和连作蕉园土壤中, 灌溉消毒水源处理的香蕉土体、根际和根内尖孢镰刀菌数量均极显著少于灌溉含病原菌水源处理(P < 0.001)。在草地土壤中, 灌溉含病原菌水源处理的香蕉土体、根际和根内病原菌数量分别为灌溉消毒水源处理的2.32、3.26和3.13倍; 在连作蕉园土壤中, 灌溉含病原菌水源处理的香蕉土体、根际和根内病原菌数量分别为灌溉消毒水源处理的1.68、2.53和1.62倍。以上结果表明, 灌溉含病原菌水源能够使尖孢镰刀菌在香蕉土体土壤、根际和根内显著富集。
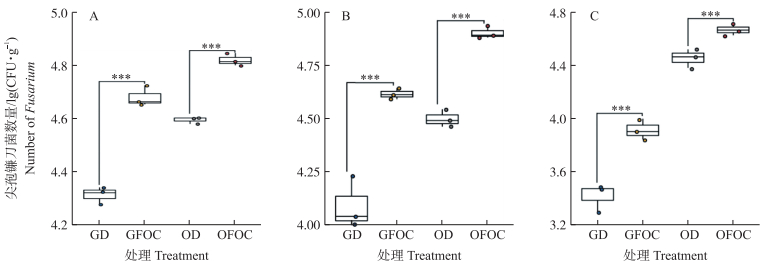
|
图 1 灌溉消毒水源对土体、根际及香蕉根内尖孢镰刀菌数量的影响 Fig. 1 Effects of irrigation of disinfectant water on the number of FOC in bulk soil, banana rhizosphere and root A.香蕉土体土壤; B.香蕉根际土壤; C.香蕉根内。 A. Banana bulk soil; B. Banana rhizosphere soil; C. Banana root. * * *P < 0.001. |
与灌溉含病原菌水源相比, 灌溉消毒水源改变了香蕉土体和根际可培养细菌和真菌数量, 同时对土体和根际可培养细菌和真菌数量比值产生了影响。在草地和连作蕉园土壤中, 灌溉消毒水源处理的土体可培养细菌数量均显著高于灌溉含病原菌水源处理(图 2-A), 可培养真菌数量均明显低于含病原菌水源处理(图 2-C); 可培养细菌数量在草地和连作蕉园土壤中分别比含病原菌水源处理极显著增加271.20%(P < 0.001)和122.63%(P < 0.01), 而真菌数量分别减少41.10%(P < 0.01)和18.34%;灌溉消毒水源处理香蕉土体B/F极显著高于灌溉含病原菌水源处理(P < 0.01), 在草地土和连作蕉园土中分别达6.31和2.70倍。灌溉含病原菌水源处理的香蕉根际可培养细菌和真菌数量在草地和连作蕉园土壤中均明显高于灌溉消毒水源处理; 可培养细菌数量在草地和蕉园连作根际土壤中分别比消毒水源处理高出47.18%(P < 0.01)和22.13%(图 2-B), 可培养真菌数量分别高出16.74%和20.37%(P < 0.01)(图 2-C); B/F值分别高出37.46%(P < 0.01)和2.36%(图 3)。以上结果表明, 灌溉消毒水源处理显著提高了香蕉土体土壤的B/F值, 灌溉含病原菌水源处理则明显提高了根际土壤的B/F值。
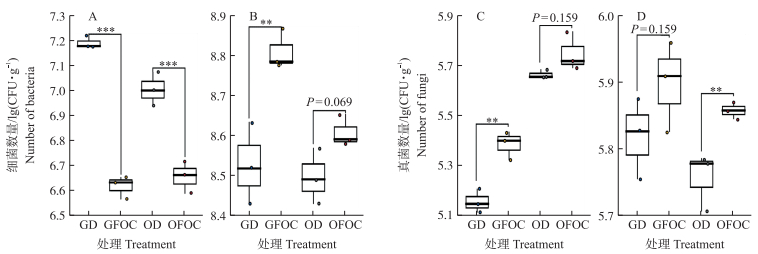
|
图 2 灌溉消毒水源对香蕉土体和根际可培养细菌(A、B)和真菌(C、D)数量的影响
Fig. 2 Effects of irrigation of disinfectant water on the number of bacteria(A, B)and fungi(C, D) in banana bulk and rhizosphere soils
A、C.香蕉土体土壤; B、D.香蕉根际土壤。 A, C. Banana bulk soil; B, D. Banana rhizosphere soil. * * P < 0.01, * * * P < 0.001. |
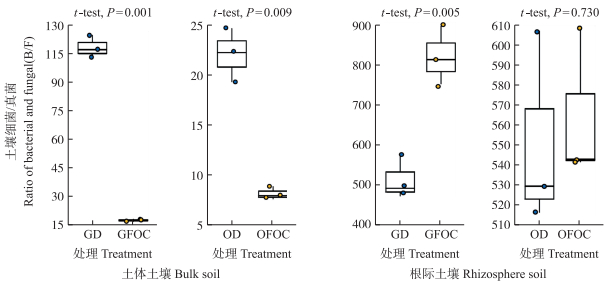
|
图 3 灌溉消毒水源对香蕉土体和根际土壤细菌和真菌数量比值的影响 Fig. 3 Effects of irrigation of disinfectant water on the ratio of the bacteria and fungi in banana bulk and rhizosphere soils |
从图 4可知:灌溉消毒水源和含病原菌水源处理的香蕉根际土壤芽胞杆菌和假单胞菌的数量发生了明显改变。灌溉含病原菌水源的香蕉根际芽胞杆菌和假单胞菌的数量均明显多于灌溉消毒水源的处理。与灌溉消毒水源处理相比, 根际芽胞杆菌数量在草地土壤和连作蕉园土壤中分别高出14.35%和46.98%(P < 0.001), 假单胞菌数量则分别高出69.23%(P < 0.001)和96.39%(P < 0.001)。以上结果表明, 灌溉含病原菌水源处理明显增加了香蕉根际土壤芽胞杆菌和假单胞菌数量。

|
图 4 灌溉消毒水源对香蕉根际芽胞杆菌和假单胞菌数量的影响 Fig. 4 Effects of irrigation of disinfectant water on the number of Bacillus and Pseudomonas in banana rhizosphere soils * * * P < 0.001. |
基于Bray-curits距离的主成分分析结果(图 5)表明, 灌溉消毒水源和含病原菌水源处理间香蕉土壤样品的可培养微生物群落组成存在明显差异(AMOVA, P < 0.01)。第1、2主坐标轴分别解释了总变异的52.92%和29.08%。灌溉消毒水源和含病原菌水源处理香蕉根际环境的可培养微生物群落均延第1轴(PCA1)和第2轴(PCA2)明显区分。其中, 草地土和连作蕉园土壤中灌溉消毒水源处理和含病原菌水源处理在第1轴(PCA1)上相距较远, 说明其微生物群落之间存在较大差异。综上, 灌溉消毒水源和含病原菌水源处理分别显著形成了不同的土壤可培养微生物群落。
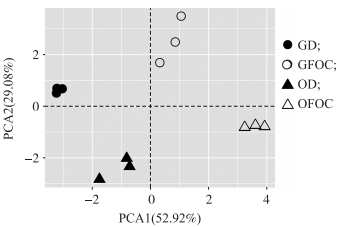
|
图 5 可培养微生物群落主成分分析 Fig. 5 Principal component analysis(PCA)of cultivable microbes |
香蕉土体土壤可培养细菌(Bacterial B)、真菌(Fungal B)、尖孢镰刀菌(Fusarium B), 根际土壤可培养细菌(Bacterial R)、真菌(Fungal R)、尖孢镰刀菌(Fusarium R)、芽胞杆菌(Bacillus R)、假单胞菌(Pseudomonas R)和根内尖孢镰刀菌(Fusarium Root)间的斯皮尔曼相关性分析结果如图 6所示。土体土壤中可培养细菌数量与土体和根际土壤中尖孢镰刀菌数量均呈显著负相关关系(P < 0.01);可培养真菌数量与土体、根际土壤和根内尖孢镰刀菌数量均呈显著正相关关系; 土体尖孢镰刀菌数量与根际尖孢镰刀菌数量呈显著正相关关系(P < 0.01)。土体土壤中尖孢镰刀菌入侵时, 可培养细菌数量减少, 可培养真菌和尖孢镰刀菌数量增加。根际土壤中可培养细菌数量与土体和根际土壤尖孢镰刀菌数量均呈正相关关系(P < 0.1);可培养真菌与根际尖孢镰刀菌数量呈正相关关系(P < 0.1);假单胞菌数量与土体土壤(P < 0.001)、根际土壤和根内尖孢镰刀菌的数量均呈显著正相关关系; 芽胞杆菌与根内尖孢镰刀菌数量呈显著负相关关系(P < 0.05)。根际中尖孢镰刀菌入侵时, 可培养微生物群落结构发生明显改变, 可培养细菌、可培养真菌和假单胞菌数量均明显减少。

|
图 6 可培养微生物间斯皮尔曼相关性分析 Fig. 6 Spearman ' s correlation matrix of cultivable microbes B.香蕉土体土壤; R.香蕉根际土壤; Root.香蕉根内。 B. Banana bulk soil; R. Banana rhizosphere soil; Root. Banana root. *P < 0.05, * * P < 0.01, * * * P < 0.001. |
对含有病原菌的水源进行消毒处理可以切断灌溉水源这一传播途径, 减少枯萎病的发生, 但是国内外关于灌溉水源消毒的报道较少。本研究从灌溉水源入手, 探究其对香蕉生长和生长过程中的土体、根际和根内病原菌数量的影响, 具有创新性意义。过氧化氢、氨水和次氯酸钠均为环境友好型生态试剂[11-12]。本研究选用过氧化氢、氨水和次氯酸钠对含病原菌灌溉水源进行消毒处理, 3种消毒剂均对水中的病原菌具有消毒作用, 高浓度时消毒率均为100%。随着稀释倍数增加, 次氯酸钠具有最优的病原菌消毒效果, 原液稀释4 000倍后病原菌消毒效率仍为100%, 此结果与钟书堂等[13]的报道一致。
本研究发现, 灌溉含病原菌水源处理的香蕉植株生长缓慢, 灌溉通过次氯酸钠消毒处理水源的香蕉植株长势良好, 株高、茎粗、叶面积和生物量等生长指标均显著高于灌溉含病原菌水源处理, 这与赵丽娅等[14]在黄瓜研究中的结果相符。致病性尖孢镰刀菌成功侵入香蕉植株根系后, 在植物体内释放造成植物枯萎性状的毒素, 导致香蕉生长受到抑制[15]。
在土体土中, 无论是草地土还是蕉园土, 灌溉含病原菌水源处理的病原菌数量均明显高于灌溉消毒水源处理, 说明灌溉水消毒处理有效地减少了土体中病原菌数量。土传枯萎病的发生与根际病原菌数量有直接关系, 发病率的高低与植物根际土壤中的病原菌数量呈显著正相关关系[16-17]。本研究表明灌溉消毒水源可以降低尖孢镰刀菌在香蕉根际环境中的富集, 从根本上减缓香蕉枯萎病等土传病害的发生。本研究同样发现根际土中病原菌的数量少于土体土中病原菌的数量, 可能是由于香蕉处于苗期, 并未出现发病症状, 根际处于病原菌富集阶段, 这与先前报道的香蕉[18]、西瓜[19]苗期病原菌数量的研究结果类似。能够被培养的微生物在自然环境中的生态功能才能够被评估, 并且, 土壤可培养微生物的生物量和代谢活性对维持土壤的生态功能具有极其重要的作用[20]。本研究采用平板稀释涂布法研究香蕉灌溉消毒水源和含病原菌水源后土壤可培养微生物群落结构的变化, 结果表明灌溉消毒水源改变了香蕉根际可培养微生物群落结构。有研究表明, 不同健康程度蕉园具有不同的可培养微生物群落结构[21]。因此, 灌溉水源可以通过改变香蕉根际可培养微生物群落结构, 从而改变香蕉植株的长势与健康状况。
在土体土中, 与灌溉消毒水源相比, 灌溉含病原菌水源后, 病原菌数量明显增高, 可能是导致其土体土壤中真菌数量高于灌溉消毒水源处理的原因, 这与Shen等[22]的研究结果一致。高发病率土壤具有更高的病原菌和真菌数量。灌溉含病原菌水源的土体中, 可培养细菌数量显著低于消毒水源灌溉处理, 可能是由于真菌数量增多, 与细菌竞争养分和生存空间, 从而使细菌数量降低。病原菌入侵植物时, 会造成土壤B/F值下降, 导致土壤向真菌化发展, 土壤抵御病原菌的能力减弱, 枯萎病病害发生的可能性增加[23-25], 抑病能力降低[26]。发病率高的香蕉根际病原菌和真菌数量高[27]。本试验中, 根际病原菌和真菌数量显著高于灌溉消毒水源处理。此外, 灌溉消毒水源处理香蕉植株根际中, 细菌数量高于灌溉含病原菌水源处理, 可能是由于根际病原菌数量显著增多, 使根际中有益细菌数量增加(芽胞杆菌、假单胞菌等), 抵御病原菌的入侵[28], 这与Mendes等[29]的研究结果一致。根际微生物和植物间可以相互影响, 病原菌入侵植物根际后, 激发植物自我保护机制, 通过分泌根系分泌物等途径促进有益细菌向根际聚集抵御病原真菌。
本研究中, 根际可培养细菌数量与尖孢镰刀菌数量呈显著负相关关系, 可培养真菌数量与尖孢镰刀菌数量呈显著正相关关系。香蕉根际尖孢镰刀菌数量决定了香蕉枯萎病的发生, 与发病率呈显著正相关关系[30-31]。丁文娟等[32]发现真菌丰度与香蕉枯萎病病原菌之间存在显著的正相关关系, Xiong等[33]发现细菌丰度与香蕉枯萎病病原菌之间存在显著的负相关关系。与上述研究结果一致, 灌溉消毒水源处理可能通过降低土壤可培养真菌数量、增加可培养细菌数量从而降低香蕉患枯萎病的风险。灌溉消毒水源处理的香蕉根际芽胞杆菌和假单胞菌的数量明显少于灌溉含病原菌水源处理。芽胞杆菌和假单胞菌也常被作为植物健康状况和土壤抵御疾病能力的指示微生物, 具备抑病能力的土壤以及植物被病原菌侵害发病时均能检测到较高丰度的芽胞杆菌和假单胞菌[34]。这表明水源中的病原菌入侵香蕉成功并诱导香蕉根际的免疫反应, 通过诱导芽胞杆菌和假单胞菌在香蕉根际富集增强香蕉根际抵御病原菌的能力, 根际假单胞菌和芽胞杆菌与根际和根内尖孢镰刀菌数量的斯皮尔曼相关性分析结果也证实了这一假设。
综上所述, 灌溉用环保消毒剂次氯酸钠进行消毒处理的无病原菌水源, 能够显著减缓病原菌在土壤中传播和在香蕉根际的富集, 促进香蕉植株生长, 这为防控香蕉枯萎病提供了新的研究思路, 有望提高香蕉枯萎病的综合防控效果。
| [1] |
李进, 张立丹, 刘芳, 等. 碱性肥料对香蕉枯萎病发生及土壤微生物群落的影响[J]. 植物营养与肥料学报, 2016, 22(2): 429-436. Li J, Zhang L D, Liu F, et al. Effect of alkaline fertilizer on occurrence of banana wilt disease and soil microbial community[J]. Plant Nutrition and Fertilizer Science, 2016, 22(2): 429-436 (in Chinese with English abstract). |
| [2] |
陈波, 黄霄, 刘小玉, 等. 不同香蕉枯萎病区土壤细菌群落多样性[J]. 应用生态学报, 2013, 24(8): 2281-2286. Chen B, Huang X, Liu X Y, et al. Diversity of soil bacterial communities in banana orchards infected with wilt disease[J]. Chinese Journal of Applied Ecology, 2013, 24(8): 2281-2286 (in Chinese with English abstract). |
| [3] |
剧虹伶, 张曼, 阮云泽, 等. 不同品种香蕉抗枯萎病效果及抗性生理研究[J]. 植物保护, 2017, 43(2): 82-87. Ju H L, Zhang M, Ruan Y Z, et al. The effects and mechanisms of different banana varieties to Fusarium wilt disease[J]. Plant Protection, 2017, 43(2): 82-87 (in Chinese with English abstract). DOI:10.3969/j.issn.0529-1542.2017.02.013 |
| [4] |
张茂星, 陈鹏, 张明超, 等. 硝/铵营养对香蕉枯萎病尖孢镰刀菌生长的影响[J]. 植物营养与肥料学报, 2013, 19(1): 232-238. Zhang M X, Chen P, Zhang M C, et al. Influence of nitrate/ammonium on Fusarium oxysporum f. sp. cubense of banana wilt disease[J]. Plant Nutrition and Fertilizer Science, 2013, 19(1): 232-238 (in Chinese with English abstract). |
| [5] |
钟书堂, 沈宗专, 孙逸飞, 等. 生物有机肥对连作蕉园香蕉生产和土壤可培养微生物区系的影响[J]. 应用生态学报, 2015, 26(2): 481-489. Zhong S T, Shen Z Z, Sun Y F, et al. Effects of continuous application of bio-organic fertilizer on banana production and cultural microflora of bulk soil in orchard with serious disease incidence[J]. Chinese Journal of Applied Ecology, 2015, 26(2): 481-489 (in Chinese with English abstract). |
| [6] |
付琳, 阮云泽, 沈宗专, 等. 生物有机肥对连作香蕉根际土壤可培养细菌区系的影响[J]. 南京农业大学学报, 2012, 35(6): 82-88. Fu L, Ruan Y Z, Shen Z Z, et al. Effects of bio-organic fertilizer on the community structure of culturable bacteria in the rhizosphere soil of a continuous-cropping banana filed[J]. Journal of Nanjing Agricultural University, 2012, 35(6): 82-88 (in Chinese with English abstract). DOI:10.7685/j.issn.1000-2030.2012.06.014 |
| [7] |
吴运新, 卓国豪. 香蕉枯萎病的发生及防治对策[J]. 柑桔与亚热带果树信息, 2004, 20(4): 39-40. Wu Y X, Zhuo G H. The occurrence of banana wilt and its control strategies[J]. Citrus and Subtropical Fruit Tree Information, 2004, 20(4): 39-40 (in Chinese). DOI:10.3969/j.issn.1673-1514.2004.04.060 |
| [8] |
黄建凤, 张发宝, 逄玉万, 等. 两株香蕉枯萎病拮抗细菌的筛选及抑菌机理[J]. 微生物学通报, 2017, 44(4): 835-844. Huang J F, Zhang F B, Pang Y W, et al. Inhibition of banana Fusarium wilt by two biocontrol agents[J]. Microbiology China, 2017, 44(4): 835-844 (in Chinese with English abstract). |
| [9] |
俞鲁, 凌宁, 张楠, 等. 香蕉枯萎病拮抗菌的筛选鉴定及其生防效果[J]. 南京农业大学学报, 2012, 35(4): 81-86. Yu L, Ling N, Zhang N, et al. Isolation, identification and biocontrol effect of antagonistic bacteria against Fusarium oxysporum f. sp. cubense[J]. Journal of Nanjing Agricultural University, 2012, 35(4): 81-86 (in Chinese with English abstract). DOI:10.7685/j.issn.1000-2030.2012.04.015 |
| [10] |
王小星, 樊文华. 熏蒸剂对土传病害防治的研究进展[J]. 山西农业大学学报(自然科学版), 2017, 37(1): 72-76. Wang X X, Fan W H. The research progress of fumigant ' s effects to soil-borne disease prevention and treatment[J]. Journal of Shanxi Agricultural University(Natural Science Edition), 2017, 37(1): 72-76 (in Chinese with English abstract). DOI:10.3969/j.issn.1671-8151.2017.01.013 |
| [11] |
杨瑶, 朱琳, 赵巍, 等. 几种消毒剂对自来水中"红虫"的杀灭效果比较[J]. 环境科学与技术, 2006, 29(4): 66-68, 119. Yang Y, Zhu L, Zhao W, et al. Comparison of the killing effect of several disinfectants on"red worm"in tap water[J]. Environmental Science and Technology, 2006, 29(4): 66-68, 119 (in Chinese). DOI:10.3969/j.issn.1003-6504.2006.04.026 |
| [12] |
沈宗专, 钟书堂, 赵建树, 等. 氨水熏蒸对高发枯萎病蕉园土壤微生物区系及发病率的影响[J]. 生态学报, 2015, 35(9): 2946-2953. Shen Z Z, Zhong S T, Zhao J S, et al. Effects of ammonia fumigation on soil microflora and banana production in an orchard with serious Fusarium wilt disease[J]. Acta Ecologica Sinica, 2015, 35(9): 2946-2953 (in Chinese with English abstract). |
| [13] |
钟书堂, 吕娜娜, 孙逸飞, 等. 连作香蕉园生态熏蒸剂的筛选及其对土壤微生物群落结构的影响[J]. 土壤, 2015, 47(6): 1092-1100. Zhong S T, Lü N N, Sun Y F, et al. Screening of ecological fumigant and its effect on soil microbial community structure of continuous-cropping banana field[J]. Soils, 2015, 47(6): 1092-1100 (in Chinese with English abstract). |
| [14] |
赵丽娅, 李文庆, 唐龙翔, 等. 有机肥对黄瓜枯萎病的防治效果及防病机理研究[J]. 土壤学报, 2015, 52(6): 1383-1391. Zhao L Y, Li W Q, Tang L X, et al. Effect of organic manure on cucumber Fusarium wilt control and its mechanism[J]. Acta Pedologica Sinica, 2015, 52(6): 1383-1391 (in Chinese with English abstract). |
| [15] |
李赤, 黎永坚, 于莉, 等. 香蕉枯萎病菌毒素的成分分析及其生物测定[J]. 果树学报, 2010, 27(6): 969-974. Li C, Li Y J, Yu L, et al. Ⅱngredient analysis and bioassay of the toxin of Fusarium oxysporum f. sp. cubense[J]. Journal of Fruit Science, 2010, 27(6): 969-974 (in Chinese with English abstract). |
| [16] |
Wang J J, Zhao Y, Ruan Y Z. Effects of bio-organic fertilizers produced by four Bacillus amyloliquefaciens strains on banana Fusarium wilt disease[J]. Compost Science & Utilization, 2015, 23(3): 185-198. |
| [17] |
吕恒, 牛永春, 邓晖, 等. 根际真菌对黄瓜土传病害的抑制作用[J]. 应用生态学报, 2015, 26(12): 3759-3765. Lü H, Niu Y C, Deng H, et al. Suppression of three soil-borne diseases of cucumber by a rhizosphere fungal strain[J]. Chinese Journal of Applied Ecology, 2015, 26(12): 3759-3765 (in Chinese with English abstract). |
| [18] |
陶成圆.含解淀粉芽胞杆菌NJN-6的生物有机肥防控香蕉枯萎病研究[D].南京: 南京农业大学, 2016. Tao C Y. Effect of the combination of bio-organic fertilizer with Bacillus amyloliquefaciens NJN-6 on the control of banana Fusarium wilt disease[D]. Nanjing: Nanjing Agricultural University, 2016(in Chinese with English abstract). |
| [19] |
凌宁, 王秋君, 杨兴明, 等. 根际施用微生物有机肥防治连作西瓜枯萎病研究[J]. 植物营养与肥料学报, 2009, 15(5): 1136-1141. Ling N, Wang Q J, Yang X M, et al. Control of Fusarium wilt of watermelon by nursery application of bio-organic fertilizer[J]. Plant Nutrition and Fertilizer Science, 2009, 15(5): 1136-1141 (in Chinese with English abstract). DOI:10.3321/j.issn:1008-505X.2009.05.022 |
| [20] |
Ellis R J, Morgan P, Weightman A J, et al. Cultivation-dependent and-independent approaches for determining bacterial diversity in heavy-metal-contaminated soil[J]. Applied and Environmental Microbiology, 2003, 69(6): 3223-3230. DOI:10.1128/AEM.69.6.3223-3230.2003 |
| [21] |
Fu L, Ruan Y Z, Tao C Y, et al. Continous application of bioorganic fertilizer induced resilient culturable bacteria community associated with banana Fusarium wilt suppression[J]. Scientific Reports, 2016, 6: 27731. DOI:10.1038/srep27731 |
| [22] |
Shen Z Z, Zhong S T, Wang Y G, et al. Induced soil microbial suppression of banana Fusarium wilt disease using compost and biofertilizers to improve yield and quality[J]. European Journal of Soil Biology, 2013, 57: 1-8. |
| [23] |
Yao H Y, Wu F Z. Soil microbial community structure in cucumber rhizosphere of different resistance cultivars to Fusarium wilt[J]. FEMS Microbiology Ecology, 2010, 72: 456-463. DOI:10.1111/fem.2010.72.issue-3 |
| [24] |
李进, 樊小林, 蔺中. 碱性肥料对土壤微生物多样性及香蕉枯萎病发生的影响[J]. 植物营养与肥料学报, 2018, 24(1): 212-219. Li J, Fan X L, Lin Z. Effect of alkaline fertilizer on diversity of soil microbial communities and occurrence of banana wilt disease[J]. Plant Nutrition and Fertilizers Science, 2018, 24(1): 212-219 (in Chinese with English abstract). |
| [25] |
薛超, 黄启为, 凌宁, 等. 连作土壤微生物区系分析、调控及高通量研究方法[J]. 土壤学报, 2011, 48(3): 612-618. Xue C, Huang Q W, Ling N, et al. Continuous microflora analysis, regulation and high-throughput research methods[J]. Acta Pedologica Sinica, 2011, 48(3): 612-618 (in Chinese with English abstract). |
| [26] |
张瑞福, 沈其荣. 抑病型土壤的微生物区系特征及调控[J]. 南京农业大学学报, 2012, 35(5): 125-132. Zhang R F, Shen Q R. Characterization of the microbial flora and management to induce the disease suppressive soil[J]. Journal of Nanjing Agricultural University, 2012, 35(5): 125-132 (in Chinese with English abstract). DOI:10.7685/j.issn.1000-2030.2012.05.014 |
| [27] |
Shen Z Z, Ruan Y Z, Wang B B, et al. Effect of biofertilizer for suppressing Fusarium wilt disease of banana as well as enhancing microbial and chemical properties of soil under greenhouse trial[J]. Applied Soil Ecology, 2015, 93: 111-119. DOI:10.1016/j.apsoil.2015.04.013 |
| [28] |
Fu L, Penton C R, Ruan Y Z, et al. Inducing the rhizosphere microbiome by biofertilizer application to suppress banana Fusarium wilt disease[J]. Soil Biology & Biochemistry, 2017, 104: 39-48. |
| [29] |
Mendes R, Kruijt M, de Bruijn I, et al. Deciphering the rhizosphere microbiome for disease-suppressive Bacteria[J]. Science, 2011, 332(6033): 1097-1100. DOI:10.1126/science.1203980 |
| [30] |
赖朝圆, 杨越, 陶成圆, 等. 不同作物-香蕉轮作对香蕉生产及土壤肥力质量的影响[J]. 江苏农业学报, 2018, 34(2): 299-306. Lai C Y, Yang Y, Tao C Y, et al. Effects of replanted banana after rotation of different crops on banana production and soil fertility quality[J]. Jiangsu Journal of Agricultural Sciences, 2018, 34(2): 299-306 (in Chinese with English abstract). DOI:10.3969/j.issn.1000-4440.2018.02.011 |
| [31] |
何欣, 郝文雅, 杨兴明, 等. 生物有机肥对香蕉植株生长和香蕉枯萎病防治的研究[J]. 植物营养与肥料学报, 2010, 16(4): 978-985. He X, Hao W Y, Yang X M, et al. Effects of bioorganic fertilization on growth and controlling fusarium-wilt disease of banana[J]. Plant Nutrition and Fertilizer Science, 2010, 16(4): 978-985 (in Chinese with English abstract). |
| [32] |
丁文娟, 曹群, 赵兰凤, 等. 生物有机肥施用期对香蕉枯萎病及土壤微生物的影响[J]. 农业环境科学学报, 2014, 33(8): 1575-1582. Ding W J, Cao Q, Zhao L F, et al. Effects of biological fertilizer applications on banana wilt disease and soil microorganisms[J]. Journal of Agro-Environment Science, 2014, 33(8): 1575-1582 (in Chinese with English abstract). |
| [33] |
Xiong W, Guo S, Jousset A, et al. Bio-fertilizer application induces soil suppressiveness against Fusarium wilt disease by reshaping the soil microbiome[J]. Soil Biology & Biochemistry, 2017, 114: 238-247. |
| [34] |
Liu H J, Xiong W, Zhang R F, et al. Continuous application of different organic additives can suppress tomato disease by inducing the healthy rhizospheric microbiota through alterations to the bulk soil microflora[J]. Plant & Soil, 2018, 423(12): 229-240. |




