文章信息
- 黄河, 胡波, 胡松竹, 钮建国, 魏琪, 薛圆, 苏建亚
- HUANG He, HU Bo, HU Songzhu, NIU Jianguo, WEI Qi, XUE Yuan, SU Jianya
- 甜菜夜蛾尿苷二磷酸糖基转移酶对毒死蜱敏感性的影响
- The effects of UDP-glycosyltransferases on chlorpyrifos susceptibility to Spodoptera exigua
- 南京农业大学学报, 2019, 42(3): 448-455
- Journal of Nanjing Agricultural University, 2019, 42(3): 448-455.
- http://dx.doi.org/10.7685/jnau.201810003
-
文章历史
- 收稿日期: 2018-10-05
甜菜夜蛾(Spodoptera exigua)是一种广泛分布的农业害虫, 严重危害多种经济作物, 包括青菜、卷心菜、豇豆、大豆、葱、棉花等。生产上针对该害虫的防治主要依赖化学农药的使用。由于杀虫剂的大量、重复使用, 甜菜夜蛾的抗药性问题日益严重, 国内外许多地区均报道该害虫已对各种不同类型的杀虫剂产生抗药性[1-2], 尤其是在我国南方蔬菜种植区。如广东惠州地区甜菜夜蛾田间种群已对毒死蜱、三氟氯氰菊酯、氰氟虫腙、阿维菌素等杀虫剂产生极高水平的抗药性[3]。这种多药抗性往往与解毒代谢能力提高有密切关系, 如多功能氧化酶(P450)、酯酶(EST)、谷胱甘肽-S-转移酶(GST)及转运蛋白(ABC)等解毒酶参与其中[4-5]; 同时靶标突变也是介导抗性的原因之一, 如电压门控钠离子通道突变导致对拟除虫菊酯类杀虫剂(三氟氯氰菊酯)产生抗性[6]。
过去人们对昆虫代谢抗性的研究主要关注P450、EST与GST[7], 随着组学技术的发展, 人们对昆虫解毒代谢的理解达到了新的广度与深度, 又揭示出许多过去不为人所知的基因与害虫抗药性之间的关系[8-9]。尿苷二磷酸糖基转移酶(UDP-glycosyltransferase, UGT)基因就是最近报道与害虫抗药性有关的基因[10]。UGT是生物体内的Ⅱ相解毒代谢酶系, 催化小分子亲脂性化合物与UDP-糖基的轭合反应形成糖苷, 从而改变底物的亲水性, 有助于其排出体外, 糖苷轭合反应是各种亲脂性内源物与外源物生物转化的重要代谢途径[11-12]。UGT参与杀虫剂的解毒代谢近年来已有报道, 如家蝇(Musca domestica)用吡唑硫磷、棉铃虫(Helicoverpa armigera)用溴氰菊酯处理后, 虫体内UGT活性显著升高, 以提高对杀虫剂胁迫的抵抗能力[13-14]; UGT催化杀虫剂与糖基的轭合反应, 形成糖苷化杀虫剂代谢物, 抗性水平的升高与UGT活性增强有关[13]。与P450基因类似, 昆虫的UGT基因也是具有众多成员的基因家族, 每种昆虫同时表达多个UGT基因[12]:小菜蛾(Plutella xylostella)对氯虫苯甲酰胺的抗性就与UGT 2B17基因的组成型高表达相关[15]; 棉蚜(Aphis gossypii)对噻虫嗪的抗性则与UGT348A2、UGT344B4以及UGT344J2的过表达有关, 并且UGT抑制剂对抗性棉蚜具有增效作用, 说明UGT在棉蚜对噻虫嗪的抗性中起重要作用。转录组测序揭示抗性品系中许多UGT基因表达上调, 这些上调表达的UGT基因可能与滴滴涕[10]、拟除虫菊酯[16]、氨基甲酸酯[17]和新烟碱类[18]的抗性相关。
我们前期已鉴定出在甜菜夜蛾幼虫期表达的32个UGT基因, 其中许多基因的表达受三氟氯氰菊酯、氯虫苯甲酰胺、氰氟虫腙以及茚虫威等不同杀虫剂胁迫的影响, 多数表现为受杀虫剂影响后上调表达, 尤其是UGT33J3与UGT33T3基因的上调表达非常明显[19], 但这些上调表达的UGT基因对杀虫剂的敏感性或抗药性有何影响未见报道。本试验拟进一步开展UGT基因表达影响甜菜夜蛾对毒死蜱敏感性的研究。毒死蜱是属于有机磷的广谱触杀型杀虫剂, 在我国广泛用于防治水稻、蔬菜、果树等经济作物上的各种害虫, 其中许多害虫已对其产生抗药性[20]。本研究测定了广东省惠州地区甜菜夜蛾种群对毒死蜱的抗药性水平, 探讨其抗药性与UGT活性以及UGT基因表达的关系, 同时采用UGT抑制剂分析对毒死蜱毒力的影响, 旨在探讨UGT与甜菜夜蛾对毒死蜱敏感性的关系, 揭示甜菜夜蛾对毒死蜱的抗性机制, 为抗药性治理提供理论技术支撑。
1 材料与方法 1.1 供试昆虫甜菜夜蛾敏感种群(Sus)由武汉科诺生物技术有限公司提供, 自2001年5月以来在不接触任何药剂的情况下在室内连续饲养。饲养过程中甜菜夜蛾成虫所产卵块用50 g · L-1的甲醛消毒, 幼虫用人工饲料饲养至化蛹, 成虫用100 mg · L-1的糖水喂食。养虫室或光照培养箱饲养条件:温度(27±1)℃, 湿度70%~80%, 光/暗培养时间为14 h/10 h[21]。甜菜夜蛾田间种群(Res)于2016年11月采自广东省惠州市蔬菜地, 室内饲养方法同敏感种群[2]。
1.2 杀虫剂生物测定甜菜夜蛾对杀虫剂敏感性的测定采用叶片浸渍法[3]。供试的毒死蜱原药(南京红太阳公司提供)用丙酮溶解配制成母液, 置低温避光保存备用。生物测定前将母液用含1 g · L-1 Triton X-100的水溶液倍比稀释成所需浓度的含药悬浮液, 选取室内种植的甘蓝叶片(未使用任何杀虫剂)洗净后, 剪成直径约2 cm× 2 cm片状, 将叶片浸入毒死蜱药液15 s后在室内自然风干0.5 h, 再放置在带有湿润滤纸的培养皿中, 以含1 g · L-1 Triton X-100的水溶液处理叶片作为空白对照。将已饥饿2 h的3龄中期幼虫转入含叶片的培养皿中, 每皿3头幼虫, 每处理30头幼虫, 将培养皿置(27±1)℃、湿度70%~80%、光/暗培养时间为14 h/10 h的养虫室中饲养, 处理72 h后观察统计幼虫死亡数, 以用毛笔轻触虫体, 幼虫不能协调运动作为死亡判断标准。所有处理均重复3次。
在测定UGT抑制剂5-硝基脲嘧啶与苯磺唑酮或苯巴比妥(Sigma公司)对毒死蜱毒力影响时, 3种化合物均用二甲基亚砜溶解配制成母液, 按1 mmol · L-1(苯巴比妥)或2 mmol · L-1(5-硝基脲嘧啶、苯磺唑酮)浓度加入到毒死蜱溶液中处理甜菜夜蛾幼虫, 处理方法同上述生物测定。毒力增加比例=(联用死亡率-毒死蜱单用死亡率)/毒死蜱单用死亡率。
1.3 甜菜夜蛾UGT基因的相对表达量测定使用实时荧光定量PCR(RT-qPCR)测定敏感种群和田间种群中32个UGT基因的mRNA相对表达水平。分别从田间与敏感种群中收集共30头3龄中期幼虫, 分3组(3个重复)用Trizol试剂盒(Invitrogen)提取总RNA。采用反转录试剂盒(TaKaRa公司)合成cDNA, 保存在-20 ℃冰箱备用。所用定量PCR引物参见文献[19]。使用荧光定量PCR试剂盒(Invitrogen公司)和ABI 7500实时PCR系统(Applied Biosystems, Foster, CA)进行实时定量分析。PCR反应在50 ℃初始温育2 min, 然后在95 ℃孵育2 min, 接着进行40个循环的95 ℃ 15 s和60 ℃ 30 s。整个定量分析过程与数据处理按照文献[22]描述的2-ΔΔCT方法进行。
在分析毒死蜱与苯巴比妥对UGT基因表达水平影响时, 按生物测定的方法给100头以上3龄初期幼虫分别饲喂用LC30浓度毒死蜱和/或1 mmol · L-1苯巴比妥处理过的甘蓝叶片, 分别在饲养12、24、36、48 h后随机挑取10头幼虫, 按照上述方法提取总RNA, 对UGT基因进行定量分析。用1 g · L-1 Triton X-100溶液处理过的叶片饲喂幼虫作为对照, 每个处理设置3个生物学重复, 每个生物学样品进行3次独立的物理性重复测定。
1.4 甜菜夜蛾UGT活性测定UGT酶液的制备与活性测定参考Ahn等[23]的试验方法。取甜菜夜蛾3龄幼虫于匀浆器中加匀浆缓冲液(0.1 mol · L-1磷酸钠缓冲液、0.1 mmol · L-1 EDTA、1 mmol · L-1 DTT、1 mmol · L-1 PTU、1 mmol · L-1 PMSF、100 g · L-1甘油, pH7.5)匀浆, 匀浆液经4层纱布过滤后在4 ℃、10 000 g下离心15 min, 上清液过滤后再在4 ℃、100 000 g下离心1 h。将管底的微粒体沉淀用悬浮缓冲液(0.1 mol · L-1磷酸钠缓冲液、0.1 mmol · L-1 EDTA、1 mmol · L-1 DTT、1 mmol · L-1 PMSF、200 g · L-1甘油, pH7.5)悬浮后用作酶液备用。采用Bradford方法测定微粒体蛋白质含量[24]。
UGT活性测定以α-萘酚为底物, 尿苷二磷酸葡萄糖(UDPG)为糖基供体, 反应原理是在UGT催化下将UDPG的糖基转移至α-萘酚羟基上, 形成α-萘基葡萄糖苷, 该糖苷在287 nm激发光刺激下发出波长为335 nm的荧光, 用SpectraMax多功能酶标仪测定反应体系中335 nm下的荧光强度值变化(狭缝宽度为5 nm)。通过α-萘基葡萄糖苷标准曲线计算出每毫克蛋白在每分钟内催化生成α-萘基葡萄糖苷的量来反映酶活性大小。测定步骤如下:将终浓度为50 mmol · L-1的磷酸缓冲液、10 mmol · L-1氯化镁、1 mmol · L-1 UDP-葡萄糖、200 μg微粒体酶液依次加入到1.5 mL EP管中, 补水至960 μL; 将EP管置37 ℃恒温振荡器上预热1 min; 混匀后分装到黑色酶标板孔中, 每孔加样240 μL, 再加入2.5 μmol · L-1的α-萘酚10 μL到酶标板孔中; 迅速启动酶标仪检测10 min内荧光强度的变化。每个处理设置4个生物学重复。测定抑制剂对UGT活性的抑制作用时, 抑制剂添加在酶液前, 抑制剂终浓度控制在0~1 mmol · L-1, 其他操作同前。
1.5 数据分析生物测定数据采用Polo Plus软件计算LC50值及相应的95%置信区间。其他数据采用Graph Prism 6.0软件进行统计分析与作图, 多重比较采用单因素方差分析, 两两比较采用t测验。
2 结果与分析 2.1 甜菜夜蛾田间种群对毒死蜱的抗性与UGT活性生物测定结果表明:广东惠州地区甜菜夜蛾田间种群(Res)已对毒死蜱产生极高水平的抗药性, LC50为1 888.6 mg · L-1, 远高于敏感种群(Sus)的LC50(2.0 mg · L-1), 抗性倍数达到944.3倍(表 1)。比较田间与敏感种群幼虫之间的UGT活性, 田间种群UGT活性为2.42 nmol · mg-1 · min-1, 而敏感种群的UGT活性仅为0.80 nmol · mg-1 · min-1, 田间种群幼虫UGT活性是敏感种群的3倍, 显著高于敏感种群(图 1)。
| 种群 Population |
LC50/(mg·L-1) (95%置信限)(95% FL) |
斜率(标准误) Slope(SE) |
χ2(n) | 抗性倍数RR |
| Sus | 2.0(0.9~6.1) | 0.9(0.3) | 0.83(3) | — |
| Res | 1 888.6(993.8~4 277.7) | 1.4(0.4) | 0.37(3) | 944.3 |
| 注: Sus:敏感种群Susceptible population; Res:田间种群Field population.抗性倍数(RR)=田间种群LC50值/敏感种群LC50值。RR is the resistance ratio(LC50 value of Res population/LC50 value of Sus population). | ||||
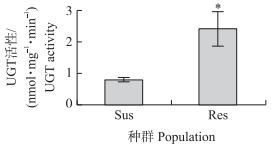
|
图 1 甜菜夜蛾田间种群(Res)与敏感种群(Sus)的UGT活性 Fig. 1 The UGT activities in the field(Res) and susceptible(Sus)population of S. exigua *P < 0.05. The same as follows. |
由图 2可见:在所测定的32个UGT基因中有17个UGT基因在田间种群中上调表达3倍以上, 并且与敏感种群表达水平有显著差异, 其中UGT33J3上调表达最高(42倍), 其次是UGT33F7与UGT33F5, 分别上调表达37倍与34倍, 上调表达10倍以上的还有UGT43A2(15倍)、UGT33V3(13倍)、UGT33V1(12倍)、UGT33V4(11倍)和UGT33B14(10倍)。也有2个UGT基因在田间种群中显著下调表达, 分别是UGTT50A5与UGT44A5。上述结果说明在该田间种群中半数以上UGT基因表现为上调表达。
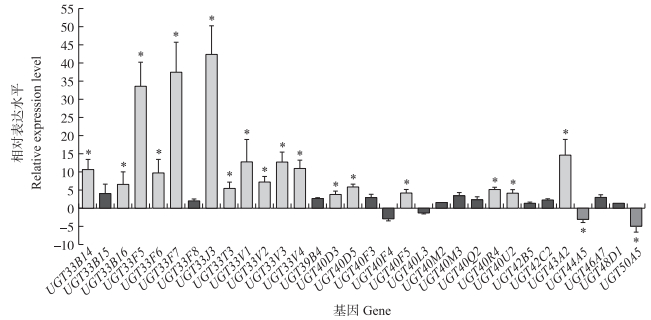
|
图 2 甜菜夜蛾田间种群与敏感种群的UGT基因相对表达水平 Fig. 2 The relative expression level of UGT genes in field and susceptible populations of S. exigua 图中所示是田间种群与敏感种群间UGT基因表达的差异倍数, 正值表示在田间种群中上调表达, 负值表示在田间种群中下调表达, 每个柱上的*号表示与敏感品系相比有显著差异(P < 0.05), 并且差异倍数达3倍以上。 The heights of columns represent increased or decreased fold of expression levels in field population compared with susceptible one, the positive values mean up-regulated expression, negative values mean down-regulated expression in resistance strain. *on columns represents that there is significant difference in expression levels between two populations(P < 0.05)and the increased or decreased expression are greater than 3 folds. |
用典型的UGT表达诱导物——苯巴比妥(1 mmol · L-1)处理田间种群幼虫, 分析其中3个UGT基因表达水平的变化。由图 3可见:UGT33F5基因表达对苯巴比妥胁迫的响应非常迅速, 在12 h即表现出显著上调表达, 36 h后恢复到对照水平, 该基因表达对毒死蜱胁迫的响应与苯巴比妥类似, 48 h后恢复到对照水平, 但苯巴比妥与毒死蜱联合使用并未使该基因的表达进一步上调(图 3-A)。2种外源物胁迫对UGT33F7的诱导倍数不及UGT33F5 (图 3-B), 对UGT33J3的诱导倍数介于UGT33F7与UGT33F5之间(图 3-C)。苯巴比妥与毒死蜱对这3个UGT基因的表达均有诱导作用, 幼虫被苯巴比妥或毒死蜱处理后UGT基因表现出一定程度的表达上调。同时也观察到在苯巴比妥或毒死蜱的胁迫下UGT活性提高, 苯巴比妥处理后24 h幼虫的UGT活性明显增加, 显著高于对照幼虫体内的UGT活性(图 3-D), 用毒死蜱(LC30)处理幼虫也产生类似于苯巴比妥的诱导效果, 毒死蜱处理后UGT活性显著增加, 这说明UGT基因的诱导表达导致UGT活性的提高。
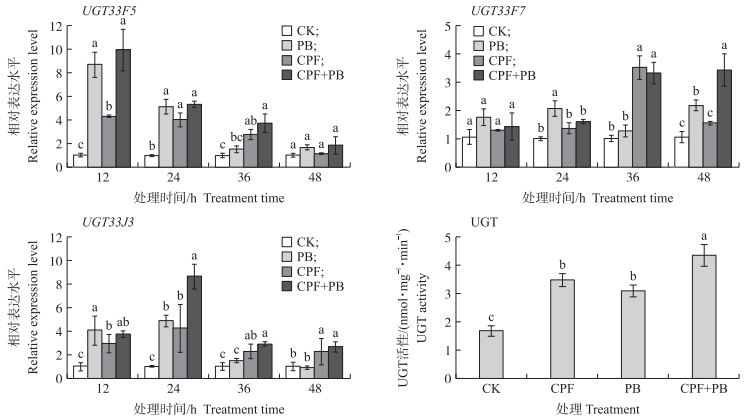
|
图 3 毒死蜱(CPF, LC30浓度)与苯巴比妥(PB, 1 mmol · L-1)处理对甜菜夜蛾UGT基因表达的影响 Fig. 3 The effects of chlorpyrifos(CPF, LC30 concentration)and phenobarbital(PB, 1 mmol · L-1)exposure on the expression of UGT genes in S. exigua 不同小写字母表示相同时间点不同处理间有显著差异(P < 0.05)。 Different letters above error bars indicate significant difference among treatments at the same time(P < 0.05). |
由图 4可见:苯巴比妥显著降低毒死蜱对甜菜夜蛾幼虫的毒力。用敏感种群的LC50浓度处理敏感种群导致53.3%的幼虫死亡, 但用苯巴比妥与毒死蜱联合处理时的死亡率下降至36.6%;同样用田间种群LC50浓度处理田间种群导致46.7%的幼虫死亡, 而毒死蜱与苯巴比妥联合处理时幼虫死亡率仅23.3%, 在田间与敏感种群上UGT表达诱导物均能显著降低毒死蜱的毒力, 说明UGT的上调表达增加了受胁迫幼虫对毒死蜱的解毒代谢能力。
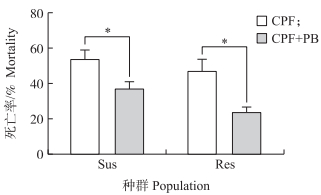
|
图 4 苯巴比妥(PB)处理对毒死蜱(CPF)毒力的影响 Fig. 4 The effects of phenobarbital(PB)exposure on toxicity of chlorpyrifos(CPF) |
选用2种UGT的抑制剂5-硝基脲嘧啶与苯磺唑酮, 测定它们对毒死蜱的影响。结果表明:它们对甜菜夜蛾幼虫离体UGT表现出抑制活性, 并且抑制效果呈现浓度依赖关系, 5-硝基脲嘧啶对甜菜夜蛾幼虫UGT活性的抑制中浓度(IC50)为348.7 μmol · L-1, 苯磺唑酮的IC50为489.8 μmol · L-1(图 5-A)。说明这2种抑制剂可用于抑制甜菜夜蛾的UGT活性。
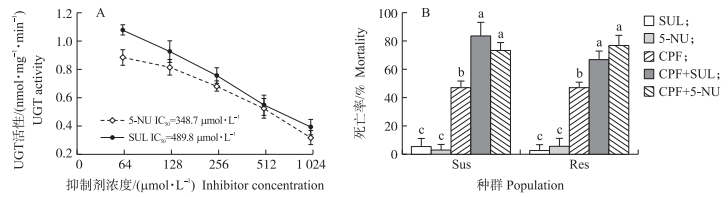
|
图 5 UGT抑制剂对毒死蜱毒力的影响
Fig. 5 The effects of UGT inhibitors on chlorpyrifos toxicities against S. exigua larvae
A. UGT抑制剂对UGT活性的影响The effect of UGT inhibitor on UGT activity; B. UGT抑制剂对毒死蜱毒力的影响The effect of UGT inhibitor on chlorpyrifos toxicity. 1)SUL:苯磺唑酮Sulfinpyrazone; 5-NU:5-硝基脲嘧啶5-nitrouracil; CPF:毒死蜱Chlorpyrifos. 2)不同字母表示处理间差异显著(P < 0.05)。Difference letters upon columns mean significant difference among treatments(P < 0.05). |
采用1 mmol · L-1 UGT抑制剂处理甜菜夜蛾幼虫活体, 对田间种群与敏感种群幼虫造成的死亡率均很低, 72 h后死亡率均低于6%, 说明这2种抑制剂对甜菜夜蛾幼虫基本没有毒性。当与LC50浓度毒死蜱联合使用后, 所致死亡率显著高于毒死蜱单用所致死亡率(图 5-B)。用2个种群的毒死蜱LC50浓度分别处理田间与敏感幼虫时, 死亡率为46.7%, 当与UGT抑制剂5-硝基脲嘧啶或苯磺唑酮联合处理甜菜夜蛾幼虫时, 敏感种群幼虫死亡率分别为73.3%与83.3%, 2种抑制剂使毒死蜱毒力分别提高57%与78%;田间种群幼虫的死亡率分别为76.6%与67.7%, 毒死蜱毒力分别提高64%与45%, 均显著高于毒死蜱单用时的死亡率, 说明田间种群与敏感种群中UGT抑制剂均能显著提高毒死蜱的毒力(图 5-B)。
3 讨论根据以往的研究报道, 我国甜菜夜蛾田间种群已对多种不同结构类型的化学杀虫剂产生高水平抗药性[1-2, 25-27]。该问题在广东省尤其突出, 本实验室自2011年以来对该地区甜菜夜蛾种群进行了连续的抗药性监测, 发现其已对甲维盐(174~867倍)、三氟氯氰菊酯(2 925~3 449倍)、毒死蜱(>1 786倍)、氰氟虫腙(60~942倍)等杀虫剂的抗性问题非常严重, 已到无药可治的地步[3]。本次研究的田间种群系2016年11月采自该地区蔬菜田, 对上述药剂的抗药性仍保持极高水平, 其中对毒死蜱的抗性倍数为944.3倍。解毒酶基因表达水平组成型上调, 导致解毒酶活性增加, 提高对杀虫剂的降解能力, 是害虫产生抗药性的重要机制[3-4, 25]。在对不同类型杀虫剂产生多药抗性的种群中往往涉及多种抗性机制, 其中包括多种解毒代谢酶基因的上调表达[28-30]。我们过去的研究表明, 广东甜菜夜蛾田间种群具有较高的P450、酯酶以及黄素单加氧酶水平, 这些解毒酶基因的高表达与对多种杀虫剂的抗药性有关[4]。
本研究发现该地甜菜夜蛾田间种群中另一类解毒酶——UGT基因的组成型高表达, 并导致该种群具有显著高于敏感种群的UGT活性, 从而使其具有较高的解毒代谢能力。UGT基因在抗性昆虫中上调表达导致抗药性的现象已在抗DDT果蝇[10]、抗噻虫嗪的烟粉虱[18]与棉蚜[31]、抗吡虫啉烟粉虱[32]、抗氯菊酯的冈比亚按蚊[16]以及抗氯虫苯甲酰胺的小菜蛾[15]等害虫中有报道。为证明这种上调表达与抗药性的关联, 人们采用注射或喂食相关UGT基因dsRNA的方法敲低抗性昆虫体内UGT基因的表达, 结果可提高抗性昆虫对杀虫剂的敏感性, 或降低其抗药性水平[31-32]。由于甜菜夜蛾幼虫的RNAi效果不是特别理想, 因此, 本研究未采用dsRNA进行研究, 而是采用UGT表达诱导物结合应用UGT抑制剂的研究方法, 证明UGT与毒死蜱毒力的关系。结果表明, 苯巴比妥诱导UGT基因表达上调后导致对毒死蜱的毒力下降。该方法曾在小菜蛾抗氯虫苯甲酰胺抗性机制研究中被采用, 用苯巴比妥处理小菜蛾幼虫可诱导 UGT2B17 的显著上调表达, 并导致对氯虫苯甲酰胺毒力的显著下降, 说明UGT上调表达与该药剂毒力下降有关[15]。另外, 本研究采用UGT活性抑制剂(5-硝基脲嘧啶与苯磺唑酮)抑制昆虫体内的UGT活性, 降低了虫体对毒死蜱的降解作用, 从而提高毒死蜱对甜菜夜蛾的毒力, 说明UGT基因的表达与甜菜夜蛾对毒死蜱敏感性直接相关。
解毒酶介导的代谢抗性在生化上可通过使用该代谢酶的抑制剂进行鉴定, 在杀虫剂毒理研究中, 通常分别采用胡椒基丁醚、磷酸三苯酯、马来酸二乙酯作为抑制剂来分析P450、EST、GST在抗性中的作用[7]。也有学者采用UGT抑制剂对抗性害虫开展类似研究, UGT抑制剂5-硝基脲嘧啶与苯磺唑酮对抗氯虫苯甲酰胺小菜蛾与抗噻虫嗪棉蚜有显著的增效作用[15, 31], 说明抑制UGT活性可降低UGT催化的解毒代谢, 使害虫对杀虫剂的敏感性上升, 从而在某种程度上克服UGT介导的代谢抗性。虽然有学者采用5-硝基脲嘧啶与苯磺唑酮作为UGT的抑制剂用于害虫代谢抗性机制分析, 但这2个化合物对昆虫UGT是否具有抑制效果则未见报道。为此, 我们测定了这2种抑制剂对甜菜夜蛾幼虫离体UGT的抑制活性, 这2种抑制剂均能抑制这种幼虫的UGT活性, 其抑制活性与对鼠肝微粒体UGT的抑制活性相当[33]。用抑制剂处理甜菜夜蛾幼虫活体时, 对幼虫本身的毒性很低, 但却能显著提高幼虫对毒死蜱的敏感性, 说明抑制UGT活性可提高杀虫剂的毒力, 也说明UGT参与了对毒死蜱的解毒代谢, 与甜菜夜蛾对毒死蜱的敏感性有关。
| [1] |
Che W N, Shi T, Wu Y D, et al. Insecticide resistance status of field populations of Spodoptera exigua(Lepidoptera:Noctuidae)from China[J]. Journal of Economic Entomology, 2013, 106(4): 1855-1862. DOI:10.1603/EC13128 |
| [2] |
Lai T C, Li J, Su J Y. Monitoring of beet armyworm Spodoptera exigua(Lepidoptera:Noctuidae)resistance to chlorantraniliprole in China[J]. Pesticide Biochemistry and Physiology, 2011, 101(3): 198-205. DOI:10.1016/j.pestbp.2011.09.006 |
| [3] |
Su J Y, Sun X X. High level of metaflumizone resistance and multiple insecticide resistance in field populations of Spodoptera exigua(Lepidoptera:Noctuidae)in Guangdong Province, China[J]. Crop Protection, 2014, 61: 58-63. DOI:10.1016/j.cropro.2014.03.013 |
| [4] |
Tian X X, Sun X X, Su J Y. Biochemical mechanisms for metaflumizone resistance in beet armyworm, Spodoptera exigua[J]. Pesticide Biochemistry and Physiology, 2014, 113: 8-14. DOI:10.1016/j.pestbp.2014.06.010 |
| [5] |
Tian X, Zhao S, Guo Z, et al. Molecular characterization, expression pattern and metabolic activity of flavin-dependent monooxygenases in Spodoptera exigua[J]. Insect Molecular Biology, 2018, 27(5): 533-544. DOI:10.1111/imb.v27.5 |
| [6] |
Tian X X, Liu J D, Guo Z M, et al. The characteristics of voltage-gated sodium channel and the association with lambda cyhalothrin resistance in Spodoptera exigua[J]. Journal of Asia-Pacific Entomology, 2018, 21(3): 1020-1027. DOI:10.1016/j.aspen.2018.07.013 |
| [7] |
Li X C, Schuler M A, Berenbaum M R. Molecular mechanisms of metabolic resistance to synthetic and natural xenobiotics[J]. Annual Review of Entomology, 2007, 52(1): 231-253. DOI:10.1146/annurev.ento.51.110104.151104 |
| [8] |
Homem R A, Davies T G E. An overview of functional genomic tools in deciphering insecticide resistance[J]. Current Opinion in Insect Science, 2018, 27: 103-110. DOI:10.1016/j.cois.2018.04.004 |
| [9] |
Ingham V A, Wagstaff S, Ranson H. Transcriptomic meta-signatures identified in Anopheles gambiae populations reveal previously undetected insecticide resistance mechanisms[J]. Nature Communications, 2018, 9: 5282. DOI:10.1038/s41467-018-07615-x |
| [10] |
Pedra J H F, Mclntyre L M, Scharf M E, et al. Genome-wide transcription profile of field- and laboratory-selected dichlorodiphenyltrichloroethane(DDT)-resistant Drosophila[J]. Proc Natl Acad Sci USA, 2004, 101(18): 7034-7039. DOI:10.1073/pnas.0400580101 |
| [11] |
Rowland A, Miners J O, Mackenzie P I. The UDP-glucuronosyltransferases:their role in drug metabolism and detoxification[J]. The International Journal of Biochemistry & Cell Biology, 2013, 45(6): 1121-1132. |
| [12] |
Bock K W. The UDP-glycosyltransferase(UGT)superfamily expressed in humans, insects and plants:animal-plant arms-race and co-evolution[J]. Biochemical Pharmacology, 2016, 99: 11-17. DOI:10.1016/j.bcp.2015.10.001 |
| [13] |
Lee S W, Ohta K, Tashiro S, et al. Metabolic resistance mechanisms of the housefly(Musca domestica)resistant to pyraclofos[J]. Pesticide Biochemistry and Physiology, 2006, 85(2): 76-83. DOI:10.1016/j.pestbp.2005.10.005 |
| [14] |
Tao X Y, Xue X Y, Huang Y P, et al. Gossypol-enhanced P450 gene pool contributes to cotton bollworm tolerance to a pyrethroid insecticide[J]. Molecular Ecology, 2012, 21(17): 4371-4385. DOI:10.1111/j.1365-294X.2012.05548.x |
| [15] |
Li X X, Zhu B, Gao X W, et al. Over-expression of UDP-glycosyltransferase gene UGT2B17 is involved in chlorantraniliprole resistance in Plutella xylostella(L.)[J]. Pest Management Science, 2017, 73(7): 1402-1409. DOI:10.1002/ps.2017.73.issue-7 |
| [16] |
Vontas J, Blass C, Koutsos A C, et al. Gene expression in insecticide resistant and susceptible Anopheles gambiae strains constitutively or after insecticide exposure[J]. Insect Molecular Biology, 2005, 14(5): 509-521. DOI:10.1111/imb.2005.14.issue-5 |
| [17] |
Silva A X, Bacigalupe L D, Luna-Rudloff M, et al. Insecticide resistance mechanisms in the green peach aphid Myzus persicae(Hemiptera:Aphididae)Ⅱ:costs and benefits[J]. PLoS One, 2012, 7(6): e36810. DOI:10.1371/journal.pone.0036810 |
| [18] |
Yang N N, Xie W, Yang X, et al. Transcriptomic and proteomic responses of sweetpotato whitefly, Bemisia tabaci, to thiamethoxam[J]. PLoS One, 2013, 8(5): e61820. DOI:10.1371/journal.pone.0061820 |
| [19] |
Hu B, Zhang S H, Ren M M, et al. The expression of Spodoptera exigua P450 and UGT genes:tissue specificity and response to insecticides[J]. Insect Science, 2019, 26: 199-216. DOI:10.1111/ins.2019.26.issue-2 |
| [20] |
王世玉, 汤雨洁, 任淼淼, 等. 稻纵卷叶螟杀虫剂敏感基线的建立与抗药性监测[J]. 南京农业大学学报, 2016, 39(3): 402-407. Wang S Y, Tang Y J, Ren M M, et al. The establishment of insecticide susceptibility baselines and resistance monitoring for rice leaffolder, Cnaphalocrocis medinalis(Güenée)[J]. Journal of Nanjing Agricultural University, 2016, 39(3): 402-407 (in Chinese with English abstract). DOI:10.7685/jnau.201509037 |
| [21] |
Lai T C, Su J Y. Assessment of resistance risk in Spodoptera exigua(Hübner)(Lepidoptera:Noctuidae)to chlorantraniliprole[J]. Pest Management Science, 2011, 67(11): 1468-1472. DOI:10.1002/ps.2201 |
| [22] |
Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [23] |
Ahn S J, Badenes-Pérez F R, Reichelt M, et al. Metabolic detoxification of capsaicin by UDP-glycosyltransferase in three Helicoverpa species[J]. Archives of Insect Biochemistry and Physiology, 2011, 78(2): 104-118. DOI:10.1002/arch.v78.2 |
| [24] |
Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72(1/2): 248-254. |
| [25] |
Wang X G, Xiang X, Yu H L, et al. Monitoring and biochemical characterization of beta-cypermethrin resistance in Spodoptera exigua(Lepidoptera:Noctuidae)in Sichuan Province, China[J]. Pesticide Biochemistry and Physiology, 2018, 146: 71-79. DOI:10.1016/j.pestbp.2018.02.008 |
| [26] |
Zhang P, Gao M, Mu W, et al. Resistant levels of Spodoptera exigua to eight various insecticides in Shandong, China[J]. Journal of Pesticide Science, 2014, 39(1): 7-13. DOI:10.1584/jpestics.D13-053 |
| [27] |
Zhou C, Liu Y Q, Yu W L, et al. Resistance of Spodoptera exigua to ten insecticides in Shandong, China[J]. Phytoparasitica, 2011, 39(4): 315-324. DOI:10.1007/s12600-011-0157-5 |
| [28] |
Safi N H Z, Ahmadi A A, Nahzat S, et al. Evidence of metabolic mechanisms playing a role in multiple insecticides resistance in Anopheles stephensi populations from Afghanistan[J]. Malaria Journal, 2017, 16: 100. DOI:10.1186/s12936-017-1744-9 |
| [29] |
Seixas G, Grigoraki L, Weetman D, et al. Insecticide resistance is mediated by multiple mechanisms in recently introduced Aedes aegypti from Madeira Island(Portugal)[J]. PLoS Neglected Tropical Diseases, 2017, 11(7): e0005799. DOI:10.1371/journal.pntd.0005799 |
| [30] |
Delannay C, Goindin D, Kellaou K, et al. Multiple insecticide resistance in Culex quinquefasciatus populations from Guadeloupe(French West Indies)and associated mechanisms[J]. PLoS One, 2018, 13(6): e0199615. DOI:10.1371/journal.pone.0199615 |
| [31] |
Pan Y O, Tian F Y, Wei X, et al. Thiamethoxam resistance in Aphis gossypii Glover relies on multiple UDP-glucuronosyltransferases[J]. Frontiers in Physiology, 2018, 9: 322. DOI:10.3389/fphys.2018.00322 |
| [32] |
Kaplanoglu E, Chapman P, Scott I M, et al. Overexpression of a cytochrome P450 and a UDP-glycosyltransferase is associated with imidacloprid resistance in the Colorado potato beetle, Leptinotarsa decemlineata[J]. Scientific Reports, 2017, 7: 1762. DOI:10.1038/s41598-017-01961-4 |
| [33] |
Naydenova Z, Grancharov K, Shopova M, et al. Inhibition of UDP-glucuronyltransferase activity in rat liver microsomes by pyrimidine derivatives[J]. Comparative Biochemistry and Physiology Part C:Pharmacology, Toxicology and Endocrinology, 1995, 112(3): 321-325. DOI:10.1016/0742-8413(95)02027-6 |




