文章信息
- 蒋大华, 张茹佳, 张昌伟, 侯喜林
- JIANG Dahua, ZHANG Rujia, ZHANG Changwei, HOU Xilin
- 不结球白菜细胞质雄性不育相关基因BcATPA的克隆和表达分析
- Cloning and expression analysis of cytoplasmic male sterility-related gene BcATPA in Brassica campestris ssp. chinensis Makino
- 南京农业大学学报, 2019, 42(3): 406-412
- Journal of Nanjing Agricultural University, 2019, 42(3): 406-412.
- http://dx.doi.org/10.7685/jnau.201806025
-
文章历史
- 收稿日期: 2018-06-19
不结球白菜(Brassica campestris ssp. chinensis Makino)是我国重要的叶菜类蔬菜, 在南方和北方多地都有种植, 栽培面积十分广泛[1]。杂种优势利用是实现不结球白菜周年供应及优质、高产和均衡上市的有效途径, 而雄性不育系是利用杂种优势的重要手段之一。植物细胞质雄性不育(cytoplasmic male sterility, CMS)实质是核质互作型雄性不育, 是一种母性遗传导致的植物不能产生有活力花粉或花粉败育, 但卵细胞发育正常, 可接受外来花粉正常结实的性状[2]。细胞质雄性不育是高等植物中较为常见的生物学特征, 是杂种优势利用的基础, 同时又是研究核质互作的理想模式系统[3]。Hou等[4]采用非对称细胞融合技术获得了不结球白菜胞质不育的新种质, 其后代有效克服了原不育材料的相关问题如低温缺绿和无蜜腺等, 不育度、不育率均达到100%;结实率在自然条件下仍然与保持系相同, 并显著高于原不育材料。因此对该新种质进行深入研究, 对不结球白菜新品种的选育具有重要的理论意义, 在实际生产中也具有重要的应用价值。
研究表明, 植物细胞质雄性不育的分子机制与呼吸链和ATP合成的嵌合基因存在相关性[2-3], 如‘碧云冬茄’中Cox Ⅱ基因以及其他植物中的atpA、atp6、atp9基因等。由于线粒体是合成ATP的主要场所, 因此一些植物线粒体的嵌合基因(如玉米的urf-13T、牵牛花的pcf、甘蓝的atp6、水稻的urf-rmc等)与细胞质雄性不育具有密切的关系[5]。
在之前的研究中, 我们利用cDNA-AFLP技术, 分析了不结球白菜Ogura CMS保持系和不育系蕾期基因表达的差异, 获得1个在Ogura不育系花蕾中上调表达的基因[6], 并且与ATPA(ATPase alpha subunit)基因具有较高同源性。本研究利用PCR技术获得ATPA基因的全长, 通过实时荧光定量PCR技术对该基因在不育系和保持系植株的不同组织和器官及花蕾不同发育时期的表达进行分析, 以期更加深入探讨ATPA基因与胞质雄性不育之间的关系并为指导利用CMS进行新品种选育提供理论基础。
1 材料与方法 1.1 材料供试材料为不结球白菜细胞质雄性不育新种质及其保持系D, 由南京农业大学白菜课题组提供。在植株开花期分别取不育系和保持系的花瓣、雌蕊、雄蕊、花萼、花柄、嫩叶、老叶、根、角果以及不同小孢子发育时期的花蕾样品(小孢子母细胞时期花蕾, 0.8~1.2 mm; 二分体时期花蕾, 1.2~1.6 mm; 四分体时期花蕾, 1.6~2.0 mm; 成熟期花蕾, 2.0~3.0 mm), 每个样品3个生物学重复, 用锡箔纸包好, 立即投入液氮中固定, 并于-70 ℃冰箱保存备用。
1.2 基因组DNA的提取和cDNA的合成采用CTAB法进行植物基因组DNA的提取。总RNA的提取按照Simply P Total RNA Extraction Kit提取试剂盒(Bioflux公司)说明书进行。cDNA合成参照RNA PCR Kit(AMV)Ver. 2.1试剂盒(TaKaRa公司)说明书。
1.3 引物的设计和PCR扩增参照差异片段序列(GenBank登录号:GW315346)和同源的线粒体ATPA基因(CAA39483.1)DNA序列保守区设计特异性引物, 引物由南京金斯瑞生物科技有限公司合成(表 1)。以不结球白菜不育系叶片DNA为模板, 利用特异引物进行PCR扩增, 扩增产物在10 g · L-1琼脂糖凝胶中电泳15 min, 利用凝胶成像分析系统进行拍照及分析。
| 引物名称Primer name | 引物对序列Primer pairs sequence |
| ATPA-F1/R1 | AAAATGGAATTATGGAATTA/CTACATAGACACAATACATT |
| ATPA-F2/R2 | GAGCTCTTTTATCGCGGAAT/GTTCGCTTATAATCAAAATCA |
| ATPA-F3/R3 | ATCAGTGCACGAGCCTATGCA/GTAATGCCTGAGTCGCAGCAT |
| BcGAPDH-F/R | CCACTAACTGCCTTGCTCCAC/GCTTGCCCTCAGATTCCTCCT |
| BcATPA-F/R | GGTTGTGAAGAAAATGGCCT/AACAACGCAAAACTTCCACA |
扩增产物电泳后按照DNA Fragment Purification Kit Ver. 2.0(TaKaRa)的使用说明对得到的目的条带进行回收。回收的目的片段连接到pMD18-T载体(TaKaRa)上。连接产物转化大肠杆菌JM109感受态细胞, 进行蓝白斑筛选。序列测定由南京金斯瑞生物科技有限公司完成。将所得的中间序列与5′端特异扩增以及3′端序列拼接得到基因全长。在NCBI网站上用BLAST进行氨基酸序列同源性和系统进化分析, 用DNAMAN 5.0软件进行氨基酸序列系统树分析。
1.5 实时荧光定量PCR分析采用实时荧光定量PCR法验证BcATPA在不同组织和器官及不同小孢子发育时期的时空表达量。试验采用双标线法, 以不结球白菜3-磷酸甘油醛脱氢酶基因(BcGAPDH, AB331373.1)作为内标基因, BcATPA的引物根据测序结果设计(表 1)。试验重复3次。反应结束后分析荧光值变化曲线以及熔解曲线, 采用Excel 2013软件绘图。
2 结果与分析 2.1 BcATPA基因cDNA全长克隆以及序列分析利用PCR特异性扩增获得的序列进行拼接, 在NCBI数据库上进行核苷酸序列分析, 得到不结球白菜ATPA基因全长序列, 命名为BcATPA。序列分析发现该基因核苷酸序列全长为1 806 bp, 其最大开放阅读框为1 527 bp, 编码508个氨基酸(图 1)。基于Swiss-Prot中ExPASy数据库的预测和分析, 理论等电点(pI)为6.34, 相对分子质量约为55.076×103。将BcATPA编码的氨基酸与GenBank中得到的其他植物ATPA蛋白进行比对, 结果(图 2)发现, 其与芥菜(AAO59388.2)相似性最高, 达到97%;与甘蓝型油菜(CAA39483.1)和拟南芥(NP_085571.2)相似性达96%, 与烟草(YP_173459.1)、甜菜(BAA03664.1)、向日葵(AAB03874.1)、番木瓜(ACB20478.1)和矮牵牛(CAA37022.1)等相似性都在90%左右, 说明该基因比较保守。

|
图 1 不结球白菜BcATPA基因的核苷酸(上)及其推导的氨基酸序列(下) Fig. 1 Nucleotide sequence(upper)and deduced amino acid sequence(lower)of BcATPA gene in Brassica campestris ssp. chinensis 黄色底纹代表ATPA-F1、ATPA-R1;蓝色底纹代表ATPA-F2、ATPA-R2;绿色底纹代表ATPA-F3、ATPA-R3。 The yellow shading represents ATPA-F1, ATPA-R1;the blue shading represents ATPA-F2, ATPA-R2;the green shading represents ATPA-F3, ATPA-R3. |

|
图 2 不结球白菜与其他植物ATPA氨基酸序列同源性比较 Fig. 2 Alignment of predicted amino acid sequences of ATPA from Brassica campestris ssp. chinensis and other plants |
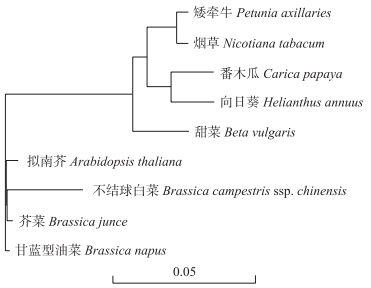
应用DNAMAN 5.0软件将ATPA编码的氨基酸序列与其他植物进行系统树分析。结果(图 3)发现:植物ATPA可分为2大类。不结球白菜BcATPA与芸薹属中的芥菜、甘蓝型油菜和拟南芥最先聚为一大类, 亲缘关系最近; 烟草、甜菜、向日葵、番木瓜和矮牵牛聚为第2大类, 但2类根距离比较短, 因此亲缘关系比较近, 进一步说明该基因在进化上比较保守。
|
图 3 不结球白菜和其他植物ATPA氨基酸序列的系统树分析 Fig. 3 Phylogenetic tree analysis of the deduced amino acid sequences of ATPA in Brassica campestris ssp. chinensis and other plants |
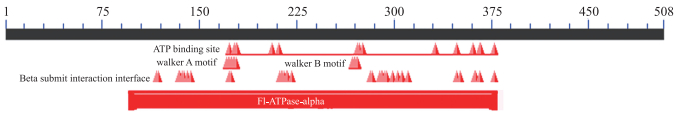
将BcATPA编码的氨基酸序列利用BLASTp程序搜索蛋白序列的保守区域, 结果表明BcATPA包含F1-ATP酶α亚基保守区域, 并且含有ATP结合、walker A motif和walker B motif等位点, 并在287~315的位置含有29个氨基酸的跨膜区域(图 4)。
|
图 4 BcATPA的保守区域 Fig. 4 Conserved domains of BcATPA protein obtained |
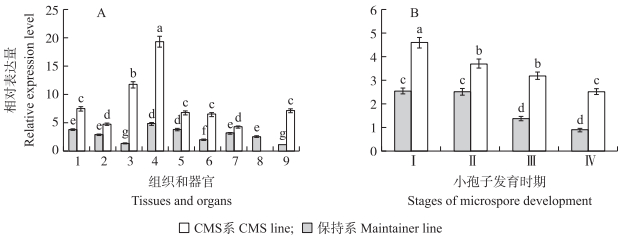
由图 5可见:不结球白菜BcATPA在不育系中的表达水平高于保持系; 在不同组织和器官中的表达水平也存在差异, 在花瓣萼片中表达水平较高, 并且不育系和保持系差距较大。不育系和保持系中在小孢子发育的不同时期BcATPA的表达量也不同。在整个小孢子发育时期, 不育系中该基因表达量逐渐降低; 而在保持系中, 从四分体时期开始显著下降, 且不育系与保持系表达量差异逐渐加大。
|
图 5 不结球白菜BcATPA基因在不同组织和器官(A)以及不同小孢子发育时期(B)的表达分析
Fig. 5 Expression analysis of BcATPA in different tissues and organs(A)and different stages of microspore development(B)in Brassica campestris ssp. chinensis
1.雌蕊Pisyils; 2.雄蕊Stamens; 3.花瓣Petals; 4.花萼Calyces; 5.花柄Flower stalks; 6.嫩苔Carexs; 7.嫩叶Leaves; 8.嫩荚Siliques; 9.根Roots. Ⅰ.小孢子母细胞时期Microsporocyte development stage; Ⅱ.二分体时期Dyad stage; Ⅲ.四分体时期Tetrad stage; Ⅳ.成熟期Mature microspore stage. 不同小写字母代表差异显著(P < 0.05)。The different small letters indicate significant difference at 0.05 level. |
大白菜细胞质雄性不育主要分为大白菜波里马细胞质雄性不育(Pol CMS)和萝卜细胞质雄性不育(Ogu CMS)2种类型[7]。控制Ogura CMS不育性状的基因是位于线粒体DNA(mtDNA)上的orf138位点, 在atp8基因5′端的上游, 并与其紧密连锁[8]。萝卜的Ogura不育胞质在引起萝卜不育的同时, 还可引起甘蓝型油菜的不育, 但两者的不育表型差异较大[9]。相对于正常萝卜胞质mtDNA而言, Ogura胞质的mtDNA发生了高度重排, 而且含有正常胞质中不存在的DNA序列。通过对甘蓝型油菜原生质体融合再生植株的重组mtDNA分析, 找到了1个DNA区域, 发现该区域与Ogura CMS不育性连锁, 并含有1个orfB和1个orf138[10], 这2个基因共转录可产生嵌合的mRNA, 而且orf138在Ogura CMS中起着重要作用[11-12], 因此, 我们推测白菜细胞质雄性不育主要是萝卜细胞质雄性不育这一类型。
大量研究表明, 细胞质雄性不育是由线粒体基因转录过程的异常引起的, 转录异常进一步导致线粒体中与能量代谢有关的电子传递链或ATP酶复合体蛋白亚基异常, 致使线粒体功能紊乱, 从而影响细胞的整个代谢过程[13-15]。Singh等[16]研究表明油菜Polima胞质不育性与嵌合基因orf224/atp6共转录有关。Handa等[10]也认为油菜中线粒体基因组的重排将导致atp6基因附近产生1个特异的pol-urf开放阅读框, 表达特异蛋白质, 进而影响线粒体的功能和小孢子的发育, 从而导致细胞质雄性不育。Ogura CMS起源于萝卜(Raphanus sativus)[17], Krishnasamy等[11]认为其不育性与线粒体基因orf138和orfB的共转录有关。
本试验得到的Ogura CMS中差异表达片段的全长BcATPA包含F1-ATP酶α亚基保守区域, 并且含有ATP结合、walker A motif和walker B motif等位点, 并在287~315的位置含有29个氨基酸的跨膜区域。BcATPA与芸薹属中的芥菜、甘蓝型油菜和拟南芥亲缘关系特别近。序列分析表明, 该基因与ATP结合有关[18]。本研究表明, BcATPA在不育系的各个器官中表达水平比保持系高。虽然在花萼和花瓣中表达较高, 并且不育系和保持系差异最大, 但是花萼和花瓣及其他器官的形态没有差异; 在雄蕊中虽然不育系仅比保持系表达量高1倍左右, 但是造成了花粉败育, 说明线粒体和能量代谢对小孢子正常发育起重要作用。在整个小孢子发育时期, BcATPA的表达水平从四分体时期开始下降, 而且在不育系中的相对表达量显著高于保持系, 推测可能是Ogura CMS相关的线粒体基因orf138和orfB共转录异常从而导致ATP酶复合体蛋白α亚基异常, 使线粒体的功能发生紊乱, 雄蕊中的小孢子细胞的整个代谢过程受到影响, 最终导致雄性不育。
| [1] |
侯喜林. 不结球白菜育种研究新进展[J]. 南京农业大学学报, 2003, 26(4): 111-115. Hou X L. Advances in breeding of non-heading Chinese cabbage[J]. Journal of Nanjing Agricultural University, 2003, 26(4): 111-115 (in Chinese with English abstract). DOI:10.7685/j.issn.1000-2030.2003.04.026 |
| [2] |
Hanson M R, Bentolila S. Interactions of mitochondrial and nuclear genes that affect male gametophyte development[J]. The Plant Cell, 2004, 16: S154-S169. DOI:10.1105/tpc.015966 |
| [3] |
Chase C D. Cytoplasmic male sterility:a window to the world of plant mitochondrial-nuclear interactions[J]. Trends in Genetics, 2007, 23(2): 81-90. DOI:10.1016/j.tig.2006.12.004 |
| [4] |
Hou X L, Cao S C, He Y K. Creation of a new germplasm of CMS non-heading Chinese cabbage[J]. Acta Horticulturae, 2004, 637: 75-81. |
| [5] |
范彦君, 王瑜, 刘齐元, 等. 植物细胞质雄性不育研究进展[J]. 中国农学通报, 2016, 32(18): 70-75. Fan Y J, Wang Y, Liu Q Y, et al. Advances in cytoplasmic male sterility in plant[J]. Chinese Agricultural Science Bulletin, 2016, 32(18): 70-75 (in Chinese with English abstract). DOI:10.11924/j.issn.1000-6850.casb15110120 |
| [6] |
Zhang C W, Qi L, Hou X L, et al. Differential gene expression analysis of a new Ogura CMS line and its maintainer in non-heading Chinese cabbage by cDNA-AFLP[J]. Acta Physiologiae Plantarum, 2010, 32(4): 781-787. DOI:10.1007/s11738-010-0463-4 |
| [7] |
崔冰, 石绍峻, 李鑫, 等. 大白菜细胞质雄性不育研究进展[J]. 山东农业科学, 2018(3): 154-157. Cui B, Shi S J, Li X, et al. Research progress on cytoplasmic male sterility of Chinese cabbage[J]. Shandong Agricultural Sciences, 2018(3): 154-157 (in Chinese with English abstract). |
| [8] |
王同华, 陈卫江, 李莓, 等. 甘蓝型油菜萝卜细胞质雄性不育杂种优势利用研究进展[J]. 分子植物育种, 2017, 15(7): 2777-2783. Wang T H, Chen W J, Li M, et al. Research progress on heterosis utilization of radish cytoplasmic male sterility in Brassica napus L.[J]. Molecular Plant Breeding, 2017, 15(7): 2777-2783 (in Chinese). |
| [9] |
任成伟, 曹寿椿. 萝卜细胞质芸薹属作物雄性不育材料的研究概况[J]. 中国蔬菜, 1992(2): 42-46, 56. Ren C W, Cao S C. The general situation of research on male sterility materials of radish cytoplasmic genus[J]. Chinese Vegetables, 1992(2): 42-46, 56 (in Chinese). |
| [10] |
Handa H, Nakajima K. Different organization and altered transcription of the mitochondrial atp6 gene in the male-sterile cytoplasm of rapeseed(Brassica napus L.)[J]. Current Genetics, 1992, 21: 153-159. DOI:10.1007/BF00318475 |
| [11] |
Krishnasamy S, Makaroff C A. Organ-specific reduction in the abundance of a mitochondrial protein accompanies fertility restoration in cytoplasmic male-sterile radish[J]. Plant Molecular Biology, 1994, 26(3): 935-946. DOI:10.1007/BF00028860 |
| [12] |
Grelon M, Budar F, Bonhomme S, et al. Ogura cytoplasmic male-sterility(CMS)-associated orf138 is translated into a mitochondrial membrane polypeptide in male-sterile Brassica cybrids[J]. Molecular & General Genetics, 1994, 243(5): 540-547. |
| [13] |
Sabar M, Gagliardi D, Balk J, et al. ORFB is a subunit of F1F0-ATP synthase:insight into the basis of cytoplasmic male sterility in sunflower[J]. EMBO Reports, 2003, 4(4): 381-386. DOI:10.1038/sj.embor.embor800 |
| [14] |
Wang Z, Zou Y, Li X, et al. Cytoplasmic male sterility of rice with Boro Ⅱ cytoplasm is caused by a cytotoxic peptide and is restored by two related PPR motif genes via distinct modes of mRNA silencing[J]. The Plant Cell, 2006, 18(3): 676-687. DOI:10.1105/tpc.105.038240 |
| [15] |
Wise R P, Pring D R. Nuclear-mediated mitochondrial gene regulation and male fertility in higher plants:light at the end of the tunnel?[J]. Proc Natl Acad Sci USA, 2002, 99(16): 10240-10242. DOI:10.1073/pnas.172388899 |
| [16] |
Singh M, Brown G G. Characterization of expression of a mitochondrial gene region associated with the Brassica "Polima" CMS:developmental influences[J]. Current Genetics, 1993, 24(4): 316. DOI:10.1007/BF00336783 |
| [17] |
Motegi T, Nou I S, Zhou J, et al. Obtaining an ogura-type CMS line from asymmetrical protoplast fusion between cabbage(fertile)and radish(fertile)[J]. Euphytica, 2003, 129(3): 319-323. DOI:10.1023/A:1022284803689 |
| [18] |
Abrahams J P, Buchanan S K, van M R, et al. The structure of bovine F1-ATPase complexed with the peptide antibiotic efrapeptin[J]. Proc Natl Acad Sci USA, 1996, 93(18): 9420-9424. DOI:10.1073/pnas.93.18.9420 |




