文章信息
- 连光倩, 翟雪, 尚菲, 王建飞
- LIAN Guangqian, ZHAI Xue, SHANG Fei, WANG Jianfei
- 水稻穗长基因qPL9的精细定位及其候选基因分析
- Fine mapping and candidate genes analysis of a major QTL, qPL9, for panicle length in rice(Oryza sativa L.)
- 南京农业大学学报, 2019, 42(3): 398-405
- Journal of Nanjing Agricultural University, 2019, 42(3): 398-405.
- http://dx.doi.org/10.7685/jnau.201805044
-
文章历史
- 收稿日期: 2018-05-25
水稻是全球最重要的粮食作物之一, 提高其产量和品质具有重要实践意义[1]。穗长直接决定稻穗分枝的数量和长度, 进而影响其穗粒数[2-3]。据报道, 水稻穗长与诸多性状相关, 例如穗粒数、着粒密度、落粒率、抽穗期、枝梗数等[4-5], 所以穗长通常都与这些性状结合起来研究。qPL1控制水稻直立穗表型, 研究发现在该位点由于获得性突变成为一个显性基因, 通过促进细胞分裂, 降低穗颈节长度并使稻穗变密、枝梗数増加, 因此使每穗粒数增加[6]。DEP2 [7]、dep 3 [8]、LP(EP 3)[9]也调控水稻直立穗表型。APO1正调节一次枝梗数和小穗数, apo1突变体穗比野生型短小, 一次枝梗数和小穗数也较野生型少, 主要是由于apo1突变体的小穗分生组织提早形成的同时浆片和心皮的形成时期延长[10]。FZP编码的蛋白在水稻穗发育过程中介导小穗分生组织向小花分生组织的转变, 是APO2主要的负调控因子[11-13]。qHD7.2是1个未克隆的QTL位点, 可能是OsPRR37的等位基因, 该位点使野生稻在长日照条件下生育期延长, 稻穗变短[14]。SP1位于第11号染色体, 决定水稻穗长表型, 该基因在幼穗的韧皮部表达水平较高, 编码1个属于多肽转运蛋白家族的转运蛋白(peptide transporter, PTR_)[15-16]。水稻ASP1编码1个转录共抑子, 被定位于细胞核, 与拟南芥TPL以及玉米REL2同源, 参与水稻分生组织命运的调控, 能调控水稻发育过程及生理反应的多个方面, 如穗、枝梗、小穗等发育[17]。近年来, 已有超过250个与穗长相关的QTL被检测到, 分布于水稻的12条染色体上, 但被克隆的QTL很少[18-19]。因此, 穗长的遗传因素及其对产量提高的贡献仍需要进一步研究。
本研究用水稻品种‘Saber’与‘茭白稻’杂交后代的F2作为初定位群体, 对F2群体的穗部性状进行QTL分析, 以发掘更多与水稻产量相关位点。根据F2初定位结果, 以qPL9为目标QTL, 选取杂合体构建分离群体, 进行精细定位。
1 材料与方法 1.1 植物材料和群体选用株型、穗型以及粒形差别较大的籼稻品种‘Saber’和粳稻品种‘茭白稻’作为亲本构建包含142株的F2分离群体。该群体及亲本于2016年夏季种植在南京农业大学江浦试验站, 每行8株, 株距为16.5 cm, 行距为25 cm, 田间种植管理按照水稻种植常规管理模式。F2个体自交, 单株收种, 获得相应的F2 : 3家系, 选取15个杂合单株用同样的方法于2017年夏季种植于南京农业大学江浦试验站。
1.2 性状调查株高取自地面至单株穗顶最高处(不含芒)的距离(精确至1 cm)。在完熟期按DNA取样编号对应一致进行取穗调查。每株收取3个较大的穗子, 装入纸袋, 室内调查穗长、一次枝梗数、二次枝梗数、每穗颖花数, 计平均值。穗长量取穗颈节至穗顶(不含芒)的长度(精确至0.1 cm)。随后依次调查一次枝梗数、二次枝梗数和每穗颖花数。穗部性状调查后, 同一单株种子装入纸袋、晒干, 以备籽粒性状调查和后代使用。粒长、粒宽则是随机选取10粒饱满种子, 用数字游标卡尺量取籽粒长度和宽度(精确至0.01 mm), 取平均值。
1.3 DNA提取采用CTAB法提取DNA。在移栽定苗后的分蘖盛期, 按田间材料、行、株编号, 分别采集群体各单株的幼嫩叶片, 同时采集亲本叶片, 提取总DNA。
1.4 基因定位首先在两亲本之间筛选多态SSR标记, 从中挑选出在12条染色体上分布相对均匀的标记对F2群体进行分型、构建连锁图和初步定位。根据初步定位的结果选择适当的位点利用F2 : 3家系进行高精度连锁分析。采用软件Primer Premier 5.0进行目标区间InDel标记的开发(表 1)。
| 标记 Marker |
染色体 Chromosome |
前引物(5′→3′) Forward primer |
后引物(5′→3′) Reverse primer |
产物大小/bp Product size |
| Y28 | 4 | TCTGTTTTGACCTAGCCTAGCATT | CGTCGGCTGAACATTCCACTA | 231 |
| Y7 | 1 | GAAAACAGTGGGCGACATC | CAATGAAGCAACTGGGTCTG | 172 |
| L83 | 6 | CGTGTGGGGAGGTAGAGT | CTCGAGTTACCGAACAAGCC | 118 |
| K17 | 2 | CAAGCTAGCGACATAGCGAG | AGCTCATCGATGTAGCTGCT | 116 |
| L75 | 5 | ACCTGTCACAAGGAGTTCCA | GCTTGCTGTACATAGTTCACAGA | 142 |
| K36 | 12 | ATTTCGCCTACCACGGATTG | GGTCCGGCTCCATTCGAAAA | 107 |
| L170 | 9 | TGCCCACACATGATGAGC | AACGGGCAAGAGATCTTCTG | 92 |
| L171 | 9 | GGCCCACGACTTAATAGACATCG | ACAGCGAACGTGGTGTCTCC | 192 |
| L174 | 9 | GGACCAACAACATCACAAC | TACCACCATCACCACCTT | 126 |
| L254 | 9 | CCTTTATGCATGTGTGGAACAGC | GTAATGCCAAAGGGAATGTGAGG | 162 |
在水稻基因组注释网(http://rice.plantbiology.msu.edu/index.shtml, RGAP)对整个目标区间内可能包含的基因进行预测, 查询预测到的ORF的相关功能。排除转座子或逆转座子, 在网站(http://rise2.genomics.org.cn/page/rice/search.jsp)下载目标区间ORF序列, 设计引物进行全长扩增并测序。
2 结果与分析 2.1 亲本及F2群体的表型分析亲本‘茭白稻’和‘Saber’的表型差异较大, ‘Saber’的生育期较‘茭白稻’晚10 d左右, 成熟期的株高是‘茭白稻’的66.7%, 穗长约为‘茭白稻’的1.5倍, 一次枝梗数、二次枝梗数及穗粒数也比‘茭白稻’少。‘Saber’为细长粒形, 粒长为(8.86±0.26)mm, 粒宽为(2.40±0.09)mm, ‘茭白稻’椭圆粒形, 粒长为(7.44±0.36)mm, 粒宽为(3.64±0.25)mm(图 1, 表 2)。

|
图 1 ‘茭白稻’和‘Saber’的成熟期植株和穗部表型 Fig. 1 Plants and panicles of'Jiaobaidao'and'Saber'at mature stage A.‘茭白稻’(左)和‘Saber’(右)成熟期植株形态; B.‘茭白稻’(左)和‘Saber’(右)成熟期稻穗。 A. Plant morphology of'Jiaobaidao'(left)and'Saber'(right)at the mature stage; B. Main panicle of'Jiaobaidao'(left)and'Saber'(right). |
| 性状 Traits |
茭白稻 Jiaobaidao |
Saber | F2群体F2 population | |||||
| 变幅 Variation |
均值 Average |
标准差 SD |
方差 Range |
偏度 Skewness |
峰度 Kurtosis |
|||
| 株高/cm Plant hight | 115.50±3.00 | 83.63±2.55 | 67.30~151.50 | 108.49 | 16.97 | 287.88 | 1.14 | 4.84 |
| 二次枝梗数Secondary branch number | 85.50±1.50 | 30.30±7.42 | 9.00~93.00 | 49.20 | 15.51 | 240.56 | 0.08 | -0.39 |
| 穗长/cm Panicle length | 18.17±1.00 | 27.83±0.83 | 14.00~33.10 | 22.83 | 3.82 | 14.58 | 0.49 | -0.18 |
| 每穗颖花数Spikelet number | 413.00±3.00 | 170.00±24.00 | 102.00~484.00 | 259.11 | 69.23 | 4 793.27 | 0.29 | 0.02 |
| 粒长/mm Grain length | 7.44±0.36 | 8.86±0.260 | 6.83~9.64 | 8.30 | 0.51 | 0.26 | 0.00 | 0.33 |
| 粒宽/mm Grain width | 3.64±0.25 | 2.40±0.09 | 2.34~3.67 | 3.04 | 0.25 | 0.06 | 0.02 | 0.24 |
F2群体的株高、二次枝梗数、每穗颖花数、粒长、粒宽、穗长等性状都表现出明显的分离现象, 且次数分布近似正态分布(图 2)。
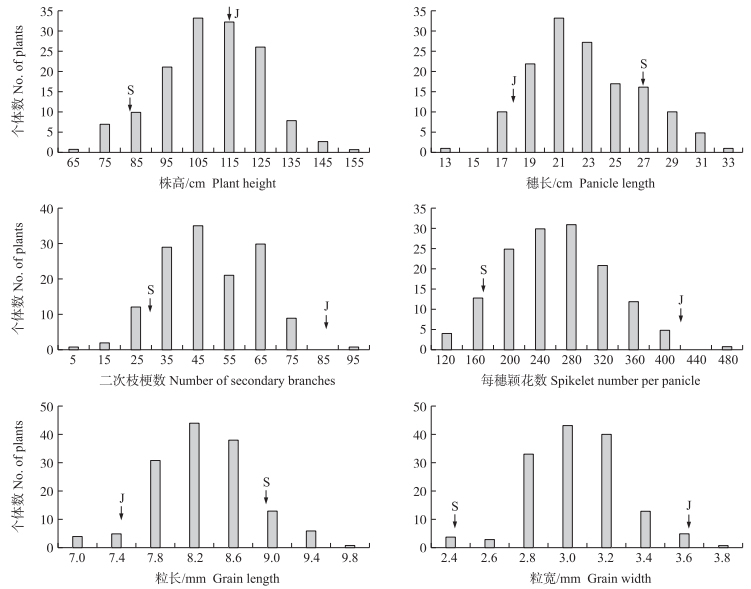
|
图 2 F2群体株高、穗部性状和籽粒性状的次数分布 Fig. 2 Frequency distribution of plant height, panicle traits and grain traits in F2 population 箭头对应横坐标表示亲本‘茭白稻’(J)和‘Saber’(S)的表型值。 The arrowhead corresponding to the abscissa represents the phenotypic value of'Jiaobaidao'(J)and'Saber'(S). |
用1 576对SSR引物在2个亲本间筛选具有多态性标记, 共获得235对多态引物, 从中挑选出89对分辨清晰、分布相对均匀的标记, 构建F2群体连锁图, 对株高、穗长、二次枝梗数、每穗颖花数、粒长、粒宽等性状进行QTL分析。共检测到6个性状的16个QTL位点(表 3)。4个株高QTL中, qPH1解释了30.96%的株高变异, 其所在区间存在1个已知的半矮秆基因sd1, 克隆测序证实‘Saber’中qPH1为半矮秆基因sd1 [20]。3个穗长QTL中, 效应最大的qPL9位于9号染色体上的标记RM1189和L171之间。2个穗粒数QTL与2个二次枝梗数QTL位于1号、6号染色体的相同区间, 说明穗粒数与二次枝梗数受共同或连锁的QTL支配。1个粒长QTL位于7号染色体, 4个粒宽QTL位于2号、5号、12号染色体。
| 性状 Trait |
染色体 Chromosome |
数量性 状位点QTL |
左标记 Left marker |
右标记 Right marker |
LOD值 LOD value |
贡献率/% Variance explained |
加性效应 Additive |
显性效应 Domiant |
| 株高Plant height | 1 | qPH1 | RM5389 | RM3482 | 11.442 | 30.960 | 10.157 | 10.303 |
| 3 | qPH3 | RM7072 | RM3417 | 4.187 | 8.958 | 7.023 | -2.293 | |
| 4 | qPH4 | Y28 | RM1155 | 5.567 | 16.557 | -8.022 | 6.272 | |
| 9 | qPH9 | L148 | RM566 | 5.532 | 15.852 | -13.968 | -0.348 | |
| 穗长Panicle length | 5 | qPL5 | RM7293 | RM4674 | 3.261 | 18.271 | -0.201 | 3.209 |
| 9 | qPL9 | RM1189 | L171 | 8.272 | 32.803 | -2.776 | -1.636 | |
| 10 | qPL10 | RM1126 | RM228 | 3.112 | 9.450 | 1.784 | -0.403 | |
| 二次枝梗数Secondary branch number | 1 | qSBN1 | Y7 | RM5389 | 3.860 | 21.647 | 5.300 | 13.017 |
| 6 | qSBN6 | RM3431 | L83 | 3.053 | 12.202 | 7.675 | -1.732 | |
| 每穗颖花数Spikelet number per panicle | 1 | qSN1 | Y7 | RM5389 | 3.058 | 19.800 | 24.042 | 52.701 |
| 6 | qSN6 | RM3431 | L83 | 3.400 | 15.305 | 34.595 | -20.359 | |
| 粒长Grain length | 7 | qGL7 | RM11 | RM1048 | 5.315 | 17.842 | -0.319 | 0.034 |
| 粒宽Grain width | 2 | qGW2 | RM5350 | K17 | 3.593 | 23.737 | 0.124 | -0.146 |
| 5 | qGW5-1 | RM7302 | RM4915 | 3.208 | 11.357 | 0.114 | -0.033 | |
| 5 | qGW5-2 | RM4674 | L75 | 2.991 | 28.545 | 0.181 | 0.040 | |
| 12 | qGW12 | RM27982 | K36 | 4.029 | 16.232 | 0.125 | -0.041 |
针对穗长主效qPL9, 在F2群体中选择目标区间杂合型个体, 种植F3群体, 进行定位验证和精细定位。在随机选取的编号为6441群体, 采用连锁标记RM1189鉴定基因型, 分析次数分布特征, 发现2种纯合型交错分布(图 3), 说明RM1189与qPL9之间存在连锁。QTL分析表明, qPL9仍处于RM1189和L171之间(图 4-A), 说明qPL9能在世代间稳定重演, 所以对qPL9进行精细定位。
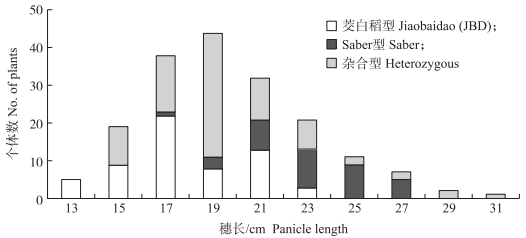
|
图 3 F3家系6441的穗长次数分布及连锁标记RM1189基因型分布 Fig. 3 Frequency distribution of panicle length and genotyping by SSR marker RM1189 in F3 segregation line 6441 |
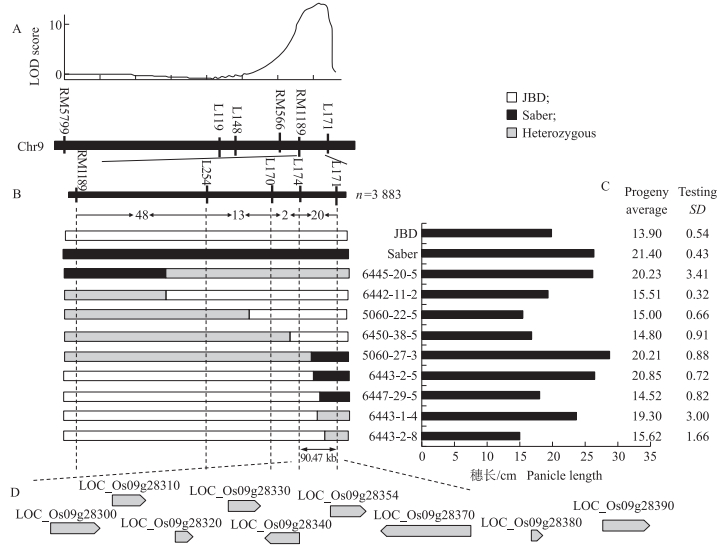
|
图 4 qPL9的精细定位 Fig. 4 Fine mapping of qPL9 A.在F3分离群体中检测qPL9; B. qPL9区间的高精度连锁分析; C.重组单株后代表型分析(n=40);D. ORF预测(参照RGAP)。 A. Genetic linkage map for primary location of qPL9; B. High-resolution linkage analysis of qPL9 locus; C. Progeny testing of recombinants(n=40);D. Predicted open reading frames(ORF)in target interval with reference to Rice Genome Annotation Project(RGAP). |
用标记RM1189和L171对来自于F3分离群体的3 883个植株进行筛查, 共获得83个交换植株。在该区间内设计新的InDel标记(表 1), 对83个交换单株进行分析, 获得更精确的交换区间, 与表型进行连锁分析。初步认定qPL9在L174与L171之间90.47 kb的物理区间(图 4-B, 部分植株的交换区间与表型)。为鉴定定位区间准确性, 将L174与L171之间的交换单株及其他区间的代表性交换株分别种植成40株小群体, 以群体表型判断上代基因型。发现qPL9仍定位在L174与L171之间(图 4-C)。根据水稻基因组注释( http://rice.plantbiology.msu.edu/index.shtml, RGAP), 在标记L174和L171之间注释了9个ORF(图 4-D, 表 4)。
| 开放阅读框ORF | 候选基因Candidate gene | 核酸长度/bp Nucleotide length | 功能注释Putative function |
| 1 | LOC_Os09g28300 | 1 863 | Remorin C末端保守蛋白Remorin C-terminal domain containing protein |
| 2 | LOC_Os09g28310 | 1 131 | bZIP转录因子bZIP transcription factor |
| 3 | LOC_Os09g28320 | 531 | 表达蛋白Expressed protein |
| 4 | LOC_Os09g28330 | 3 036 | 转录蛋白Transposon protein |
| 5 | LOC_Os09g28340 | 1 191 | 表达蛋白Expressed protein |
| 6 | LOC_Os09g28354 | 909 | CPuORF39-具有保守肽的uORF-保守转录本CPuORF39-conserved peptide uORF-containing transcript |
| 7 | LOC_Os09g28370 | 6 942 | 逆转录转座子蛋白Retrotransposon protein |
| 8 | LOC_Os09g28380 | 240 | 功能未知Hypothetical protein |
| 9 | LOC_Os09g28390 | 1 503 | 细胞色素P450 Cytochrome P450 |
以‘日本晴’序列为参照设计14对特异性引物, 以双亲为模板扩增7个ORF。经测序及序列比对, 只有ORF1、ORF2、ORF3在双亲间存在编码氨基酸序列差异。ORF1(LOC_Os09g28300)的编码序列存在4处SNP, 其中2处SNP分别导致‘Saber’氨基酸序列第135位的脯氨酸(Pro, P)突变为丝氨酸(Ser, S), 第416位的谷氨酸(Glu, E)突变为天冬氨酸(Asp, D)(图 5-A)。ORF2(LOC_Os09g28310)的编码序列发生了5处SNP, 其中1处导致‘Saber’氨基酸序列第321处的亮氨酸(Leu, L)突变为蛋氨酸(Met, M)(图 5-B)。ORF3(LOC_Os09g28320)在编码序列发生9处SNP, 其中6处导致‘Saber’氨基酸序列的改变, 分别为第10位苏氨酸(Thr, T)突变为异亮氨酸(Ile, I); 第21位后面增加了1个甘氨酸(Gly, G); 第76位亮氨酸(Leu, L)突变为苯丙氨酸(Phe, F); 第81位丝氨酸(Ser, S)突变为天冬酰胺(Asn, N); 第97位酪氨酸(Tyr, T)突变为天冬酰胺(Asn, N); 第366位缬氨酸(Val, V)突变为丙氨酸(Ala, A)(图 5-C)。

|
图 5 qPL9候选基因结构分析 Fig. 5 The gene structure of candidate qPL9 虚线表示‘茭白稻’与‘Saber’间SNP位点; 红色字体表示引起氨基酸变化的错义突变。 The vertical dotted lines represent SNP between'Jiaobaidao'and'Saber'. Red fonts represent missense mutation that lead to amino acid changes. |
通过分子标记辅助选择(molecular assisted selection, MAS)技术, 可显著提高水稻育种效率, 缩短育种年限。穗长是影响水稻产量的重要农艺性状。不断发掘水稻的穗长相关基因对提高水稻产量具有重要意义。本研究中共检测到3个穗长相关QTL, 分别为qPL5、qPL9、qPL10。其中9号染色体上的qPL9的效应值最大, 而且该位点所在区间没有被克隆的穗长相关基因, 但在该位点上游物理距离770 kb处有1个基因qPL1 [6], 该基因调控水稻穗型, 其显性等位基因导致水稻稻穗变短、直立且着粒密集, 该基因与qPL9的物理位置说明二者不是同一基因。5号染色体上qPL5所在区间还没有穗长相关位点被报道, 但在该染色体上有1个基因SUI2 [21], 其调节控制节间伸长居间分生组织的发育以及穗轴细胞的扩展, 主要在节间和穗轴的维管束细胞表达。该位点与qPL5的物理距离为14.8 Mb, 而且qPL5只解释18%的变异, 所以其可能不是主效位点。10号染色体上未见报道与穗型相关的基因, 且本研究定位到的位点qPL10只解释9%的穗长表型变异, 说明该位点是微效的。
qPL9所在90.47 kb区间内的7个候选基因中, 有3个候选基因的编码序列发生突变且导致氨基酸序列发生改变。ORF1(LOC_Os09g28300)编码remorin_C蛋白, 属于remorin蛋白家族。该蛋白被定位于植物细胞的细胞膜、胞间连丝以及细胞膜上的微结构域脂筏, 在植物体内多个组织中广泛表达, 可能与细胞间的物质运输有关系。很多植物在生物和非生物胁迫条件下的转录组和蛋白质组分析检测中都发现有remorin蛋白的表达[22]。remorin蛋白GSD1直接调控细胞胞间连丝通透性从而影响水稻的灌浆过程[23]。水稻条纹病毒可以干扰remorin蛋白NbREM1的棕榈酰化修饰, 从而使水稻防御机制减弱[24]。ORF2(LOC_Os09g28310)是编码bZIP转录因子的OsbZIP72, 该基因参与水稻ABA信号转导途径, 对水稻耐旱性具有正向调节作用[25-26]。ORF3(LOC_Os09g28320)编码一种未知蛋白。结合这3个候选基因的功能, 后期可对所有候选基因进行表达分析, 转基因验证时可着重对ORF1进行验证。本研究发掘到新的水稻穗长位点, 为分子标记辅助选择培育高产水稻新品种提供有用的基因资源和技术支撑。
| [1] |
Khush G S. What it will take to feed 5.0 billion rice consumers in 2030[J]. Plant Molecular Biology, 2005, 59(1): 1-6. DOI:10.1007/s11103-005-2159-5 |
| [2] |
Cho Y G, Kang H J, Lee J S, et al. Identification of quantitative trait loci in rice for yield, yield components, and agronomic traits across years and locations[J]. Crop Science, 2007, 47(6): 2403-2417. DOI:10.2135/cropsci2006.08.0509 |
| [3] |
Marathi B, Guleria S, Mohapatra T, et al. QTL analysis of novel genomic regions associated with yield and yield related traits in new plant type based recombinant inbred lines of rice(Oryza sativa L.)[J]. BMC Plant Biology, 2012, 12: 137. DOI:10.1186/1471-2229-12-137 |
| [4] |
Hittalmani S, Huang N, Courtois B, et al. Identification of QTL for growth-and grain yield-related traits in rice across nine locations of Asia[J]. Theoretical and Applied Genetics, 2003, 107(4): 679-690. DOI:10.1007/s00122-003-1269-1 |
| [5] |
Liu T M, Li L Z, Zhang Y S, et al. Comparison of quantitative trait loci for rice yield, panicle length and spikelet density across three connected populations[J]. Journal of Genetics, 2011, 90(2): 377-382. DOI:10.1007/s12041-011-0083-9 |
| [6] |
Huang X Z, Qian Q, Liu Z B, et al. Natural variation at the DEP1 locus enhances grain yield in rice[J]. Nature Genetics, 2009, 41(4): 494-497. DOI:10.1038/ng.352 |
| [7] |
Zhu K M, Tang D, Yan C J, et al. ERECT PANICLE2 encodes a novel protein that regulates panicle erectness in indica rice[J]. Genetics, 2010, 184(2): 343-350. DOI:10.1534/genetics.109.112045 |
| [8] |
Qiao Y L, Piao R H, Shi J X, et al. Fine mapping and candidate gene analysis of dense and erect panicle 3, DEP3, which confers high grain yield in rice(Oryza sativa L.)[J]. Theoretical and Applied Genetics, 2011, 122(7): 1439-1449. DOI:10.1007/s00122-011-1543-6 |
| [9] |
Li M, Tang D, Wang K J, et al. Mutations in the F-box gene LARGER PANICLE improve the panicle architecture and enhance the grain yield in rice[J]. Plant Biotechnology Journal, 2011, 9(9): 1002-1013. DOI:10.1111/pbi.2011.9.issue-9 |
| [10] |
Ikeda-Kawakatsu K, Maekawa M, Izawa T, et al. ABERRANT PANICLE ORGANIZATION 2 /RFL, the rice ortholog of Arabidopsis LEAFY, suppresses the transition from inflorescence meristem to floral meristem through interaction with APO1[J]. Plant Journal, 2012, 69(1): 168-180. DOI:10.1111/tpj.2011.69.issue-1 |
| [11] |
Komatsu K, Maekawa M, Ujiie S, et al. LAX and SPA:major regulators of shoot branching in rice[J]. Proc Natl Acad Sci USA, 2003, 100(20): 11765-11770. DOI:10.1073/pnas.1932414100 |
| [12] |
Bai X F, Huang Y, Mao D, et al. Regulatory role of FZP in the determination of panicle branching and spikelet formation in rice[J]. Scientific Reports, 2016, 6: 19022. DOI:10.1038/srep19022 |
| [13] |
Yi G, Choi J H, Jeong E G, et al. Morphological and molecular characterization of a new frizzy panicle mutant, "fzp- 9 (t)", in rice(Oryza sativa L.)[J]. Hereditas, 2005, 142(2005): 92-97. |
| [14] |
Li J, Xu R, Wang C C, et al. A heading date QTL, qHD 7.2, from wild rice(Oryza rufipogon)delays flowering and shortens panicle length under long-day conditions[J]. Scientific Reports, 2018, 8(1): 2928. DOI:10.1038/s41598-018-21330-z |
| [15] |
Li S B, Qian Q, Fu Z M, et al. Short panicle1 encodes a putative PTR family transporter and determines rice panicle size[J]. The Plant Journal, 2009, 58(4): 592-605. DOI:10.1111/tpj.2009.58.issue-4 |
| [16] |
Léran S, Varala K, Boyer J C, et al. A unified nomenclature of NITRATE TRANSPORTER 1/PEPTIDE TRANSPORTER family members in plants[J]. Trends in Plant Science, 2014, 19(1): 5-9. DOI:10.1016/j.tplants.2013.08.008 |
| [17] |
Yoshida A, Ohmori Y, Kitano H, et al. ABERRANT SPIKELET AND PANICLE1, encoding a TOPLESS-related transcriptional co-repressor, is involved in the regulation of meristem fate in rice[J]. The Plant Journal, 2012, 70(2): 327-339. DOI:10.1111/tpj.2012.70.issue-2 |
| [18] |
Zhang L, Wang J J, Wang J M. Quantitative trait locus analysis and fine mapping of the qPL 6 locus for panicle length in rice[J]. Theor Appl Genet, 2015, 128(6): 1151-1161. DOI:10.1007/s00122-015-2496-y |
| [19] |
姚晓云, 李清, 刘进, 等. 不同环境下水稻株高和穗长的QTL分析[J]. 中国农业科学, 2015, 48(3): 407-414. Yao X Y, Li Q, Liu J, et al. Dissection of QTL for plant height and panicle length traits in rice under different environment[J]. Scientia Agricultura Sinica, 2015, 48(3): 407-414 (in Chinese with English abstract). |
| [20] |
Monna L, Kitazawa N, Yoshino R, et al. Positional cloning of rice semidwarfing gene, sd- 1 :rice"Green Revolution Gene"encodes a mutant enzyme involved in gibberellin synthesis[J]. DNA Research, 2002, 9(1): 11-17. DOI:10.1093/dnares/9.1.11 |
| [21] |
Yin H F, Gao P, Liu C W, et al. SUI-family genes encode phosphatidylserine synthases and regulate stem development in rice[J]. Planta, 2013, 237(1): 15-27. DOI:10.1007/s00425-012-1736-5 |
| [22] |
Perraki A, Cacas J L, Crowet J M, et al. Plasma membrane localization of Solanum tuberosum remorin from group 1, homolog 3 is mediated by conformational changes in a novel C-terminal anchor and required for the restriction of potato virus X movement[J]. Plant Physiology, 2012, 160(2): 624-637. DOI:10.1104/pp.112.200519 |
| [23] |
Gui J S, Liu C, Sh en, J H, et al. Grain setting defect1, encoding a remorin protein, affects the grain setting in rice through regulating plasmodesmatal conductance[J]. Plant Physiology, 2014, 166(3): 1463-1478. DOI:10.1104/pp.114.246769 |
| [24] |
Fu S, Xu Y, Li C Y, et al. Rice stripe virus interferes with S-acylation of remorin and induces its autophagic degradation to facilitate virus infection[J]. Molecular Plant, 2018, 11: 269-287. DOI:10.1016/j.molp.2017.11.011 |
| [25] |
Nijhawan A, Jain M K, Tyagi A, et al. Genomic survey and gene expression analysis of the basic leucine zipper transcription factor family in rice[J]. Plant Physiology, 2008, 146(2): 333-350. |
| [26] |
Lu G J, Gao C X, Zheng X N, et al. Identification of OsbZIP72 as a positive regulator of ABA response and drought tolerance in rice[J]. Planta, 2009, 229(3): 605-615. DOI:10.1007/s00425-008-0857-3 |




