文章信息
- 武鸿, 康亚男, 唐荣宏, 陈冰, 郁宏伟, 鲍恩东
- WU Hong, KANG Yanan, TANG Ronghong, CHEN Bing, YU Hongwei, BAO Endong
- 3株樱桃谷肉鸭源和2株番鸭源新型鸭呼肠孤病毒的分离与鉴定
- The isolation and identification of novel duck reovirus from Cherry Valley ducks(3 strains)and Muscovy ducks(2 strains)
- 南京农业大学学报, 2019, 42(2): 328-335
- Journal of Nanjing Agricultural University, 2019, 42(2): 328-335.
- http://dx.doi.org/10.7685/jnau.201805051
-
文章历史
- 收稿日期: 2018-05-31
2. 天津瑞普生物技术股份有限公司研究院, 天津 300308
2. Institute of Tianjin Ringpu Biological Technology Co. Ltd., Tianjin 300308, China
自1997年以来, 在我国福建、浙江、广东等番鸭养殖省暴发了一种以软脚为主要临床症状, 以肝、脾表面有多量白点为主要病理变化的“番鸭肝白点病”[1]。2001年, 吴宝成等[2]首次分离并鉴定了该病病原为呼肠孤病毒科、正呼肠孤病毒属、番鸭呼肠孤病毒(Muscovy duck reovirus, MDRV)。近年来, 半番鸭、北京鸭和野鸭等多品种鸭都陆续出现感染和发病, 发病日龄为3~43日龄, 病程5~7 d, 发病率20%~60%, 死亡率5%~80%, 临床主要表现为雏鸭出雏率降低, 免疫抑制和生长障碍等, 通过分离和鉴定均证实为新型鸭呼肠孤病毒(novel duck reovirus, NDRV)[3-6]。新型鸭呼肠孤病毒感染在我国分布已非常广泛, 并已成为近几年在全国各地鸭养殖区流行的一种危害严重的传染病[7], 给养鸭业造成了较为严重的经济损失。
我们于2017年9月至12月自广西、山东、广东及江苏等省养鸭场采集疑似DRV感染病鸭的病变肝脏、脾脏等样品, 通过生物学特性和理化特性测定及σC基因序列分析, 对此新型鸭呼肠孤病毒的病原特点及致病特征进行了研究, 为禽呼肠孤病毒的流行病学调查和分类积累资料, 并为有效防控鸭呼肠孤病毒病提供试验依据。
1 材料与方法 1.1 试验材料 1.1.1 样品采集于2017年9月至12月自广西、广东、山东及江苏等地养鸭场采集一批以樱桃谷肉鸭、番鸭为感染对象, 5~20日龄, 具有典型的肝脾坏死特征的疑似DRV感染患鸭的病变肝脏、脾脏等样品; DRV阳性对照株由天津渤海农牧产业联合研究院有限公司惠赠。
1.1.2 试验用细胞、鸭胚和试验动物LMH细胞购自ATCC细胞库; 1日龄肉鸭胚、1日龄肉鸭均购自河北安新无呼肠孤病毒感染的某鸭场; 1日龄SPF鸡胚购自北京梅里亚维通实验动物技术有限公司。
1.1.3 主要仪器设备和耗材电脑孵化设备(600IB型)为北京海江孵化设备制造有限公司产品; 生物安全柜(NU-425-6000S型)为美国Nuaire公司产品; XSP-37XB三目倒置生物显微镜(DSZ-LV320型)为上海川翔生物科技有限公司产品; 正置显微镜(CI-L型)为上海Nikon仪器有限公司产品; 梯度PCR扩增仪(T100型)、凝胶成像分析系统(GELDOCXR+型)均为美国Bio-Rad公司产品; 生物组织自动包埋机(TB-FL1型)为武汉天之瑞医疗科技有限公司产品; 自动脱水机(HY-TS1090B型)、半自动石蜡切片机(HY3500型)和摊烤片机(HY-HP型)均为金华惠友仪器设备有限公司产品。
1.1.4 主要试剂DMEM/F-12培养基购自Gibco公司; 胎牛血清购自Biolodical Indutries公司; 二甲基亚砜(DMSO)D2650购自Sigma公司; G-100琼脂糖购自GENE公司; 50×TAE购自Biotopped公司; 6×Loading Buffer、DL1000 DNA Marker、MiniBEST病毒RNA/DNA提取试剂盒、PrimeScriptTMⅡ cDNA合成试剂盒、PCR试剂盒、Ex Taq酶R001B均购自宝生物(TaKaRa)工程有限公司。
1.2 病毒分离与分子生物学鉴定 1.2.1 样本处理无菌采集可疑病鸭的肝、脾等病变组织, 剪碎研磨, 2倍PBS稀释制成匀浆, 加入1 500~ 2 000 IU青、链霉素灭菌处理, 反复冻融3次, 4 ℃、6 000 r · min-1离心5 min, 取上清液即为样本处理液。
1.2.2 分离培养将处理后的样品液经绒毛尿囊膜接种10日龄肉鸭胚, 每份样品接种5枚鸭胚, 每枚0.2 mL, 另取5枚鸭胚接种等量PBS溶液作为对照组; 37 ℃孵育, 弃除24 h内的死亡鸭胚。收集120 h内死亡的胚体及其尿囊液, 于-15 ℃以下保存。按照上述方法在鸭胚上同时盲传3代。
1.2.3 核酸提取及PCR鉴定从收获的鸭胚F3代病毒培养液中提取病毒RNA, 将提取的病毒RNA反转录合成cDNA, 再以cDNA为模板进行PCR扩增。根据GenBank公布的鸭呼肠孤病毒σC基因序列设计引物, 由北京擎科新业生物技术有限公司合成, 预期扩增产物长度为1 002 bp。引物对(P1/P2)序列为:5′-ATGATGGATCGCAACGAGGCG-3′/5′-GGCGAATAGCTCTTCTCATTAC-3′。PCR反应条件:95 ℃ 5 min; 95 ℃ 45 s, 50 ℃ 30 s, 72 ℃ 1 min, 34个循环; 72 ℃ 10 min。
1.2.4 序列分析将PCR阳性产物送至华大基因科技有限公司测序, 使用DNAStar等分子生物学软件对测序结果进行遗传进化树构建和同源性分析。选择GenBank收录的新型鸭呼肠孤病毒(novel duck reovirus, NDRV)、鹅呼肠孤病毒(goose reovirus, GRV)、番鸭呼肠孤病毒(Muscovy duck reovirus, MDRV)及禽呼肠孤病毒(avian reovirus, ARV)参考株的σC基因比对分析。参考株及登录号分别为NDRV SD-12野鸭(KJ879930.1)、NDRV HZ09番鸭(KF729982.1)、NDRV NP03番鸭(KC312699.1)、NDRV QY番鸭(KF689545.1), GRV 03G鹅(KF729962.1), MDRV S12番鸭(DQ643970.1)、MDRV 89330番鸭(AJ251834.1)、MDRV CA番鸭(KJ569583.1), ARV 138鸡(AF218359.1)、ARV 176鸡(AF218358.1)、ARV S1133鸡(AF330703.1)。
1.3 病毒分离株的生物学特性鉴定 1.3.1 细胞致病性将NDRV分离毒株分别接种鸡肝癌细胞(Leghorn male chicken hepatocellular carcinoma, LMH)、鸡胚成纤维细胞(chicken embryo fibroblast, CEF)及鸡胚肝细胞(chicken embryo liver cell, CEL)的单层细胞[8], 37 ℃、5% CO2培养箱中感作1 h, 加入2%(体积分数)血清维持液, 继续培养, 观察病毒增殖产生的细胞病变。将分离病毒液按10-1~10-8进行10倍系列稀释, 以2%血清维持液为对照组, 接种96孔板LMH细胞, 每个稀释度接种5孔。37 ℃、5% CO2培养箱中培养5 d, 按照Reed-Muench法计算各分离毒株的组织细胞培养半数感染量(tissue culture infective dose 50, TCID50)。
1.3.2 鸭胚致病性将NDRV分离病毒液进行10倍系列稀释, 取10-3~10-8经绒毛尿囊膜接种11日龄樱桃谷鸭胚, 每个稀释度接种5枚, 每枚0.2 mL。同时设置接种无菌PBS的5枚鸭胚作为对照组。接种后, 于37 ℃生化培养箱中培养。弃去24 h内非特异性死亡的鸭胚, 观察记录鸭胚的死亡数, 按Reed-Muench法计算各分离毒株的胚半数致死量(embryo lethal dose 50, ELD50)。
1.3.3 雏鸭致病性将60羽4日龄雏鸭随机分成6组, 每组10羽, 其中5组分别感染NDRV分离毒株, 1组为空白对照组。将分离株的LMH细胞培养液经腿部肌肉注射感染雏鸭, 每羽0.2 mL, 对照组注射等量无病毒接种的LMH细胞培养液。采用隔离器饲养, 保证充足的饮水、采食和光照, 定时观察并记录发病状况, 观察期为14 d。分别于接种后第2、7、14天自各组中随机取2只发病雏鸭和1只对照组雏鸭, 颈静脉放血致死, 剖检并观察肝脏和脾脏的病理变化。同时采集肝、脾组织, 一部分经无菌处理后接种LMH, 进行分离培养, 再取培养液进行PCR鉴定。另一部分于4%甲醛中固定, 制备石蜡切片, HE染色, 观察组织病理学变化。
1.4 病毒分离株的理化特性鉴定 1.4.1 氯仿敏感试验取各NDRV分离毒株的LMH细胞培养液0.5 mL, 均加入0.05 mL 10%(体积分数)氯仿作为处理组, 同时设置将病毒液换为等量细胞维持液的对照组。将各组避光振摇25 min后, 4 ℃下6 000 r · min-1离心10 min, 收集上清液。按照上述TCID50测定方法对各组进行处理并判定结果。
1.4.2 胰蛋白酶敏感试验取各NDRV分离毒株的LMH细胞培养毒液0.5 mL, 均加入0.5 mL 10 μg · mL-1胰蛋白酶作为处理组, 同时设置将病毒液换为等量细胞维持液的对照组。将各组混匀, 37 ℃下作用1 h, 加入10%(体积分数)胎牛血清终止反应。按照上述TCID50测定方法对各组进行处理并判定结果。
2 结果与分析 2.1 病毒分离鸭胚接种样本处理液后48~96 h开始死亡, 且病毒致死率随鸭胚传代数增加而升高, 第3代时死亡率可达100%。死亡胚主要病变为全身明显出血, 绒毛尿囊膜局部出血、肿胀、增厚, 内脏出血、水肿。
2.2 分离病毒特性鉴定 2.2.1 分子生物学鉴定以提取的鸭胚F3代病毒RNA为模板, 通过反转录(RT)和PCR检测, 5份待测样品RPVA1311、RPVA1312、RPVA1313、RPVA1314和RPVA1315均特异性扩增出大小约为1 000 bp的条带, 与σC基因大小相符, 与阳性株对比结果一致, 说明分离毒株疑似呼肠孤病毒(图 1)。

|
图 1 NDRV分离毒株σC基因扩增图 Fig. 1 Amplification of σC gene of the isolated NDRV M. DNA分子量标准品; 1~5. RPVA1311~RPVA1315毒株; 6.阴性对照株; 7.阳性对照株。 M. DNA molecular weight standard; 1-5. RPVA1311-RPVA1315 strain; 6. Negative strain; 7. Positive strain. |
各分离毒株的PCR产物序列检测结果与GenBank所发布的DRV的σC基因序列有95%以上的同源性。与参考株的对比结果显示:分离毒株主要与NDRV毒株(SD-12、HZ09、NP03、QY)相似性较高, 为94%~98%。其中RPVA1311和RPVA1312处于进化树同一分支, 均与SD-12同源性较高, 分别为97.7%和97.5%;RPVA1313和RPVA1315处于进化树同一分支, RPVA1313与QY同源性较高, 为97.0%, 而RPVA1315与NP03同源性较高, 为98.2%;RPVA1314株与HZ09处于进化树同一分支, 同源性为90.9%。
从σC基因核苷酸序列的遗传进化树(图 2)可以看出, NDRV分离毒株根据宿主类型形成2个明显的进化分支, RPVA1313和RPVA1315符合目前毒株分型特点, 同属于番鸭分离毒株, 而RPVA1311、RPVA1312和RPVA1314分离自樱桃谷肉鸭, 不属于传统型番鸭发病分离毒株[7]。分离毒株形成的进化分支与传统的MDRV分支相并列, 同源性为40%~50%, 亲缘关系相对较远。此外, NDRV分离毒株与目前市场上番鸭呼肠孤病毒病活疫苗CA株处于不同的进化分支, 同源性约为41%, 遗传关系较远。

|
图 2 基于σC基因核苷酸序列NDRV分离毒株进化树分析 Fig. 2 Phylogenetic tree analysis of σC gene of the isolated NDRV |
细胞致病性:将NDRV分离毒株感染LMH和CEL细胞, 约24 h后开始出现细胞病变, 而接种CEF细胞后约48 h才开始出现细胞病变。病毒在LMH细胞上产生的细胞病变更典型, 病变程度更严重。但主要的病理过程相似, 都表现为细胞收缩变圆, 胞膜折光性加深, 胞质内颗粒增多, 随之细胞融合, 形成合胞体, 大量细胞死亡、脱落, 聚集成簇, 悬浮在培养液中, 贴壁细胞数目明显减少, 细胞单层出现大面积空洞(图 3)。此外, 番鸭源的RPVA1313和RPVA1315感染LMH细胞出现病变的时间明显早于肉鸭源分离株, 表明其对细胞的致病力相对较强。

|
图 3 NDRV分离毒株感染致细胞病变观察 Fig. 3 The observation of cytopathy induced by the isolated NDRV |
NDRV分离毒株感染LMH的TCID50测定结果显示, RPVA1313株和RPVA1315株的病毒滴度高于RPVA1312株和RPVA1314株, 表明番鸭源分离毒株的毒力要比樱桃谷肉鸭源分离毒株对细胞的毒力更强, 这与出现典型细胞病变的时间一致(表 1)。
| 效价Titer | RPVA1311 | RPVA1312 | RPVA1313 | RPVA1314 | RPVA1315 |
| lg[TCID50] | 5.83 | 5.68 | 6.32 | 5.63 | 6.63 |
| lg[ELD50] | 5.32 | 5.17 | 5.50 | 5.00 | 5.63 |
鸭胚致病性:NDRV分离毒株接种11日龄非免鸭胚后均可引起死亡, 死亡率可达100%。鸭胚在接种2 d后开始出现死亡, 3~5 d的死亡率最高, 其中RPVA1313株和RPVA1315株致鸭胚死亡高峰主要集中在接种后2~3 d, 而RPVA1311、RPVA1312和RPVA1314株致鸭胚死亡时间较晚, 主要出现在接种后4~5 d。感染鸭胚的分离毒ELD50不低于105.0(表 1)。病死胚主要病变为鸭胚发育不良, 胚体蜷缩变小、质地较脆, 皮下水肿, 全身表现为严重出血, 头颈部最为明显, 内脏出血、肿胀(图 4)。
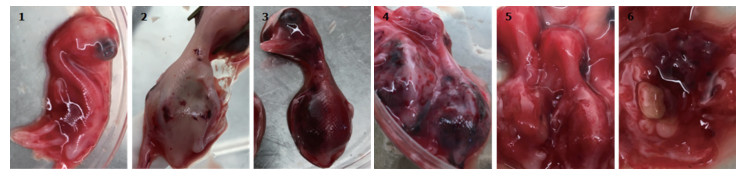
|
图 4 NDRV分离毒株感染鸭胚病变 Fig. 4 Lesion of duck embryo infected with the isolated NDRV 1. RPVA1311毒株:全身弥漫性出血; 2. RPVA1312毒株:背部斑块状出血; 3. RPVA1313毒株:全身弥漫性出血; 4. RPVA1314毒株:全身点状出血; 5. RPVA1315毒株:全身弥漫性出血; 6.内脏肿胀, 有出血点。 1. RPVA1311 strain, diffuse systemic hemorrhage; 2. RPVA1312 strain, plaque-like hemorrhage; 3. RPVA1313 strain, diffuse systemic hemorrhage; 4. RPVA1314 strain, generally dot-like hemorrhage; 5. RPVA1315 strain, diffuse systemic hemorrhage; 6.Visceral swelling and bleeding points. |
雏鸭致病性:将5株NDRV分离病毒分别接种10只4日龄雏鸭后第2天开始表现临床症状, 发病多在7~13日龄, 发病率100%, 但致死率低, 其中RPVA1313株为10%, RPVA1315株为20%, 其他分离毒株则未见死亡。发病鸭表现为精神沉郁, 羽毛松乱不齐, 眼周湿润、泪痕明显, 食欲减退, 腹泻, 生长发育迟缓, 体型较小。部分雏鸭站立困难, 运动不便(图 5-1)。有的还表现出伸颈张口、呼吸困难的症状(图 5-2)。

|
图 5 NDRV分离毒株感染雏鸭临床表现 Fig. 5 Clinical manifestations of ducklings infected with the isolated NDRV |
NDRV分离毒株主要的剖检病变为脾脏明显肿大, 伴有不同程度的坏死。发病鸭的脾脏最初肿大, 呈深红色, 颜色逐渐加深, 淤血呈暗黑色, 随之脾脏变硬, 表面散在分布大小不同的白色坏死病灶, 病灶中央或周围有红色出血, 坏死灶与周围健康组织界限明显。肝脏没有明显可见的病理变化, 最初有不同程度的肿大, 边缘钝圆, 表面呈土黄色, 但逐渐恢复正常, 无明显病变(图 6)。
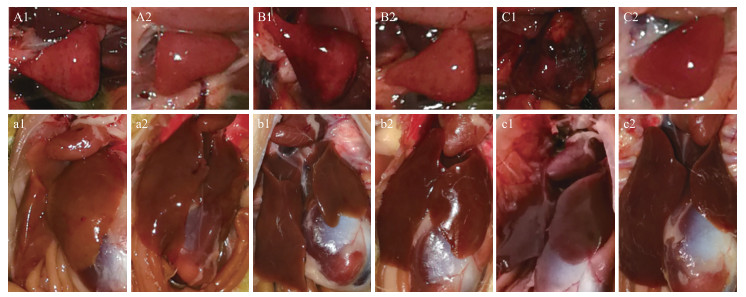
|
图 6 NDRV分离毒株感染雏鸭脾脏和肝脏剖检病变
Fig. 6 Spleen and liver lesion of ducklings infected with the isolated NDRV
脾脏:A1.感染后2 d, 肿大, 呈深红色; B1.感染后7 d, 局部淤血, 呈暗黑色; C1.感染后14 d, 白色坏死, 病灶周围出血, 与健康组织界限明显; A2、B2、C2.对照组2、7、14 d。 肝脏:a1.感染后2 d, 肿大、边缘钝圆、呈土黄色; b1.感染后7 d, 病变逐渐恢复; c1.感染后14 d, 无明显病变。a2、b2、c2:对照组2、7、14 d。 Spleen:A1. 2 d after infection, swelling, deep red; B1. 7 d after infection, partial congestion, dark black; C1. 14 d after infection, white necrotic lesions, surrounding hemorrhage, a clear boundary between necrosis and healthy tissue. A2, B2, C2. Control group 2, 7, 14 d spleen. Liver:a1. 2 d after infection, swelling, blunt edges, yellowish; b1. 7 d after infection, gradual recovery; c1. 14 d after infection, inconspicuous lesion. a2, b2, c2. Control group 2, 7, 14 d liver. |
感染RPVA1311株和RPVA1315分离毒株发病鸭的组织病理学病变主要表现为:脾脏红白髓界限不清, 淋巴细胞数量减少, 脾窦淤血。脾中分布有大量的坏死灶, 坏死灶中心为坏死的淋巴细胞及网状细胞, 外周有大量嗜中性粒细胞浸润, 伴随大量结缔组织增生(图 7-A1);肝组织中肝索紊乱、断裂, 肝细胞发生脂肪变性和水泡变性, 胞核溶解、消失。此外, 接种番鸭源毒株的雏鸭的肝脏还表现出淋巴细胞于汇管区周围浸润的病变特点(图 7-B1)。
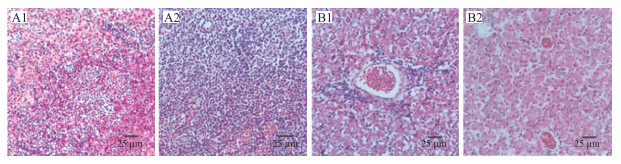
|
图 7 NDRV分离毒株感染雏鸭病理组织学病变(HE染色) Fig. 7 Histopathological examination of ducklings infected with the isolated NDRV by HE staining A1. 脾脏:脾窦淤血, 淋巴细胞减少, 脾中分布坏死灶, 中心为坏死的淋巴细胞以及网状细胞, 周围嗜中性粒细胞浸润, 结缔组织增生; A2.脾脏对照; B1.肝脏:肝索紊乱、断裂, 肝细胞脂肪变性、水泡变性, 淋巴细胞在汇管区周围浸润; B2.肝脏对照。 A1. Spleen:congestion in spleen sinuses, lymphocytes decrease, necrotic foci in the spleen, necrotic lymphocytes and reticular cells in the center, peripheral neutrophil infiltration, hyperplasia of the connective tissue; A2. Spleen control; B1. Liver:hepatic cord disorder, rupture, hepatocyte steatosis, vacuolar degeneration, lymphocyte infiltration around the portal area; B2. Liver control. |
接种后14 d放血致死所有发病鸭, 取肝脏和脾脏作为病料感染LMH细胞, 结果出现典型的细胞病变, 与病毒初次分离时一致。PCR检测阳性产物, 基因测序的结果表明为原攻击病毒, 说明NDRV分离毒株对雏鸭有一定的致病性, 动物回归试验成立。
2.2.4 理化特性鉴定氯仿敏感试验结果显示:与未经氯仿处理的对照组相比, 氯仿处理的NDRV分离毒株在LMH细胞上的lg[TCID50]之差均小于1, 说明各株病毒对氯仿处理不敏感(表 2)。氯仿能溶解囊膜脂质, 从而使有囊膜病毒失活, 分离毒株经氯仿处理后仍可保持较强的感染力, 可知其为无囊膜病毒。
| 处理分组Groups | 各株病毒滴度lg[TCID50] Viral titer | |||||
| RPVA1311 | RPVA1312 | RPVA1313 | RPVA1314 | RPVA1315 | ||
| 氯仿处理Chloroform treatment | 处理组Treatment group 对照组Control group |
6.17 5.83 |
5.83 5.68 |
6.32 6.32 |
5.57 5.63 |
6.68 6.63 |
| 胰蛋白酶处理Trypsin treatment | 处理组Treatment group 对照组Control group |
4.57 5.83 |
4.50 5.68 |
3.50 6.32 |
4.17 5.63 |
3.63 6.63 |
胰蛋白酶敏感试验结果显示:与对照组相比, 经胰酶处理的NDRV分离毒株在LMH细胞上的lg[TCID50]之差均大于1, 说明NDRV毒株对胰酶敏感。RPVA1313株和RPVA1315株的lg[TCID50]差值约为3, 说明对胰酶高度敏感(表 2)。胰酶处理可使病毒外衣壳发生部分裂解, 但并不将其完全除去[8], 使核酸容易暴露, 在核酸酶作用下发生降解而导致病毒被灭活。
3 讨论近几年来, 能被鸭呼肠孤病毒感染的鸭品种有增多趋势, 临床表现也发生了一定变化。根据病理变化我国养鸭生产中与鸭呼肠孤病毒感染相关的疫病可以分为4种类型, 即多脏器坏死型、多脏器出血型、肝脏坏死型和脾脏坏死型[9]。新型鸭呼肠孤病毒在血清学、致病性及基因组序列等方面均不同于传统的番鸭呼肠孤病毒, 且不同地区发病情况也有所差异。本研究用鸭胚进行了病毒分离, 鸭胚死亡的时间随着病毒传代明显缩短, 死亡率也逐渐升高, 第3代可达100%。通过RT-PCR测定及阳性产物测序分析, 5份样品中均可检出DRV的特异性σC基因, 提示这与DRV感染有关。
NDRV病毒基因组为10条片段组成的双链RNA, 依据SDS-PAGE电泳结果可将基因组分为3组, 分别为L(L1—L3)、M(M1—M3)和S(S1—S4)[10-11]。编码σC蛋白基因在NDRV与经典MDRV中有较大的差异。NDRV的σC蛋白由S 1基因编码, 而经典MDRV的σC蛋白由S4基因编码[12-13]。σC基因片段的变异可能是导致鸭呼肠孤病毒表现出不同致病性的一个重要因素[14-15]。由于σC蛋白是一种位于病毒衣壳表面的黏附蛋白, 也是DRV结合细胞受体的主要位点, 能够诱导细胞凋亡, 并具有高度变异特性, 能增强病毒对细胞的感染能力, 从而引起病毒抗原发生变异[16-18]。
5株NDRV分离毒株间σC基因序列分析显示, 它们的序列同源性大于93%, 与NDRV参考株的同源性为88%~98%, 与经典MDRV株和ARV株的同源性分别为40%~50%和38%~41%, 说明DRV的σC核酸序列相对保守, 但部分核苷酸序列的改变可能导致病毒感染不同的宿主。分离自山东的肉鸭源RPVA1311和RPVA1314与野鸭源的SD-12处于一个进化分支, 同源性约为97%;分离自广东的RPVA1313株与QY及邻近地区的广西RPVA1315和福建NP03则处于同一个进化分支, 且宿主都为番鸭, 同源性为97%~98%, 说明不同地域环境的流行毒株有所不同, 一些致病特征也可能表现出一定的相似性。目前广泛使用的番鸭呼肠孤病毒病活疫苗(CA株)与MDRV的同源性为70%~80%, 而与NDRV的同源性仅为40%左右, 因此在NDRV广泛流行的背景下免疫番鸭呼肠孤病毒疫苗效果可能并不理想。
NDRV分离毒株能在传代细胞LMH及原代细胞CEF、CEL上增殖并出现细胞病变, 主要表现为细胞融合, 大量合胞体形成、脱落及崩解。这与ARV和NDRV的致病性相似, 均表现为细胞融合形成合胞体, 而经典MDRV则致感染细胞出现细胞圆缩、崩解的病变, 无细胞融合现象[1, 19]。相比CEF和CEL细胞, LMH细胞对DRV最敏感, 产生细胞病变更早、更明显, 且该细胞是传代细胞, 具有技术简单、成本低以及生物安全性好的特点, 因此可以用于DRV早期的分离培养。
NDRV分离毒株对鸭胚致病性强, 且可致死。病死胚体发育不良, 全身性皮肤出血明显, 符合NDRV感染鸭胚的主要致病特征[8, 19-20], 其中RPVA1313和RPVA1315接种鸭胚出现病变及死亡的时间均早于RPVA1311、RPVA1312和RPVA1314, 对鸭胚的致病力更强, 这与细胞病变结果一致。
NDRV分离病毒感染4日龄樱桃谷肉鸭后均能出现与原临床发病鸭相同的症状和病理变化, 并能重新分离到病毒, 说明动物回归试验成立。感染雏鸭的主要特点是发病率高(100%)、致死率较低(10%~20%), 而临床具有较高的死亡率, 可能与病毒引起的免疫抑制密切相关[20-21]。NDRV分离病毒感染幼鸭主要病理特征为脾脏肿大坏死, 肝脏无明显病变, 而经典的MDRV则是以肝、脾表面出现大量白点为主要特征[19], 说明分离毒株的致病特征发生了一定的变化, 更符合NDRV的特征, 但其他已报道的NDRV感染雏鸭后肝脏表现为不同程度点状或斑块状出血[6, 22-23]。联系σC基因序列差异可知, 5株分离毒株明显不同于MDRV, 因此暂将这些分离毒归属于呼肠孤病毒科正呼肠孤病毒属新型鸭呼肠孤病毒。
鸭呼肠孤病毒病是危害我国鸭养殖业的重要疾病之一, 多品种鸭都可感染DRV。本研究对全国各地养鸭场送检的病料进行鸭呼肠孤病毒的分离, 对分离到的毒株进行基因序列分析、生物学特性和理化特性鉴定, 了解鸭呼肠孤病毒临床感染的致病特征, 为鸭呼肠孤病毒病的防控提供了一定的理论和试验依据。长期的进化和选择已使DRV发生了明显的变异, 对鸭的致病性有所改变, 发病鸭的种类也在不断增多。因此, 应通过分子病毒学相关方面的深入研究, 明确NDRV的遗传特征和变异水平, 为新型鸭呼肠孤病毒病的有效防制提供一定的理论指导。
| [1] |
胡奇林, 陈少莺, 江斌, 等. 一种新的番鸭疫病(暂名番鸭肝白点病)病原的发现[J]. 福建畜牧兽医, 2000, 22(6): 1-3. Hu Q L, Chen S Y, Jiang B, et al. Discovery of the pathogen of Muscovy duck liver white spots disease[J]. Fujian Animal Husbandry and Veterinarian, 2000, 22(6): 1-3 (in Chinese with English abstract). |
| [2] |
吴宝成, 陈家祥, 姚金水, 等. 番鸭呼肠孤病毒的分离与鉴定[J]. 福建农业大学学报, 2001, 30(2): 227-230. Wu B C, Chen J X, Yao J S, et al. Isolation and identification of Muscovy duck reovirus[J]. Journal of Fujian Agricultural University, 2001, 30(2): 227-230 (in Chinese with English abstract). |
| [3] |
黄瑜, 程龙飞, 李文杨, 等. 雏半番鸭呼肠孤病毒的分离与鉴定[J]. 中国兽医学报, 2004, 24(1): 14-15. Huang Y, Cheng L F, Li W Y, et al. Isolation and identification of reovirus in semi-Muscovy duckling[J]. Chinese Journal of Veterinary Science, 2004, 24(1): 14-15 (in Chinese with English abstract). DOI:10.3969/j.issn.1005-4545.2004.01.006 |
| [4] |
刘红.一株北京鸭呼肠孤病毒的分离鉴定[C]//中国畜牧兽医学会.中国畜牧兽医学会禽病学分会第十六次学术研讨会论文集.北京, 2012: 191-193. Liu H.Isolation and identification of Pekin duck reovirus[C]//Chinese Association of Animal and Veterinary Science.Poultry Health Branch of China Animal and Veterinary Science Conference on 16th.Beijing, 2012: 191-193(in Chinese). |
| [5] |
Liu Q F, Zhang G Z, Yu H, et al. Isolation and characterization of a reovirus causing spleen necrosis in Pekin ducklings[J]. Veterinary Microbiology, 2010, 148(2): 200-206. |
| [6] |
陈宗艳, 朱英奇, 王世传, 等. 一株新型鸭源呼肠孤病毒(TH11株)的分离与鉴定[J]. 中国动物传染病学报, 2012, 20(1): 10-15. Chen Z Y, Zhu Y Q, Wang S C, et al. Isolation and characterization of a new type of duck reovirus[J]. Chinese Journal of Animal Infectious Diseases, 2012, 20(1): 10-15 (in Chinese with English abstract). DOI:10.3969/j.issn.1674-6422.2012.01.002 |
| [7] |
宁康.鸭呼肠孤病毒的分子流行病学研究[C]//中国畜牧兽医学会禽病学分会.第三届水禽疫病防控研讨会论文集.成都, 2015: 82. Ning K.Duck reovirus molecular epidemiology research[C]//Poultry Epidemiology Branch of China Animal Husbandry and Veterinary Institute.The Third Annual Waterfowl Conference on Disease Prevention and Control.Chengdu, 2015: 82(in Chinese). |
| [8] |
殷震, 刘景华. 动物病毒学[M]. 2版. 北京: 科学出版社, 1997: 204-542. Yin Z, Liu J H. Animal Virology[M]. 2nd ed. Beijing: Science Press, 1997: 204-542 (in Chinese). |
| [9] |
黄瑜, 苏敬良, 施少华, 等. 我国鸭呼肠孤病毒感染相关的疫病[J]. 中国兽药杂志, 2009, 45(7): 57-58. Huang Y, Su J L, Shi S H, et al. Diseases related to the infection of duck reovirus in China[J]. Chinese Journal of Veterinary Medicine, 2009, 45(7): 57-58 (in Chinese). DOI:10.3969/j.issn.1002-1280.2009.07.016 |
| [10] |
Nick H, Cursiefen D, Becht H. Structural and growth characteristics of two avian reoviruses[J]. Archives of Virology, 1975, 48(3): 261-269. DOI:10.1007/BF01317969 |
| [11] |
Benavente J, Martínez-Costas J. Avian reovirus:structure and biology[J]. Virus Research, 2007, 123(2): 105-119. DOI:10.1016/j.virusres.2006.09.005 |
| [12] |
Yun T, Yu B, Ni Z, et al. Isolation and genomic characterization of a classical Muscovy duck reovirus isolated in Zhejiang, China[J]. Infection, Genetics and Evolution, 2013, 20: 444-453. DOI:10.1016/j.meegid.2013.10.004 |
| [13] |
Yun T, Yu B, Ni Z, et al. Genomic characteristics of a novel reovirus from Muscovy duckling in China[J]. Veterinary Microbiology, 2014, 168: 261-271. DOI:10.1016/j.vetmic.2013.11.005 |
| [14] |
Zheng X J, Wang D, Ning K, et al. A duck reovirus variant with a unique deletion in the sigma C gene exhibiting high pathogenicity in Pekin ducklings[J]. Virus Research, 2016, 215: 37-41. DOI:10.1016/j.virusres.2016.01.020 |
| [15] |
Liu H J, Lee L H, Hsu H W, et al. Molecular evolution of avian reovirus:evidence for genetic diversity and reassortment of the S-class genome segments and multiple cocirculating lineages[J]. Virology, 2003, 314(1): 336-349. DOI:10.1016/S0042-6822(03)00415-X |
| [16] |
陈海鹏, 云涛, 张存, 等. 新型番鸭呼肠孤病毒σC蛋白的原核表达及其抗原特[J]. 浙江农业学报, 2014, 26(6): 1448-1452. Chen H P, Yun T, Zhang C, et al. Prokaryotic expression of the recombinant σC protein of new Muscovy duck reovirus and preliminary study of the antigen characteristic[J]. Acta Agriculturae Zhejiangensis, 2014, 26(6): 1448-1452 (in Chinese with English abstract). DOI:10.3969/j.issn.1004-1524.2014.06.08 |
| [17] |
Grande A, Rodriguez E, Costas C, et al. Oligomerization and cell-binding properties of the avian reovirus cell-attachment protein σC[J]. Virology, 2000, 274(2): 367-377. DOI:10.1006/viro.2000.0473 |
| [18] |
郑献进.两株北京鸭源呼肠孤病毒生物学特性比较[D].北京: 中国农业大学, 2016: 16-19. Zheng X J.Comparison of biological characteristics of two Pekin duck-origin reoviruses[D].Beijing: China Agricultural University, 2016: 16-19(in Chinese with English abstract). |
| [19] |
胡奇林, 陈少莺, 林锋强, 等. 番鸭呼肠孤病毒的鉴定[J]. 病毒学报, 2004, 20(3): 242-248. Hu Q L, Chen S Y, Lin F Q, et al. The identification of Muscovy duck reovirus[J]. Chinese Journal of Vriology, 2004, 20(3): 242-248 (in Chinese with English abstract). DOI:10.3321/j.issn:1000-8721.2004.03.009 |
| [20] |
祁保民, 陈晓燕, 吴宝成, 等. 番鸭呼肠孤病毒诱导的细胞凋亡观察[J]. 畜牧兽医学报, 2010, 41(4): 495-499. Qi B M, Chen X Y, Wu B C, et al. The observation of the apoptosis induced by Muscovy duck reovirus[J]. Chinese Journal of Animal and Veterinary Sciences, 2010, 41(4): 495-499 (in Chinese with English abstract). |
| [21] |
刘伟, 崔国杰, 陈少莺. 新型鸭呼肠孤病毒和鸭肝炎病毒混合感染的诊断及病原分离[J]. 畜牧与兽医, 2014, 46(5): 92-95. Liu W, Cui G J, Chen S Y. Diagnosis and pathogen isolation of the mixed infection of novel duck reovirus and duck hepatitis virus[J]. Animal Husbandry and Veterinary Medicine, 2014, 46(5): 92-95 (in Chinese with English abstract). |
| [22] |
陈少莺, 陈仕龙, 林锋强, 等. 新型鸭呼肠孤病毒的分离与鉴定[J]. 病毒学报, 2012, 28(3): 224-230. Chen S Y, Chen S L, Lin F Q, et al. The isolation and identification of novel duck reovirus[J]. Chinese Journal of Vriology, 2012, 28(3): 224-230 (in Chinese with English abstract). |
| [23] |
陈峰, 雷雯, 张祥斌, 等. 免疫鸭群中一株变异型番鸭呼肠孤病毒的分离与特性研究[J]. 中国预防兽医学报, 2013, 35(8): 618-622. Chen F, Lei W, Zhang X B, et al. Isolation and characterization of a variant avian reovirus from vaccinated Muscovy duck flocks[J]. Chinese Journal of Preventive Veterinary Medicine, 2013, 35(8): 618-622 (in Chinese with English abstract). DOI:10.3969/j.issn.1008-0589.2013.08.04 |




