文章信息
- 高懿, 黄金虎, 陈丽, 王梦莉, 孙俊杰, 王丽平
- GAO Yi, HUANG Jinhu, CHEN Li, WANG Mengli, SUN Junjie, WANG Liping
- 江苏北部地区猪源屎肠球菌耐药性分析及其酰胺醇类耐药基因的检测
- Antimicrobial susceptibility and amphenicols resistance genes in Enterococcus faecium isolated from swine in the northern of Jiangsu Province
- 南京农业大学学报, 2019, 42(2): 322-327
- Journal of Nanjing Agricultural University, 2019, 42(2): 322-327.
- http://dx.doi.org/10.7685/jnau.201806024
-
文章历史
- 收稿日期: 2018-06-19
肠球菌(Enterococcus)广泛栖居在人和动物的肠道中, 临床分离的肠球菌以粪肠球菌(E. faecalis)和屎肠球菌(E.faecium)为主, 可引起人菌血症、心内膜炎和脑膜炎等疾病, 是医院感染的重要病原之一[1-2]。肠球菌因其细胞壁坚厚, 对很多药物为天然耐药, 同时因各类抗菌药在临床中广泛应用产生的高选择性压力, 导致肠球菌耐药率升高, 甚至出现多药耐药菌株[3], 给临床抗感染治疗带来极大挑战。目前耐万古霉素肠球菌(vancomycin-resistant enterococci, VRE)已被WHO列为严重威胁人类健康的超级细菌之一, 其中耐万古霉素屎肠球菌(VREfm)为主要病原体。流行病学调查显示, 人肠球菌感染病例中屎肠球菌的分离率高于粪肠球菌[4-6], 且由耐药屎肠球菌引起的人感染病例也在不断增加[7-8]。中国细菌耐药监测网(CHINET)2014—2016数据显示, 除酰胺醇类抗生素外, 屎肠球菌对万古霉素、替考拉宁、环丙沙星、左氧氟沙星、利福平、氨苄西林、红霉素、高浓度庆大霉素等药物的耐药率均高于粪肠球菌, 其对氨苄西林、氟喹诺酮类、红霉素、利福平耐药率均高于79%[9-11]。由此可见屎肠球菌耐药现状不容乐观, 有必要对其耐药性进行监测。屎肠球菌引起猪、禽、羊等动物的感染也不断被发现[12-13], 故存在通过食物链传播并转移耐药基因的风险[14-15]。氟苯尼考作为兽医专用的酰胺醇类广谱抗生素, 广泛应用于畜禽呼吸道和肠道疾病的防治, 对肠球菌有较好疗效, 但研究显示动物源肠球菌对该类抗生素的耐药性也日趋严重[16]。
肠球菌作为人畜共患、消化道共栖菌, 有可能成为潜在的耐药基因储库, 尤其动物源非临床来源肠球菌耐药性存在跨界传播的风险, 为病原菌的感染控制带来更大的困难。对动物源肠球菌进行长期动态的耐药性监测, 分析其耐药性变迁特点, 对指导临床合理使用抗菌药物具有重要意义, 因此本试验针对江苏地区部分猪场分离的屎肠球菌的耐药性及其携带的酰胺醇类耐药基因展开研究。
1 材料与方法 1.1 材料 1.1.1 主要试剂和药品肠球菌肉汤、肠球菌琼脂、脑心浸液琼脂、Mueller-Hinton培养基均购自青岛海博生物技术有限公司。青霉素G、氨苄西林、万古霉素、红霉素、四环素、麻保沙星、氟苯尼考、利福平、利奈唑胺、磷霉素、链霉素、庆大霉素均购自Aladdin公司。DNA Marker、2×Taq PCR Master Mix和琼脂糖购自TaKaRa公司; 溴化乙锭购自北京鼎国公司。
1.1.2 样本来源2016—2017年间, 在江苏省北部地区(简称苏北地区)10个猪场共采集300份肛门拭子样品。其中, 2016年采集120份样品, 2017年采集180份样品。
1.2 方法 1.2.1 菌株的分离鉴定肛门拭子样本加肠球菌肉汤培养12 h, 于肠球菌琼脂划线接种, 挑取单菌落增菌培养、保存。肠球菌菌株通过屎肠球菌特异性引物进行PCR扩增鉴定, 并经生化试验验证。肠球菌PCR产物引物对序列为:5′-TTGAGGCAGACCAGATTGACG-3′和5′-TATGACAGCGACTCCGATTCC-3′。目的片段大小为658 bp。反应程序:94 ℃ 5 min; 94 ℃ 30 s, 54 ℃ 30 s, 72 ℃ 45 s, 35个循环; 72 ℃ 10 min[17]。
1.2.2 药敏试验按照美国临床和实验室标准协会(Clinical and Laboratory Standards Institute, CLSI)[18-19]推荐的微量肉汤稀释法进行MIC测定, 并根据其耐药折点进行结果判断。
1.2.3 酰胺醇类耐药基因检测水煮法提取各菌株DNA, 采用PCR方法检测氟苯尼考耐药屎肠球菌中酰胺醇类耐药基因fexA、fexB、floR、cfr、optrA的携带情况。PCR反应体系:2×Taq PCR MasterMix 10 μL, 10 μmol·L-1的上、下游引物各1 μL, DNA模板2 μL, 加灭菌三蒸水至20 μL。参考文献合成的各基因引物序列及特点见表 1。对扩增的阳性PCR产物进行测序, 查证待检基因。
| 耐药基因Resistance gene | 引物对序列Primer pairs sequences(5′→3′) | 产物大小/bpProduct size | 退火温度/℃Annealing temperature |
| fexA[20] | GTACTTGTAGGTGCAATTACGGCTGA/CGCATCTGAGTAGGACATAGCGTC | 1 272 | 57 |
| fexB[16] | TTCCCACTATTGGTGAAAGGAT/GCAATTCCCTTTTATGGACGTT | 787 | 55 |
| floR[21] | GCGATATTCATTACTTTGGC/TAGGATGAAGGTGAGGAATG | 425 | 55 |
| cfr[22] | TGAAGTATAAAGCAGGTTGGGAGTCA/ACCATATAATTGACCACAAGCAGC | 746 | 54 |
| optrA[23] | AGGTGGTCAGCGAACTAA/ATCAACTGTTCCCATTCA | 1 395 | 50 |
2016—2017年从苏北地区10个猪场共采集300份健康猪肛门拭子样品, 对样品进行屎肠球菌的分离、鉴定和纯化, 最后获得135株屎肠球菌, 分离率为45.00%。其中2016年120份样品中分离到59株, 分离率为49.17%, 2017年180份样品中分离到76株, 分离率为42.22%。
2.2 分离菌株对12种抗菌药的耐药率分析135株屎肠球菌对各种药物的耐药率情况见表 2。其中, 氟苯尼考耐药菌株为111株, 耐药率高达82.22%, 仅次于红霉素(99.26%)和四环素(98.52%)。对其他药物的耐药率由高到低分别为氨苄西林75.56%、链霉素74.07%、庆大霉素71.11%、麻保沙星69.63%、青霉素G 45.19%、利福平34.07%和磷霉素20.00%。本次分离的菌株中未发现万古霉素耐药菌株。
| 抗菌药Antimicrobial agents | 耐药折点Breakpoint | MIC范围/(mg·L-1)MIC range | MIC50/(mg·L-1) | MIC90/(mg·L-1) | 耐药率/%(耐药株数)Resistance rate(No. of strains) |
| 红霉素Erythromycin | 8 | 4~>256 | >256 | >256 | 99.26%(134) |
| 四环素Tetracycline | 16 | ≤0.5~>256 | 128 | 256 | 98.52%(133) |
| 氟苯尼考Florfenicol | 8 | 1~128 | 32 | 64 | 82.22%(111) |
| 氨苄西林Ampicillin | 16 | ≤0.5~>256 | 16 | 128 | 75.56%(102) |
| 链霉素Streptomycin | 1 000 | — | — | — | 74.07%(100) |
| 庆大霉素Gentamicin | 500 | — | — | — | 71.11%(96) |
| 麻保沙星Marbofloxacin | 4 | 0.5~>32 | 4 | 32 | 69.63%(94) |
| 青霉素GPenicillin G | 16 | ≤0.5~>256 | 8 | 32 | 45.19%(61) |
| 利福平Rifampicin | 4 | ≤0.125~>64 | 2 | 8 | 34.07%(46) |
| 磷霉素Fosfomycin | 256 | 16~>1 024 | 64 | 256 | 20.00%(27) |
| 利奈唑胺Linezolid | 8 | 0.5~16 | 2 | 4 | 2.96%(4) |
| 万古霉素Vancomycin | 32 | 0.5~4 | 1 | 2 | 0(0) |
| 注:链霉素及庆大霉素按CLSI[18-19]规定的高水平耐氨基糖苷类耐药判定标准判定。 Note:Streptomycin and gentamicin were determined according to the high-level aminoglycoside resistant prescribed by CLSI[18-19]. |
|||||
本试验进一步比较了2016年和2017年的分离菌株对12种抗菌药物的耐药率(图 1), 结果显示, 2017年分离株对兽医临床常用的青霉素和氟苯尼考以及人医临床使用的磷霉素和利奈唑胺的耐药率均高于2016年分离株。
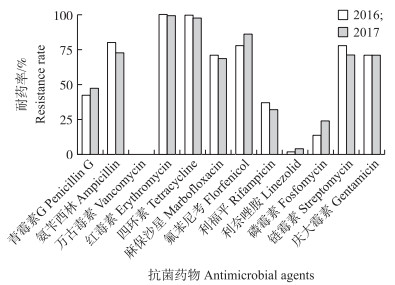
|
图 1 2016和2017年分离株对常用抗菌药物的耐药性比较 Fig. 1 Comparison of the resistant rates of the strainsisolated in 2016 and 2017 |
对临床分离的135株屎肠球菌的多药耐药情况进行分析, 结果如图 2显示:所有耐药屎肠球菌分离株均为多药耐药菌株, 集中在同时对5~9种抗菌药物的耐药, 多药耐药谱尤其以耐7种抗菌药为主, 达28.89%(39株); 另外, 有2.22%(3株)的菌株表现为同时对10种抗菌药物耐药。
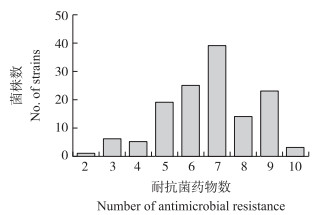
|
图 2 猪源屎肠球菌的多药耐药菌株分布 Fig. 2 Multidrug-resistant(MDR)distributionof E.faecium isolates from pigs |
对111株耐氟苯尼考的屎肠球菌进行酰胺醇类耐药基因fexA、fexB、floR、cfr和optrA的检测, PCR产物的电泳图见图 3, 各耐药基因的检出情况如图 4所示。111株氟苯尼考耐药菌株中, 耐药基因fexB、fexA、optrA、floR和cfr 的携带率分别为58.56%(65)、27.03%(30)、20.72%(23)、17.12%(19)和0.90%(1), 其中60株菌(54.05%)只携带1种耐药基因, 33株菌(29.72%)携带2种耐药基因, 携带3种耐药基因的有4株菌(3.60%), 即97株菌携带相关耐药基因, 与菌株耐药表型的相符率达87.4%, 有14株菌(12.60%)未检测到上述耐药基因。进一步对携带酰胺醇类耐药基因菌株的耐药基因谱进行分析, 结果(表 3)显示共有11种基因谱型, 其中单一的fexB和fexA基因谱型最为常见, 分别占36.04%和10.81%, 发现4株菌同时携带3种耐药基因, 耐药基因谱型为optrA+fexA+fexB。
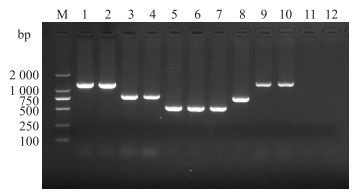
|
图 3 耐药基因fexA、fexB、floR、cfr、optrA的PCR产物电泳图 Fig. 3 Electrophoretogram of PCR products of fexA、fexB、floR、cfr、optrA from part of the strains M:Marker; 1, 2: fexA; 3, 4. fexB; 5-7. floR; 8. cfr; 9, 10. optrA; 11, 12.阴性对照Negative control. |
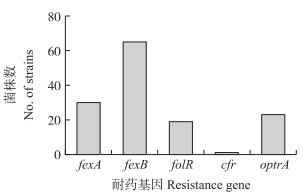
|
图 4 耐氟苯尼考菌株中相关耐药基因的统计 Fig. 4 Numbers of different amphenicols resistancegenes in florfenicol resistance strains |
| 耐药基因Resistance genes | 携带率/%(菌株数)Carrying rate(No. of strains) | MIC范围/(mg·L-1)MIC range |
| fexB | 36.04%(40) | 8~64 |
| fexA | 10.81%(12) | 32~128 |
| fexB, floR | 8.11%(9) | 8~64 |
| optrA, fexA | 8.11%(9) | 32~64 |
| optrA, fexB | 8.11%(9) | 16~64 |
| floR | 6.31%(7) | 8~64 |
| optrA, fexA, fexB | 3.60%(4) | 16~64 |
| fexA, floR | 2.70%(3) | 8~64 |
| fexA, fexB | 1.80%(2) | 32 |
| cfr, fexB | 0.90%(1) | 32 |
| optrA | 0.90%(1) | 32 |
耐药肠球菌感染治疗难度高, 且多重耐药菌株极为常见, 并且耐药基因易通过质粒接合等方式发生水平转移而引起耐药菌株的传播与扩散。对耐药性进行常态化监测, 有助于指导临床医生规范、有效使用抗菌药物。本试验结果显示, 从苏北地区分离的猪源屎肠球菌对红霉素和四环素的耐药率均高于98%。据CHINET报道[9-11], 自2005年以来, 在多家医院分离的人源屎肠球菌对红霉素耐药率一直在88%以上, 本试验结果佐证了屎肠球菌对红霉素的高耐药性。有研究者检测到人源屎肠球菌对四环素的耐药率多为20%~60%[5,24], 与本试验结果有较大差异, 分析主要原因为四环素类抗生素在人医抗感染治疗中应用逐渐减少, 但该类药物仍用于动物的抗感染治疗中, 是动物源细菌对四环素耐药率居高不下的重要原因。本试验中链霉素和庆大霉素的高水平耐药菌株的分离率高达70%以上, 表明氨基糖苷类与青霉素类或糖肽类抗生素合用治疗肠球菌感染已无法获得协同作用。杨青等[10]在中国CHINET的报告中指出, 上海某医院的人源屎肠球菌对万古霉素的耐药率从2005年的0.8%上升至2014年的10.7%。本研究中, 在江苏猪场分离的猪源屎肠球菌中尚未发现耐此药物的菌株, 但同批样品中分离的猪链球菌却检测到了携带耐药基因vanG的万古霉素耐药菌株[25]。因此, 要加强对动物源万古霉素耐药菌株及耐药相关基因的实时监测, 防止耐药菌株在动物群体中传播, 从而造成万古霉素耐药菌株扩散。磷霉素和利奈唑胺为人医临床专用抗菌药, 未批准用于动物, 但本研究中出现了对这2种药物的耐药株, 且2017年的耐药率高于2016年, 需引起足够重视。氟苯尼考是兽医临床中广泛应用的酰胺醇类抗生素, 而本研究中氟苯尼考耐药菌株耐药率高达82.22%, 并且2017年分离株的耐药率高于2016年, 由此推测菌株对氟苯尼考的耐药率有逐年增高的趋势, 该结果说明了对氟苯尼考耐药菌株进行深入研究与紧急预防的必要性。菌株对麻保沙星显现出较高耐药性, 其可能与氟喹诺酮类药物的频繁使用有关。不仅如此, 此次分离的猪源屎肠球菌均为多药耐药菌株, 多药耐药菌株的大量出现, 为临床感染治疗, 尤其是联合用药带来极大的挑战。因此, 相关部门、一线兽医人员应继续加强动物临床抗生素的使用管理, 尤其是要合理使用四环素类、酰胺醇类、大环内酯类、氨基糖苷类等抗生素, 并实时跟踪细菌耐药情况的变化, 研究更科学的感染治疗方案。
鉴于氟苯尼考为兽医临床重要的抗生素, 我们通过检测目前已知的与酰胺醇类抗生素耐药相关的耐药基因, 进一步探讨了屎肠球菌对其耐药性产生的机制。其中fexA、fexB、floR基因均为外排泵编码基因, 通过外排作用减少酰胺醇类药物进入菌株从而产生耐药, 广泛存在于革兰阳性和阴性菌中[16,26]。多重耐药基因cfr可编码rRNA甲基转移酶, 使核糖体23S rRNA的A2503位点腺嘌呤甲基化, 导致靶位修饰, 造成细菌对酰胺醇类、唑烷酮类、林可霉素类、截短侧耳素类和链阳菌素A这5类抗生素耐药, 目前发现该基因在肠球菌中的检出率仍较低[22,27], 本研究也仅检测到1株携带cfr的菌株。耐药基因optrA首次于2015年在粪肠球菌和屎肠球菌中检测到, 其编码的F家族ATP结合盒(ATP-binding cassette, ABC)蛋白可通过与核糖体互作而解除靶向核糖体抗生素与核糖体的结合, 进而使细菌对利奈唑胺、泰地唑胺以及酰胺醇类抗菌药产生耐药性[23]。本试验中, 20.7%的氟苯尼考耐药菌株中检测到该基因, 且发现该基因多数情况与其他耐药基因共存于耐药菌株中, 其传播机制值得深入研究。
总之, 此次针对江苏地区分离的屎肠球菌耐药性的调查结果显示, 屎肠球菌对常用的抗菌药均产生一定程度的耐药性, 尤其对兽医常用抗生素氟苯尼考的耐药率较高, 且87.4%的菌株是因获得外源耐药基因而产生耐药, 并且33.33%(37株)的菌株携带2种以上耐药基因, 该现象应引起重视。因肠球菌中存在可转移的基因元件, 对此若无必要的防范措施, 以可移动基因元件为载体的新型多药耐药屎肠球菌甚至超级细菌的频现将会成为趋势。
| [1] |
Akpaka P E, Kissoon S, Wilson C, et al. Molecular characterization of vancomycin resistant Enterococcus faecium isolates from Bermuda[J]. PLoS One, 2017, 12(3): e0171317. DOI:10.1371/journal.pone.0171317 |
| [2] |
Donald E L, Keller N, Barth A, et al. Clinical prevalence antimicrobial susceptibility and geographic resistance patterns of Enterococci:results from the SENTRY antimicrobial surveillance program, 1997-1999[J]. Clinical Infectious Diseases, 2001, 32(12): 133-145. |
| [3] |
瞿婷婷.多重耐药肠球菌耐药基因筛选及传播机制研究[D].杭州: 浙江大学, 2007. Qu T T. Study on the resistance genes and resistance transmission mechanism in multidrug-resistant Enterococcus[D]. Hangzhou: Zhejiang University, 2007(in Chinese with English abstract). |
| [4] |
廖国林, 刘建, 李芳, 等. 肠球菌属医院感染分布及耐药性分析[J]. 中华医院感染学杂志, 2009, 19(13): 1735-1736. Liao G L, Liu J, Li F, et al. Distribution and drug resistance of Enterococcus in hospital:analysis and prevention[J]. Chinese Journal of Nosocomiology, 2009, 19(13): 1735-1736 (in Chinese with English abstract). DOI:10.3321/j.issn:1005-4529.2009.13.049 |
| [5] |
吴海鹏, 潘国宏. 肠球菌感染的临床分布及耐药性分析[J]. 中国医药指南, 2015, 13(23): 77-78. Wu H P, Pan G H. Clinical distribution and drug resistance analysis of infection by Enterococcus[J]. Guide of China Medicine, 2015, 13(23): 77-78 (in Chinese). |
| [6] |
贾伟, 赵梅, 王文, 等. 肠球菌属耐药性与耐药基因的比较研究[J]. 中华医院感染学杂志, 2015, 25(24): 5551-5554. Jia W, Zhao M, Wang W, et al. Comparative study on drug resistances and drug-resistant genes of Enterococcus species in clinic[J]. Chinese Journal of Nosocomiology, 2015, 25(24): 5551-5554 (in Chinese with English abstract). |
| [7] |
Mutschler M, Trojan S, Defosse J M, et al. Severe sepsis caused by a linezolid-resistant Enterococcus faecium in a 10-year-old girl after multiple trauma[J]. International Journal of Infectious Diseases, 2013, 17: 466-467. DOI:10.1016/j.ijid.2013.01.009 |
| [8] |
Alatorre-Fernández P, Mayoral-Terán C, Velázquez-Acosta C, et al. A polyclonal outbreak of bloodstream infections by Enterococcus faecium in patients with hematologic malignancies[J]. American Journal of Infection Control, 2017, 45: 260-266. |
| [9] |
胡付品, 朱德妹, 汪复, 等. 2015年CHINET细菌耐药性监测[J]. 中国感染与化疗杂志, 2016, 16(6): 685-694. Hu F P, Zhu D M, Wang F, et al. Report of CHINET antimicrobial resistance surveillance program in 2015[J]. Chinese Journal of Infection and Chemotherapy, 2016, 16(6): 685-694 (in Chinese with English abstract). |
| [10] |
杨青, 俞云松, 林洁, 等. 2005-2014年CHINET肠球菌属细菌耐药性监测[J]. 中国感染与化疗杂志, 2016, 16(2): 146-152. Yang Q, Yu Y S, Lin J, et al. Resistance profile of Enterococcus in hospitals across China:results of CHINET antimicrobial resistance surveillance program, 2005-2014[J]. Chinese Journal of Infection and Chemotherapy, 2016, 16(2): 146-152 (in Chinese with English abstract). |
| [11] |
胡付品, 郭燕, 朱德妹, 等. 2016年中国CHINET细菌耐药性监测[J]. 中国感染与化疗杂志, 2017, 17(5): 481-491. Hu F P, Guo Y, Zhu D M, et al. CHINET surveillance of bacterial resistance across China:report of the results in 2016[J]. Chinese Journal of Infection and Chemotherapy, 2017, 17(5): 481-491 (in Chinese with English abstract). |
| [12] |
刘永安, 李学瑞, 周建华, 等. 一株羊源致病性屎肠球菌的分离鉴定及耐药性分析[J]. 中国畜牧兽医, 2017, 44(2): 530-537. Liu Y A, Li X R, Zhou J H, et al. Isolation, identification and drug resistance analysis of pathogenic Enterococcus faecium of sheep[J]. China Animal Husbandry & Veterinary Medicine, 2017, 44(2): 530-537 (in Chinese with English abstract). |
| [13] |
卢彩景, 张秀平, 陈陆, 等. 猪源屎肠球菌致病力与耐药性及生物被膜形成能力的相关性分析[J]. 中国预防兽医学报, 2014, 36(5): 350-353. Lu C J, Zhang X P, Chen L, et al. Correlation analysis among pathogenicity and antibiotic resistance and capability of biofilm formation of Enterococcus faecium isolated from swine[J]. Chinese Journal of Preventive Veterinary Medicine, 2014, 36(5): 350-353 (in Chinese with English abstract). DOI:10.3969/j.issn.1008-0589.2014.05.04 |
| [14] |
Tamang M D, Moon D C, Kim S R, et al. Detection of novel oxazolidinone and phenicol resistance gene optrA in enterococcal isolates from food animals and animal carcasses[J]. Veterinary Microbiology, 2017, 201: 252-256. DOI:10.1016/j.vetmic.2017.01.035 |
| [15] |
刘佳, 陈霞, 赵爱兰, 等. 河南省某地区健康人源及动物源肠球菌种属分布及耐药性差异研究[J]. 中国畜牧兽医, 2014, 41(12): 172-177. Liu J, Chen X, Zhao A L, et al. Study on the differences of prevalence and drug resistance of Enterococcus species of human and animal origins in Henan Province, China[J]. China Animal Husbandry & Veterinary Medicine, 2014, 41(12): 172-177 (in Chinese with English abstract). |
| [16] |
刘凌.不同来源肠球菌的耐药性调查及对氟苯尼考耐药机制的研究[D].郑州: 河南农业大学, 2015. Liu L. Investigation on the resistance situation in enterococci strains from various resources and its resistance mechanism to florfenicol[D]. Zhengzhou: Henan Agricultural University, 2015(in Chinese with English abstract). |
| [17] |
Macovei L, Zurek L. Ecology of antibiotic resistance genes:characterization of Enterococci from houseflies collected in food settings[J]. Applied and Environmental Microbiology, 2006, 72(6): 4028-4035. DOI:10.1128/AEM.00034-06 |
| [18] |
Clinical and Laboratory Standards Institute. Performance standards for antimicrobial disk and diffusion susceptibility tests for bacteria isolated from animals: second informational supplement VET01-S2[R]. Wayne: CLSI, 2013.
|
| [19] |
Clinical and Laboratory Standards Institute. Performance standards for antimicrobial susceptibility testing: twenty-third informational supplement M100-S23[R]. Wayne: CLSI, 2013.
|
| [20] |
Kehrenberg C, Schwarz S. Florfenicol-chloramphenicol exporter gene fexA is part of the novel transposon Tn558[J]. Antimicrobial Agents and Chemotherapy, 2005, 49(2): 813-815. DOI:10.1128/AAC.49.2.813-815.2005 |
| [21] |
Faldynova M, Pravcova M, Sisak F, et al. Evolution of antibiotic resistance in Salmonella enterica serovar typhimurium strains isolated in the Czech Republic between 1984 and 2002[J]. Antimicrobial Agents and Chemotherapy, 2003, 47(6): 2002-2005. DOI:10.1128/AAC.47.6.2002-2005.2003 |
| [22] |
Kehrenberg C, Schwarz S. Distribution of florfenicol resistance genes fexA and cfr among chloramphenicol-resistant Staphylococcus isolates[J]. Antimicrobial Agents and Chemotherapy, 2006, 50(4): 1156-1163. DOI:10.1128/AAC.50.4.1156-1163.2006 |
| [23] |
Wang Y, Lü Y, Cai J C, et al. A novel gene, optrA, that confers transferable resistance to oxazolidinones and phenicols and its presence in Enterococcus faecalis and Enterococcus faecium of human and animal origin[J]. Journal of Antimicrobial Chemotherapy, 2015, 70: 2182-2190. DOI:10.1093/jac/dkv116 |
| [24] |
廖云凤, 罗鹏, 孙珊. 2015年重庆市粪肠球菌和屎肠球菌耐药性监测结果分析[J]. 国际检验医学杂志, 2017, 38(12): 1585-1588. Liao Y F, Luo P, Sun S. Surveillance of antibiotic resistance of Enterococcus faecalis and Enterococcus faecium in Chongqing in 2015[J]. International Journal of Laboratory Medicine, 2017, 38(12): 1585-1588 (in Chinese with English abstract). DOI:10.3969/j.issn.1673-4130.2017.12.001 |
| [25] |
杜凡姝, 吕茜, 段锻, 等. 江苏苏北地区猪链球菌耐药性调查及万古霉素耐药基因检测[J]. 畜牧与兽医, 2018, 50(12): 32-36. Du F S, Lü X, Duan D, et al. Antimicrobial susceptibility and emergence of vancomycin resistance genes in Streptococcus suis[J]. Animal Husbandry & Veterinary Medicine, 2018, 50(12): 32-36 (in Chinese with English abstract). |
| [26] |
陈霞, 刘玉庆, 李文革, 等. 山东省猪源肠球菌酰胺醇类药物耐药表型及耐药机制研究[J]. 中国人兽共患病学报, 2013, 29(10): 959-964. Chen X, Liu Y Q, Li W G, et al. Characterization phenotypes and mechanisms of phenicols resistance among Enterococcus species of swine origin from Shandong Province[J]. Chinese Journal of Zoonoses, 2013, 29(10): 959-964 (in Chinese with English abstract). DOI:10.3969/cjz.j.issn.1002-2694.2013.10.005 |
| [27] |
赵丽青.广东某猪场噁唑烷酮类耐药基因optrA的流行特点[D].广州: 华南农业大学, 2016. Zhao L Q. The epidemic characteristics of oxazolidinone-resistant gene optrA in a pig farm in Guangdong[D]. Guangzhou: South China Agricultural University, 2016(in Chinese with English abstract). |




