文章信息
- 肖航, 王换换, 王凯, 张源淑
- XIAO Hang, WANG Huanhuan, WANG Kai, ZHANG Yuanshu
- 猪血管紧张素转化酶2重组蛋白诱导表达和纯化条件的优化
- The expression and optimization of purifying recombinant conditions of the recombinant ACE2 protein of porcine
- 南京农业大学学报, 2019, 42(2): 316-321
- Journal of Nanjing Agricultural University, 2019, 42(2): 316-321.
- http://dx.doi.org/10.7685/jnau.201802018
-
文章历史
- 收稿日期: 2018-02-09
血管紧张素转化酶2(angiotensin converting enzyme 2, ACE2)是2000年Tipnis等[1]发现的肾素-血管紧张素系统(RAS)的重要调控因子之一。完整的人ACE2蛋白由805个氨基酸组成, 相对分子质量(90~120)×103, 蛋白多肽链包含1个N末端的信号肽区、1个锌结合区和1个锚定在细胞膜上的C末端区, 属跨膜蛋白, 其基因定位在X染色体上[2]。研究已经证实ACE2广泛存在于人和老鼠的心、肝、肺、肾等器官组织中[3], 其主要功能是将血管紧张素Ⅱ(AngⅡ)水解成血管紧张素1~7(Ang1—Ang7), 后者与Mas受体结合, 发挥对AngⅡ信号级联反应的抑制作用, 如舒张血管、抗损伤等多种作用[3-4], 展现出巨大的研究潜力。
2000年至今, 有关ACE2的研究非常活跃, 研究涉及了心血管、呼吸道、消化道及肝脏等系统或组织器官, 对ACE2的抗损伤、抗炎、SARS冠状病毒受体作用及肠道氨基酸转运等方面的功能研究取得了许多重要成果, 其多方面的功能作用得到广泛认可[5-7], 但以上研究仅限于人医临床, 且研究对象多限于人和鼠, 对其他动物的研究较少, 而ACE2在动物方面的研究值得关注。
本试验以猪为研究对象, 运用传统的分子生物学等方法对本实验室前期构建的猪pET-32a-ACE2重组质粒, 通过改变IPTG浓度及诱导时间, 筛选获得猪pET-32a-ACE2重组蛋白的最佳诱导表达条件, 并对获得的目的蛋白包涵体的纯化方法进行优化, 以建立一种简单、经济、有效的获得目的蛋白和纯化融合蛋白包涵体的最优方法, 为后期猪ACE2多克隆抗体的制备以及其在猪体内的分布、生物学活性及作用研究奠定基础。
1 材料与方法 1.1 试剂与仪器感受态表达菌大肠杆菌(Escherichia coli)BL21(DE3)(南京诺唯赞生物科技有限公司); 猪ACE2蛋白阳性质粒pET-32a-ACE2 (南京农业大学动物生理生化重点实验室构建); 兔抗鼠ACE2多克隆抗体(Santa Cruse公司); 辣根酶标记的山羊抗兔IgG(Sigma公司); 考马斯亮蓝R250(上海瑞永生物科技有限公司); 蛋白胨、酵母粉、LB培养基(OXOID公司); Ampicillin、异丙基硫代-β-D-半乳糖苷(IPTG)(Amresco公司); HisPurTMNi2+-NTA Chromatography Cartridges(赛默飞世而科技公司); 其余试剂均为国产分析纯。
POWER-PAC 300电泳仪(BIO-RAD); Mini-PROTEAN 3垂直电泳槽(Cell BIO-RAD); DYY-11型水平电泳槽(北京六一仪器厂); AKTA蛋白纯化仪(GE医疗生命科学); 5804R Eppendorf离心机(北京博仪恒业科技发展有限公司); JS-380自动凝胶图像分析仪(上海培清科技有限公司); SW-CJ-2FD型双人单面净化工作台(江苏净化设备有限公司)。
1.2 重组蛋白表达条件的探究取少量经双酶切和测序鉴定的阳性重组质粒pET-32a-ACE2, 转化感受态BL21(DE3), 挑选单个白色菌落接种于含Ampicillin(100 μg · mL-1)的LB液体培养基中培养过夜。取菌液按1 : 100(体积比)的比例接种于新鲜的含相同浓度抗生素的LB液体培养基中, 于摇床中37 ℃培养至D600接近0.6时, 取2 mL菌液作为诱导前对照, 其余菌液分装于7支试管中, 加入IPTG, 使各管IPTG终浓度分别为0.125、0.25、0.5、1.0、2.0、4.0和8.0 mmol · mL-1, 24 ℃, 振荡培养。分别收取IPTG诱导后2、4、6、8、10 h及过夜诱导菌液各2 mL, 8 000 r · min-1离心20 min, 收集菌体。
将各时间点收集的菌体重悬于200 μL PBS中吹散混匀, 各取20 μL分别加入5 μL 5×蛋白电泳上样缓冲液, 置沸水浴中煮5 min, 用50 g · L-1的浓缩胶和120 g · L-1的分离胶进行SDS-PAGE鉴定。电泳结果用凝胶成像系统采集图像。
1.3 重组蛋白表达形式的鉴定根据1.2节结果选取表达量高的IPTG刺激浓度以及时间进行目的蛋白的大量诱导表达, 菌液以8 000 r · min-1离心20 min, 收集菌体沉淀, 用PBS重悬并洗涤2次, 菌体重悬于适量PBS中, 超声破碎(冰浴条件下进行)离心后的菌体上清液和沉淀经SDS-PAGE进行鉴定。
1.4 KCl染色切胶纯化包涵体蛋白采用于在江等[8]的方法, 配制SDS-PAGE 120 g · L-1的分离胶和50 g · L-1的浓缩胶, 上样, 加入蛋白标准品作为对照, 按常规方法进行SDS-PAGE。电泳完毕, 将胶放入0.25 mol · L-1KCl溶液中脱色约10 min后, 切下染成银白色的目的条带且用PBS洗3次后碾碎, 加入500 μL PBS振荡混匀, -20 ℃反复冻融3次, 12 000 r · min-1离心2 min, 取上清液用于进行SDS-PAGE电泳检测纯化效果。
1.5 Ni2+-NTA亲和柱纯化包涵体蛋白根据1.2节方法, 超声破碎离心后收集菌液沉淀, 沉淀加入包涵体溶解缓冲液经4 ℃、12 000 r · min-1离心20 min, 收集上清液并经0.45 μm滤器过滤至新离心管中, 经AKTA蛋白纯化仪进行目的蛋白纯化, SDS-PAGE电泳检测纯化效果。
1.6 重组蛋白的Western blot检测将KCl染色切胶纯化后的重组蛋白进行SDS-PAGE, 然后将凝胶上的相应条带转印至PVDF膜上, 湿转后的PVDF膜置于含50 g · L-1脱脂奶粉的TBST液中, 室温封闭2 h, 然后转入用TBST液按1 : 500倍稀释的兔抗鼠ACE2多克隆抗体中, 4 ℃过夜, 用TBST液洗膜5次, 再转入用TBST液按1 : 5 000稀释的辣根过氧化物酶(HRP)标记的山羊抗兔IgG中, 室温孵育2 h, TBST液洗膜3次后于全自动化学发光图像分析系统中观察。
2 结果与分析 2.1 目的蛋白诱导表达最佳条件的筛选 2.1.1 不同浓度IPTG诱导ACE2蛋白在BL21(DE3)中的表达重组表达菌在IPTG诱导6 h时, 收集不同终浓度IPTG刺激后的表达产物进行SDS-PAGE分析(图 1)。由图 1可以看出:IPTG诱导表达前, 在100×103处未见蛋白表达带, 但由不同浓度IPTG(8.0、4.0、2.0、1.0、0.5、0.25、0.125和0 mmol · L-1)诱导表达后均获得大小约为100×103的目的蛋白。当IPTG终浓度为1.0 mmol · L-1时, 目的蛋白表达量较高, 且随着IPTG浓度增高, 蛋白表达量未见明显增加。认为1.0 mmol · L-1 IPTG为诱导表达最适浓度。
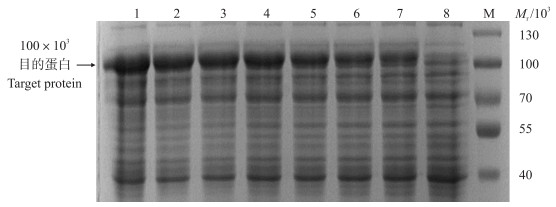
|
图 1 不同浓度IPTG诱导ACE2蛋白在大肠杆菌BL21(DE3)上的表达 Fig. 1 Expression of pET-32a-ACE2 fusion protein in Escherichia coli BL21(DE3)induced by different concentrations of IPTG M.蛋白分子质量标准品; 1~7. IPTG诱导浓度分别为8.0、4.0、2.0、1.0、0.5、0.25、0.125和0 mmol · L-1的表达产物; 8.IPTG诱导前表达。 M. Protein molecular weight marker; 1-7. Recombinant pET-32a-ACE2 expression products in E.coli BL21(DE3)induced with IPTG at 8.0, 4.0, 2.0, 1.0, 0.5, 0.25, 0.125 and 0 mmol · L-1; 8. Expression of pET-32a-ACE2 fusion protein before induced with IPTG. |
重组表达菌经终浓度1.0 mmol · L-1 IPTG分别诱导培养0、2、4、6、8、10 h及过夜, 收集表达产物经SDS-PAGE分析(图 2)。由图 2看出:当诱导时间为10 h时, 目的蛋白表达量最高(泳道6)。

|
图 2 IPTG诱导不同时间ACE2蛋白在E.coli BL21(DE3)上的表达 Fig. 2 Eexpression of pET-32a-ACE2 induced by IPTG at different time in E.coli BL21(DE3) M.蛋白分子质量标准品; 1~7.分别为诱导0、2、4、6、8、10 h以及过夜的表达产物。 M. Protein molecular weight marker; 1-7. Recombinant pET-32a-ACE2 expression products in E.coli BL21(DE3)induced with IPTG at 0, 2, 4, 6, 8, 10 h and overnight. |
取1.0 mmol · L-1 IPTG, 诱导10 h后产物经超声破碎离心后的菌体上清液和沉淀进行SDS-PAGE分析, 结果如图 3显示:诱导后pET-32a-ACE2重组菌表达产物(泳道1)以及破碎后的表达产物(泳道2)均在相对分子质量约100×103处有1条特异性表达带, 且菌体沉淀(泳道4)中目的蛋白含量显著高于上清液(泳道3)中, 说明pET-32a-ACE2重组蛋白主要以包涵体的形式存在于菌体沉淀中。
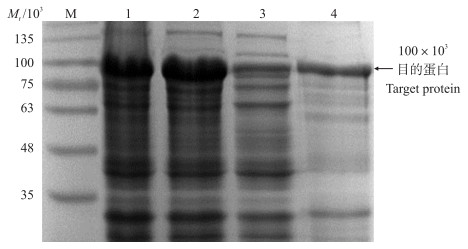
|
图 3 超声破碎后重组蛋白pET-32a-ACE2的SDS-PAGE图 Fig. 3 Solubility analysis of pET-32a-ACE2 fusion protein M.蛋白分子质量标准品; 1.诱导后pET-32a-ACE2重组菌表达产物; 2.诱导后pET-32a-ACE2重组菌超声破碎表达产物; 3.诱导后pET-32a-ACE2重组菌体超声破碎上清液; 4.诱导后pET-32a-ACE2重组菌体超声破碎沉淀。 M. Protein molecular weight marker; 1. Recombinant bacterium; 2. Expression products of pET-32a-ACE2 recombinant bacteria induced by ultrasonic fragmentation; 3.The upernatant of pET-32a-ACE2 recombinant bacteria induced by ultrasonic fragmentation; 4.The deposit of pET-32a-ACE2 recombinant bacteria induced by ultrasonic fragmentation. |
收集Ni2+-NTA亲和柱纯化重组蛋白进行SDS-PAGE电泳, 结果(图 4-A)显示:用Ni2+-NTA亲和柱纯化包涵体蛋白后, 除在100×103左右处可见蛋白表达带外, 在(25~75)×103之间均有多条杂蛋白, 且目的蛋白损失较多, 说明Ni2+-NTA亲和柱纯化此包涵体蛋白效果不佳。

|
图 4 Ni2+-NTA亲和柱(A)和KCl染色切胶(B)纯化pET-32a-ACE2包涵体蛋白SDS-PAGE图 Fig. 4 pET-32a-ACE2 inclusion body protein purified by Ni2+-NTA affinity column(A)and KCl staining(B) A:M.蛋白分子质量标准品; 1~4. Ni2+-NTA亲和柱纯化pET-32a-ACE2包涵体蛋白。B:M.蛋白分子质量标准品; 1.诱导后pET-32a-ACE2重组菌表达产物; 2.诱导后pET-32a-ACE2重组菌超声破碎表达产物; 3.KCl染色切胶纯化pET-32a-ACE2重组蛋白; 4.KCl染色切胶纯化pET-32a-ACE2重组蛋白后反复冻融3次。 A:M.Protein molecular weight marker; 1-4.pET-32a-ACE2 inclusion body protein eluted by Ni2+-NTA. B:M.Protein molecular weight marker; 1.Recombinant bacterium; 2.Expression products of pET-32a-ACE2 recombinant bacteria induced by ultrasonic fragmentation; 3.Recombinant pET-32a-ACE2 fusion protein obtained were purified by KCl gel slices; 4.Recombinant pET-32a-ACE2 fusion protein obtained were purified by KCl gel slices through freezing and thawing 3 times repeatly. |
将得到的包涵体蛋白经KCl染色切胶纯化, 纯化结果(图 4-B)显示:相比于未纯化组(泳道1、2), 经KCl染色切胶纯化组(泳道3、4)在100×103左右处有1个较为单一的目的蛋白条带, 且此处获得的纯化蛋白含量较高。
2.4 KCl切胶纯化蛋白的Western blot鉴定进一步对KCl切胶纯化蛋白进行Western blot检测, 结果如图 5所示:相比于未纯化组, 经KCl染色切胶纯化目的蛋白具有较为单一的条带, 说明本试验中经KCl切胶纯化后的蛋白能够与羊抗兔的ACE2多克隆抗体特异性结合, 在相对分子质量约100×103处出现特异条带, 且具有良好的抗原性, 与预期结果一致。

|
图 5 pET-32a-ACE2重组蛋白的Western bolt鉴定 Fig. 5 Identification of pET-32a-ACE2 recombinant protein by Western bolt 1. KCl染色切胶纯化pET-32a-ACE2重组蛋白; 2.重组蛋白纯化前样品。 1. Recombinant pET-32a-ACE2 fusion protein obtained was purified by KCl gel slices; 2. Recombinant pET-32a-ACE2 fusion protein before purification. |
原核表达系统具有操作方便、快捷, 需时较短, 表达量大, 适合工业化生产等优点, 是蛋白表达和生物合成最常用的方法。其中, 大肠杆菌原核表达系统发展最为迅速、成熟, 因为其具有操作方便、遗传背景明确、表达量高且试验成本低等优点, 而成为目前研究较为深入并最常用的表达系统之一[9-10]。本研究在成功构建猪pET-32a-ACE2原核表达载体的基础上, 利用大肠杆菌表达系统对ACE2基因进行原核表达, 得到预期目的蛋白ACE2。进一步通过设置不同终浓度IPTG以及不同诱导时间诱导重组蛋白, 筛选出目的蛋白在E.coli BL21(DE3)中表达量最高的条件是:IPTG终浓度1.0 mmol · L-1、诱导时间10 h。
大肠杆菌原核表达系统的缺点之一是其表达的蛋白较多以包涵体形式存在, 给后续纯化有活性的可溶性蛋白工作带来不便。本研究尝试了2种纯化该包涵体蛋白的方法:传统的亲和层析Ni-NTA法和KCl染色切胶纯化方法, 结果表明前者的纯化效果不佳, 且蛋白损失较多, 不能满足后续动物免疫等的研究要求。
切胶纯化包涵体的方法是目前国内外已逐步采用的方法[11]。如国外有推荐采用的考马斯亮蓝R-250染色切胶的方法, 虽快速, 但所得蛋白质的一级结构会受影响[12]; 于在江等[8]以马传染性贫血病毒重组表达的衣壳蛋白P26为例, 用醋酸钠(NaAc)染色切胶纯化法成功纯化了P26, 且保持了其原有的抗原性, 为切胶纯化蛋白提供了一个新方法。范贵荣等[13]进一步应用此法纯化了幽门螺旋杆菌VacA-HpaA融合蛋白, 但由于其染色、电泳、透析等过程耗时长, 影响了获得目的蛋白的纯化效率和成本。为此, 在该方法基础之上, 高慎阳等[14]通过以KCl取代NaAc染色目的蛋白、反复冻融后快速离心等操作步骤取代原来的电泳后过夜透析等试验步骤, 在不降低浓度和纯度的基础上节省了时间和成本。本试验选用KCl染色切胶法对表达的pET-32a-ACE2重组蛋白进行了纯化且与Ni2+-NTA法进行了比较, 发现此方法不仅提高了目的蛋白浓度, 且获得了条带单一的目的蛋白, 纯化效果明显优于Ni2+-NTA法。
综上, 本试验对猪pET-32a-ACE2重组蛋白诱导条件进行了优化, 并成功建立了KCl染色切胶纯化重组蛋白包涵体的有效方法, 为ACE2在动物上的进一步研究奠定了基础。
| [1] |
Tipnis S R, Hooper N M, Hyde R, et al. A human homolog of angiotensin-converting enzyme. Cloning and functional expression as a captopril-insensitive carboxypeptidase[J]. J Biol Chem, 2000, 275(43): 33238-33243. DOI:10.1074/jbc.M002615200 |
| [2] |
Lambert D W, Clarke N E, Turner A J. Not just angiotensinases:new roles for the angiotensin-converting enzymes[J]. Cell Mol Life Sci, 2010, 67: 89-98. DOI:10.1007/s00018-009-0152-x |
| [3] |
翁智远, 晋学庆, 吴可贵. 肾素-血管紧张素系统的重大发现—ACE2与Ang(1~7)[J]. 高血压杂志, 2004, 12(3): 191-193. Weng Z Y, Jin X Q, Wu K G. Major findings of the renin-angiotensin system:ACE2 and Ang(1-7)[J]. Chinese Journal of Hypertension, 2004, 12(3): 191-193 (in Chinese). DOI:10.3969/j.issn.1673-7245.2004.03.003 |
| [4] |
Pei Z, Meng R, Li G, et al. Angiotensin-(1-7)ameliorates myocardial remodeling and interstitial fibrosis in spontaneous hypertension:role of MMPs/TIMPs[J]. Toxicol Lett, 2010, 199(2): 173-181. DOI:10.1016/j.toxlet.2010.08.021 |
| [5] |
Wang K, Liu X, Xiao H, et al. The correlation between inflammatory injury induced by LPS and RAS in EpH4-Ev cells[J]. Int Immunopharmacol, 2017, 46: 23-30. DOI:10.1016/j.intimp.2017.02.016 |
| [6] |
Yu X B, Lin Q, Qin X, et al. ACE2 antagonizes VEGFa to reduce vascular permeability during acute lung injury[J]. Cellular Physiology and Biochemistry, 2016, 38(3): 1055-1062. DOI:10.1159/000443056 |
| [7] |
Hashimoto T, Perlot T, Rehman A, et al. ACE2 links amino acid malnutrition to microbial ecology and intestinal inflammation[J]. Nature, 2012, 487(7408): 477-481. DOI:10.1038/nature11228 |
| [8] |
于在江, 马学恩, 周建华. 切胶纯化表达蛋白包涵体的可行性分析[J]. 生物技术, 2007, 17(3): 46-48. Yu Z J, Ma X E, Zhou J H. A modified method for purification of inclusion bodies proteins in gel slices[J]. Biotechnology, 2007, 17(3): 46-48 (in Chinese with English abstract). |
| [9] |
柴燕涛, 姜棋予, 谢国明, 等. 包涵体蛋白3种纯化方法的比较[J]. 中国医药导报, 2016, 13(10): 4-6. Chai Y T, Jiang Q Y, Xie G M, et al. Comparison of three methods for purification of inclusion body protein[J]. China Medical Herald, 2016, 13(10): 4-6 (in Chinese with English abstract). |
| [10] |
Herget-Rosenthal S, Feldkamp T, Volbracht L, et al. Measurement of urinary cystatin C by particle-enhanced nephelometric immunoassay:precision, interferences, stability and reference range[J]. Annals of Clinical Biochemistry, 2004, 41(2): 111-118. DOI:10.1258/000456304322879980 |
| [11] |
肖航, 王凯, 王换换, 等. 真核表达质粒pcDNA.3.1(+)-ACE2的构建及其在CHO细胞中的表达[J]. 畜牧与兽医, 2018, 50(1): 54-58. Xiao H, Wang K, Wang H H, et al. Construction of eukaryotic expression plasmid pcDNA3.1(+)-ACE2 and its expressions in CHO cells[J]. Animal Husbandry & Veterinary Medicine, 2018, 50(1): 54-58 (in Chinese with English abstract). |
| [12] |
Bio-Rad Laboratories. Model 422 electro-eluter instruction manual[Z]. Hercules: Bio-Rad Laboratories, 2005: 1-11.
|
| [13] |
范贵荣, 杨致邦, 田一玲, 等. 两种纯化幽门螺旋杆菌VacA-HpaA融合蛋白包涵体方法的比较[J]. 中国病原生物学杂志, 2009, 4(2): 81-84. Fan G R, Yang Z B, Tian Y L, et al. Comparison of two methods of purifying recombinant VacA-HpaA fusion protein inclusion bodies of Helicobacter pylori[J]. Journal of Pathogen Biology, 2009, 4(2): 81-84 (in Chinese with English abstract). |
| [14] |
高慎阳, 李一经. 猪流行性腹泻病毒重组M蛋白膜外区原核表达IPTG最佳诱导条件的确定[J]. 中国畜禽种业, 2008, 4(7): 75-76. Gao S Y, Li Y J. Determination of optimal inducing conditions for IPTG expression of recombinant M protein of porcine epidemic diarrhea virus[J]. The Chinese Livestock and Poultry Breeding, 2008, 4(7): 75-76 (in Chinese). DOI:10.3969/j.issn.1673-4556.2008.07.051 |




