文章信息
- 张晨智, 张旭, 陈抒瑶, 沈宗专, 李荣, 薛超, 沈其荣
- ZHANG Chenzhi, ZHANG Xu, CHEN Shuyao, SHEN Zongzhuan, LI Rong, XUE Chao, SHEN Qirong
- 健康与发病香蕉植株内生细菌菌群差异
- Endophytic bacterial community between healthy and diseased banana plants
- 南京农业大学学报, 2019, 42(2): 284-291
- Journal of Nanjing Agricultural University, 2019, 42(2): 284-291.
- http://dx.doi.org/10.7685/jnau.201804036
-
文章历史
- 收稿日期: 2018-04-23
香蕉是我国第四大宗水果, 也是国内消费和创收的重要资源, 其经济地位极其重要[1]。由尖孢镰刀菌古巴专化型4号小种(Fusarium oxysporum f. sp. cubense race 4)引发的香蕉枯萎病, 已造成香蕉的种植区域逐年减少, 对我国香蕉种植基地构成严重威胁, 因此针对香蕉枯萎病防治工作的研究非常重要[2]。
香蕉枯萎病的传统防治手段有农艺措施防控、化学防治等。这些措施增加了种植园成本, 容易造成农药残留和环境污染等问题, 因此不能在香蕉种植园大范围推广[3]。生物防治是一种利用生物物种间的相互关系, 以一种或一类微生物抑制另一种或另一类微生物的防治方法, 由生防菌剂结合有机肥二次发酵研制的微生物有机肥通过促进生防菌定殖, 分泌抗菌活性物质有效抑制或杀死病原微生物, 具有环保、经济、长效等特点, 因此成为香蕉枯萎病防控的有效方法[4]。
内生菌是一类既与宿主存在竞争又和谐共处的微生物[5]。宿主通过提供养分帮助内生菌繁殖, 内生菌提供次级活性物质(如抗生素、激素), 促进宿主生长, 并增加宿主免疫力。由于这种互惠互利的密切联系, 植物内生菌成为筛选生防菌的重要来源[6]。王梦颖[7]通过T-RFLP技术研究易感与抗病香蕉品种在健康和发病状态下内生细菌群落结构, 发现健康香蕉易感品种内生细菌群落丰度高于健康香蕉抗病品种, 发病香蕉抗病品种内生细菌群群落丰度高于发病香蕉易感品种。然而, 目前对于病原菌入侵后香蕉植株根、茎、叶内生细菌群落结构的研究还很少。本研究运用MiSeq高通量测序分析健康和发病‘巴西香牙蕉’植株根、茎、叶内生细菌群落结构差异, 为生防菌筛选和防控香蕉枯萎病提供理论依据。
1 材料与方法 1.1 试验材料与处理香蕉品种为‘巴西香牙蕉’(Musa AAA cavendish cv. Brazil), 于抽蕾后采集于海南省乐东县(109°17′E, 18°73′N)香蕉枯萎病防控长期定位试验点。在香蕉枯萎病高发田块随机各采集4株健康与发病香蕉植株根、茎和叶。处理设置为:RD:发病香蕉植株根部; RH:健康香蕉植株根部; SD:发病香蕉植株茎部; SH:健康香蕉植株茎部; LD:发病香蕉植株叶部; LH:健康香蕉植株叶部。以上样品分别于4 ℃保存。
1.2 试验方法 1.2.1 表面消毒将健康与发病香蕉植株根、茎、叶组织分别转移至2%(体积分数)次氯酸钠溶液中充分浸泡15 min, 用无菌水冲洗5次后转移至70%(体积分数)乙醇溶液中充分浸泡5 min, 后用无菌水冲洗7次, 用无菌吸水纸吸干表层水分后待用[7]。
1.2.2 样品研磨与DNA提取在无菌操作台中将4株健康与发病香蕉植株根、茎、叶剪成长约1 cm的组织块, 转移至灭菌研钵中, 添加液氮, 使用研磨棒研磨, 直至粉末状, 将粉末转移至50 mL灭菌离心管中用于DNA提取。使用Mobio强力土壤DNA提取试剂盒(MoBio Laboratories, USA)提取DNA, 具体步骤参照产品说明书。
1.2.3 细菌16S rRNA基因扩增与MiSeq高通量测序PCR引物采用314F:5′-GTGCCAGCMGCCGCGGTAA-3′和806R:5′-GGACTACHVGGGTWTCTAAT-3′, 扩增片段大小为500 bp。PCR反应体系:DNA模板2 μL, 10×PCR Buffer 2.5 μL, dNTP 2 μL, 引物各1 μL, Taq酶(TaKaRa宝生物公司)0.2 μL, ddH2O 16.3 μL。PCR反应条件:95 ℃ 4 min; 95 ℃ 40 s, 55 ℃ 45 s, 72 ℃ 30 s, 30个循环; 72 ℃ 10 min。
MiSeq高通量测序由南京佰恩生物科技有限公司完成。基于Qiime[8]对高通量数据进行分析, 主要处理步骤如下:首先将MiSeq正、反序列进行拼接, 去除两端引物、短序列(小于200 bp)和低质量序列(Q < 26), 然后用Uchime程序去除嵌合体序列, 根据序列间的相似度获得OTU(operation taxonomy unit)信息(相似度cutoff 97%), 对OTU代表序列进行鉴定获得类群分类信息, 去除叶绿体和线粒体信息后将各样品序列数抽平用于后续分析。
具体的分析步骤如下:1)计算各样品的Chao1丰富度指数和Shannon多样性指数, 以表征样品间的alpha多样性差异; 2)基于Bary-Curtis距离用非度量多维尺度(nonmetric multidimensional scaling, NMDS)分析比较样品间群落组成的beta多样性差异[9]; 3)基于Bary-Curtis距离进行多元回归树(multivariate regression tree, MRT)分析, 检验健康水平和香蕉植株部位对香蕉植株内生细菌群落组成的影响[10]; 4)通过相似性分析(analysis of similarity, ANOSIM)[11]和置换多元方差分析(permutational multivariate analyses of variance, PERMANOVA)[12]检测样品间微生物群落差异的显著性; 5)通过维恩图(venn diagram)比较健康与发病香蕉植株各部位群落结构差异。序列保存在NCBI Sequence Read Archive(SRA)数据库, 登录号为SRP140417。
1.3 数据统计与分析采用Excel 2016和SPSS 20.0软件进行数据统计与分析。用单因素方法分析(ANOVA)和t测验(t-test)对数据进行比较, 通过Duncan’s新复极差法检验处理间差异的显著性水平。
2 结果与分析 2.1 香蕉植株内生细菌群落alpha多样性分析由图 1可知:发病香蕉植株根、茎和叶中内生细菌菌群多样性分别是6.86、5.08和5.35, 而健康香蕉菌群多样性分别是6.11、2.50和5.49, 发病香蕉植株茎中内生细菌菌群多样性显著高于健康香蕉植株茎(P < 0.05)。在健康香蕉植株中, 根和叶中内生细菌群多样性没有显著性差异, 茎中内生细菌菌群多样性显著低于根及叶(P < 0.05);发病香蕉根中内生细菌菌群多样性显著高于茎和叶, 叶与茎中内生细菌菌群多样性没有显著性差异。
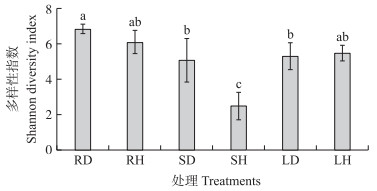
|
图 1 健康与发病香蕉不同部位内生细菌菌群多样性分析 Fig. 1 Analysis of endophytic bacterial community diversity between different parts of healthy and diseased banana RD:发病香蕉植株根部; RH:健康香蕉植株根部; SD:发病香蕉植株茎部; SH:健康香蕉植株茎部; LD:发病香蕉植株叶部; LH:健康香蕉植株叶部。不同字母表示处理间在0.05水平差异显著。下同。 RD:Diseased banana plant root; RH:Healthy banana plant root; SD:Diseased banana plant stem; SH:Healthy banana plant stem; LD:Diseased banana plant leaf; LH:Healthy banana plant leaf. Different letters indicate significant differences in different treatment at 0.05 level. The same as follows. |
从图 2可知:发病香蕉植株根、茎内生细菌菌群丰富度分别是1 226和731, 均显著高于健康香蕉, 发病香蕉植株叶中内生细菌菌群丰富度是447, 高于健康香蕉(P>0.05)。发病香蕉植株3个部位中, 根内生细菌菌群丰富度最高(1 226), 其次是茎(731), 最低是叶(447);健康香蕉植株3个部位中, 根中内生细菌菌群丰富度最高(671), 其次是叶(370), 最低是茎(237)。
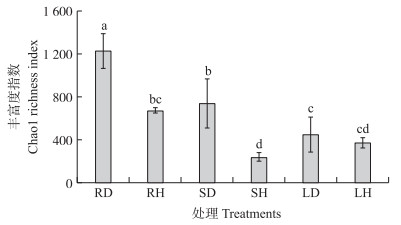
|
图 2 健康与发病香蕉不同部位内生细菌菌群丰富度分析 Fig. 2 Analysis of endophytic bacterial community richness between different parts of healthy and diseased banana |
不同健康水平和植株部位对香蕉植株内生细菌群落结构都有显著影响。NMDS排序分析(图 3)表明, 健康香蕉与发病香蕉植株沿NMDS1轴显著区分(PERMANOVA, pseudo-F=6.289, P < 0.001;ANOSIM, P < 0.001);健康香蕉与发病香蕉植株根、茎、叶沿NMDS2区分(PERMANOVA, pseudo-F=3.205 6, P < 0.001;ANOSIM, P < 0.001)。健康香蕉植株各部位重复性较高, 发病香蕉植株根、茎、叶内部较为离散, 其中发病香蕉植株茎离散性最大; 香蕉植株根、茎、叶的内生细菌群落结构差异显著; 健康与发病香蕉植株内生细菌群落结构差异显著。
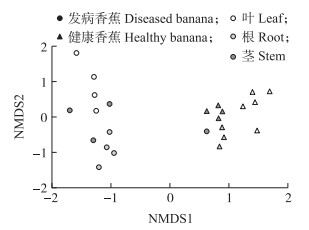
|
图 3 健康与发病香蕉植株根、茎、叶内生细菌菌群组成非度量多维尺度分析 Fig. 3 Nonmetric multidimensional scaling(NMDS)ordinations of root, stem and leaf endophytic bacterial community composition between healthy and diseased banana |
从图 4可知:基于Bary-Curtis距离进行的多元回归树(MRT)分析解释了香蕉内生细菌群落组成总变异的65.1%。香蕉植株内生细菌群落首先根据健康和发病香蕉处理分成2个分支, 然后再依据香蕉不同部位进行区分, 获得6个分支, 分别为发病香蕉植株根部(RD)、发病香蕉植株茎部(SD)、发病香蕉植株叶部(LD)、健康香蕉植株根部(RH)、健康香蕉植株茎部(SH)、健康香蕉植株叶部(LH)。结果表明:香蕉的健康水平是香蕉内生细菌群落差异的最主要原因, 不同香蕉部位对菌群具有一定的选择能力。
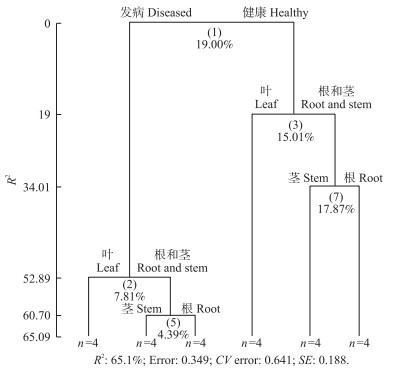
|
图 4 健康与发病香蕉植株各部位内生细菌群落组成的多元回归树 Fig. 4 Multivariate regresson tree(MRT)of endophytic bacterial community in various parts of healthy and diseased banana 回归树中分叉点上的数字表示被解释的方差比例。Numbers under the crosses of each split indicate percentage of variance explained by the split. |
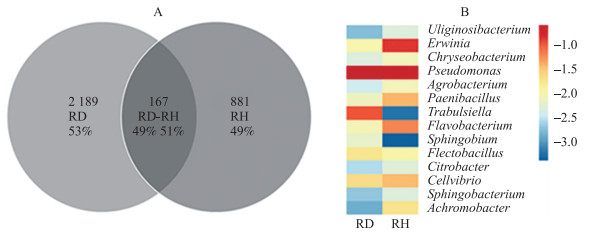
由图 5-A可知:健康与发病香蕉植株根部共有的OTU为167个, 分别占健康和发病香蕉植株根部序列的51%和47%。欧文氏菌属(Erwinia)、类芽胞杆菌属(Paenibacillus)、黄杆菌属(Flavobacterium)在健康香蕉植株根部内生细菌中相对丰度较高(P < 0.05), 特布尔西氏菌属(Trabulsiella)在健康香蕉植株根部内生细菌中相对丰度较低(P < 0.05)(图 5-B)。
|
图 5 健康与发病香蕉植株根部OTU(A)及共有OTU属(B)水平分析 Fig. 5 Analysis of OTU(A)and common OTU genus(B)between healthy and diseased banana plant root 图 5-A中数值代表OTU数目, 百分比代表这些OTU所包含的序列数占各样品总序列数的比例。下同。 The numbers in Fig. 5-A represent the OTU number. The percentages represent the proportion of the reads of these OTU in each sample. The same as follows. |
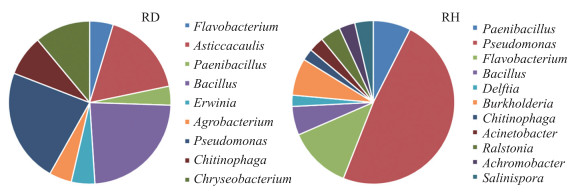
健康与发病香蕉植株根部特有OTU分别为881和2 189个, 占健康与发病香蕉植株根部序列的49%和53%(图 5-A)。代尔夫特菌属、不动杆菌属(Acinetobacter)、芽胞杆菌属、海洋放线菌属是健康香蕉植株根部(RH)内生细菌特有属(图 6)。不黏柄菌属是发病香蕉植株根部(RD)内生细菌特有属。综上所述, 健康与发病香蕉植株根具有不同的内生细菌群落, 病原菌入侵降低了香蕉植株根对外源菌的选择能力。
|
图 6 健康与发病香蕉植株根部特有OTU属水平分析 Fig. 6 Analysis of unique OTU sequence between healthy and diseased banana plant root in genus level |
由图 7-A可知:健康与发病香蕉植株茎部共有OTU 120个, 分别占健康和发病香蕉植株茎部序列的90%和66%。对这部分OTU分析发现:欧文氏菌属在健康香蕉植株茎部内生细菌中相对丰度较高(P < 0.05), 假单胞菌属(Pseudomonas)、克雷伯氏菌属(Klebsiella)、特布尔西氏菌属在健康香蕉植株茎部内生细菌中相对丰度较低(P < 0.05)(图 7-B)。

|
图 7 健康与发病香蕉植株茎部OTU(A)及共有OTU属(B)水平分析 Fig. 7 Analysis of OTU(A)and common OTU genus(B)between healthy and diseased banana plant stem |
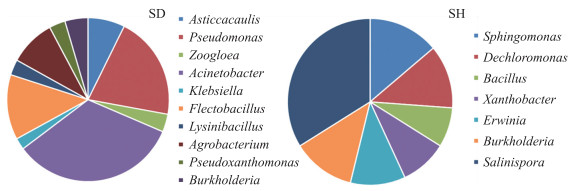
健康与发病香蕉植株茎部特有OTU分别有309和1 137个, 占健康与发病香蕉植株茎部样品序列的10%和34%(图 7-A)。芽胞杆菌、海洋放线菌属为健康香蕉植株茎部(SH)内生细菌特有属(图 8); 不黏柄菌属、动胶菌属、弯曲杆菌属(Flectobacillus)、梭形杆菌属(Lysinibacillus)、黄假单胞菌属(Pseudoxanthomonas)为发病香蕉植株茎部(SD)内生细菌特有属(图 8)。综上所述, 健康与发病香蕉植株茎具有不同的内生细菌群落, 病原菌入侵降低香蕉植株茎部对外源菌的选择能力。
|
图 8 健康与发病香蕉植株茎部特有OTU属水平分析 Fig. 8 Analysis of unique OTU sequence between healthy and diseased banana plant stem in genus level |
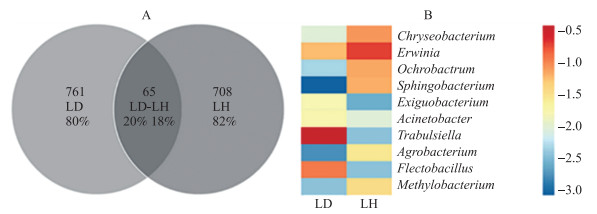
从图 9-A可知:健康与发病香蕉植株叶部共有OTU 65个, 分别占健康和发病香蕉植株叶部序列的18%和20%。欧文氏菌属、土壤杆菌属(Agrobacterium)、鞘氨醇杆菌属(Sphingobacterium)、苍白杆菌属(Ochrobactrum)、甲基杆菌属(Methylobacterium)在健康香蕉植株叶部内生细菌中相对丰度较高(P < 0.05);特布尔西氏菌属、弯曲杆菌属在健康香蕉植株叶部内生细菌中相对丰度较低(P < 0.05)(图 9-B)。
|
图 9 健康与发病香蕉植株叶部OTU(A)及共有OTU属(B)水平分析 Fig. 9 Analysis of OTU(A)and common OTU genus(B)between healthy and diseased banana plant leaf |
健康与发病香蕉植株叶部特有OTU分别有708和761个, 占健康与发病香蕉植株叶部样品序列的82%和80%(图 9-A)。不黏柄菌属、动胶菌属、假单胞菌属为健康香蕉植株叶部(LH)特有属(图 10), 其中假单胞菌属能在健康与发病香蕉植株根部(图 5-B)和茎部(图 7-B)样品中检测到。鞘安醇单胞菌属(Sphingomonas)、短小杆菌(Curtobacterium)、代尔夫特菌属、栖热菌属(Thermus)、黄色杆菌属(Xanthobacter)、无毛螺旋体属(Spirosoma)为发病香蕉植株叶部(LD)内生细菌特有属(图 10)。综上所述, 健康与发病香蕉植株叶部具有不同的内生细菌群落, 病原菌入侵降低了香蕉植株叶部对外源菌的选择能力。
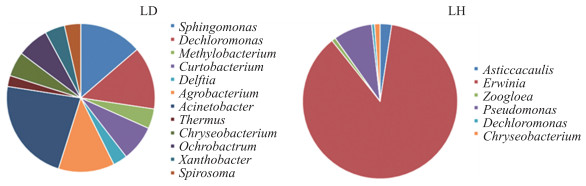
|
图 10 健康与发病香蕉植株叶部特有OTU属水平分析 Fig. 10 Analysis of unique OTU between healthy and diseased banana plant leaf in genus level |
本研究使用MiSeq高通量测序技术[13]研究健康与发病香蕉植株根、茎、叶内生细菌群落差异, 发现香蕉植株根、茎和叶内生细菌群落结构和组成存在显著差异, 说明香蕉植株不同部位对菌群具有选择性。这与张苗苗[14]对白木香内生菌群落结构研究结果一致, 说明香蕉植株不同部位对菌群具有选择性。细菌可以通过香蕉植株叶部皮孔、气孔以及香蕉植株根部侧根、胚根等组织进入香蕉体内, 而茎部多为维管束等输导组织, 细菌难以通过茎部进入香蕉内部, 茎部的内生细菌主要来源于根部或者叶部[15]。由于各部分内生细菌来源存在差异, 因此其菌群在结构组成与多样性方面存在差异[6]。NMDS和MRT分析均表明, 相比于叶部内生细菌菌群, 根与茎更相似, 说明茎部内生细菌可能大多来源于香蕉植株根部。alpha多样性分析表明香蕉根内生细菌菌群多样性和丰富度最高, 其次是叶, 最后是茎。而付业勤等[16]研究香蕉内生细菌多样性发现香蕉植株根多样性最高, 其次是茎, 最后是叶, 与本研究结果不同, 可能是由于所采用的研究方法不同所致。本研究采用了高通量测序, 获得的菌群信息更丰富, 在多样性描述方面具有显著优势。
香蕉的健康水平与香蕉内生细菌群落密切相关。NMDS和MRT分析结果表明, 健康状况是决定香蕉各部位内生细菌群分布的主要因子。这与Xue等[17]关于健康与发病香蕉根际土壤微生物群落的研究结果一致。由于根与茎的内生细菌大多来源于根际, 健康与发病香蕉根际的微生物群落差异显著, 因此其内生细菌群落也存在显著差异。健康香蕉植株根、茎及叶处理重复性较好, 丰富度和多样性较低, 这与王梦颖[7]的研究结果相一致。说明病原菌入侵改变香蕉植株内生细菌生存环境[18], 降低植株的免疫力, 从而降低植株对内生细菌群的选择能力。
香蕉植株健康状况对内生细菌相对丰度具有显著影响, 欧文氏菌属、类芽胞杆菌属、鞘氨醇杆菌属在健康香蕉植株内相对丰度显著较高。蓝江林等[19]利用细菌脂肪酸技术研究健康与发病香蕉植株内生细菌菌群发现, 摩氏摩根菌(Morganella morganii)、嗜麦芽窄食单胞菌(Stenotrophomonas maltophilia)、马氏棒杆菌(Corynebacterium atruchotii)等在健康香蕉植株体内相对丰度较高, 这与本研究结果不同。究其原因:一方面是采用不同的研究方法; 另一方面由于根际是香蕉内生细菌的重要来源[20], 且根际微生物受土壤微生物群落影响较大[17], 取样地点不同导致两地土壤微生物群落有显著差异, 最终导致香蕉内生细菌菌群存在差异[21]。有研究表明, 欧文氏菌属可以分泌抗生素及生长素类活性物质促进植株生长[22]。类芽胞杆菌属发酵液对真菌具有强烈的拮抗作用[6]。鞘氨醇杆菌属可以分泌活性肽等物质促进香蕉植株生长[23]。由此可见, 能够分泌促生和抗菌活性物质的细菌是健康香蕉植株内生细菌菌群的重要组成部分。
本研究中, 我们发现了健康香蕉植株特有的内生细菌属(代尔夫特菌属、芽胞杆菌属、海洋放线菌属、动胶菌属)。王梦颖[7]通过T-RFLP技术分析健康香蕉植株内生细菌群落结构发现柠檬酸细菌属(Citrobacter)、弧菌属(Vibrio)是健康香蕉植株特有内生细菌, 与本研究结果不同。这可能是由于不同品种香蕉植株对内生细菌群落具有显著影响[5]。海洋放线菌属[24]、芽胞杆菌属[25]、代尔夫特菌属[26]、动胶菌属[27]已被证实对枯萎病病原菌具有显著拮抗作用。健康香蕉特有属对香蕉植株拮抗枯萎病病原菌的防控具有重要意义, 是筛选生防菌并构建具备拮抗功能的健康香蕉微生物菌群的潜在资源。
| [1] |
邱优辉, 李会, 徐贞贞, 等. 我国香蕉产业现状与发展的科技措施[J]. 农业现代化研究, 2011, 32(2): 200-203. Qiu Y H, Li H, Xu Z Z, et al. Status of banana industry in China and technological measures on its development[J]. Research of Agricultural Modernization, 2011, 32(2): 200-203 (in Chinese with English abstract). DOI:10.3969/j.issn.1000-0275.2011.02.017 |
| [2] |
Butler D. Fungus threatens top banana[J]. Nature, 2013, 504(7479): 195-196. DOI:10.1038/504195a |
| [3] |
赵娜, 李荣, 辛侃, 等. 茄科蔬菜轮作对高发枯萎病蕉园土壤可培养微生物的影响[J]. 热带作物学报, 2014, 35(8): 1469-1474. Zhao N, Li R, Xin K, et al. Effects of different solanaceae crop rotations on the soil culturable microbes in an orchard with serious fusarium wilt disease[J]. Chinese Journal of Tropical Crops, 2014, 35(8): 1469-1474 (in Chinese with English abstract). DOI:10.3969/j.issn.1000-2561.2014.08.003 |
| [4] |
朱小花, 赵利敏, 戴晓灵, 等. 香蕉枯萎病生物综合防控技术研究[J]. 广东农业科学, 2013, 40(7): 86-88. Zhu X H, Zhao L M, Dai X L, et al. Study on biological comprehensive prevention and control technology of Fusarium wilt of banana[J]. Guangdong Agricultural Sciences, 2013, 40(7): 86-88 (in Chinese with English abstract). DOI:10.3969/j.issn.1004-874X.2013.07.026 |
| [5] |
陈龙, 梁子宁, 朱华. 植物内生菌研究进展[J]. 生物技术通报, 2015, 31(8): 30-34. Chen L, Liang Z N, Zhu H. Research advances in the studies of plant entophytic[J]. Biotechnology Bulletin, 2015, 31(8): 30-34 (in Chinese with English abstract). |
| [6] |
陈博, 朱军, 孙前光, 等. 一株抗香蕉枯萎病内生细菌的分离鉴定及其抗病促生作用[J]. 微生物学通报, 2011, 38(2): 199-205. Chen B, Zhu J, Sun Q G, et al. A bacterial endophyte from banana:its isolation, identification, activity to Fusarium wilt and PGPR effect to banana seedlings[J]. Microbiology China, 2011, 38(2): 199-205 (in Chinese with English abstract). |
| [7] |
王梦颖.香蕉内生菌多样性分析及广谱拮抗菌筛选[D].海口: 海南大学, 2014. Wang M Y. Diversity research of endophytes and broad-spectrum antagonistic bacterium screening from banana[D]. Haikou: Hainan University, 2014(in Chinese with English abstract). |
| [8] |
Caporaso J G, Kuczynski J, Stombaugh J, et al. QⅡME allows analysis of high-throughput community sequencing data[J]. Nature Methods, 2010, 7(5): 335-336. DOI:10.1038/nmeth.f.303 |
| [9] |
Shepard R N. The analysis of proximities:multidimensional scaling with an unknown distance function Ⅱ[J]. Psychometrika, 1962, 27(3): 219-246. DOI:10.1007/BF02289621 |
| [10] |
De'Ath G. Multivariate regression trees:a new technique for modeling species-environment relationships[J]. Ecology, 2002, 83(4): 1105-1117. |
| [11] |
Clarke K R. Non-parametric multivariate analyses of changes in community structure[J]. Austral Ecology, 1993, 18(1): 117-143. DOI:10.1111/aec.1993.18.issue-1 |
| [12] |
Anderson M J. A new method for non-parametric multivariate analysis of variance[J]. Austral Ecology, 2001, 26(1): 32-46. |
| [13] |
Kirk J L, Beaudette L A, Hart M, et al. Methods of studying soil microbial diversity[J]. Journal of Microbiological Methods, 2004, 58(2): 169-188. DOI:10.1016/j.mimet.2004.04.006 |
| [14] |
张苗苗.白木香中内生菌的分离鉴定及其分布规律的初步研究[D].广州: 广州中医药大学, 2017. Zhang M M. Apreliminary study on the isolation and identification of endophytic bacteria in white fragrant and distribution[D]. Guangzhou: Guangzhou University of Chinese Medicine, 2017(in Chinese with English abstract). |
| [15] |
Hallmann J, Quadt-Hallmann A, Mahaffee W F, et al. Bacterial endophytes in agricultural crops[J]. Canadian Journal of Microbiology, 1997, 43(10): 895-914. DOI:10.1139/m97-131 |
| [16] |
付业勤, 蔡吉苗, 刘先宝, 等. 香蕉内生细菌分离、活性评价及数量分布[J]. 热带作物学报, 2007, 28(4): 78-83. Fu Y Q, Cai J M, Liu X B, et al. Isolation, bioactivity evaluation and quantity distribution of endophytic bacteria in banana[J]. Chinese Journal of Tropical Crops, 2007, 28(4): 78-83 (in Chinese with English abstract). DOI:10.3969/j.issn.1000-2561.2007.04.016 |
| [17] |
Xue C, Penton C R, Shen Z, et al. Manipulating the banana rhizosphere microbiome for biological control of panama disease[J]. Scientific Reports, 2015, 5: 11124. DOI:10.1038/srep11124 |
| [18] |
Snyder W C, Hansen H N. The species concept in fusarium[J]. American Journal of Botany, 1940, 27(2): 64-67. DOI:10.1002/ajb2.1940.27.issue-2 |
| [19] |
蓝江林, 刘波, 焦会民, 等. 香蕉植株内生细菌群落多态性研究[J]. 热带亚热带植物学报, 2012, 20(3): 285-291. Lan J L, Liu B, Jiao H M, et al. Community and diversity of endophytic bacteria in Musa nana[J]. Journal of Tropical and Subtropical Botany, 2012, 20(3): 285-291 (in Chinese with English abstract). DOI:10.3969/j.issn.1005-3395.2012.03.012 |
| [20] |
Hardoim P R, van Overbeek L S, Elsas J D. Properties of bacterial endophytes and their proposed role in plant growth[J]. Trends in Microbiology, 2008, 16(10): 463-471. DOI:10.1016/j.tim.2008.07.008 |
| [21] |
李文英, 彭智平, 于俊红, 等. 香蕉根际促生菌的研究展望[J]. 热带作物学报, 2011, 32(1): 182-187. Li W Y, Peng Z P, Yu J H, et al. Progress and prospect on plant growth-promoting rhizobacteria of banana rhizosphere[J]. Chinese Journal of Tropical Crops, 2011, 32(1): 182-187 (in Chinese with English abstract). DOI:10.3969/j.issn.1000-2561.2011.01.036 |
| [22] |
Thomas P, Kumari S, Swarna G K, et al. Papaya shoot tip associated endophytic bacteria isolated from in vitro cultures and host-endophyte interaction in vitro and in vivo[J]. Canadian Journal of Microbiology, 2007, 53(3): 380-390. DOI:10.1139/W06-141 |
| [23] |
孟宪法.滩涂植物菊芋根际固氮菌群落分析及其内生细菌作用机制[D].南京: 南京农业大学, 2015. Meng X F. Analysis on diazotrophic communities in the rhizosphere of beach plant Jerusalem artichoke and the mechanism of action of its endophytic bacteria[D]. Nanjing: Nanjing Agricultural University, 2015(in Chinese with English abstract). |
| [24] |
栗方崎.海洋放线菌的分离筛选及其双组分信号转导系统功能的初步研究[D].济南: 山东大学, 2015. Li F Q. Isolation and screening of marine actinomycetes and study on the function of its two-component signal transduction system[D]. Jinan: Shandong University, 2015(in Chinese with English abstract). |
| [25] |
李静, 操一凡, 丁佳兴, 等. 含复合菌群生物育苗基质的研制及其育苗效果[J]. 南京农业大学学报, 2018, 41(4): 676-684. Li J, Cao Y F, Ding J X, et al. Development of bio-nursery substrates containing PGPR flora and evaluation of their seedlings growth promoting effect[J]. Journal of Nanjing Agricultural University, 2018, 41(4): 676-684 (in Chinese with English abstract). DOI:10.7685/jnau.201801009 |
| [26] |
彭爱琴.代尔夫特菌MTQ3拮抗相关基因tetR的克隆及功能验证[D].泰安: 山东农业大学, 2012. Peng A Q. Cloning and functional confirmation of the tetR related to antagonistic activity to Delftia tsuruhatensis MTQ3[D]. Tai ' an: Shandong Agricultural University, 2012(in Chinese with English abstract). |
| [27] |
郝晓娟.作物枯萎病生防细菌的研究[D].杭州: 浙江大学, 2006. Hao X J. Study on antagonistic bacteria for biocontrol of the Fusarium wilt[D]. Hangzhou: Zhejiang University, 2006(in Chinese with English abstract). |




