文章信息
- 张松, 鲍海波, 张建华, 张懿熙, 刘泽文
- ZHANG Song, BAO Haibo, ZHANG Jianhua, ZHANG Yixi, LIU Zewen
- 亚致死剂量噻虫嗪对日本弓背蚁觅食和亲系识别能力的影响
- A sublethal dose of thiamethoxam impaired the foraging and discrimination ability of the ant Camponotus japonicus
- 南京农业大学学报, 2019, 42(2): 270-275
- Journal of Nanjing Agricultural University, 2019, 42(2): 270-275.
- http://dx.doi.org/10.7685/jnau.201806038
-
文章历史
- 收稿日期: 2018-06-26
在农业生产中, 新烟碱类药剂被广泛用于害虫的防治, 为农业的稳产增收做出了贡献, 但与此同时也产生了一些负面的影响, 例如抗药性、再猖獗和农药残留。噻虫嗪是一种新烟碱类杀虫剂, 主要作用于害虫的中枢和外周神经系统, 用于防治刺吸式口器害虫, 例如褐飞虱、蚜虫、叶蝉等[1]。除了能够直接作用于靶标害虫, 噻虫嗪也会对一些非靶标生物产生不利影响, 例如改变物种内部个体之间的交流[2-3]。作为一种神经毒剂, 噻虫嗪能够对昆虫的认知能力产生损坏, 进而引起昆虫生理生化与行为的一系列变化[4-5], 其中以蜜蜂与蚂蚁等社会性昆虫为对象的研究较多[6-7]。
日本弓背蚁易于饲养与获得, 且个体大小适中, 容易控制, 在中国大部分地区均有分布, 是一种理想的试验材料。日本弓背蚁的一系列行为易于观察, 且相关行为的研究报道较多, 所以本研究选择日本弓背蚁为研究对象。蚂蚁通过取食植物与蜜露接触到农药, 亚致死剂量的杀虫剂能够改变蚂蚁的觅食与竞争行为, 而竞争行为主要负责维持蚂蚁种群的大小和构建蚂蚁群落[8]。蚂蚁也是农业生态系统中的重要组成部分, 它为许多附生植物提供了营养, 并影响了害虫的数量[9]。
对社会性昆虫日本弓背蚁而言, 觅食、攻击和亲系识别是很重要的种群行为, 有专门的蚂蚁负责觅食和清理巢穴, 巢穴中蚂蚁主要通过交哺获得食物[10-11]。外出觅食的蚂蚁发现食物返回巢穴, 然后招募巢穴中的蚂蚁前去觅食[12]。蚂蚁的招募行为会受到一些外在环境因素的影响, 并做出相应的反应, 以应对其他因素的影响[13]。当蚂蚁遇到异巢蚂蚁时, 它们会表现出攻击性行为, 如腹部弯曲、张开上颚等[14]。在蚂蚁之间存在着很多的合作, 而这些合作需要依赖亲系识别, 因此蚂蚁的亲系识别能力是非常重要的[15]。大多数昆虫能够形成独特的表皮碳水化合物作为信息物质, 许多环境因素可以影响表皮碳水化合物的成分组成与各成分的占比, 昆虫通过触角能够感知到这些细微的变化[16-17]。当蚁巢遭到不利的寄生菌或者化学物质时, 蚂蚁会从个体水平与种群水平上做出响应[18]。对日本弓背蚁这些行为进行相关的观察与研究, 能够更加全面且深刻了解亚致死剂量对生态环境的影响。
在本研究中, 我们主要探讨亚致死剂量的噻虫嗪对日本弓背蚁一些社会行为的影响。通过观察农药直接处理组、通过个体交流获得的间接处理组和对照组的觅食、攻击行为和亲系识别行为的变化, 了解亚致死剂量农药对社会性昆虫的间接影响, 加深对农药的认识, 为合理科学使用农药提供理论依据。
1 材料与方法 1.1 试验昆虫日本弓背蚁9个种群分别采自陕西汉中(105°30′50″E, 32°08′54″N)不同的巢穴, 每个种群包含1只蚁后和800~1 000只工蚁。其中, 种群1~6的采集时间为2017年2月, 种群7~9的采集时间为2017年3月。尼科巴弓背蚁种群采自广西桂林(109°36′50″E, 24°15′23″N), 采集时间2016年12月, 有1只蚁后和200~300只工蚁。每个种群的蚂蚁都饲养在由石膏制成的尺寸大小为35 cm×23.5 cm×3.5 cm的人工蚁巢中, 每个蚁巢都包含觅食区与休息区。饲养环境温度为(26±1)℃, 相对湿度为60%。试验前, 每个种群的蚂蚁要饲养到蚁后产卵才可以使用蚂蚁。食物主要是蜂蜜水, 每周饲喂3次。
1.2 化学试剂丙酮购买于Sigma-Aldrich公司(USA); 噻虫嗪(90.13%)由华东理工大学的李忠教授提供; 正己烷(色谱级)与氯化钠(分析纯)购买于南京化学试剂有限公司; Triton X-100购买于南京厚百电子商务有限公司。
1.3 日本弓背蚁的不同处理与收集在经过对日本弓背蚁的毒力试验得到毒力回归方程的基础上, 确定亚致死剂量LD20为每虫10 ng。将噻虫嗪溶解于丙酮中, 配制成浓度为200 mg · L-1的药液, 放置于-20 ℃冰箱中保存备用。用微量点滴仪(World Precision Instruments, Sarasota, FL USA; UMC4)将50 nL的药液点滴在蚂蚁的腹部, 作为处理组(TG), 并且用颜料在胸部背板做上标记。将只点滴50 nL丙酮的蚂蚁与处理组蚂蚁按照1 :1的比例饲养在一起5 d, 然后收集仅由丙酮处理的蚂蚁作为影响组(AG)。对照组(CK)的蚂蚁只点滴50 nL的丙酮。
1.4 不同处理组日本弓背蚁的觅食能力观察为了了解工蚁的觅食能力是否发生改变, 在实验室条件下进行了一系列的Y形管试验。Y形管直径为2.8 cm, 主枝长21 cm, 2个臂长为17.3 cm。在Y形管的2个臂的端口, 一个端口放置加水的脱脂棉, 另一个端口放置加蜂蜜水的脱脂棉。经过活性炭净化过后的气流, 以0.5 L · min-1的流速接在Y形管2个端口。不同处理组的蚂蚁放置在Y形管主枝的端口, 然后观察蚂蚁选择哪一端口。30只蚂蚁作为一组处理, 每个处理进行3次生物学重复, 每次生物学重复的蚂蚁均来自不同的巢穴。本试验中所用日本弓背蚁种群为种群1~3。
1.5 不同处理组日本弓背蚁的招募行为观察为了观察不同处理组蚂蚁的招募行为, 准备了一些简易装备用于模拟蚂蚁觅食的场景, 主要包含蚁巢和觅食区。这些简易装置包含透明塑料杯和培养皿, 在塑料杯与培养皿上钻1个直径为1 cm的小孔, 用15 cm长的塑料软管将其连接在一起, 在培养皿中加入2 mL的蜂蜜水作为食物。将不同处理组的蚂蚁放置在塑料杯中, 然后观察蚂蚁在培养皿中的数量, 每2 min观察记录1次数据。90只蚂蚁作为1次重复, TG组、AG组和CK组各30只, 分别观察不同处理组蚂蚁的招募行为, 进行3次生物学重复, 每次生物学重复的蚂蚁均来自不同巢穴。本试验中所用日本弓背蚁种群为种群4~6。
1.6 不同处理组日本弓背蚁的亲系识别能力观察为了研究亚致死剂量噻虫嗪对日本弓背蚁亲系识别能力的影响, 进行了3次不同设置的Y形管试验。在第1种设置中, Y形管一端放置8只同巢蚂蚁, 另一端放置8只非同巢蚂蚁。在第2种设置中, 同巢蚂蚁放置在一端, 另一端为空白对照。在第3种设置中, 非同巢蚂蚁放置在一端, 另一端也为空白对照。记录不同处理组蚂蚁的最终选择情况[19]。每次重复至少包含60只蚂蚁, CK组、AG组、TG组各20只, 进行3次生物学重复, 每次生物学重复的蚂蚁均来自不同的巢穴。本试验中所用日本弓背蚁种群为种群7~9。
1.7 表皮碳水化合物的提取及触角电位反应为了验证表皮碳水化合物(cuticular hydrocarbons, CHC)与亲系识别之间的关系, 进行了触角电位反应试验。首先提取蚂蚁的表皮碳水化合物, 将20只蚂蚁在-20 ℃冰箱中冷冻5 min, 目的是为了减少蚂蚁腺体分泌其他的信息素, 然后将所有蚂蚁浸没在3 mL的正己烷(色谱级)中, 振荡5 min, 最后将蚂蚁移除, 待正己烷挥发后加入200 μL含0.1%(体积分数)Triton X-100的NaCl(10 mmol · L-1)溶液, 溶解表皮碳水化合物。在触角电位的试验中, 将10 μL的CHC溶液加在滤纸上, 置于巴斯德管中。根据Ozaki等[20]和Zhang等[21]的触角电位的试验条件, 对仪器进行了相关的调试。将蚂蚁的头部切下, 然后将蚂蚁触角的两端分别接在电极的两端, 最后用CHC刺激。通过EAG-Pro软件, 对触角电位信号进行扩大、监测与分析。在空白对照的试验中, 将10 μL含0.1%(体积分数)Triton X-100的NaCl(10 mmol · L-1)溶液作为刺激物质。每次物质刺激时间间隔为2 min, 每种CHC提取物所进行的触角电位反应中包含CK组、AG组和TG组蚂蚁各15只。触角电位试验进行3次生物学重复, 每次生物学重复的蚂蚁均来自不同的巢穴。本试验中所用日本弓背蚁种群为种群7~9。
1.8 不同处理组日本弓背蚁攻击行为的观察为了研究亚致死剂量噻虫嗪对日本弓背蚁攻击行为的影响, 将不同处理的日本弓背蚁和尼科巴弓背蚁放在5 mL的离心管中, 然后观察它们的攻击行为, 观察时间2 min。将日本弓背蚁的攻击行为划分为4个等级, 然后给每个等级赋1个值, 0为触角相互碰撞或者相互照料; 1为上颚张开; 2为相互撕咬; 3为腹部弯曲, 分泌毒液。根据攻击行为的等级划分, 记录日本弓背蚁在观察时间内的最高攻击等级。通过攻击指数来研究日本弓背蚁的攻击强弱, 攻击指数=(蚂蚁的攻击等级×该攻击等级蚂蚁的数量)/(蚂蚁的总数量×最高的攻击等级数值)×100%。90只蚂蚁作为1个生物学重复, CK组、AG组和TG组蚂蚁各30只。本次试验共进行3次生物学重复, 每次生物学重复的蚂蚁均来自不同的巢穴。本试验中所用日本弓背蚁种群为种群7~9。
1.9 数据分析觅食行为、攻击行为和亲系识别行为的试验数据使用单因素方差分析(one-way ANOVA), 显著性分析使用最小显著性差异法(LSD)。触角电位试验数据使用一般线性模型(GLM)分析, 多重比较使用最小显著性差异法。试验数据均采用 x±SE表示。
2 结果与分析 2.1 亚致死剂量噻虫嗪对日本弓背蚁觅食行为和招募行为的影响Y形管试验发现, 亚致死剂量噻虫嗪处理对日本弓背蚁的觅食能力不存在显著影响。在日本弓背蚁发现食物的概率上, CK组与TG组和AG组蚂蚁之间均不存在显著性差异(图 1)。
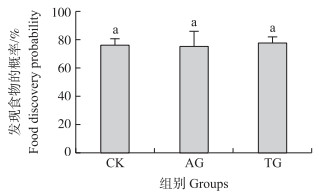
|
图 1 不同处理组蚂蚁发现食物的概率(x±SE, n=90) Fig. 1 The food discovery probability of the different groups CK:对照; AG:间接影响组; TG:处理组。小写字母代表在0.05水平差异显著。下同。 CK:Control; AG:Affected group; TG:Treated group. The significant differences were marked by lowercase at 0.05 level. The same as follows. |
日本弓背蚁的招募行为是指日本弓背蚁发现食物并在食物周围分泌信息物质, 在返回途中同时释放信息素, 然后返回巢穴召集其他工蚁依靠信息物质前往食物地点。蚂蚁觅食的招募曲线展示了不同处理组蚂蚁在觅食区数量的动态变化情况(图 2)。从CK组蚂蚁觅食招募曲线可以看出, 在30~35 min, 觅食区蚂蚁数量明显减少, 然后逐渐增加(图 2-A, 箭头所示), 这种曲线的变化可能预示着蚂蚁之间存在招募行为。相比之下, AG组与TG组蚂蚁均没有表现出招募行为, 在动态曲线上则表现为没有明显的下凹部分(图 2-B和图 2-C)。
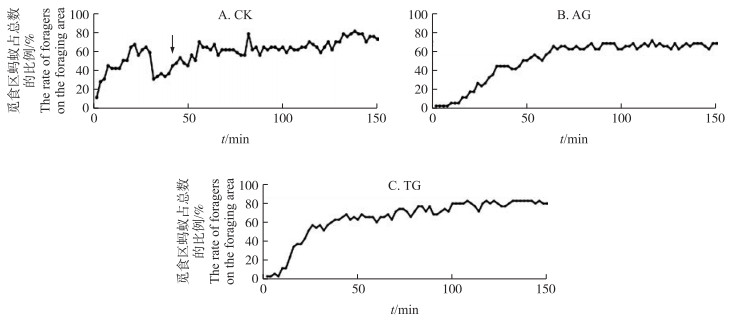
|
图 2 具有代表性的同巢蚂蚁在不同时间段内工蚁出现在觅食区的比例(n=60) Fig. 2 The rate of foragers on the foraging area at different time for one representative colony |
在Y形管一端为空白, 另一端为同巢蚂蚁或者异巢蚂蚁的试验中, 不同处理的蚂蚁并没有表现出显著性差异, 大多数蚂蚁会选择有蚂蚁的一端(图 3-A, B)。在Y形管一端是同巢蚂蚁, 另一端是异巢蚂蚁的亲系识别试验中, CK组蚂蚁优势选择同巢蚂蚁(91.12%±1.95%); 相比之下, AG组(52.15%±4.00%)和TG组(51.85%±3.70%)蚂蚁在同巢蚂蚁与非同巢蚂蚁之间无明显的选择, 失去了亲系识别能力(图 3-C)。
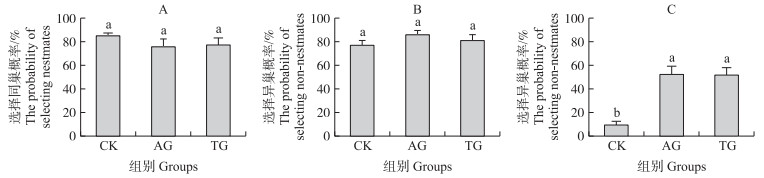
|
图 3 噻虫嗪处理蚂蚁选择同巢或者异巢的概率(x±SE, n=90) Fig. 3 The probability of selecting nestmates or non-nestmates in Y-tube olfactometer after thiamethoxam treatment A.一端放置同巢蚂蚁, 另一端为空白对照; B.一端放置异巢蚂蚁, 另一端为空白对照; C.一端放置同巢蚂蚁, 另一端放置异巢蚂蚁。 A. One arm was with nestmate workers, and the other arm was blank; B. One arm was with non-nestmate workers and the other was blank; C. One arm was with nestmate workers, and the other arm was with non-nestmate workers. |
在触角电位反应的试验中, 用同巢和异巢蚂蚁的CHC提取物分别作为刺激物质, 观察3组不同处理组蚂蚁的触角电位变化情况。在用异巢蚂蚁的CHC作为刺激物质时, CK组蚂蚁的触角电位[(8.907±0.634)mV]显著高于AG组蚂蚁[(5.310±0.385)mV]和TG组蚂蚁[(5.133±0.415)mV](图 4-A)。当将刺激物质变为同巢蚂蚁的CHC时, CK组蚂蚁的触角电位[(1.810±0.249)mV]与AG组蚂蚁[(1.540±0.166)mV]和TG组蚂蚁[(2.088±0.338)mV]之间均无显著性差异(图 4-B)。
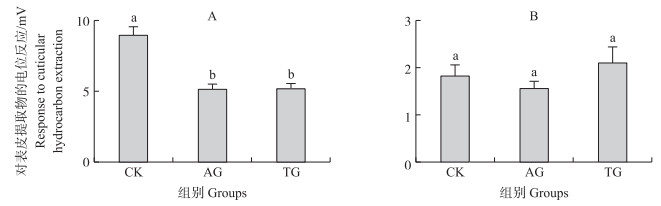
|
图 4 不同处理组蚂蚁对表皮碳水化合物提取物的触角电位反应(x±SE, n=45) Fig. 4 The electroantennography response of workers to cuticular hydrocarbons extraction A.用异巢蚂蚁的表皮碳水化合物提取物作为刺激源; B.用同巢蚂蚁的表皮碳水化合物提取物作为刺激源。 A. Stimulated by the non-nestmate cuticular hydrocarbons extraction. B.Stimulated by the nestmate cuticular hydrocarbons extraction. |
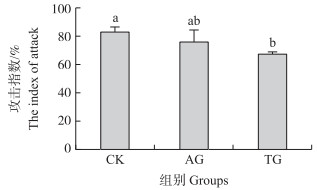
试验结果(图 5)表明:亚致死剂量直接处理后, 日本弓背蚁对尼科巴弓背蚁的攻击指数(66.73%±1.19%)比对照组蚂蚁(82.71%±2.00%)显著降低。但是, 间接影响组的日本弓背蚁所表现出的攻击指数(75.57%±4.94%)与其他2组蚂蚁均不存在显著差异。
|
图 5 不同处理组蚂蚁对外来蚂蚁的攻击指数(x±SE) Fig. 5 The index of attack of the workers against the align counterparts |
对社会性昆虫而言, 觅食行为、攻击行为和亲系识别行为都是十分重要的。在蚂蚁中, 工蚁的招募行为在种群水平上能够明显提高觅食效率[12]。蚂蚁在同巢与异巢蚂蚁的亲系识别对蚂蚁与蚂蚁之间的合作非常重要, 亲系识别有助于保护蚁巢内的幼蚁与卵[15]。亚致死剂量的农药能够直接杀死部分接触到农药的蚂蚁, 同时亚致死剂量能够改变蚂蚁的觅食、攻击和亲系识别行为, 进而影响蚂蚁种群的大小和结构[8]。除了一些蚂蚁能够直接接触到农药外, 通过交哺、身体接触和信息交流等方式, 农药的不利影响也可以在蚂蚁之间互相传递[10-11]。
在社会性昆虫中, 昆虫的招募行为在维持种群结构中十分重要, 通过摇摆舞, 蜜蜂可以招募蜂巢中其他的蜜蜂去觅食区域[22]。蚂蚁在觅食路径上分泌一些特殊的信息素, 并且同被招募的蚂蚁进行一些交流[23-24]。招募行为是一种高效的觅食行为, 增加觅食效率和减少工蚁的死亡率。在本试验中, 处理组蚂蚁和间接影响组蚂蚁没有展现出招募行为, 而对照组蚂蚁有明显的招募行为。处理组蚂蚁与间接影响组蚂蚁之间存在信息交流, 说明农药对蚂蚁招募行为的影响可以通过个体交流进行传递。处理组蚂蚁与间接影响组蚂蚁在一些行为上没有显著差异, 说明处理组蚂蚁影响了间接影响组蚂蚁的社会行为。在蚁巢里, 蚁后和幼蚁通过交哺得到食物[11], 这就意味着农药的水平转移在社会性昆虫之间是非常普遍的[25]。在个体水平上, 处理组蚂蚁和间接影响组蚂蚁能够发现食物, 行为表现正常同对照组蚂蚁一样。然而, 在种群水平上, 处理组蚂蚁和间接影响组蚂蚁招募行为的缺失将会影响觅食的效率, 进而影响种群的发展。
表皮碳水化合物(cuticular hydrocarbons, CHC)在蚂蚁的通讯交流之间具有很重要的作用[16, 26]。CHC的不同和组成变化传递着不同的信息, 工蚁之间的亲系识别主要是通过CHC来完成[27], CHC还可以激活免疫相关的基因[26]。在同巢和异巢蚂蚁之间的识别, 首先是为了保护蚁巢免受外来种群的侵害[15]。在Y形管试验中, 对照组的日本弓背蚁更倾向于选择放有同巢蚂蚁的一端, 对照组蚂蚁对于异巢蚂蚁的CHC提取物的触角电位反应明显较同巢蚂蚁的CHC提取物的强烈, 说明这种强烈的触角刺激可能是趋避信息物质造成的。然而, 噻虫嗪的直接或者间接接触能够减少对同巢或异巢蚂蚁CHC的反应差异。当识别到异巢或异种蚂蚁时, 工蚁为了保护蚁巢会表现出攻击行为, 而亚致死剂量的新烟碱类杀虫剂能够改变这一攻击行为, 进而打破了蚁巢的生态平衡, 并给种群增长带来了不利影响[2]。
综上所述, 本研究证明新烟碱类杀虫剂噻虫嗪通过直接接触和蚂蚁个体间的信息交流, 对日本弓背蚁的招募与亲系识别行为产生明显影响。这些社会行为的变化将会影响蚂蚁社会种群的稳定与发展, 严重的情况下会导致种群的崩溃。试验结果从另一个角度说明了新烟碱类农药对环境生态的影响, 使我们对农药的认识更加深刻与全面。
| [1] |
Brown L A, Ihara M, Buckingham S D, et al. Neonicotinoid insecticides display partial and super agonist actions on native insect nicotinic acetylcholine receptors[J]. Journal of Neurochemistry, 2006, 99(2): 608-615. DOI:10.1111/jnc.2006.99.issue-2 |
| [2] |
Barbieri R F, Lester P J, Miller A S, et al. A neurotoxic pesticide changes the outcome of aggressive interactions between native and invasive ants[J]. Proceedings of the Royal Society B, 2013, 280(1772): 20132157. DOI:10.1098/rspb.2013.2157 |
| [3] |
Blacquière T, Smagghe G, van Gestel C A M, et al. Neonicotinoids in bees:a review on concentrations, side-effects and risk assessment[J]. Ecotoxicology, 2012, 21(4): 973-992. DOI:10.1007/s10646-012-0863-x |
| [4] |
Giurfa M. Cognition with few neurons:higher-order learning in insects[J]. Trends in Neurosciences, 2013, 36(5): 285-294. DOI:10.1016/j.tins.2012.12.011 |
| [5] |
Wu M C, Chang Y W, Lu K H, et al. Gene expression changes in honey bees induced by sublethal imidacloprid exposure during the larval stage[J]. Insect Biochemistry & Molecular Biology, 2017, 88: 12-20. |
| [6] |
Whitehorn P R, O'connor S, Wackers F L, et al. Neonicotinoid pesticide reduces bumble bee colony growth and queen production[J]. Science, 2012, 336(6079): 351-352. DOI:10.1126/science.1215025 |
| [7] |
Yan H, Simola D F, Bonasio R, et al. Eusocial insects as emerging models for behavioural epigenetics[J]. Nature Reviews Genetics, 2014, 15(10): 677-688. DOI:10.1038/nrg3787 |
| [8] |
Thiel S, Köhler H R. A sublethal imidacloprid concentration alters foraging and competition behaviour of ants[J]. Ecotoxicology, 2016, 25(4): 814-823. DOI:10.1007/s10646-016-1638-6 |
| [9] |
Chomicki G, Renner S S. Obligate plant farming by a specialized ant[J]. Nature Plants, 2016, 2(12): 16181. DOI:10.1038/nplants.2016.181 |
| [10] |
Mersch D P, Cyespi A, Keller L. Tracking individuals shows spatial fidelity is a key regulator of ant social organization[J]. Science, 2013, 340(6136): 1090-1093. DOI:10.1126/science.1234316 |
| [11] |
LeBoeuf A C, Waridel P, Brent C S, et al. Oral transfer of chemical cues, growth proteins and hormones in social insects[J]. eLife, 2016, 5: e20375. DOI:10.7554/eLife.20375 |
| [12] |
Greene M J, Pinter-Wollman N, Gordon D M. Interactions with combined chemical cues inform harvester ant foragers ' decisions to leave the nest in search of food[J]. PLoS One, 2013, 8(1): e52219. DOI:10.1371/journal.pone.0052219 |
| [13] |
Udiani O, Pinter-Wollman N, Kang Y. Identifying robustness in the regulation of collective foraging of ant colonies using an interaction-based model with backward bifurcation[J]. Journal of Theoretical Biology, 2015, 367: 61-75. DOI:10.1016/j.jtbi.2014.11.026 |
| [14] |
Guerrieri F J, D'Ettorre P. The mandible opening response:quantifying aggression elicited by chemical cues in ants[J]. Journal of Experimental Biology, 2008, 211(7): 1109-1113. DOI:10.1242/jeb.008508 |
| [15] |
Guerrieri F J, Nehring V, Jørgensen C G, et al. Ants recognize foes and not friends[J]. Proceedings of the Royal Society B, 2009, 276(1666): 2461-2468. DOI:10.1098/rspb.2008.1860 |
| [16] |
Sharma K R, Enzmann B L, Schmidt Y, et al. Cuticular hydrocarbon pheromones for social behavior and their coding in the ant antenna[J]. Cell Reports, 2015, 12(8): 1261-1271. DOI:10.1016/j.celrep.2015.07.031 |
| [17] |
Yew J Y, Chung H. Insect pheromones:an overview of function, form, and discovery[J]. Progress in Lipid Research, 2015, 59: 88-105. DOI:10.1016/j.plipres.2015.06.001 |
| [18] |
Cremer S, Armitage S A O, Schmid-Hempel P. Social immunity[J]. Current Biology, 2007, 17(16): R693-R702. DOI:10.1016/j.cub.2007.06.008 |
| [19] |
D'Ettorre P, Heinze J. Individual recognition in ant queens[J]. Current Biology, 2005, 15(23): 2170-2174. DOI:10.1016/j.cub.2005.10.067 |
| [20] |
Ozaki M, Wada-Katsumata A, Fujikawa K, et al. Ant nestmate and non-nestmate discrimination by a chemosensory sensillum[J]. Science, 2005, 309(5732): 311-314. DOI:10.1126/science.1105244 |
| [21] |
Zhang R, Wang B, Grossi G, et al. Molecular basis of alarm pheromone detection in aphids[J]. Current Biology, 2017, 27(1): 55-61. DOI:10.1016/j.cub.2016.10.013 |
| [22] |
Couvillon M J, Schürch R, Ratnieks F L W. Waggle dance distances as integrative indicators of seasonal foraging challenges[J]. PLoS One, 2014, 9(4): e93495. DOI:10.1371/journal.pone.0093495 |
| [23] |
Riley J R, Greggers U, Smith A D, et al. The flight paths of honeybees recruited by the waggle dance[J]. Nature, 2005, 435(7039): 205-207. DOI:10.1038/nature03526 |
| [24] |
Bouchebti S, Ferrere S, Vittori K, et al. Contact rate modulates foraging efficiency in leaf cutting ants[J]. Scientific Reports, 2015, 5: 18650. |
| [25] |
Choe D H, Rust M K. Horizontal transfer of insecticides in laboratory colonies of the Argentine ant(Hymenoptera:Formicidae)[J]. Journal of Economic Entomology, 2008, 101(4): 1397-1405. DOI:10.1093/jee/101.4.1397 |
| [26] |
Hernández López J, Riessberger-Gallé U, Crailsheim K, et al. Cuticular hydrocarbon cues of immune-challenged workers elicit immune activation in honey bee queens[J]. Molecular Ecology, 2017, 26(11): 3062-3073. DOI:10.1111/mec.2017.26.issue-11 |
| [27] |
Leonhardt S D, Menzel F, Nehring V, et al. Ecology and evolution of communication in social insects[J]. Cell, 2016, 164(6): 1277-1287. DOI:10.1016/j.cell.2016.01.035 |




