文章信息
- 刘唱, 杨洋, 俞静, 李燕, 刘海龙, 张昌伟, 侯喜林, 李英
- LIU Chang, YANG Yang, YU Jing, LI Yan, LIU Hailong, ZHANG Changwei, HOU Xilin, LI Ying
- 不结球白菜BcCNL基因的克隆及功能分析
- Cloning and functional analysis of BcCNL gene in non-heading Chinese cabbage
- 南京农业大学学报, 2019, 42(2): 229-235
- Journal of Nanjing Agricultural University, 2019, 42(2): 229-235.
- http://dx.doi.org/10.7685/jnau.201803048
-
文章历史
- 收稿日期: 2018-03-23
不结球白菜(Brassica campestris ssp. chinensis)在生长过程中会受到多种病害的影响, 从而导致产量和品质下降[1-2]。霜霉菌主要危害不结球白菜的叶片, 使叶片萎蔫变黄, 严重时产生白色霜状霉层[3], 生产上主要使用农药进行防控, 但效果不明显且污染严重[4]。因此, 寻找抗病基因, 培育抗病品种是降低病害的最有效方法之一。
为了抑制微生物病原体的入侵, 植物已经发展了复杂而精确的防御机制以识别病原体攻击, 例如:病原相关分子模式(PAMP)-触发免疫(PTI)是植物抵抗病原体入侵的首要防线, 即通过质膜上的识别受体感知病原体的PAMP并最后诱导PTI反应[5], 但是, 有些病原体的效应子会巧妙躲避植物的PTI, 植物为了阻止这些病原体的入侵, 会通过抗病基因(R基因)来检测效应子, R基因通常能够编码受体蛋白质, 启动植物的抗病反应信号, 是植物抗病过程中的一个关键因子[6]。CC-NBS-LRR(coiled-coil-nucleotide binding-site-leucine-rich repeat, CNL)是高度保守的植物抗病蛋白家族, 其中卷曲螺旋结构域(CC)在植物固有免疫中发挥重要作用[7-8]。目前, CNL基因的功能已经在许多植物中报道, 如在水稻中, Pb1编码的CNL蛋白能够显著提高对稻瘟病的抗性[9], 在大麦中, CC结构域与WRKY转录因子相互作用提高对白粉病的抗性[10], 在四倍体和六倍体小麦中, Lr10介导对叶锈病的抗性需要2个不同的CNL基因[11], 在葡萄中VqCN基因的过表达增强了对霜霉病的抗性[12], 这为验证BcCNL基因在不结球白菜抗霜霉病的功能提供借鉴。
本试验利用同源克隆的方法在不结球白菜中获得了BcCNL基因, 对BcCNL基因进行生物信息学分析及亚细胞定位, 通过病毒诱导基因沉默(VIGS)方法研究该基因沉默后对霜霉病抗性的影响, 旨在深入研究BcCNL基因在不结球白菜抗霜霉病中的作用, 为培育抗霜霉病品种奠定基础。
1 材料与方法 1.1 试验材料及菌液收集植物材料为不结球白菜自交系‘苏州青’(抗病品种)和‘矮脚黄’(感病品种)。菌液收集及保存方法采用程永安等[13]的方法, 接种霜霉病菌方法采用刘克钧等[2]的方法。芜菁黄化花叶病毒质粒pTY由Antoine Bouteilly教授馈赠。
1.2 BcCNL基因的克隆BcCNL基因在大白菜数据库中的基因编号为Bra027866。以‘苏州青’叶片cDNA为模板, 采用同源克隆的方法, 用Primer Premier 5.0设计基因克隆引物BcCNL-F和BcCNL-R(表 1)。PCR反应体系为20 μL:cDNA模板1 μL, BcCNL-F和BcCNL-R各1μL, Ex Taq DNA polymerase(5 U · μL-1)1 μL, 10×Ex Taq Buffer(Mg2+ free)2 μL, dNTP Mixture(Each 2.5 mmol · L-1)2 μL, MgCl2(25 mmol · L-1)2 μL, ddH2O 10.8 μL。反应程序为:94 ℃ 5 min; 94 ℃ 30 s, 60 ℃ 30 s, 72 ℃ 3 min, 35个循环; 72 ℃ 10 min。PCR产物用10 g · L-1琼脂糖凝胶电泳进行检测, 使用凝胶提取试剂盒(CWBIO)回收目的片段, 然后连接至pMD18-T载体(TaKaRa), 将连接产物转化到大肠杆菌DH-5α中, 挑取阳性单克隆, 测序验证。
| 引物名称Primer name | 引物序列(5′→3′)Primer sequence |
| BcCNL-F/R | ATGTCTGGGGAACTTGTGTCATT/TTAAAATATTATATGCATGATTTCAACAGA |
| CNL-F/R | TCGAGCTCAAGCTTCGAATTCTGATGTCTGGGGAACTTGTGTCATT/GGATCCCGGGCCCGCGGTACCGTTG- TTAAAATATTATATGCATGATTTCAACAGA |
| CP-F/R | TCCACCCTCACCACCTTC/GGGACAGACCTCGCTAACT |
| qRT-F/R | GGGACGAAAGAAGGACGAGTG/CAGGCTTGTTAGGCGAGAAGG |
| Actin-F/R | CTCAGTCCAAAAGAGGTATTCT/GTAGAATGTGTGATGCCAGATC |
采用MEGA 5软件中的邻接法构建系统发育树, 修正参数Bootstrap设置为1 000次; 在NCBI(https://www.ncbi.nlm.nih.gov/)数据库网站上分析BcCNL蛋白结构域, 利用DNAMAN 6.0软件翻译BcCNL基因编码的氨基酸序列, 并计算相对分子质量和等电点。
1.4 亚细胞定位表达载体的构建BcCNL与pEZS-NL-GFP的融合表达载体的构建采用同源重组的方法, 设计引物CNL-F和CNL-R(表 1)。重组质粒采用徐淑平等[14]的方法用金粉包埋。将包埋好的质粒用基因枪(1 000 psi)轰击进入洋葱内表皮细胞, 经16 h的黑暗培养后, 在激光共聚焦显微镜的白光下观察明场, 在蓝光激发光(488 nm)下观察荧光, 用300 g · L-1蔗糖溶液使其质壁分离。
1.5 病毒诱导基因沉默(VIGS)表达载体的构建pTY-BcCNL的载体构建方法主要参照杨学东等[15]的方法。BcCNL选取的40 bp序列为:5′-TTAAGGTACACCAGAGAATTGACGATGTAAAGGATCCACA-3′。由金斯瑞生物科技有限公司合成反向互补的序列80 bp。pTY载体用SnaBⅠ酶切后, 用T4连接酶与合成好的DNA片段过夜连接, 转化大肠杆菌, 挑取阳性单克隆, 测序验证。大量提取pTY-BcCNL质粒, 用金粉包埋后, 基因枪(1 000 psi)轰击转入到2片真叶的‘苏州青’中, 以轰击pTY作为对照, 20 d后可观察到发病症状。选取pTY载体中的外壳蛋白(coat protein, CP)基因片段设计特异引物, 进行PCR检测转基因植株[15]。
1.6 实时定量PCR用RNA Simple Total RNA Kit试剂盒(TIANGEN)提取总RNA。cDNA的合成方法采用PrimeScript RT reagent Kit(TaKaRa)。使用Beacon Designer 7设计荧光定量特异性引物, 其中qRT-F/R为BcCNL的特异性定量引物(表 1), 参照Xiao等[16]报道的Actin-F/R(Bra028615)引物序列, 反应体系参照SYBR Premix Ex Taq试剂盒(TaKaRa)。相对表达量采用2-ΔΔCT法[17]分析。
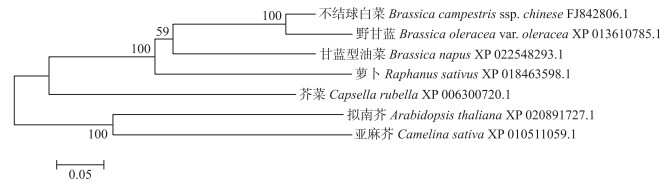
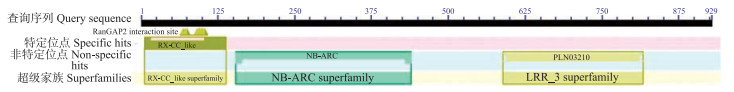
2 结果与分析 2.1 BcCNL基因的克隆、序列及进化分析采用同源克隆的方法, 以不结球白菜‘苏州青’cDNA为模板, 克隆获得目的片段(图 1)。BcCNL基因含有2 790 bp的开放阅读框, 编码929个氨基酸, 相对分子质量为226.7, 等电点为2.7。系统进化树结果显示, 不结球白菜与野甘蓝的进化关系最近(图 2)。在NCBI网站上分析BcCNL蛋白二级结构域, 结果(图 3)显示:该蛋白属于RX-CC、NB-ARC和LRR-3超家族。

|
图 1 BcCNL基因编码的核苷酸序列及氨基酸序列 Fig. 1 Nucleotide and amino acid sequences encoded by BcCNL gene |
|
图 2 不结球白菜与其他物种中CNL蛋白的进化分析 Fig. 2 Evolutionary analysis of CNL proteins in non-heading Chinese cabbage and other species |
|
图 3 BcCNL氨基酸序列的保守结构域 Fig. 3 Conserved domains of BcCNL amino acid sequences |
由图 4可见:GFP蛋白在整个细胞中都有表达, 而BcCNL-GFP融合蛋白主要在细胞膜上表达, 质壁分离结果进一步说明了BcCNL-GFP融合蛋白主要在细胞膜上表达。

|
图 4 BcCNL蛋白的亚细胞定位分析 Fig. 4 Subcellular localization of BcCNL protein |
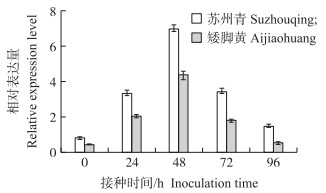
由图 5可见:BcCNL基因在接种霜霉菌后呈先上升后下降的趋势, 且在48 h达到最大值。‘苏州青’BcCNL基因的整体表达量显著高于‘矮脚黄’。
|
图 5 不结球白菜接种霜霉菌后BcCNL基因的表达量 Fig. 5 Expression level of BcCNL gene after infected with downy mildew in non-heading Chinese cabbage |
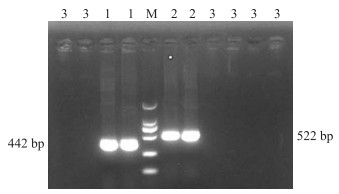
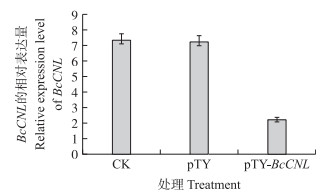
由图 6可见:转入pTY-BcCNL或pTY的‘苏州青’叶片都出现黄色的斑点, 分别侵染霜霉菌5 d后发现, 转入pTY-BcCNL的‘苏州青’叶片的感病程度明显高于转入pTY的植株。用外壳蛋白(CP)特异引物检测发现转入空载pTY的植株中含有1条442 bp的条带, 而转入pTY-BcCNL的植株中含有1条522 bp的条带, 正常植株中没有(图 7)。正常植株中BcCNL在接种霜霉菌后48 h表达量最高。将转入pTY-BcCNL或pTY的植株接种霜霉菌48 h后, 对BcCNL进行实时荧光定量PCR检测, 结果(图 8)显示:转入pTY-BcCNL重组质粒的‘苏州青’中BcCNL基因的表达量与正常植株相比平均降低70%, 而转入pTY质粒的植株与正常植株相比BcCNL基因的表达量无显著差异。

|
图 6 转入pTY或pTY-BcCNL的‘苏州青’接种霜霉菌5 d后的表型
Fig. 6 Phenotypes of'Suzhouqing'after transferred in plasmid pTY or pTY-BcCNL and after 5 days of infected with downy mildew
A、B:转入pTY的植株Plant transferred in plasmid pTY; C、D:转入pTY-BcCNL的植株Plant transferred in plasmid pTY-BcCNL; E、F:正常植株Normal plant; B、D、F:侵染霜霉菌5 d后的表型Plant phenotype after 5 days of infected with downy mildew. 箭头指不同处理植株接种霜霉菌后叶片发病程度。The arrows indicate the degree of disease in the leaves of different treated plants inoculated with downy mildew. |
|
图 7 用CP引物进行PCR检测植株体内病毒质粒转录产物 Fig. 7 Detection of viral plasmid transcripts in plants by PCR with CP primers M:DL2000 marker; 1:转入pTY的植株Plant transferred in plasmid pTY; 2:转入pTY-BcCNL的植株Plant transferred in plasmid pTY-BcCNL; 3:正常植株Normal plant. |
|
图 8 转入pTY-BcCNL或pTY后发病植株BcCNL的表达水平 Fig. 8 Expression level of BcCNL in the diseased plants after transferred in plasmid pTY-BcCNL or pTY CK:正常植株Normal plant; pTY:转入pTY的植株Plant transferred in plasmid pTY; pTY-BcCNL:转入pTY-BcCNL的植株Plant transferred in plasmid pTY-BcCNL. |
在植物抗病反应中, CNL产物作为免疫受体, 直接或间接感知病原体的存在并引发强烈的防御反应, 最终导致细胞死亡, 病原体进一步生长停止[18]。陈俏丽等[19]研究发现CNL蛋白的编码基因参与水稻品种‘大白谷’天然免疫反应, 从而在水稻抗线虫侵染过程中起到一定抗性作用。本研究中, 克隆得到的BcCNL基因中含有CNL结构域, 荧光定量PCR结果显示, BcCNL基因在接种前和接种霜霉菌后24 h的表达量较低, 而在48 h的表达量上调, 且抗病品种的表达量高于感病品种, 这与向日葵中CNL基因可显著增强对霜霉病抗性的结果一致[20]。说明在没有病原体感染的情况下, R基因以低水平表达, 然而, 这些基因在病原体感染后迅速诱导, 增强植株的抗病性[21]。本研究中, 在72和96 h时BcCNL基因的表达量降低, 说明此时植株免疫信号通路遭到破坏, 不能正常识别病原的分子模式, 促进R基因编码受体蛋白[22]。Zhang等[12]发现VqCN蛋白在烟草细胞中具有很强的膜定位信号, 且VqCN的过表达增强了葡萄对霜霉菌的抗性。本研究中, BcCNL蛋白定位于洋葱的细胞膜上, 推测BcCNL蛋白可能与VqCN具有相同的功能, 通过在细胞膜上发挥防御作用, 抵抗病原菌的入侵, 从而提高不结球白菜对霜霉病的抗性。
VIGS具有简单、快速的沉默基因, 不受植物种类限制, 只需部分序列信息就足以沉默1个基因等优点[23], 目前已经应用到许多植物中, 如:在拟南芥中采用VIGS的方法沉默PDS基因后, 导致植株叶绿素合成受阻, 叶片、茎和花萼出现明显的白化现象[24]; 在小麦中将Era1和Sal1沉默后的植株在水分胁迫的情况下与正常植株相比含水量增高, 并且在Era1沉默后能够促进种子的萌发[25]; 通过VIGS敲除PcSTPK后辣椒叶片坏死病变出现、叶面上疫霉增殖、孢子形成的增加, 均证明PcSTPK的沉默增加了辣椒疫霉感染的敏感性[26]。pTY载体主要由35S启动子及芜菁花叶病毒全基因组组成, 可以用质粒直接侵染植物, 操作简单, 沉默效果显著, 是目前应用最广泛的载体之一[24]。本研究将pTY-BcCNL转入‘苏州青’后, 发现BcCNL基因的表达量降低70%, 沉默效果与杨学东等[15]沉默BcPDS的效果基本一致, 这表明在‘苏州青’中BcCNL基因的表达得到了有效抑制。本研究发现, 沉默BcCNL基因的‘苏州青’对霜霉病的抗性明显低于未沉默植株, 这进一步说明BcCNL基因在不结球白菜抵抗霜霉病中起积极作用。在下一步的研究中, 我们将通过酵母双杂交技术筛选与BcCNL基因互作的上、下游基因并将其过表达载体转入不结球白菜中, 进一步明确该基因在抗霜霉病过程中发挥的作用。
| [1] |
侯喜林. 不结球白菜育种研究新进展[J]. 南京农业大学学报, 2003, 26(4): 111-115. Hou X L. Advances in breeding of non-heading Chinese cabbage[J]. Journal of Nanjing Agricultural University, 2003, 26(4): 111-115 (in Chinese with English abstract). DOI:10.7685/j.issn.1000-2030.2003.04.026 |
| [2] |
刘克钧, 朱月林, 侯喜林, 等. 不结球白菜抗病育种的研究. Ⅳ:不结球白菜抗芜菁花叶病、霜霉病及黑斑病的多抗性鉴定及筛选[J]. 南京农业大学学报, 1997, 20(3): 31-35. Liu K J, Zhu Y L, Hou X L, et al. Studies on breeding for disease resistance in non-heading Chinese cabbage. Ⅳ:Identification and screening for multiple resistance to turnip mosaic virosis, downy mildew and black spot in non-heading Chinese cabbage[J]. Journal of Nanjing Agricultural University, 1997, 20(3): 31-35 (in Chinese with English abstract). DOI:10.7685/j.issn.1000-2030.1997.03.006 |
| [3] |
申姗娜, 侯喜林. 不结球白菜感染霜霉病菌后防御物质及酶的变化[J]. 南京农业大学学报, 2009, 32(1): 23-26. Shen S N, Hou X L. Changes of protective substances and enzymes in non-heading Chinese cabbage after infection by downy mildew[J]. Journal of Nanjing Agricultural University, 2009, 32(1): 23-26 (in Chinese with English abstract). DOI:10.7685/j.issn.1000-2030.2009.01.005 |
| [4] |
刘世拓, 肖栋, 许玉超, 等. 不结球白菜过氧化还原蛋白基因Brc2-Cys Prx的克隆和表达分析[J]. 南京农业大学学报, 2017, 40(1): 40-47. Liu S T, Xiao D, Xu Y C, et al. Clone and expression analysis of Brc2-Cys Prx gene from non-heading Chinese cabbage[J]. Journal of Nanjing Agricultural University, 2017, 40(1): 40-47 (in Chinese with English abstract). DOI:10.7685/jnau.201603040 |
| [5] |
Xiao S, Ellwood S, Calis O, et al. Broad-spectrum mildew resistance in Arabidopsis thaliana mediated by RPW8[J]. Science, 2001, 291(5501): 118-120. DOI:10.1126/science.291.5501.118 |
| [6] |
Gururani M A, Venkatesh J, Upadhyaya C P, et al. Plant disease resistance genes:current status and future directions[J]. Physiological and Molecular Plant Pathology, 2012, 78: 51-65. DOI:10.1016/j.pmpp.2012.01.002 |
| [7] |
Meyers B C, Kozik A, Griego A, et al. Genome-wide analysis of NBS-LRR-encoding genes in Arabidopsis[J]. Plant Cell, 2003, 15(4): 809-834. DOI:10.1105/tpc.009308 |
| [8] |
Bent A F, Kunkel B N, Dahlbeck D, et al. RPS2 of Arabidopsis thaliana:a leucine-rich repeat class of plant disease resistance genes[J]. Science, 1994, 265(5180): 1856-1860. DOI:10.1126/science.8091210 |
| [9] |
Hayashi N, Inoue H, Kato T, et al. Durable panicle blast-resistance gene Pb1 encodes an atypical CC-NBS-LRR protein and was generated by acquiring a promoter through local genome duplication[J]. The Plant Journal, 2010, 64(3): 498-510. DOI:10.1111/tpj.2010.64.issue-3 |
| [10] |
Deyoung B J, Innes R W. Plant NBS-LRR proteins in pathogen sensing and host defense[J]. Nature Immunology, 2006, 7(12): 1243-1249. DOI:10.1038/ni1410 |
| [11] |
Loutre C, Wicker T, Travella S, et al. Two different CC-NBS-LRR genes are required for Lr10 -mediated leaf rust resistance in tetraploid and hexaploid wheat[J]. The Plant Journal, 2009, 60(6): 1043-1054. DOI:10.1111/tpj.2009.60.issue-6 |
| [12] |
Zhang S, Ding F, Peng H, et al. Molecular cloning of a CC-NBS-LRR gene from Vitis quinquangularis, and its expression pattern in response to downy mildew pathogen infection[J]. Molecular Genetics and Genomics, 2018, 293(1): 61-68. DOI:10.1007/s00438-017-1360-y |
| [13] |
程永安, 柯桂兰. 影响大白菜霜霉病抗性鉴定的因素[J]. 西北农业学报, 1995, 4(4): 69-72. Cheng Y A, Ke G L. Factors affecting evaluation of Chinese cabbage resistance to downy midew[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 1995, 4(4): 69-72 (in Chinese with English abstract). |
| [14] |
徐淑平, 卫志明. 基因枪的使用方法介绍[J]. 植物生理学通讯, 1998, 34(1): 41-43. Xu S P, Wei Z M. Introduction to method of microprojectile bombardment and its application[J]. Plant Physiology Communications, 1998, 34(1): 41-43 (in Chinese). |
| [15] |
杨学东, 戴薇, 张昌伟, 等. 白菜病毒诱导基因沉默技术体系的建立[J]. 园艺学报, 2012, 39(11): 2168-2174. Yang X D, Dai W, Zhang C W, et al. The technology system establishment of VIGS in non-heading Chinese cabbage[J]. Acta Horticulturae Sinica, 2012, 39(11): 2168-2174 (in Chinese with English abstract). |
| [16] |
Xiao D, Liu S T, Wei Y P, et al. cDNA-AFLP analysis reveals differential gene expression in incompatible interaction between infected non-heading Chinese cabbage and Hyaloperonospora parasitica[J]. Horticulture Research, 2016, 3: 16034. DOI:10.1038/hortres.2016.34 |
| [17] |
Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [18] |
Jones J D G, Dangl J L. The plant immune system[J]. Nature, 2006, 444(7117): 323-329. DOI:10.1038/nature05286 |
| [19] |
陈俏丽, 王峰, 李丹蕾, 等. '大白谷'CC-NBS-LRR蛋白编码基因抗干尖线虫侵染时空表达研究[J]. 中国农学通报, 2015, 31(21): 279-283. Chen Q L, Wang F, Li D L, et al. Spatial-temporal expression of CC-NBS-LRR protein-coding gene resisting to infection of Aphelenchoides besseyi in Oryza sativa L. ssp. indica[J]. Chinese Agricultural Science Bulletin, 2015, 31(21): 279-283 (in Chinese with English abstract). DOI:10.11924/j.issn.1000-6850.casb15010080 |
| [20] |
Radwan O, Mouzeyar S, Nicolas P, et al. Induction of a sunflower CC-NBS-LRR resistance gene analogue during incompatible interaction with Plasmopara halstedii[J]. J Exp Bot, 2005, 56(412): 567-575. DOI:10.1093/jxb/eri030 |
| [21] |
Veena M, Melvin P, Prabhu S A, et al. Molecular cloning of a coiled-coil-nucleotide-binding-site-leucine-rich repeat gene from pearl millet and its expression pattern in response to the downy mildew pathogen[J]. Molecular Biology Reports, 2016, 43(3): 117-128. DOI:10.1007/s11033-016-3944-8 |
| [22] |
Radwan O, Gandhi S, Heesacker A, et al. Genetic diversity and genomic distribution of homologs encoding NBS-LRR disease resistance proteins in sunflower[J]. Molecular Genetics and Genomics, 2008, 280(2): 111-125. DOI:10.1007/s00438-008-0346-1 |
| [23] |
孙威, 许奕, 许桂莺, 等. 病毒诱导的基因沉默及其在植物研究中的应用[J]. 生物技术通报, 2015, 31(10): 105-110. Sun W, Xu Y, Xu G Y, et al. Virus-induced gene silencing and its application in plant research[J]. Biotechnology Bulletin, 2015, 31(10): 105-110 (in Chinese with English abstract). |
| [24] |
Pflieger S, Blanchet S, Camborde L, et al. Efficient virus-induced gene silencing in Arabidopsis using a 'one-step' TYMV-derived vector[J]. The Plant Journal, 2008, 56(4): 678-690. DOI:10.1111/tpj.2008.56.issue-4 |
| [25] |
Manmathan H, Shaner D L, Snelling J, et al. Virus-induced gene silencing of Arabidopsis thaliana gene homologues in wheat identifies genes conferring improved drought tolerance[J]. Journal of Experimental Botany, 2013, 64(5): 1381-1392. DOI:10.1093/jxb/ert003 |
| [26] |
Krishnan A, Mahadevan C, Mani T, et al. Virus-induced gene silencing(VIGS)for elucidation of pathogen defense role of serine/threonine protein kinase in the non-model plant Piper colubrinum Link[J]. Plant Cell, Tissue and Organ Culture, 2015, 122(2): 269-283. DOI:10.1007/s11240-015-0764-9 |




