文章信息
- 黄鹭, 黄颜众, 轩慧冬, 马玲, 郭娜, 赵晋铭, 邢邯
- HUANG Lu, HUANG Yanzhong, XUAN Huidong, MA Ling, GUO Na, ZHAO Jinming, XING Han
- 大豆GmMYB46基因的克隆、定位及表达分析
- Cloning, localization and expression analysis of GmMYB46 in soybean
- 南京农业大学学报, 2019, 42(2): 209-219
- Journal of Nanjing Agricultural University, 2019, 42(2): 209-219.
- http://dx.doi.org/10.7685/jnau.201804050
-
文章历史
- 收稿日期: 2018-04-27
MYB转录因子代表真核生物中最大的转录因子家族之一, 数量众多且功能多样[1]。Paz-Ares等[2]首次在单子叶植物玉米中发现了与花青素合成有关的MYB基因ZmMYBC 1。此后, 在拟南芥、水稻中陆续分离和鉴定了大量的MYB转录因子[3-4]。在大豆中, 目前已分析预测出127个1R-MYB、244个2R-MYB和6个3R-MYB[5]。近年来发现许多MYB转录因子在参与植物生长发育过程中起重要作用, 包括细胞周期和细胞分化, 初级和次级代谢, 激素合成和信号转导, 以及植物对各种生物和非生物胁迫的响应[6]。迄今为止, 已报道的大多数MYB转录因子均可响应非生物胁迫。许玲等[7]从栽培大豆品种‘Williams’中克隆得到R2R3类型的转录因子基因GmMYB 111, 该基因的表达量受到ABA、高盐、干旱和低温的诱导。Wang等[8]在大豆中分离出R2R3-MYB转录因子基因GmMYB 84, 其表达受到干旱、盐胁迫、H2O2和ABA的诱导, 且其过表达植株表现出抗旱性。Guo等[9]从桦木中克隆出了BplMYB46基因, 其属于R2R3-MYB转录因子; 通过过表达和沉默BplMYB46基因获得转基因桦木植株; 功能获得和缺失分析结果表明, 过表达BplMYB46植株通过影响SOD、POD基因以及P5CS基因的上调表达来提高其耐盐和耐渗透性。
基因定位在一定程度上影响其功能, 因此, 了解基因定位是系统研究植物生长发育、逆境耐性的首要环节之一。王春霞等[10]根据豌豆COP1蛋白的4种不同结构域的片段构建了不同结构域的亚细胞定位载体, 探索该基因在光信号转导中的作用。潘婷等[11]采用转基因技术分析AtKEA1和AtKEA2的N-端结构域的生物学功能, 结果表明N-端结构域决定AtKEA1和AtKEA2的亚细胞定位, 这对于了解AtKEA1和AtKEA2参与调节植物生长发育的生物功能至关重要; Huang等[12]对NbPHAN蛋白构建不同结构域的缺失突变体, 研究对定位起决定性作用的结构域, 并采用VIGS技术研究该基因对本氏烟叶片发育调控和干旱胁迫下的功能机制。大豆(Glycine max)是食用植物油的主要来源, 是家畜和人类高品质蛋白质的主要来源, 我国对大豆的需求逐年增加, 使大豆的遗传育种越来越受重视。尽管已鉴定出大量MYB46基因参与调节木质素生物途径并介导次生壁合成[13-15], 但关于大豆MYB46转录因子基因的研究还未见报道。本研究从大豆中克隆出1个R2R3型MYB转录因子基因GmMYB46, 对该基因进行生物信息学分析, 蛋白质全长及不同结构域的亚细胞定位, 以及在不同逆境处理条件下的表达模式分析, 为研究GmMYB46的生物学功能奠定了基础。
1 材料与方法 1.1 材料、菌株和试剂供试大豆(Glycine max)品种‘晋豆21’由中国农业科学院油料作物研究所提供; 亚细胞定位载体pBIN-GFP4由本实验室保存; 感受态(DH5α)、RNA提取试剂盒(DP419)购自天根公司; 限制性内切酶、pEASY-Blunt、T4连接酶、DNA Marker及反转录试剂盒(RR047A)购自TaKaRa公司; 用于基因克隆的高保真酶(phanta max super-Fidelity)、SYBR Green Master Mix(Q111-02)购自Vazyme公司; 引物合成和测序由南京金斯瑞生物公司完成。其他常规试剂为国产分析纯试剂。
1.2 生物信息学分析利用BioXM2.6对GmMYB46进行ORF查找、翻译及蛋白质理化性质的分析; 利用DNAMAN 7程序进行多重序列比对; 利用MEGA 5程序构建系统进化树; 利用GOR Ⅳ(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_gor4.html)程序预测GmMYB46蛋白质的二级结构; 利用SWISS-MODEL(https://swissmodel.expasy.org/interactive)数据库进行GmMYB46蛋白质的三级结构分析; 利用SoftBerry(http://linux1.softberry.com/berry.phtml)的TSST在线工具预测GmMYB46上游启动子序列中可能存在的转录起始位点; 利用PlantCARE(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)在线工具对GmMYB46上游启动子序列进行顺式作用元件分析; 利用在线的SMART(http://smart.embl-heidelberg.de)进行结构域分析; 利用WebLogo(http://weblogo.berkeley.edu/logo.cgi)在线程序分析R2R3-MYB转录因子蛋白结构域的保守位点。
1.3 GmMYB46基因的克隆挑选籽粒饱满、无机械损伤的‘晋豆21’种子播种于以蛭石为基质的花盆中, 置于25 ℃、16 h光照和8 h黑暗光周期条件的温室中培养, 当幼苗长至第1片三出复叶完全展开时, 取其嫩叶, 液氮速冻后置于-80 ℃冰箱保存, 用于克隆。
使用RNA提取试剂盒提取大豆叶片总RNA, 然后用TaKaRa反转录试剂盒进行反转录。以上均按试剂盒说明书进行操作。使用高保真酶以及基因上、下游引物(表 1), PCR扩增基因片段后进行胶回收, 将胶回收产物与pEASY-Blunt连接并转化DH5α, 涂布于含卡那霉素的LB培养基过夜培养, 挑取阳性克隆, PCR检测后送测序。测序正确的克隆用于后续试验。
| 引物名称 Primer name |
序列 Sequence(5′→3′) |
用途 Usage |
| GmMYB46-F | ATGAGGAAGCCAGAGGCGAGTAAT | GmMYB46克隆Cloning of GmMYB46 |
| GmMYB46-R | TCAGTATGAAAAATCAAGAAACGGAA | GmMYB46克隆Cloning of GmMYB46 |
| GmMYB46-L-F | GCTGGAGCATGGACTAAACAT | GmMYB46实时荧光定量RT-qPCR of GmMYB46 |
| GmMYB46-L-R | CACTTCTCCCAAATACTCCGTT | GmMYB46实时荧光定量RT-qPCR of GmMYB46 |
| GmActin-F | GGTGGTTCTATCTTGGCATC | 实时荧光定量内参Reference gene in RT-qPCR |
| GmActin-R | CTTTCGCTTCAATAACCCTA | 实时荧光定量内参Reference gene in RT-qPCR |
| GmMYB46-Y-F | CGGGGTACCATGAGGAAGCCAGAGGCGAGTAAT | GmMYB46亚克隆Sub-cloning of GmMYB46 |
| GmMYB46-Y-R | CGCGGATCCGTATGAAAAATCAAGAAACGGAA | GmMYB46亚克隆Sub-cloning of GmMYB46 |
| GmMYB46-YM1-F | TTTACGAACGATAGGGTACCATGAGGAAGCCAGAGGCG | GmMYB46M1亚克隆Sub-cloning of GmMYB46M1 |
| GmMYB46-YM1-R | TGCTCACCATGGATCCCCTGAGTCTTTTCTTTATCGTC | GmMYB46M1亚克隆Sub-cloning of GmMYB46M1 |
| GmMYB46-YM2-F | TTTACGAACGATAGGGTACCATGAATATGTCTTCCACGAC | GmMYB46M2亚克隆Sub-cloning of GmMYB46M2 |
| GmMYB46-YM2-R | CACTGCTCACCATGGATCCGTATGAAAAATCAAGAAACGGAAAG | GmMYB46M2亚克隆Sub-cloning of GmMYB46M2 |
| 注:下划线表示酶切位点, GGTACC表示kpnⅠ酶切位点, GGATCC表示BamHⅠ酶切位点。 Note: The underline indicates cleavage site, GGTACC indicates cleavage site of kpnⅠ, GGATCC indicates cleavage site of BamHⅠ. | ||
根据GmMYB46基因ORF序列及pBIN-GFP4载体多克隆位点设计引物(表 1), 并在其正、反向引物上分别加上KpnⅠ和BamHⅠ的酶切位点以及相应的保护碱基。以1.3节中获得的菌液为模板进行PCR扩增, 得到GmMYB46的ORF序列, 并将其通过酶切、连接的方法构建到pBIN-GFP4中, 获得pBIN-GmMYB46 -GFP的融合表达载体。采用基因枪法将pBIN-GmMYB46 -GFP的重组质粒轰击洋葱表皮细胞, 黑暗培养16~24 h, 制片, 并置于激光共聚焦显微镜下观察。
1.4.2 GmMYB46不同结构域的亚细胞定位根据1.2节中保守结构域的分析结果, 将GmMYB46蛋白全长截成2个部分, 分别是只含有MYB保守结构域的部分(M1, aa1~123)和去除MYB保守结构域的部分(M2, aa124~334), 并在其正、反向引物上分别加上KpnⅠ和BamHⅠ的酶切位点以及相应的保护碱基。以1.3节中获得菌液为模板进行PCR扩增得到GmMYB46M1和GmMYB46M2的目的片段, 并将其通过酶切、连接的方法构建到pBIN-GFP4中, 获得pBIN-GmMYB46M1 -GFP和pBIN-GmMYB46M2 -GFP的融合表达载体。采用基因枪法将pBIN-GmMYB46M1 -GFP和pBIN-GmMYB46M2 -GFP的重组质粒轰击洋葱表皮细胞, 黑暗培养16~24 h, 制片, 并置于激光共聚焦显微镜下观察。
1.5 GmMYB46基因在不同处理下的表达分析挑选籽粒饱满、无破皮的‘晋豆21’种子播种于以蛭石为基质的花盆中, 置于25 ℃、16 h光照和8 h黑暗光周期条件的温室中培养, 正常浇水。进行以下处理。
1.5.1 干旱胁迫待大豆第1片三出复叶刚刚展开时, 将每盆的大豆土壤一次性浇透后停止浇水。分别在停止浇水0、1、2、3、5、7 d取样, 取样部位分别为大豆的根、茎、叶。采用天根公司RNA提取试剂盒提取大豆各部位总RNA, 使用TaKaRa公司的荧光定量反转录试剂盒获得各组织的cDNA, 利用已设计的引物(表 1), 使用Vazyme公司的SYBR Green Master Mix试剂盒进行荧光定量PCR, 检测GmMYB46基因的表达水平。
1.5.2 盐胁迫待大豆第1片三出复叶刚刚展开时, 每盆用200 mmol · L-1 NaCl一次性浇透, 处理0、0.5、1、2、3、6、12、24 h后取样, 取样部位分别是大豆的根、茎、叶。提取RNA进行荧光定量PCR, 检测GmMYB46基因的表达水平。
1.5.3 低温胁迫待大豆第1片三出复叶刚刚展开时, 置于4 ℃(光照16 h)的人工培养箱中, 处理0、0.5、1、3、6、12、24 h后取样, 取样部位分别是大豆的根、茎、叶。提取RNA进行荧光定量PCR, 检测GmMYB46基因的表达水平。
1.5.4 激素处理待大豆第1片三出复叶刚刚展开时, 转移至200 μmol · L-1脱落酸(ABA)、500 μmol · L-1水杨酸(SA)以及100 μmol · L-1赤霉素(GA)溶液中培养, 处理0、6、12、24、36、48 h后取样, 取样部位分别是大豆的根、茎、叶。提取RNA进行荧光定量PCR, 检测GmMYB46基因的表达水平。
1.6 数据分析每个试验组设置3次生物学重复, 以大豆Actin基因(引物见表 1)作为内参基因, 利用2-ΔΔCT法计算目的基因的相对水平。利用SPSS 17.0软件进行统计分析, 采用t测验对GmMYB46基因的表达水平进行差异显著性分析。使用GraphPad Prism 5软件绘制柱形图。
2 结果与分析 2.1 GmMYB46 基因序列的克隆及同源性分析利用特异性引物, PCR扩增获得GmMYB46的ORF片段(图 1)。GmMYB46全长cDNA为1 005 bp, 编码334个氨基酸, 相对分子质量为82.53×103, 等电点为4.88。
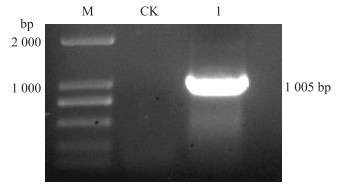
|
图 1 GmMYB46的PCR扩增产物 Fig. 1 PCR products of GmMYB46 M. DNA marker; CK.对照Control(H2O); 1. GmMYB46的PCR产物Products of GmMYB46. |
利用DNAMAN 7对GmMYB46蛋白和其他物种如:赤豆(Vigna angularis)、野生大豆(Glycine soja)、菜豆(Phaseolus vulgaris)、绿豆(Vigna radiata var.radiata)、木豆(Cajanus cajan)、蒺藜苜蓿(Medicago truncatula)、拟南芥(Arabidopsis thaliana)、棉花(Gossypium hirsutum)进行多序列比对, 比对结果(图 2)显示:栽培大豆GmMYB46与野生大豆GsMYB46、木豆CcXP020223863.1、赤豆VaBAT91826.1、菜豆PvXP007150366.1、绿豆VrXP014494074.1以及蒺藜苜蓿MtXP003597423.2的同源性分别为99%、77%、74%、71%、69%、60%, 表明该蛋白在豆科作物中的保守度较高, 亲缘关系较近。
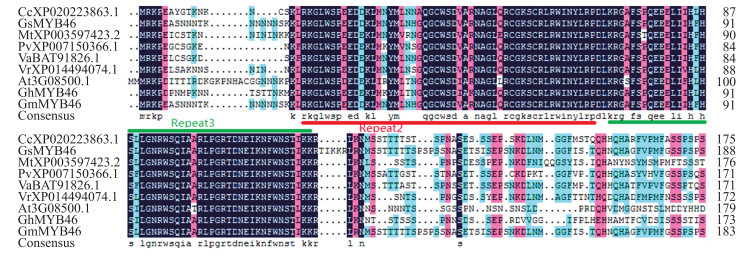
|
图 2 GmMYB46与其他物种MYB氨基酸序列的多重比对 Fig. 2 Amino acid alignment of GmMYB46 with MYB amino acid sequences from other plant species 1)Repeat2表示保守的R2结构域; Repeat3表示保守的R3结构域。Repeat2 indicated R2 domain repeat; Repeat3 indicated R3 domain repeat. 2)Cc:木豆Cajanus cajan; Gs:野生大豆Glycine soja; Mt:蒺藜苜蓿Medicago truncatula; Pv:菜豆Phaseolus vulgaris; Va:赤豆Vigna angularis; Vr:绿豆Vigna radiata var. radiata; At:拟南芥Arabidopsis thaliana; Gh:棉花Gossypium hirsutum; Gm:大豆Glycine max. |
为了进一步了解GmMYB46蛋白在物种中的进化位置和亲缘关系, 利用MEGA 7程序构建了多物种的系统进化树(图 3), 结果显示, 栽培大豆GmMYB46与野生大豆GsMYB46在进化树上位置靠近, 说明栽培大豆GmMYB46与野生大豆GsMYB46亲缘关系较近。
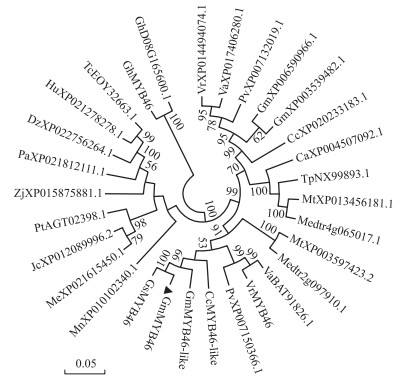
|
图 3 GmMYB46和其同源蛋白的系统进化树分析 Fig. 3 Phylogenetic tree analysis of GmMYB46 and other homologous protein Gm:大豆; Gs:野生大豆; Ca:鹰嘴豆; Pv:菜豆; Va:赤豆; Vr:绿豆; Mn:桑树; Me:木薯; Pt:白毛杨; Zj:栆; Jc:麻风树; Pa:樱桃; Dz:榴莲; Tc:可可; Gh:棉花; Cc:木豆; Mt:蒺藜苜蓿; Tp:三叶草; Hu:哥伦比亚锦葵。图中数值表示Bootstrap值, 数值越大分支可信度越高。 Gm:Glycine max; Gs:Glycine soja; Ca:Cicer arietinum; Pv:Phaseolus vulgaris; Va:Vigna angularis; Vr:Vigna radiata var. radiata; Mn:Morus notabilis; Me:Manihot esculenta; Pt:Populus tomentosa; Zj:Ziziphus jujuba; Jc:Jatropha curcas; Pa:Prunus avium; Dz:Durio zibethinus; Tc:Theobroma cacao; Gh:Gossypium hirsutum; Cc:Cajanus cajan; Mt:Medicago truncatula; Tp:Trifolium pratense; Hu:Herrania umbratica. The value indicated Bootstrap value, the bigger the value, the higher reliability of branch. |
利用GOR IV程序预测蛋白质的二级结构, GmMYB46蛋白由334个氨基酸组成, 其中64个氨基酸形成α-螺旋, 61个氨基酸形成延伸带, 209个氨基酸形成无规则卷曲。组成α-螺旋、延伸链和无规则卷曲的氨基酸比例分别为19.16%、18.26%和62.57%, α-螺旋散落在整个氨基酸序列中(图 4)。
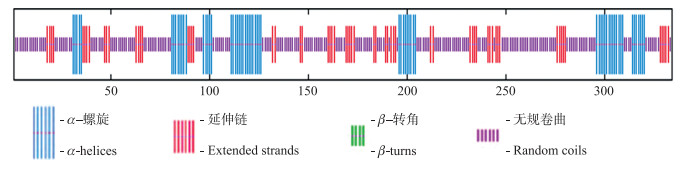
|
图 4 GmMYB46的二级结构预测 Fig. 4 Predicted secondary structure of GmMYB46 |
通过SWISS-MODEL在线软件模拟出输入蛋白序列的可能结构模型, GmMYB46蛋白质与已知模板蛋白1h8a.1.C(MYB transforming protein)的氨基酸序列具有44.23%的一致性, 其结构主要是螺旋-转角-螺旋(HTH), MYB蛋白借助此结构插入靶DNA分子大沟与目的DNA结合(图 5)。

|
图 5 GmMYB46的三维空间结构预测 Fig. 5 Predicted 3-D structure model of GmMYB46 |
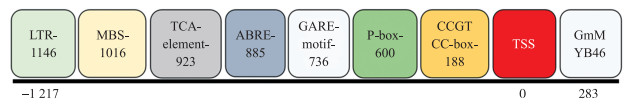
对GmMYB46上游1 500 bp的序列进行分析, 在GmMYB46起始密码子ATG上游283 bp的位置预测到1个转录起始位点(TSS)。取该位点上游1 217 bp的序列在PlantCARE网站上进行顺式作用元件分析(图 6), 结果显示, GmMYB46的启动子区除了基本元件TATA-box和CAAT-box外, 还发现了许多重要的顺式作用元件, 如与分生组织特异性激活有关的顺式调控元件CCGTCC-box以及一些与非生物胁迫相作用元件, 包括参与干旱诱导的MYB结合位点MBS, 参与低温反应的LTR元件, 参与赤霉素反应的元件GARE-motif和P-box, 参与脱落酸反应的顺式作用元件ABRE以及参与水杨酸反应的顺式元件TCA-element。除此之外, 大部分顺式作用调节元件参与光反应调节, 如ACE、CATT-motif、G-box、GATA-motif、I-box、MRE、TCT-motif等。
|
图 6 GmMYB46启动子区域的部分顺式作用元件 Fig. 6 Keycis-acting elements of the GmMYB46 promoter TSS:转录起始位点; CCGTCC-box:与分生组织特异性激活有关的顺式调控元件; P-box、GARE-motif:赤霉素反应元件; ABRE:参与脱落酸反应的顺式作用元件; TCA-element:参与水杨酸反应的顺式元件; MBS:MYB的结合位; LTR:参与低温响应的顺式作用元件。 TSS:Trancriptinal start site; CCGTCC-box:cis-acting regulatory element related to meristem specific activation; P-box, GARE-motif:Gibberellin-responsive element; ABRE:cis-acting element involved in the abscisic acid responsiveness; TCA-element:cis-acting elementinvolved in salicylic acid responsiveness; MBS:MYB binding site; LTR:cis-acting element involved in low-temperature responsiveness. |
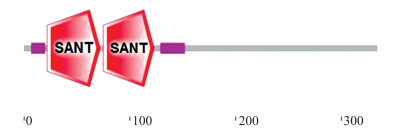
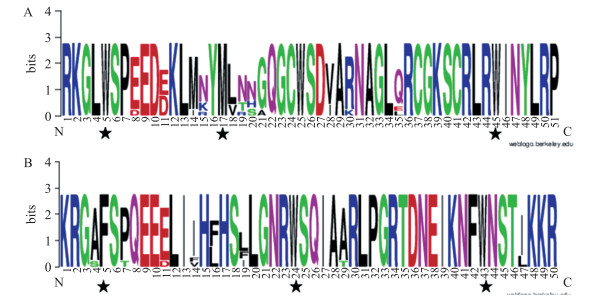
通过对GmMYB46蛋白保守结构域预测分析(图 7), 结果发现其含有2个SANT结构, 即MYB结构域, 分别位于第22~72位和第75~123位氨基酸。该结构域含有的2个不同MYB重复单元, 即为R2和R3。选取来自于其他物种, 如:赤豆(Vigna angularis)、野生大豆(Glycine soja)、菜豆(Phaseolus vulgaris)、绿豆(Vigna radiata var. radiata)、木豆(Cajanus cajan)、蒺藜苜蓿(Medicago truncatula)、拟南芥(Arabidopsis thaliana)、棉花(Gossypium hirsutum)、番茄(Solanum arcanum)等30条R2R3型MYB转录因子蛋白序列, 利用WebLogo分析MYB高度保守的结构域。结果显示, 长度约为51个氨基酸残基的R2结构域(图 8-A)中含有3个极其保守的色氨酸残基W, 而R3结构域(图 8-B)的第1个色氨酸残基被苯丙氨酸(F)所取代, R3结构域的第2个和第3个色氨酸也高度保守, 符合R2R3-MYB的特征。在MYB蛋白中含有的3个串联重复序列(R1、R2、R3)参与DNA的结合, 且R2、R3直接与DNA主沟相连, 对DNA结合活性的影响至关重要。
|
图 7 GmMYB46蛋白的保守结构域 Fig. 7 The conserved domains of GmMYB46 protein |
|
图 8 R2R3型MYB转录因子高度保守的DNA binding结构域 Fig. 8 Highly conserved DNA binding domain of R2R3-MYB transcription factors A.高度保守的R2结构域; B.高度保守的R3结构域; 黑色星号表示保守氨基酸残基。 A. Highly conserved R2 domain; B. Highly conserved R3 domain; black star indicated conserved amino acid residue. |
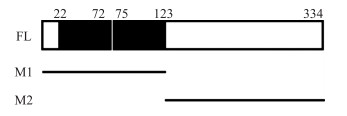
MYB转录因子只有进入细胞核才能调控靶基因的转录[16]。为了鉴定对定位起作用的结构域, 通过聚合酶链式反应(PCR)扩增GmMYB 46不同结构域的片段, 分别是只含有MYB保守结构域的部分(M1, aa1~123)和去除MYB保守结构域的部分(M2, aa124~334)(图 9)。将对照pBIN-GFP、pBIN-GmMYB46 -GFP、pBIN-GmMYB46M1 -GFP和pBIN-GmMYB46M2 -GFP重组质粒瞬时转化洋葱表皮, 激光共聚焦结果显示, 在对照中, 细胞核、细胞质、细胞膜上均能观察到GFP绿色荧光, 只含有MYB结构域片段(pBIN-GmMYB46M1 -GFP)表现出了与pBIN-GmMYB46 -GFP相同的亚细胞定位结果, 即绿色荧光均集中在细胞核上, 而pBIN-GmMYB46M2 -GFP融合蛋白的绿色荧光分布在整个植物细胞中(图 10)。
|
图 9 GmMYB46全长和各不同结构域片段的示意图 Fig. 9 Schematic diagram of full-length GmMYB46 and various domain of GmMYB46 FL表示GmMYB46全长(aa1~334);M1表示只含有MYB结构域的片段(aa1~123);M2表示不含有MYB结构域片段(aa124~334), 2个黑框代表 2个重复的MYB结构域。 FL represents the full-length of GmMYB46(aa1-334);M1 represents MYB domain(aa1-123);M2 represents the fragment without MYB domain(aa124-334).The two black boxes represent the two repeat units of MYB domain. |
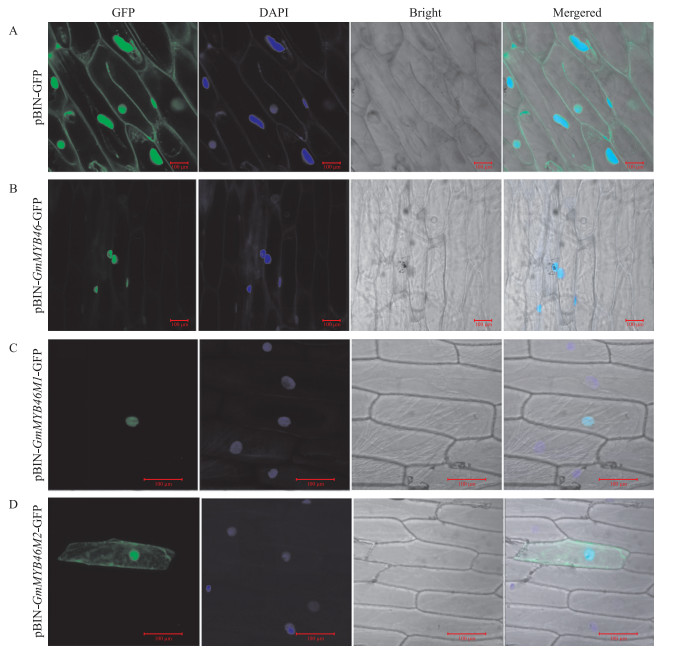
|
图 10 GmMYB46蛋白亚细胞定位分析 Fig. 10 The analysis of subcellular localization of GmMYB46 A. pBIN-GFP蛋白定位; B. pBIN-GmMYB46 -GFP融合蛋白定位; C. pBIN-GmMYB46M1 -GFP融合蛋白定位; D. pBIN-GmMYB46M2 -GFP融合蛋白定位。图中标尺代表 100 μm。DAPI是一种核染料, 作为阳性对照。 Micrographs showing cells expressing:pBIN-GFP(control, A); pBIN-GmMYB46 -GFP fusion protein(B); pBIN-GmMYB46M1 -GFP fusion protein(C); pBIN-GmMYB46M2 -GFP fusion protein(D). Scale bar represented 100 μm. DAPI is a nuclear dye that serves as a positive control. |
为研究GmMYB46基因对非生物胁迫的响应, 利用荧光定量PCR分析该基因在非生物胁迫和激素处理后的表达模式。结果(图 11)表明, 在自然干旱条件下, GmMYB46在根、茎、叶中均受诱导, 在干旱5 d的根、7 d的茎以及3 d的叶中, GmMYB46表达量分别约为对照的22、12和4.5倍(图 11-A)。在200 mmol · L-1 NaCl处理下, GmMYB46的转录水平在根、茎、叶中都表现出先上调后下降再上调的趋势, 在盐处理1 h的根、24 h的茎以及6 h的叶中GmMYB46表达量分别约为对照的4、3和2倍(图 11-B)。对大豆幼苗进行4 ℃低温处理, 在处理后的短时间内, GmMYB46在根、茎、叶中的表达量并没有发生明显变化, 在12 h时表达量均开始上升, 且处理12 h时在叶中表达量最高, 约为对照的24倍(图 11-C)。在200 μmol · L-1 ABA处理下, GmMYB46在根中上调表达; 在茎中6 h后表达量最高, 此后下调表达; 在叶中, 处理12 h后上调表达(图 11-D)。在500 μmol · L-1水杨酸(SA)以及100 μmol · L-1赤霉素(GA)溶液处理48 h时, GmMYB46在根、茎、叶中的表达量均达到了峰值(图 11-E、F)。这些结果表明, GmMYB46基因受到非生物胁迫和激素的诱导表达。
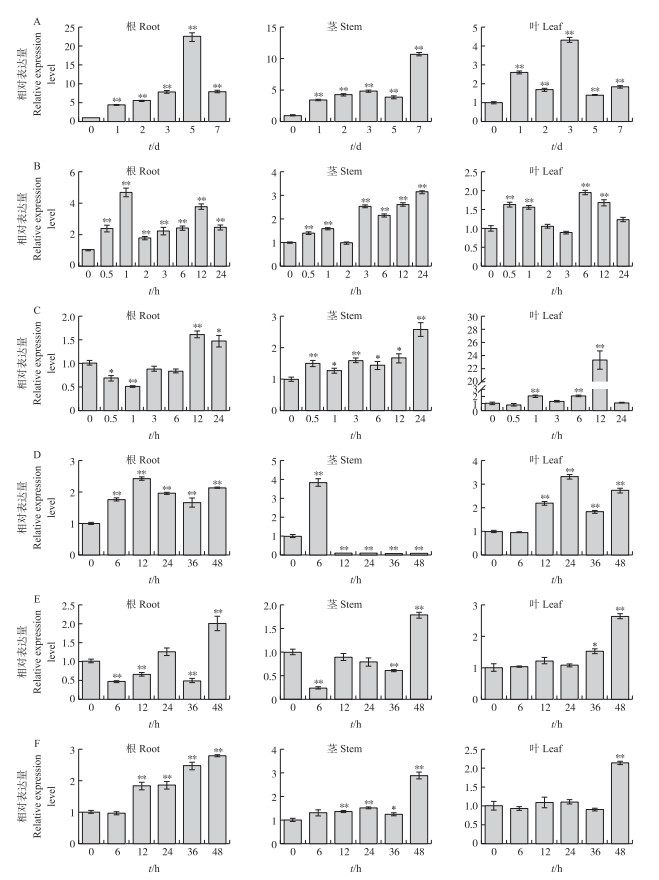
|
图 11 不同胁迫下GmMYB46基因的表达分析 Fig. 11 Expressions analysis of GmMYB46 gene under different stresses A.干旱胁迫Drought stress; B. 200 mmol · L-1 NaCl; C. 4 ℃; D. 200 μmol · L-1 ABA; E. 500 μmol · L-1 SA; F. 100 μmol · L-1 GA.*P<0.05, * *P<0.01. |
MYB转录因子是目前发现的数量最多、功能最多样化转录因子家族之一, 在N末端具有高度保守的DNA结合序列, 即MYB结构域, 该结构域由1~3个串联且不完全重复的R结构组成, R结构由约52个氨基酸残基组成, 每个R结构包括3个规则间隔的保守氨基酸残基, 这3个保守氨基酸残基形成疏水核心, 维持HTH结构的稳定性[17]。其中, 具有2个R结构的R2R3-MYB基因构成了植物中最大的MYB亚家族。本研究从大豆中分离的MYB转录因子基因GmMYB46, 其结构显示在氨基酸序列N端含有2个重复的R结构, 分别由51个和48个氨基酸残基组成, 每个R结构中含有3个极其保守的色氨酸残基W, 其中R3结构域的第1个色氨酸残基被苯丙氨酸(F)所取代, 符合R2R3-MYB转录因子的结构特征。系统进化树分析表明, 栽培大豆GmMYB46与赤豆(Vigna angularis)、野生大豆(Glycine soja)、菜豆(Phaseolus vulgaris)、绿豆(Vigna radiata var. radiata)、木豆(Cajanus cajan)等豆科作物同源性较高, 且与野生大豆GsMYB46在同一分支上, 说明亲缘关系最为接近。
MYB转录因子通常在细胞核内与靶标基因的启动子区域结合, 发挥其激活或抑制该基因表达的功能, 因此, 转录因子一般被定位于细胞核中, 起着调控表达的作用。Zhao等[18]对GmMYBJ3进行氨基酸序列特征及亚细胞定位分析, GmMYBJ3定位在细胞核中。Feng等[19]提出并验证了OjMYB1是一种核蛋白。此外, BplMYB46、ClMYB46等的亚细胞定位分析也表明, 这些基因都定位在细胞核中[9, 20]。本研究通过基因枪法将pBIN-GmMYB46 -GFP的重组质粒轰击洋葱表皮细胞, 进行该蛋白全长的亚细胞定位分析, 瞬时表达的研究结果表明, GmMYB46定位在细胞核中, 与上述研究结果一致。然而对MYB蛋白定位起决定作用的结构域的研究, 目前鲜见报道。为了明确GmMYB46蛋白对核定位起决定性的结构域, 本研究针对该蛋白的保守结构域将GmMYB46基因编码的蛋白分为2个片段:只含有MYB保守结构域的片段(M1, aa1~123)和不含MYB保守结构域的片段(M2, aa124~334), 并以pBIN-GFP为载体, 成功构建pBIN-GmMYB46M1 -GFP和pBIN-GmMYB46M2 -GFP融合表达载体。亚细胞定位结果显示, GmMYB46M1定位在细胞核中, 而GmMYB46M2在整个细胞中均有表达。本试验证明MYB转录因子结构域的功能分工, GmMYB46中含有MYB结构域的部分能够与染色体DNA结合, 发挥转录因子的核定位作用; 不含MYB结构域的部分是转录因子的调控区, 通过抑制或激活下游靶细胞, 发挥相应的作用, 进而调控相关的生理代谢, 即GmMYB46的MYB结构域对核定位信号是必需的。
已有研究报道, MYB转录因子可以应答植物激素和非生物胁迫的响应[21-26]。小麦转录因子基因TaMYB 33启动子序列中含有ABRE、MYB等非生物胁迫相关的顺式作用元件, 其过表达植株表现出对干旱和盐胁迫增强的耐受性[27]。拟南芥转录因子基因AtMYB 44和AtMYB61通过ABA介导气孔关闭来提高干旱和盐胁迫的耐受性[28-29]。GmMYBJ 1可通过激活下游基因, 包括AtRD 29B, AtCOR47, AtCOR78, AtP5CS和AtCOR15a从而赋予了转基因拟南芥植物干旱和耐冷性[30]。过表达OsMYB 4基因可以提高拟南芥植株的耐冷性[31], 水稻OsMYB 3R-2基因也与植株的冷胁迫相关[32]。在植物应答逆境的过程中, 植物激素对植物的生长发育和逆境信号具有重要的调控作用。小麦的TaMYB 4基因表达受到外源SA、ABA、MeJA的调控[33], 白木香AsMYB 1、AsMYB2基因在外源激素ABA、SA、GA3、MeJA处理下均被诱导表达[34]。在对GmMYB46转录起始位点上游的启动子元件进行分析时也发现了MBS、ABRE、GARE、TCA、LTR等逆境胁迫应答元件, 对比前人的研究推断这些元件的存在可能使GmMYB46参与对逆境胁迫的调控过程。在本研究中对GmMYB46进行了干旱、高盐、低温、ABA、SA及GA处理, 发现GmMYB46对这些处理均有响应。高盐胁迫可对植物造成离子毒害和渗透胁迫两方面的影响, GmMYB46对盐胁迫的响应表现出先上升后下降再上升的趋势。对干旱胁迫的响应中, GmMYB46在根和茎的表达量升高最多, 在茎、叶中的表达出现了先升高再下降又升高的趋势。在4 ℃低温诱导下, GmMYB46在叶中被显著诱导, 在根、茎中表达量的上升趋势趋于平稳。GmMYB46在应对外源ABA、SA、GA激素胁迫处理时, 其转录水平在根、茎、叶中均上调, 这与GmMYB46上游启动子中存在ABRE、GARE、TCA等顺式作用元件一致。且ABA胁迫时处理短时间后, 在根、茎中的表达量快速上升, 说明其对ABA极为敏感, 在SA及GA处理48 h时, GmMYB46在根、茎、叶中的转录水平均达到了峰值, 这些试验结果表明GmMYB46基因的表达受到激素的影响, 可能对植物体内激素信号的接收、传导和应答机制具有重要作用。本结果对于进一步阐明GmMYB46转录因子基因调控逆境胁迫的作用奠定了基础。
| [1] |
Baldoni E, Genga A, Cominelli E, et al. Plant MYB transcription factors:their role in drought response mechanisms[J]. Intl J Mol Sci, 2015, 16(7): 15811-15851. DOI:10.3390/ijms160715811 |
| [2] |
Paz-Ares J, Ghosal D, Wienand U, et al. The regulatory c1 locus of Zea mays encodes a protein with homology to myb proto-oncogene products and with structural similarities to transcriptional activators[J]. EMBO J, 1987, 6(12): 3553-3558. DOI:10.1002/embj.1987.6.issue-12 |
| [3] |
Dubos C, Stracke R, Grotewold E, et al. MYB transcription factors in Arabidopsis[J]. Trends Plant Sci, 2010, 15(10): 573-581. DOI:10.1016/j.tplants.2010.06.005 |
| [4] |
Katiyar A, Smita S, Lenka S K, et al. Genome-wide classification and expression analysis of MYB transcription factor families in rice and Arabidopsis[J]. BMC Genomics, 2012, 13: 544. DOI:10.1186/1471-2164-13-544 |
| [5] |
Liu J, Osbourn A, Ma P. MYB transcription factors as regulators of phenylpropaniod metabolism in plants[J]. Mol Plant, 2015, 8: 689-708. DOI:10.1016/j.molp.2015.03.012 |
| [6] |
Wang H Y, Wang H L, Shao H B, et al. Recent advances in utilizing transcription factors to improve plant abiotic stress tolerance by transgenic technology[J]. Front Plant Sci, 2016, 7: 67. |
| [7] |
许玲, 卫培培, 张大勇, 等. 大豆转录因子基因GmMYB111的克隆及功能分析[J]. 中国农业科学, 2015, 48(15): 3079-3089. Xu L, Wei P P, Zhang D Y, et al. Expression and function analysis of the transcription factor GmMYB111 in soybean[J]. Scientia Agricultura Sinica, 2015, 48(15): 3079-3089 (in Chinese with English abstract). DOI:10.3864/j.issn.0578-1752.2015.15.019 |
| [8] |
Wang N, Zhang W X, Qin M Y, et al. Drought tolerance conferred in soybean(Glycine max L.) by GmMYB84, a novel R2R3-MYB transcription factor[J]. Plant Cell Physiol, 2017, 58(10): 1764-1776. DOI:10.1093/pcp/pcx111 |
| [9] |
Guo H Y, Wang Y C, Wang L Q, et al. Expression of the MYB transcription factor gene BplMYB46 affects abiotic stress tolerance and secondary cell wall deposition in Betula platyphylla[J]. Plant Biotechnology Journal, 2017, 15: 107-121. DOI:10.1111/pbi.2017.15.issue-1 |
| [10] |
王春霞, 黄晨辉, 吴光耀, 等. 转基因烟草分析COP1亚细胞定位及各结构域的功能[J]. 科学通报, 2002, 47(7): 501-507. Wang C X, Huang C H, Wu G Y, et al. Transgenic tobacco analysis of subcellular localization of COP1 and function of each domain[J]. Chinese Science Bulletin, 2002, 47(7): 501-507 (in Chinese with English abstract). DOI:10.3321/j.issn:0023-074X.2002.07.004 |
| [11] |
潘婷, 邱全胜. N-端结构域决定拟南芥KEA1和KEA2的亚细胞定位及定位与功能的关系[J]. 中国科技论文, 2017, 12(18): 2124-2129. Pan T, Qiu Q S. N-terminal domain of Arabidopsis KEA1 and KEA2 determines their subcellular localization and relation between localization and function[J]. China Science Paper, 2017, 12(18): 2124-2129 (in Chinese with English abstract). DOI:10.3969/j.issn.2095-2783.2017.18.016 |
| [12] |
Huang C J, Hu G J, Li F F, et al. NbPHAN, a MYB transcriptional factor, regulates leaf development and affects drought tolerance in Nicotiana benthamiana[J]. Physiologia Plantarum, 2013, 149: 297-309. |
| [13] |
Kim W C, Ko J H, Kim J Y, et al. MYB46 directly regulates the gene expression of secondary wall-associated cellulose synthases in Arabidopsis[J]. Plant J, 2013, 73(1): 26-36. DOI:10.1111/j.1365-313x.2012.05124.x |
| [14] |
Zhong R Q, Ye Z H. MYB46 and MYB83 bind to the SMRE sites and directly activate a suite of transcription factors and secondary wall biosynthetic genes[J]. Plant Cell Physiol, 2012, 53(2): 368-380. DOI:10.1093/pcp/pcr185 |
| [15] |
朱秋萍, 郭春苗, 王娟, 等. 扁桃MYB46转录因子基因的克隆及其表达模式分析[J]. 植物生理学报, 2018, 54(4): 669-676. Zhu Q P, Guo C M, Wang J, et al. Cloning and expression patterns analysis of MYB46 transcription factor gene in almond[J]. Plant Physiology Journal, 2018, 54(4): 669-676 (in Chinese with English abstract). |
| [16] |
杨文杰.大豆MYB转录因子基因的克隆及其表达研究[D].雅安: 四川农业大学, 2007. Yang W J. Cloning and expression of soybean MYB transcription factor gene[D]. Ya'an: Sichuan Agricultural University, 2007(in Chinese with English abstract). |
| [17] |
杜海, 杨文杰, 刘蕾, 等. 大豆MYB转录因子基因GmMYBJ6和GmMYBJ7的克隆及表达分析[J]. 作物学报, 2008, 34(7): 1179-1187. Du H, Yang W J, Liu L, et al. Cloning and functional identification of the two MYB transcription factors GmMYBJ6 and GmMYBJ7 in soybean[J]. Acta Agronomica Sinica, 2008, 34(7): 1179-1187 (in Chinese with English abstract). |
| [18] |
Zhao M Z, Wang T L, Wu P, et al. Isolation and characterization of GmMYBJ3, an R2R3-MYB transcription factor that affects isoflavonoids biosynthesis in soybean[J]. PLoS One, 2017, 12(6). |
| [19] |
Feng K, Xu Z S, Que F, et al. An R2R3-MYB transcription factor, OjMYB1, functions in anthocyanin biosynthesis in Oenanthe javanica[J]. Planta, 2018, 247(2): 301-315. DOI:10.1007/s00425-017-2783-8 |
| [20] |
曹蕾.西瓜ClMYB46基因的耐低温功能鉴定及调控作用分析[D].武汉: 华中农业大学, 2017. Cao L. Functional identification and regulation analysis of low temperature responsive CLMYB46 in watermelon[D]. Wuhan: Huazhong Agricultural University, 2017(in Chinese with English abstract). |
| [21] |
Wei Q H, Luo Q C, Wang R B, et al. A wheat R2R3-type MYB transcription factor TaODORANT1 positively regulates drought and salt stress responses in transgenic tobacco plants[J]. Front Plant Sci, 2017, 8: 1374. DOI:10.3389/fpls.2017.01374 |
| [22] |
Prabu G, Ppasad D T. Functional characterization of sugarcane MYB transcription factor gene promoter(PScMYBASl) in response to abiotic stresses and hormones[J]. Plant Cell Reports, 2012, 31(4): 661-669. DOI:10.1007/s00299-011-1183-y |
| [23] |
Chen W Q, Provart N J, Glazebrook J, et al. Expression profile matrix of Arabidopsis transcription factor genes suggests their putative functions in response to environmental stresses[J]. Plant Cell, 2002, 14(3): 559-574. DOI:10.1105/tpc.010410 |
| [24] |
Rubio V, Linhares F, Solano R, et al. A conserved MYB transcription factor involved in phosphate starvation signaling both in vascular plants and in unicellular algae[J]. Genes & Development, 2001, 15(16): 2122-2133. |
| [25] |
Tang Z, Sadka A, Morishige D T, et al. Homeodomain leucine zipper proteins bind to the phosphate response domain of the soybean VspB tripartite promoter[J]. Plant Physiology, 2001, 125(2): 797-809. DOI:10.1104/pp.125.2.797 |
| [26] |
Wu P, Ma L, Hou X, et al. Phosphate starvation triggers distinct alterations of genome expression in Arabidopsis roots and leaves[J]. Plant Physiology, 2003, 132(3): 1260-1271. DOI:10.1104/pp.103.021022 |
| [27] |
Qin Y X, Wang M C, Tian Y C, et al. Over-expression of TaMYB33 encoding a novel wheat MYB transcription factor increases salt and drought tolerance in Arabidopsis[J]. Mol Biol Rep, 2012, 39(6): 7183-7192. DOI:10.1007/s11033-012-1550-y |
| [28] |
Liang Y K, Dubos C, Dodd I C, et al. AtMYB61, an R2R3-MYB transcription factor controlling stomatal aperture in Arabidopsis thaliana[J]. Curr Biol, 2008, 15(13): 1201-1206. |
| [29] |
Jung C, Seo J S, Han S W, et al. Overexpression of AtMYB44 enhances stomatal closure to confer abiotic stress tolerance in transgenic Arabidopsis[J]. Plant Physiol, 2008, 146(2): 623-635. |
| [30] |
Su L T, Li J W, Liu D Q, et al. A novel MYB transcription factor, GmMYBJ1, from soybean confers drought and cold tolerance in Arabidopsis thaliana[J]. Gene, 2014, 538(1): 46-55. DOI:10.1016/j.gene.2014.01.024 |
| [31] |
Vannini C, Locatelli F, Bracale M, et al. Overexpression of the rice Osmyb4 gene increases chilling and freezing tolerance of Arabidopsis thaliana plants[J]. Plant J, 2004, 37(1): 115-127. DOI:10.1046/j.1365-313X.2003.01938.x |
| [32] |
Ma Q, Dai X, Xu Y, et al. Enhanced tolerance to chilling stress in OsMYB3R-2 transgenic rice is mediated by alteration in cell cycle and ectopic expression of stress genes[J]. Plant Physiol, 2009, 150(1): 244-256. DOI:10.1104/pp.108.133454 |
| [33] |
Al-Attala M N, Wang X, Abou-Attia M A, et al. A novel TaMYB4 transcription factor involved in the defence response against Puccinia striiformis f. sp. tritici and abiotic stresses[J]. Plant Mol Biol, 2014, 84(4/5): 589. |
| [34] |
冯莹莹, 董先娟, 刘晓, 等. 白木香转录因子AsMYB1和AsMYB2克隆及表达分析[J]. 中国中药杂志, 2017, 42(17): 3305-3311. Feng Y Y, Dong X J, Liu X, et al. Cloning and expression analysis of transcription factor AsMYB1 and AsMYB2 from Aquilaria sinensis[J]. China Journal of Chinese Materia Medica, 2017, 42(17): 3305-3311 (in Chinese with English abstract). |




