文章信息
- 段银平, 薛瑛, 周爽, 张敏, 张宾, 李惠侠
- DUAN Yinping, XUE Ying, ZHOU Shuang, ZHANG Min, ZHANG Bin, LI Huixia
- 脂肪因子Chemerin对牛卵巢颗粒细胞凋亡与自噬的影响
- Effect of Chemerin on apoptosis and autophagy in bovine granulosa cells
- 南京农业大学学报, 2019, 42(1): 145-151
- Journal of Nanjing Agricultural University, 2019, 42(1): 145-151.
- http://dx.doi.org/10.7685/jnau.201801017
-
文章历史
- 收稿日期: 2018-01-15
2. 新疆农垦科学院省部共建绵羊遗传改良与健康养殖国家重点实验室, 新疆 石河子 832000
2. State Key Laboratory of Sheep Genetic Improvement and Healthy Production, Xinjiang Academy of Agricultural and Reclamation Sciences, Shihezi 832000, China
卵巢颗粒细胞作为卵泡内非常重要的一种体细胞, 通过间隙连接或旁分泌等方式对卵母细胞的发育及成熟起支持、调控和营养等作用[1]。近期的研究显示, 卵泡的发育、闭锁与颗粒细胞凋亡有关[2]。Chemerin也称为他扎罗汀诱导基因2蛋白(tazarozene-inducde gene 2 protein, TIG2)或视黄醇受体反应蛋白2(retinoic acid receptor responder protein 2, RARRES2), 是2007年发现的具有趋化作用的脂肪因子, 主要通过自分泌或旁分泌途径作用于Chemerin样受体1(Chemokin receptor like 1, CMKLRl)而实现其生物学功能[3]。Chemerin不仅对脂肪细胞本身分化及代谢有着重要的调节作用, 最近有研究表明Chemerin还可能影响雄性和雌性的生殖功能, 如在啮齿类及人的卵巢和睾丸、人脐带血中存在Chemerin的表达, 其功能涉及到卵泡发育、孕期母胎代谢以及睾丸睾酮的生成[4-5]。多囊卵巢综合征(PCOS)大鼠血清中Chemerin的含量明显升高, 卵巢中Chemerin及其受体CMKLR1的RNA和蛋白水平明显升高, 体外试验显示Chemerin会抑制FSH诱导的孕酮和雌二醇分泌, 进而促进颗粒细胞发生凋亡[5]。而凋亡并非决定细胞命运的唯一, 被称作Ⅱ型程序性细胞死亡的细胞自噬被证实与凋亡共同调控细胞死亡, 二者通路相互关联, 互为调控[6]。有研究认为氧化应激通过介导Chemerin诱导了内皮细胞自噬的发生[7]。Chemerin可诱导线粒体功能紊乱使骨骼肌细胞发生自噬[8]。但目前有关Chemerin及其受体信号在卵巢生物学中的作用仍不清楚, 其在卵巢颗粒细胞凋亡和自噬发生中的具体机制也尚不明确。本研究拟以牛卵巢颗粒细胞为试验材料, 用重组Chemerin蛋白处理牛卵巢颗粒细胞, 分析Chemerin对卵巢颗粒细胞凋亡和自噬的作用, 以探明脂肪分泌因子对动物繁殖性能的调控关系。
1 材料与方法 1.1 试剂Chemerin(2325-CM-025)购于R & D公司, 溶解于含有10 g·L-1牛血清白蛋白的PBS中, 稀释成100 μg·mL-1母液, 过滤除菌, -20 ℃保存。DMEM/F12培养基购自Hyclone公司, 胎牛血清(FBS)购于浙江天杭生物科技有限公司; 活性氧(ROS)检测试剂盒、细胞活性检测试剂盒(CCK8)、丙二醛(MDA)含量及超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GSH-Px)检测试剂盒购买于南京建成生物工程研究所; Trizol试剂购自Invitrogen公司, PrimeScriptTM RT Master Mix、SYBR Premix Ex TaqTM Ⅱ购于TaKaRa公司。
1.2 卵巢颗粒细胞的培养和处理奶牛卵巢采自南京市浦口区家虎牛羊屠宰场, 装入加有链霉素和青霉素的PBS中, 于30 ℃、4 h内运回试验室。PBS清洗2次, 从卵巢表面抽取2 mL卵泡液, 用DMEM洗涤离心(1 500 r·min-1, 6 min)2次, 接种培养板后置于CO2培养箱内培养, 培养条件:37 ℃, 5% CO2, 饱和湿度。12 h待细胞贴壁后更换培养基以除去死细胞, 每24 h换培养液1次, 待细胞长至80%~90%汇合时进行细胞消化及传代培养。试验设置对照组和处理组(0.2 μg·mL-1重组Chemerin蛋白处理细胞24 h)。
1.3 免疫荧光法鉴定牛卵巢颗粒细胞分离牛卵巢颗粒细胞制作细胞爬片, 按照免疫荧光步骤进行如下操作, 待细胞长至1×106后, 吸出培养基, PBS洗2次, 每次3 min, 每孔加1 mL 4%(体积分数)的多聚甲醛溶液固定细胞1 h, PBS洗3次后用体积分数为0.5%的Triton-X100穿孔10 min, PBS洗2次后用2%(体积分数)BSA封闭1 h, 然后加入稀释好的卵泡刺激素受体(follicle-stimulating hormone receptor, FSHR, 购于Proteintech公司)兔多克隆抗体(1:500)孵育, 4 ℃过夜, PBS洗3次后羊抗兔IgG(1:500)室温孵育1 h, PBS洗3次后加入Hoechst 33342染核10 min, PBS洗3次后用DAPI染液的封片剂进行封片, 置于激光共聚焦显微镜下观察染色情况。
1.4 细胞中ROS含量的测定将各组细胞制成细胞爬片, 加入Chemerin培养24 h后, 移去细胞培养液, 用PBS洗1次, 加入2 mL的4%多聚甲醛固定细胞30 min, PBS洗1次, 根据活性氧(ROS)检测试剂盒说明书进行操作, 最后在倒置激光共聚焦显微镜下观察染色结果。
1.5 MDA含量和GSH-px、SOD活性的测定按照MDA含量和GSH-px、SOD活性检测试剂盒说明书操作。每个样品重复6次, 取平均值。
1.6 流式细胞术检测细胞凋亡用2.5 g·L-1胰酶消化细胞, 吸取细胞悬液置于流式管内, PBS洗2次, 弃上清液后按照Annexin V-FITC凋亡双染测定试剂盒(购于美国BD公司)说明书进行。
1.7 CCK-8测定细胞活力细胞接种于96孔细胞培养板, 分组处理后按照CCK-8试剂盒说明书操作。每个样品重复6次, 取平均值。
1.8 RNA提取与RT-qPCR测定取出细胞培养板, 弃上清液, PBS洗2次后按Trizol试剂盒说明书提取细胞总RNA。取1 000 ng总RNA用TaKaRa试剂盒反转录成cDNA, -80 ℃保存备用。按照SYBR green试剂盒检测mRNA的表达水平。反应产物经熔解曲线检测特异性。用2-ΔΔCT计算各基因相对表达量。引物序列见表 1。
| 基因Gene | 基因登录号GenBank ID | 引物对序列(5'→3') Prime pairs sequences |
| Bax | XM_010814989.2 | CCAGCAAACTGGTGCTCAAGG/AGCCGCTCTCGAAGGAAGTC |
| Bcl-2 | XM_005224105.3 | AGCATCGCCCTGTGGATGAC/CAGCCTCCGTTGTCCTGGAT |
| Caspase3 | AB090246.2 | CTGAGGGTCAGCTCCTAGCG/GCTGCAGCTCTGCTGGACT |
| Atg7 | NM_001142967.1 | CAAGAGAGACCGGGATGA/GCTCAGAACCGGTGGGATGA |
| P62 | NM_001191531.1 | ATTGAGCCAGCTCAGGCTGT/CTGGCTGGAAGTCAGGCTGT |
| β-actin | X00182.1 | CATGCCATCCTCCGTCTGGA/CTCTCGGCTGTGGTGGTGAA |
收集细胞, 加入含PMSF的裂解液, 采用BCA试剂盒提取细胞总蛋白。加入上样缓冲液, 100 ℃变性10 min, 用预制胶进行电泳分离, 电泳完毕后电转移到硝酸纤维素膜上, 用50 g·L-1脱脂牛奶室温封闭1 h, 加一抗室温孵育2 h或者4 ℃过夜, 加二抗(HRP标记的羊抗兔IgG)孵育1 h, 最后用化学发光法显示结果, 用Image J进行条带的灰度分析。试验所用抗体(多抗):Bax(n-20)、Bcl-2(H-62)和pro-Caspase-3(sc-7148)购于Santa公司, cleaved-Caspase-3(bs-0081R)购于北京博奥森公司, α-tubulin(11H10)购于CST公司, LC3(AB100-2220)和P62(H00000644-M01)购于NOVUS公司。
1.10 统计分析采用SPSS 20.0分析软件进行方差分析和显著性检验。所有数据均采用平均值±标准误(x±SE)表示。所有试验均重复3次。
2 结果与分析 2.1 牛卵巢颗粒细胞的鉴定在卵泡内, 卵泡刺激素受体(FSHR)只存在卵巢颗粒细胞上。本试验通过FSHR免疫荧光染色鉴定牛卵巢颗粒细胞纯度。如图 1所示:体外培养细胞的FSHR阳性率大于95%, 并且细胞生长状态良好, 说明分离的细胞中卵巢颗粒细胞占95%以上。
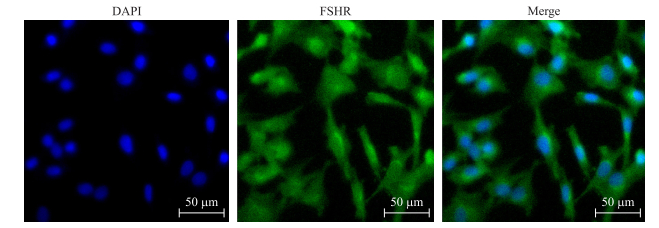
|
图 1 卵泡刺激素受体免疫染色鉴定牛卵巢颗粒细胞 Fig. 1 Identification of bovine granulosa cells by follicle-stimulating hormone receptor(FSHR)immunofluorescence |
颗粒细胞经不同质量浓度重组Chemerin蛋白(0、0.05、0.10、0.20 μg·mL-1)处理24 h后, 细胞活力随着Chemerin浓度的升高逐渐下降, 在Chemerin质量浓度达到0.2 μg·mL-1时, 细胞活力极显著降低(P < 0.01), 活力为85%(图 2)。通过流式细胞术检测发现, 经0.2 μg·mL-1 Chemerin蛋白处理细胞24 h后, 卵巢颗粒细胞凋亡率显著升高(P < 0.05)(图 3)。说明Chemerin对卵巢颗粒细胞具有促凋亡作用。
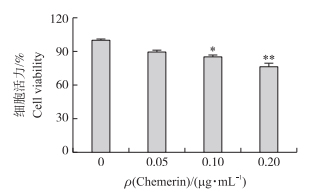
|
图 2 Chemerin对牛卵巢颗粒细胞活力的影响 Fig. 2 Effects of Chemerin on viability in bovine granulosa cells*P < 0.05, **P < 0.01. |
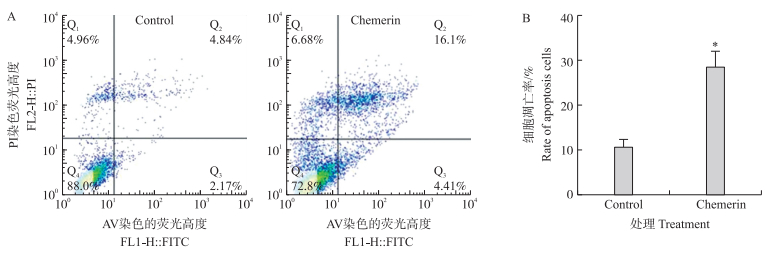
|
图 3 Chemerin对牛卵巢颗粒细胞凋亡的影响 Fig. 3 Effects of Chemerin on apoptosis in bovine granulosa cells A.流式细胞检测Flow cytometry detection; B.凋亡率统计Apoptosis rate statistics. |
ROS是细胞代谢过程中一种副产物。雌性动物卵泡中ROS的生成与清除平衡如果被打破, 将产生一系列诸如DNA降解、Caspase激活等凋亡特征。因此, 为了进一步研究Chemerin对颗粒细胞的作用, 通过免疫荧光法检测卵巢颗粒细胞中ROS含量变化。如图 4所示:与对照组相比, Chemerin处理组细胞的ROS含量(ROS荧光密度/细胞总数)极显著上升(P < 0.01), 说明Chemerin能够显著提高卵巢颗粒细胞内ROS含量, 进而引起细胞凋亡。

|
图 4 Chemerin对牛卵巢颗粒细胞内ROS含量的影响 Fig. 4 Effect of Chemerin on ROS content in bovine granulosa cells A.免疫荧光检测Immunofluorescence assay; B. ROS荧光密度/细胞总数Average ROS flourescence optical density/total cell. |
如图 5所示:与对照组相比, 添加重组Chemerin蛋白处理卵巢颗粒细胞后, 细胞中SOD活性极显著降低(P < 0.01)。MDA含量检测结果显示, Chemerin处理可使卵巢颗粒细胞中MDA含量显著升高(P < 0.05)。根据酶促反应中GSH的消耗速度来反映活力的原理, 检测添加Chemerin对牛卵巢颗粒细胞内GSH含量的影响。结果显示, 添加Chemerin处理组的卵巢颗粒细胞中GSH-px活性极显著降低(P < 0.01)。以上说明Chemerin可降低细胞内SOD和GSH-px的活性, 增加MDA的含量。

|
图 5 Chemerin对牛卵巢颗粒细胞内SOD、GSH-px活性和MDA含量的影响 Fig. 5 Effect of Chemerin on level of SOD, GSH-px activities and MDA content in bovine granulosa cells |
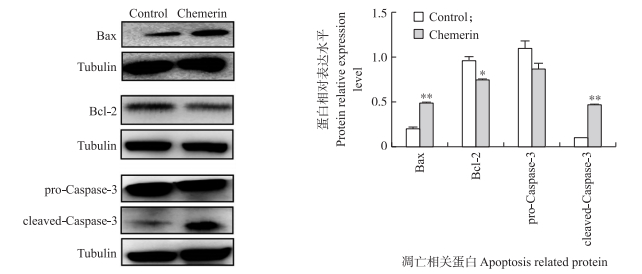
通过RT-qPCR和Western blot检测细胞凋亡相关基因和蛋白Bax、Bcl-2和Caspase-3的表达, 进一步检测Chemerin对卵巢颗粒细胞的作用。结果显示(图 6):与对照组相比, Chemerin处理组Bax/Bcl-2值显著增加(P < 0.05), 而Caspase-3 mRNA表达极显著上调(P < 0.01)。Bax和cleaved-Caspase-3凋亡相关蛋白水平极显著升高(P < 0.01)(图 7), Chemerin处理组pro-Caspase-3蛋白水平与对照组无显著差异(P > 0.05), 抑制凋亡基因的Bcl-2蛋白水平显著降低(P < 0.05)。上述结果表明, Chemerin能够通过调控凋亡相关基因的表达来发挥其促卵巢颗粒细胞凋亡的作用。
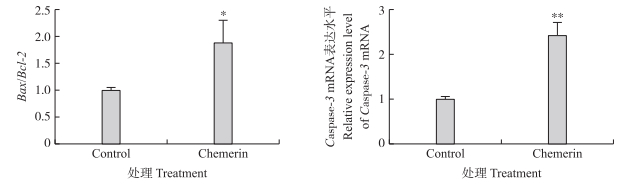
|
图 6 Chemerin对牛卵巢颗粒细胞凋亡相关基因Bax、Bcl-2与Caspase-3 mRNA表达的影响 Fig. 6 Effects of Chemerin on mRNA expression of apoptosis related genes Bax(Bcl-2)and Caspase-3 mRNA in bovine granulosa cells |
|
图 7 Chemerin对牛卵巢颗粒细胞凋亡相关蛋白Bax、Bcl-2、pro-Caspase-3、cleaved-Caspase-3表达的影响 Fig. 7 Effects of Chemerin on expression of apoptosis related protein Bax, Bcl-2, pro-Caspase-3 and cleaved-Caspase-3 in bovine granulosa cells |
研究认为, 细胞出现凋亡时会伴随着自噬的产生。为进一步分析Chemerin对颗粒细胞的作用, 本试验采样RT-qPCR检测细胞内自噬相关基因Atg7和P62 mRNA的表达。如图 8所示:与对照组相比, 添加重组Chemerin蛋白组Atg7 mRNA表达水平极显著升高(P < 0.01), 同时P62 mRNA的表达水平显著降低(P < 0.05)。

|
图 8 Chemerin对牛卵巢颗粒细胞自噬相关基因Atg7与P62 mRNA表达的影响 Fig. 8 Effects of Chemerin on mRNA expression of autophagy related genes Atg7 and P62 in bovine granulosa cells |
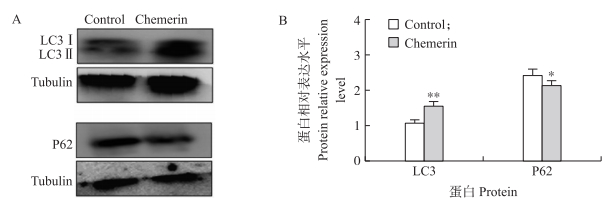
通过Western blot检测自噬相关蛋白LC3和P62的变化情况, 结果(图 9)显示:添加Chemerin可促进LC3蛋白的表达, 抑制P62蛋白的表达。这一结果表明Chemerin可能是通过上调LC3蛋白表达, 同时下调P62蛋白的表达来促进卵巢颗粒细胞自噬的发生。
|
图 9 Chemerin对牛卵巢颗粒细胞自噬相关蛋白LC3与P62表达的影响 Fig. 9 Effects of Chemerin on expression of autophagy related protein LC3 and P62 in bovine granulosa cells |
越来越多的研究结果表明, 包括Chemerin在内的脂肪因子不仅对脂肪细胞本身分化及能量代谢起重要作用, 而且还影响了包括生殖、免疫功能、心血管功能在内的多个生理病理环节。如Chemerin及CMKLR1(趋化样因子受体)在人的卵巢, 特别是颗粒细胞中有表达[9]; 在人和啮齿动物的卵巢和睾丸中均发现Chemerin的表达[5, 10]; 同时大鼠胎盘和人脐带血中也有Chemerin的表达[4]。Reverchon等[11]在研究牛的卵泡发育时发现, Chemerin能够降低体外颗粒细胞的甾类激素生成并阻碍卵母细胞的减数分裂过程。Tang等[12]研究显示, 在CMKLR1敲除小鼠中, 高雄激素诱导引起的多囊性卵巢综合征(polycystic ovary syndrome, PCOS), 激素合成酶、雌孕激素以及骨形态发生蛋白(bone morphogenetic protein, BMP)信号通路的表达都被显著改善, 即CMKLR1缺失可以改善因高雄激素诱导引起的PCOS症状。研究认为, PCOS患者卵巢中有多个小卵泡同时存在, 这些卵泡发育过程受阻不能形成优势卵泡, 卵巢局部特征主要表现为卵泡闭锁和持续不排卵, 而卵泡的发育与闭锁与颗粒细胞凋亡有关[13]。ROS是细胞出现凋亡的前体产物, 细胞内ROS的大量生成与清除平衡被打破, 进而产生一系列诸如DNA降解、Caspase激活等凋亡特征[14]。研究发现大鼠卵巢颗粒细胞出现凋亡时, 细胞内MDA含量上升, SOD和GSH-px的活性降低[15]。本试验用Chemerin处理牛卵巢颗粒细胞后发现细胞活力下降, 凋亡率极显著增加; 细胞ROS和MDA含量极显著高于对照组。同时, SOD和GSH-px活性显著降低, 凋亡关键基因Bax上调, 激活Caspase-3促进细胞凋亡[16]。推断高表达Chemerin有促进卵巢颗粒细胞凋亡的作用, 进一步说明肥胖、糖尿病等因素诱导的动物体内Chemerin升高可能是引起PCOS发生、卵泡闭锁、不孕等的原因之一, 但需要体内试验进一步证实。
卵泡的发育与颗粒细胞凋亡过程中都有细胞自噬的存在, 且自噬与凋亡之间存在着分子联系。Choi等[17]研究表明, 自吞噬体的积累通过降低Bcl-2表达和激活Caspase, 诱导颗粒细胞凋亡。在原始卵泡池形成过程中, 自噬主要促进原始卵泡存活[18], 在围产期的小鼠, 自噬基因Becn1、Atg7敲除导致生殖细胞缺失或减少, Becn1(+/-)卵巢生殖细胞减少56%, Atg7-/-卵巢检测不到生殖细胞。敲除自噬激活基因(gene of phosphate and tension homology deleted on chromsome ten, PTEN)通过负调节PI3K通路激活整个原始卵泡库, 引起卵巢早衰, 加速卵泡的闭锁[19]。LC3、P62是自噬的2个标志性蛋白, 自噬发生时, LC3由胞质型(即LC3-Ⅰ)经泛素样加工修饰与自噬膜表面的磷脂酰乙醇胺结合形成Ⅱ型LC3(LC3-Ⅱ), 其含量与自噬泡多少成正相关关系。P62又称SQSTM1, 是一种泛素化蛋白, 自噬发生时, 泛素蛋白P62与LC3-Ⅱ结合形成复合物, 导致P62下降, 促进自噬的发生[20]。本试验通过Chemeirn处理卵巢颗粒细胞, 探讨脂肪因子Chemeirn对颗粒细胞自噬的作用。结果发现Chemerin上调了促自噬相关基因表达, 同时下调了抑制自噬相关基因的表达, 进而促进卵巢颗粒细胞自噬发生。
综上所述, 内源脂肪因子Chemerin有抑制牛卵巢颗粒细胞增值, 促进细胞凋亡与自噬的作用, 为进一步研究肥胖对家畜卵巢发育及繁殖的影响提供试验数据, 但具体机制及自噬和凋亡之间的关系还需要进一步研究。
| [1] |
Hatzirodos N, Hummitzsch K, Irving-Rodgers H F, et al. Transcriptome profiling of granulosa cells from bovine ovarian follicles during Atresia[J]. BMC Genomics, 2014, 15(1): 1645-1672. |
| [2] |
Regan S L P, Knight P G, Yovich J L, et al. Granulosa cell apoptosis in the ovarian follicle:a changing view[J]. Frontiers in Endocrinology, 2018, 9: 61-72. DOI:10.3389/fendo.2018.00061 |
| [3] |
Bozaoglu K, Curran J E, Stocker C J, et al. Chemerin, a novel adipokine in the regulation of angiogenesis[J]. The Journal of Clinical Endocrinology & Metabolism, 2010, 95(5): 2476-2485. |
| [4] |
Mazaki-Tovi S, Kasher-Meron M, Rina H M, et al. Chemerin is present in human cord blood and is positively correlated with birthweight[J]. American Journal of Obstetrics and Gynecology, 2012, 207(5): 412-418. |
| [5] |
Wang Q, Kim J Y, Xue K, et al. Chemerin, a novel regulator of follicular steroidogenesis and its potential involvement in polycystic ovarian syndrome[J]. Endocrinology, 2012, 153(11): 5600-5611. DOI:10.1210/en.2012-1424 |
| [6] |
Akar U, Chaves-Reyez A, Barria M, et al. Silencing of Bcl-2 expression by small interfering RNA induces autophagic cell death in MCF-7 breast cancer cells[J]. Autophagy, 2008, 4(5): 669-679. DOI:10.4161/auto.6083 |
| [7] |
Shen W L, Tian C, Chen H, et al. Oxidative stress mediates chemerin-induced autophagy in endothelial cells[J]. Free Radical Biology and Medicine, 2013, 55(2): 73-82. |
| [8] |
Xie Q, Deng Y, Huang C, et al. Chemerin-induced mitochondrial dysfunction in skeletal muscle[J]. Journal of Cellular & Molecular Medicine, 2015, 19(5): 986-995. |
| [9] |
Reverchon M, Cornuau M, Rame C, et al. Chemerin inhibits IGF-1-induced progesterone and estradiol secretion in human granulosa cells[J]. Human Reproduction, 2012, 27(6): 1790-1800. DOI:10.1093/humrep/des089 |
| [10] |
Li L, Ma P, Huang C, et al. Expression of chemerin and its receptors in rat testes and its action on testosterone secretion[J]. Journal of Endocrinology, 2014, 220(2): 155-163. |
| [11] |
Reverchon M, Bertoldo M J, Rame C, et al. CHEMERIN(RARRES 2)decreases in vitro granulosa cell steroidogenesis and blocks oocyte meiotic progression in bovine species 1[J]. Biology of Reproduction, 2014, 90(5): 1051-1058. |
| [12] |
Tang M, Huang C, Wang Y F, et al. CMKLR1 deficiency maintains ovarian steroid production in mice treated chronically with dihydrotestosterone[J]. Scientific Reports, 2016, 6: 21328-21338. DOI:10.1038/srep21328 |
| [13] |
Rezvanfar M A, Shojaei H S, Gooshe M, et al. Ovarian aging-like phenotype in the hyperandrogenism-induced murine model of polycystic ovary[J]. Oxidative Medicine & Cellular Longevity, 2015, 2014(3): 948951-948961. |
| [14] |
Diebold L, Chandel N S. Mitochondrial ROS regulation of proliferating cells[J]. Free Radical Biology & Medicine, 2016, 100: 86-93. |
| [15] |
Wu J, Tu D, Yuan L Y, et al. T-2 toxin exposure induces apoptosis in rat ovarian granulosa cells through oxidative stress[J]. Environmental Toxicology & Pharmacology, 2013, 36(2): 493-500. |
| [16] |
Yang S D, Bai Z L, Zhang F, et al. Levofloxacin increases the effect of serum deprivation on anoikis of rat nucleus pulposus cells via Bax/Bcl-2/Caspase-3 pathway[J]. Toxicology Mechanisms & Methods, 2014, 24(9): 688-696. |
| [17] |
Choi J, Jo M, Lee E, et al. Induction of apoptotic cell death via accumulation of autophagosomes in rat granulosa cells[J]. Fertility & Sterility, 2011, 95(4): 1482-1486. |
| [18] |
Hönscheid P, Datta K, Muders M H. Autophagy:detection, regulation and its role in cancer and therapy response[J]. International Journal of Radiation Biology, 2014, 90(8): 628-635. DOI:10.3109/09553002.2014.907932 |
| [19] |
Reddy P, Liu L, Adhikari D, et al. Oocyte-specific deletion of pten causes premature activation of the primordial follicle pool[J]. Science, 2008, 319(5863): 611-613. DOI:10.1126/science.1152257 |
| [20] |
Jiang P D, Mizushima N. LC3- and p62-based biochemical methods for the analysis of autophagy progression in mammalian cells[J]. Methods, 2015, 75: 13-18. DOI:10.1016/j.ymeth.2014.11.021 |




