文章信息
- 姚瑶, 李龙龙, 姜志浩, 马海田
- YAO Yao, LI Longlong, JIANG Zhihao, MA Haitian
- 棕榈酸对BRL-3A细胞胰岛素抵抗和脂代谢的影响
- Effect of palmitic acid on insulin resistance and lipid metabolism in BRL-3A cells
- 南京农业大学学报, 2019, 42(1): 130-136
- Journal of Nanjing Agricultural University, 2019, 42(1): 130-136.
- http://dx.doi.org/10.7685/jnau.201807042
-
文章历史
- 收稿日期: 2018-07-20
Ⅱ型糖尿病、肥胖症、非酒精性脂肪肝、高血压和动脉粥样硬化等内分泌紊乱的发病率在全世界范围内逐年上升, 日趋成为影响人类公共健康的重要挑战[1]。研究发现, 这些代谢性疾病及其并发症的发生和发展均与机体胰岛素抵抗及脂代谢紊乱密切相关[2]。胰岛素抵抗(insulin resistance, IR)是指生理剂量胰岛素介导靶器官(肝脏、肌肉及脂肪)敏感性下降和生物学效应减弱的一种病理生理状态[3], 临床表现出高胰岛素血症并由此导致糖、脂代谢紊乱, 从而引发多种代谢性疾病[4-5]。然而, 机体不同组织、器官的胰岛素抵抗程度存在差异性, 这导致了对胰岛素抵抗研究的复杂性及其结果的不确定性。因此, 建立合理的胰岛素抵抗及脂代谢紊乱细胞模型, 将有助于从细胞和分子水平深入研究因内分泌紊乱引发疾病的发生机制, 从而为体外筛选改善胰岛素抵抗的天然产物和药物提供试验工具。
肝脏作为机体营养物质代谢的主要场所和胰岛素效应的主要靶器官, 对维持血糖稳态至关重要[6-8]。目前, IR细胞模型多采用3T3-L1细胞(脂肪细胞)和HepG2细胞(人肝癌细胞)[9-11], 对于以大鼠肝细胞建立的IR模型则鲜有报道。BRL-3A细胞(大鼠肝脏间质细胞)源于大鼠的肝脏, 其既保留了肝细胞许多生物学特性, 同时还作为胰岛素作用的重要靶器官, 因此是探讨胰岛素抵抗发病机制的理想靶细胞。棕榈酸(PA)属于16碳饱和游离脂肪酸, 是常见的游离脂肪酸之一, 其能够诱导骨骼肌、心肌和肝脏细胞等发生胰岛素抵抗[12-14]。棕榈酸被认为是致肝细胞脂毒性的主要分子之一, 且以其作为诱导因子广泛应用于糖脂毒性方面的研究[15]。因此, 本研究探讨不同浓度棕榈酸处理对BRL-3A细胞活力、脂代谢和胰岛素抵抗相关因子表达的影响, 以期建立由PA诱导的BRL-3A细胞IR模型, 为后续探讨药物或生物活性物质调节胰岛素抵抗及其机制的研究提供试验材料。
1 材料与方法 1.1 试验材料溴化噻唑蓝四氮唑(MTT)、胰酶和二甲基亚砜(DMSO)购于Sigma公司; 棕榈酸购于上海优宁维生物科技股份有限公司; 甘油三酯(triglyceride, TG)测定试剂盒、油红染色试剂盒购于南京建成生物工程研究所; DMEM高糖培养基购于Hyclone公司; 胎牛血清(FBS)购于Gibco公司; 兔抗IRS-1(胰岛素受体1)、p-IRS-1 Tyr612(酪氨酸磷酸化胰岛素受体1)和GLUT-2(葡萄糖转运受体2)抗体购于上海生工生物工程有限公司; 兔抗GAPDH(内参)抗体购于巴傲得生物科技有限公司; BRL-3A细胞购于中国科学院昆明细胞库。
1.2 试验方法 1.2.1 BRL-3A细胞培养将液氮中冻存的BRL-3A细胞取出后置于37 ℃恒温水浴箱中迅速融化。在无菌条件下, 将细胞悬液转移到离心管中, 加入含FBS(10%, 体积分数)的DMEM高糖培养液洗涤后, 以1 000 r·min-1离心3 min, 弃上清液。将细胞沉淀用含FBS的DMEM高糖培养液悬浮, 然后移至10 cm培养皿中, 于37 ℃、5%CO2培养箱内培养。24 h后更换含FBS的DMEM高糖培养液, 继续培养, 观察。待细胞融合度达90%时, 采用2.5 g·L-1胰蛋白酶消化后传代。
1.2.2 细胞活力检测将100 μL BRL-3A细胞悬浮液(1×105 mL-1)接种于96孔细胞培养板, 37 ℃、5% CO2条件下培养24 h后, 分别用0、0.05、0.10、0.15、0.20和0.25 mmol·L-1的棕榈酸处理6、12、24、36和48 h后, 向每孔加入20 μL(5 mg·mL-1)的MTT, 继续培养4 h。吸出培养液, 每孔加入150 μL二甲基亚砜(DMSO), 低速振荡10 min使结晶完全溶解, 酶标仪测定吸光值(D490)。
1.2.3 细胞死亡率检测将100 μL BRL-3A细胞悬浮液(1×105 mL-1)接种于96孔细胞培养板, 37 ℃、5% CO2条件下培养24 h后, 分别用0和0.25 mmol·L-1的棕榈酸处理6、12、24、36和48 h。设样品对照孔、最大酶活性孔、棕榈酸处理孔。预定检测点前1 h, 在最大酶活性孔加入乳酸脱氢酶(LDH)释放试剂, 收集培养上清液, 按照LDH试剂盒检测方法测定上清液中的LDH含量。细胞死亡率=(D棕榈酸处理孔-D样品对照孔)/(D最大酶活性孔-D样品对照孔)×100%。
1.2.4 葡萄糖消耗量的测定将100 μL BRL-3A细胞悬浮液(1×105 mL-1)接种于96孔细胞培养板, 37 ℃、5% CO2条件下培养24 h后, 分别用0、0.05、0.10、0.15、0.20和0.25 mmol·L-1棕榈酸处理24 h后, 收集培养上清液。按照葡萄糖试剂盒检测方法测定上清液中的葡萄糖含量, 计算葡萄糖消耗量。
1.2.5 甘油三酯含量的测定将2 mL BRL-3A细胞悬浮液(1×105 mL-1)接种于6孔细胞培养板, 培养24 h后, 分别用0、0.05、0.10、0.15、0.20和0.25 mmol·L-1棕榈酸处理24 h。收集细胞, 超声破碎后, 按照甘油三酯试剂盒检测方法测定甘油三酯含量。
1.2.6 油红染色细胞处理同1.2.5节。参照油红染色试剂盒的方法染色, 每张玻片显微镜拍照20张, 随机选取10张利用Image-pro Plus 6.0软件分析脂滴的数目和脂滴总面积。
1.2.7 RT-qPCR法检测细胞脂肪代谢相关基因(mRNA)的表达总RNA提取:细胞培养及处理同1.2.5节。Trizol试剂盒提取BRL-3A细胞总RNA, 生物分光光度法测定RNA浓度和纯度。
反转录:按试剂盒说明操作, 10 μL体系内总RNA最大含量不超过500 ng, 加入2 μL 5×PrimeScript RT Master Mix, 用DEPC水补足10 μL, 轻轻混匀后进行反转录(RT)。RT程序:37 ℃ 15 min, 85 ℃ 5 min。
目的基因和内参基因引物:β-actin和目的基因的上、下游引物序列(表 1)是根据GenBank上大鼠的相关cDNA序列用Primer Premier 5.0软件设计, 并由上海英骏生物技术有限公司合成。
| 基因名称 Gene names |
GenBank登录号 Accession number |
引物对序列(5'→3') Primer pairs sequences |
产物大小/bp Product size |
| β-actin | NM031144 | GATTACTGCCCTGGCTCCTA/TCATCGTACTCCTGCTTGCT | 101 |
| ACC | AY451393.1 | TGCAGGCCAATCCAGAAGTT/AGTGGAAAGGATCCTTACAA | 98 |
| FAS | NM017332 | GGACATGGTCACAGACGATGAC/GTCGAACTTGGACAGATCCTTCA | 94 |
| SREBP-1c | AF286470 | GGAGCCATGGATTGCACATT/AGGAAGGCTTCCAGAGAGGA | 194 |
| PPARα | NM013196 | TGGAGTCCACGCATGTGAAG/CGCCAGCTTTAGCCGAATAG | 64 |
| 注:ACC:乙酰辅酶A羧化酶基因Acetyl CoA carboxylase gene; FAS:脂肪酸合成酶基因Fatty acid synthase gene; SREBP-1c:固醇调节元件结合蛋白基因1c Sterol regulatory element-binding proteins-1c gene; PPARα:过氧化物酶体增殖物激活受体基因Peroxisome proliferators-activated receptor-α gene. | |||
qPCR:qPCR使用20 μL定量反应体系:2 μL cDNA模版, 10 μL SYBR Green Real-time PCR Master Mix, β-actin或目的基因引物2 μL, DEPC水补足20 μL。反应程序:95 ℃ 5 min; 95 ℃ 30 s, 60 ℃ 30 s, 72 ℃ 30 s, 40个循环。目的基因表达量采用2-ΔΔCT法进行统计。
1.2.8 Western blot分析胰岛素抵抗相关因子的表达水平Western blot分析:细胞处理同1.2.5节。细胞处理结束后弃上清液, PBS清洗3次后, 向每孔加入RIPA裂解液和蛋白酶抑制剂PMSF(V(RIPA):V(PMSF)=100:1)。12 000 r·min-1离心10 min后收集上清液, BCA法测定蛋白浓度并加入上样缓冲液, 涡旋仪充分混匀, 热水煮沸10 min, -20 ℃保存; 将上述制备好的样品加入到配好的SDS-PAGE胶孔里, 每孔上样30 μg, 并在相应孔中加入5 μL预染蛋白标准品, 80 V电泳。待条带至浓缩胶与分离胶分界线时改变电压为110 V, 至凝胶的中下部时, 停止电泳。100 V湿转90 min后5%脱脂奶粉封闭2 h, 加入磷酸化胰岛素受体1、胰岛素受体1、GLUT-2和GAPDH兔抗鼠单克隆抗体(1:1 000稀释)孵育, 摇床上4 ℃杂交过夜。TBST清洗5次, 每次10 min, 加羊抗兔二抗后室温孵育2 h。
蛋白条带显影:取出经二抗孵育的PVDF膜, 放于盛有TBST溶液的抗体孵育盒中, 置于摇床上10 min, 洗涤5次; 在避光条件下, 向PVDF膜滴加AB发光液并使其分布均匀, 置于暗室3 min; 将PVDF膜浸入显影液中5~10 min后, 取出在凝胶成像系统中曝光并拍照。
图像分析:对图像的处理以及灰度分析在Kodak1D电泳凝胶成像系统上完成, 用Bandscan 5.0软件分析条带灰度, 目的条带都以相对应的内参(GAPDH)进行校正, 确定样本中目的蛋白相对表达量。
1.3 数据处理与统计分析数据以x±SE表示, 用Graphpad prism 5和SPSS 16.0软件对试验数据进行One-way ANOVA方差分析。
2 结果与分析 2.1 棕榈酸对BRL-3A细胞活力和细胞死亡率的影响由表 2可知:与对照组相比, 0.25 mmol·L-1棕榈酸处理在12~48 h显著降低BRL-3A细胞活力(P < 0.05)。
| c(PA)/(mmol·L-1) | 棕榈酸处理时间/h PA treatment time | ||||
| 6 | 12 | 24 | 36 | 48 | |
| 0 | 0.654±0.021 | 0.695±0.037 | 0.763±0.043 | 0.832±0.042 | 0.887±0.029 |
| 0.05 | 0.649±0.029 | 0.709±0.045 | 0.739±0.030 | 0.842±0.052 | 0.871±0.046 |
| 0.10 | 0.638±0.052 | 0.689±0.048 | 0.786±0.038 | 0.838±0.042 | 0.849±0.036 |
| 0.15 | 0.689±0.048 | 0.698±0.034 | 0.758±0.036 | 0.839±0.031 | 0.901±0.041 |
| 0.20 | 0.631±0.065 | 0.668±0.039 | 0.760±0.022 | 0.829±0.038 | 0.861±0.051 |
| 0.25 | 0.598±0.044 | 0.586±0.024* | 0.612±0.024** | 0.631±0.033** | 0.582±0.038** |
| 注:同一时间点, 与对照相比较, *表示差异显著(P < 0.05), **表示差异极显著(P < 0.01), n=6。 Note:The comparison of different concentrations at the same time point, *P < 0.05, **P < 0.01, n=6. | |||||
由图 1可知:与对照组相比, 0.25 mmol·L-1棕榈酸处理12~48 h显著增加BRL-3A细胞死亡率(P < 0.05)。结果提示, 0.05~0.20 mmol·L-1棕榈酸处理6~48 h对BRL-3A细胞活力无显著影响, 而0.25 mmol·L-1棕榈酸处理12~48 h可对BRL-3A细胞造成细胞毒性效应。
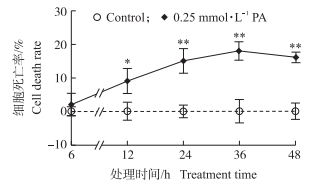
|
图 1 棕榈酸对BRL-3A细胞死亡率的影响 Fig. 1 Effect of PA on cell death rate in BRL-3A cells 与对照相比, *表示差异显著(P < 0.05), **表示差异极显著(P < 0.01), n=6。 Compared to control group:*P < 0.05, **P < 0.01, n=6. The same as follows. |
由图 2可知:与对照组相比, 0.15 mmol·L-1棕榈酸处理显著增加BRL-3A细胞中甘油三酯含量(P < 0.05);0.20和0.25 mmol·L-1棕榈酸处理极显著增加BRL-3A细胞中甘油三酯含量(P < 0.01)。结果提示, 0.15~0.25 mmol·L-1棕榈酸处理显著增加BRL-3A细胞中甘油三酯的含量。
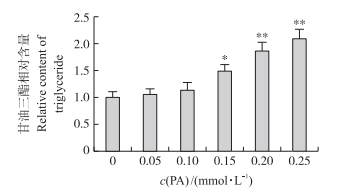
|
图 2 棕榈酸对BRL-3A细胞中甘油三酯含量的影响 Fig. 2 Effect of PA on the triglyceride content in BRL-3A cells |
利用Image-pro Plus 6.0软件分析油红O染色图片发现:与对照组相比, 0.15~0.25 mmol·L-1棕榈酸处理极显著增加BRL-3A细胞中脂滴数目和脂滴总面积(P < 0.01)(图 3)。结果提示, 一定浓度的棕榈酸处理可增加BRL-3A细胞中脂滴的堆积。
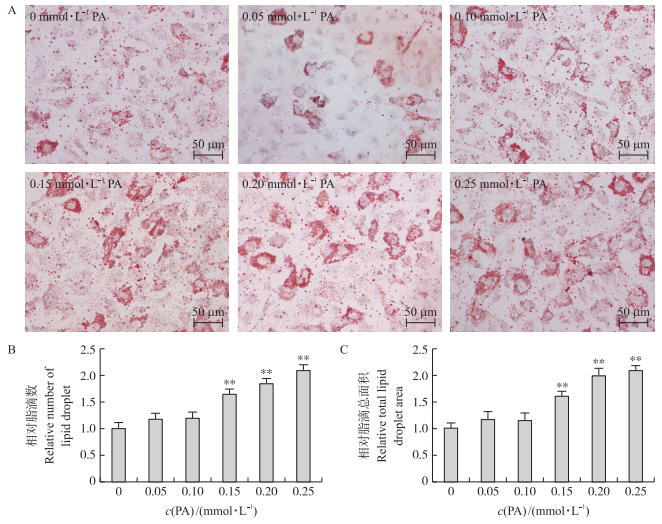
|
图 3 棕榈酸对BRL-3A细胞脂滴合成的影响 Fig. 3 Effect of PA on lipid droplet synthesis in BRL-3A cells A.油红O染色显微照片; B.相对脂滴数目; C.相对脂滴总面积。 A. Representative photomicrographs of oil red O stained; B. Relative number of lipid droplet; C. Relative total lipid droplet area. |
由图 4可知:与对照相比, 0.10~0.25 mmol·L-1棕榈酸处理显著提高BRL-3A细胞中ACC mRNA水平(P < 0.05), 0.15~0.25 mmol·L-1棕榈酸处理显著提高BRL-3A细胞中FAS和SREBP-1c mRNA水平(P < 0.05), 但0.15~0.25 mmol·L-1棕榈酸处理极显著降低BRL-3A细胞中PPARα mRNA水平(P < 0.01)。结果提示, 一定浓度的棕榈酸处理显著提高脂肪合成相关基因的表达, 同时显著降低脂肪分解相关基因的表达。

|
图 4 棕榈酸对BRL-3A细胞脂肪代谢相关基因表达的影响 Fig. 4 Effect of PA on lipid metabolism related gene mRNA level in BRL-3A cells |
由图 5可知:与对照组相比, 0.15~0.25 mmol·L-1棕榈酸处理显著或极显著降低葡萄糖的消耗量(P < 0.05, P < 0.01)。结果提示, 一定浓度的棕榈酸处理降低了BRL-3A细胞对葡萄糖的消耗。
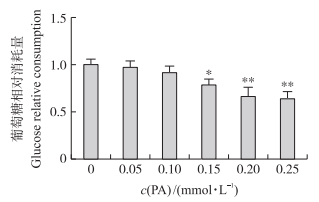
|
图 5 棕榈酸对BRL-3A细胞葡萄糖消耗量的影响 Fig. 5 Effect of PA on consumption of glucose in BRL-3A cells |
由图 6可知:与对照组相比, 0.15~0.25 mmol·L-1棕榈酸处理显著降低BRL-3A细胞中葡萄糖转运载体2(膜GLUT-2)和酪氨酸磷酸化胰岛素受体1(p-IRS-1 Tyr612)的蛋白表达水平(P < 0.05), 而对胰岛素受体1总蛋白(tIRS-1)表达水平并无显著影响(P > 0.05)。
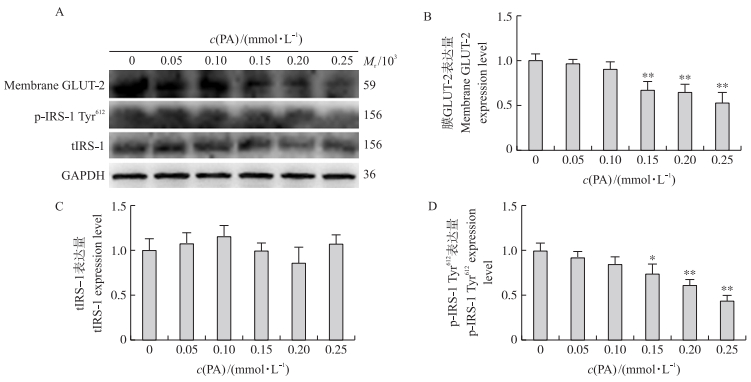
|
图 6 棕榈酸对BRL-3A细胞胰岛素抵抗相关蛋白表达的影响 Fig. 6 Effect of PA on insulin resistance related protein expression level in BRL-3A cells A.免疫印迹检测蛋白表达水平; B—D.蛋白表达水平统计。 A. Protein expression level detected by Western blot; B-D. Statistical analysis of protein expression level. |
胰岛素抵抗是机体靶组织对胰岛素的反应性低于正常的一种病理生理状态, 是包括Ⅱ型糖尿病、高血压病、肥胖、动脉粥样硬化等常见临床疾病在内的共同诱发因素[16-18]。约25%的正常人群存在胰岛素抵抗, 糖耐量低人群中75%存在胰岛素抵抗, Ⅱ型糖尿病患者胰岛素抵抗的发生率为85%左右[19]。流行病学资料显示, 胰岛素抵抗在糖尿病及心血管疾病发病之前多年就可能存在, 其常常与肥胖、年龄的增长、高血压、高脂血症相伴随。脂代谢紊乱引起的肥胖往往是导致胰岛素抵抗的重要因素, 脂代谢紊乱往往伴随着胰岛素抵抗的发生和发展。因此, 研究者将脂代谢紊乱视为心血管疾病的重要诱发因素之一。1988年Reaven等[20]提出了"胰岛素抵抗综合征"概念, 认为胰岛素抵抗是促发糖尿病、高血压、心血管疾病的最根本原因。
近年来, 为了探讨胰岛素抵抗的发病机制及寻求有效的治疗药物, 研究者运用肝细胞、脂肪细胞、肌肉细胞等体外构建了多种胰岛素抵抗细胞模型; 此外, 运用大鼠、小鼠等构建了胰岛素抵抗动物模型。目前, 在研究肝细胞胰岛素抵抗时常用的细胞是肝癌细胞系, 但肝癌细胞在氧化应激及细胞信号通路等方面蛋白表达均与一般正常细胞不同, 决定了其在脂代谢紊乱及胰岛素抵抗等方面研究不足。BRL-3A细胞源于大鼠肝脏, 已广泛用于肥胖、氧化应激和胰岛素抵抗等代谢性疾病的研究, 但以BRL-3A细胞为模型探讨胰岛素抵抗及其机制的相关研究则鲜有报道。本试验结果表明, 0.25 mmol·L-1棕榈酸在处理BRL-3A细胞12~48 h显著降低细胞活力并提高细胞死亡率。此外, 0.25 mmol·L-1棕榈酸导致细胞毒性的产生, 但低于此剂量的棕榈酸处理对细胞活力无任何影响, 且对BRL-3A细胞均无任何毒副作用。这与韩玲玲等[21]研究棕榈酸对细胞存活率影响的结果基本一致。
高脂可诱导HePG2细胞发生胰岛素抵抗[22]。本试验中, 0.15~0.25 mmol·L-1棕榈酸处理显著减少BRL-3A细胞对葡萄糖的利用, 即发生了葡萄糖摄取和利用障碍。温宇等[23]报道, 1 mmol·L-1棕榈酸可显著抑制3T3-L1细胞对葡萄糖吸收利用, 但高浓度棕榈酸处理显著降低细胞存活率。大量研究表明, 胰岛素抵抗的发生往往伴随着葡萄糖转运受体的减少及葡萄糖摄取或利用障碍。因此, 本试验进一步检测细胞膜葡萄糖转运受体表达的变化。0.15~0.25 mmol·L-1棕榈酸处理显著降低葡萄糖转运载体-2的蛋白表达水平, 同时显著降低磷酸化胰岛素受体-1的蛋白表达水平, 并呈现出一定的剂量依赖性。该结果进一步说明一定浓度的棕榈酸处理可诱导BRL-3A细胞产生胰岛素抵抗。
脂滴含量是评估脂肪沉积的重要参数[24]。本研究中, 0.15~0.25 mmol·L-1棕榈酸处理显著增加BRL-3A细胞中的脂滴数量和脂滴总面积以及甘油三酯含量, 并呈现出一定剂量依赖效应。进一步检测BRL-3A细胞脂代谢相关因子的表达情况, 发现0.15~0.25 mmol·L-1棕榈酸处理显著增加脂肪合成相关基因ACC、FAS和SREBP-1c mRNA表达水平, 而显著降低了脂肪分解相关基因PPARα mRNA表达水平。结合本试验中脂滴沉积及甘油三酯含量的结果提示:一定浓度的棕榈酸处理会造成BRL-3A细胞的脂代谢紊乱。
综上所述, 0.05~0.20 mmol·L-1棕榈酸处理对BRL-3A细胞无毒副作用, 而0.25 mmol·L-1处理导致细胞毒性; 0.05~0.10 mmol·L-1处理对BRL-3A细胞脂代谢和胰岛素抵抗无显著影响, 但0.15~0.25 mmol·L-1处理可诱发BRL-3A细胞发生脂代谢紊乱和胰岛素抵抗。因此, 0.15和0.20 mmol·L-1棕榈酸处理可作为诱导BRL-3A细胞脂代谢紊乱和胰岛素抵抗模型的效应浓度。考虑到脂代谢和胰岛素抵抗相关因子表达的变化与棕榈酸处理浓度间存在一定的剂量依赖性。因此, 0.20 mmol·L-1棕榈酸处理BRL-3A细胞24 h可作为构建脂代谢紊乱和胰岛素抵抗模型的合理条件。总之, 本试验建立的大鼠体外肝细胞胰岛素抵抗模型符合胰岛素抵抗的发生过程, 可为探讨胰岛素抵抗发病机制的研究以及用于改善脂代谢紊乱和胰岛素抵抗相关药物的筛选提供重要的试验材料。
| [1] |
Popov V B, Lim J K. Impact of insulin-sensitizing agents on risk for liver cancer and liver-related death in diabetic patients with compensated hepatitis c cirrhosis[J]. The Journal of Clinical Endocrinology & Metabolism, 2011, 96(8): 2398-2400. |
| [2] |
Vocci F, Khalsa J H, Dobs A. Hormonal and metabolic disorders of human immunodeficiency virus infection and substance abuse[J]. American Journal of Infectious Diseases, 2006, 2(3): 125-129. DOI:10.3844/ajidsp.2006.125.129 |
| [3] |
Morigny P, Houssier M, Mouisel E, et al. Adipocyte lipolysis and insulin resistance[J]. Biochimie, 2016, 125: 259-266. DOI:10.1016/j.biochi.2015.10.024 |
| [4] |
Kautzky-Willer A, Handisurya A. Metabolic diseases and associated complications:sex and gender matter![J]. European Journal of Clinical Investigation, 2009, 39(8): 631-648. DOI:10.1111/eci.2009.39.issue-8 |
| [5] |
Han T S, Lean M E. A clinical perspective of obesity, metabolic syndrome and cardiovascular disease[J]. JRSM Cardiovascular Disease, 2016, 5: 1-13. |
| [6] |
Untereiner A, Wu L Y. Hydrogen sulfide and glucose homeostasis:a tale of sweet and the stink[J]. Antioxidants & Redox Signaling, 2018, 28(16): 1463-1482. |
| [7] |
Lombarte M, Lupo M, Fina B L, et al. In vivo measurement of the rate constant of liver handling of glucose and glucose uptake by insulin-dependent tissues, using a mathematical model for glucose homeostasis in diabetic rats[J]. Journal of Theoretical Biology, 2018, 439: 205-215. DOI:10.1016/j.jtbi.2017.12.001 |
| [8] |
Buijs R M, Guerrero-Vargas N. Synchrony between suprachiasmatic nucleus-driven signals and the light/dark cycle is essential for liver homeostasis[J]. Hepatology, 2017, 65(6): 2110-2112. DOI:10.1002/hep.29124 |
| [9] |
Zhang H J, Ji B P, Chen G, et al. A combination of grape seed-derived procyanidins and gypenosides alleviates insulin resistance in mice and HepG2 cells[J]. Journal of Food Science, 2009, 74(1): 1-7. |
| [10] |
Guo X R, Wang X L, Chen Y, et al. ANGPTL8/betatrophin alleviates insulin resistance via the Akt-GSK3β or Akt-FoxO1 pathway in HepG2 cells[J]. Experimental Cell Research, 2016, 345(2): 158-167. DOI:10.1016/j.yexcr.2015.09.012 |
| [11] |
Nelson B A, Robinson K A, Buse M G. High glucose and glucosamine induce insulin resistance via different mechanisms in 3T3-L1 adipocytes[J]. Diabetes, 2000, 49(6): 981-991. DOI:10.2337/diabetes.49.6.981 |
| [12] |
Pardo V, González-Rodríguez Á, Muntané J, et al. Role of hepatocyte S6K1 in palmitic acid-induced endoplasmic reticulum stress, lipotoxicity, insulin resistance and in oleic acid-induced protection[J]. Food & Chemical Toxicology, 2015, 80: 298-309. |
| [13] |
Kwak H J, Choi H E, Cheon H G. 5-LO inhibition ameliorates palmitic acid-induced ER stress, oxidative stress and insulin resistance via AMPK activation in murine myotubes[J]. Scientific Reports, 2017, 7(1): 5025-5029. DOI:10.1038/s41598-017-05346-5 |
| [14] |
Talukder M A H, Preda M, Ryzhova L, et al. Heterozygous caveolin-3 mice show increased susceptibility to palmitate-induced insulin resistance[J]. Physiological Reports, 2016, 4(6): e12736. DOI:10.14814/phy2.12736 |
| [15] |
Poitout V, Robertson R P. Glucolipotoxicity:fuel excess and β-cell dysfunction[J]. Endocrine Reviews, 2008, 29(3): 351-366. DOI:10.1210/er.2007-0023 |
| [16] |
Jia G H, Demarco V G, Sowers J R. Insulin resistance and hyperinsulinaemia in diabetic cardiomyopathy[J]. Nature Reviews Endocrinology, 2016, 12(3): 144-153. DOI:10.1038/nrendo.2015.216 |
| [17] |
Samuel V T, Shulman G I. The pathogenesis of insulin resistance:integrating signaling pathways and substrate flux[J]. Journal of Clinical Investigation, 2016, 126(1): 12-22. DOI:10.1172/JCI77812 |
| [18] |
Yun K J, Han K, Kim M K, et al. Insulin resistance distribution and cut-off value in Koreans from the 2008-2010 Korean national health and nutrition examination survey[J]. PLoS One, 2016, 11(4): e0154593. DOI:10.1371/journal.pone.0154593 |
| [19] |
Liang Y, Tan A, Liang D, et al. Low osteocalcin level is a risk factor for impaired glucose metabolism in a chinese male population[J]. Journal of Diabetes Investigation, 2016, 7(4): 522-528. DOI:10.1111/jdi.2016.7.issue-4 |
| [20] |
Reaven G M, Huffman B B. Abnormalaties of carbohydrate metabolism may play a role in the etiology and clinical course of hypertension[J]. Trends in Pharmacological Sciences, 1988, 9(3): 78-79. DOI:10.1016/0165-6147(88)90165-4 |
| [21] |
韩玲玲, 李佳, 陈颖, 等. 高脂环境对大鼠成肌细胞糖脂代谢的影响[J]. 中国病理生理杂志, 2011, 27(11): 2156-2159. Han L L, Li J, Chen Y, et al. Influence of high-fat environment on glucose metabolism in rat myoblasts[J]. Chinese Journal of Pathophysiology, 2011, 27(11): 2156-2159 (in Chinese with English abstract). DOI:10.3969/j.issn.1000-4718.2011.11.022 |
| [22] |
柳嘉, 郭孝萱, 吴薇, 等. 高糖高脂诱导胰岛素抵抗HepG2细胞模型的建立及活性成分的功能评价[J]. 食品科技, 2012, 37(3): 73-78. Liu J, Guo X X, Wu W, et al. Establishment of the insulin resistance HepG2 cell model with elevated levels of glucose and free fatty acid and functional evaluation of active compounds[J]. Food Science and Technology, 2012, 37(3): 73-78 (in Chinese with English abstract). |
| [23] |
温宇, 王宏伟, 卢慧玲, 等. 脂肪酸诱导的3T3-L1脂肪细胞胰岛素抵抗的研究[J]. 中国病理生理杂志, 2007, 23(3): 543-547. Wen Y, Wang H W, Lu H L, et al. Fatty acid-induced insulin resistance in 3T3-L1 adipocytes[J]. Chinese Journal of Pathophysiology, 2007, 23(3): 543-547 (in Chinese with English abstract). DOI:10.3321/j.issn:1000-4718.2007.03.029 |
| [24] |
Mehlem A, Hagberg C E, Muhl L, et al. Imaging of neutral lipids by oil red O for analyzing the metabolic status in health and disease[J]. Nature Protocols, 2013, 8(6): 1149-1154. DOI:10.1038/nprot.2013.055 |




