文章信息
- 王成孜, 高丽敏, 孙玉明, 王博, 郭世伟
- WANG Chengzi, GAO Limin, SUN Yuming, WANG Bo, GUO Shiwei
- 弱光胁迫对分蘖期超级稻与常规稻叶片光合特性的影响
- The effect of weak light stress on leaf photosynthetic characteristics in super hybrid rice and conventional rice at tillering stage
- 南京农业大学学报, 2019, 42(1): 111-117
- Journal of Nanjing Agricultural University, 2019, 42(1): 111-117.
- http://dx.doi.org/10.7685/jnau.201803050
-
文章历史
- 收稿日期: 2018-03-27
水稻是世界三大粮食作物之一, 全球50%以上人口以稻谷为食。如何实现水稻高产是水稻科学研究的前沿, 同时也是水稻栽培及育种的重要目标[1]。超级杂交水稻是兼具高产量与高品质的新型水稻品种, 理想株型和杂种优势的组合使其具有巨大的增产潜力[2]。与常规水稻品种相比, 杂交水稻的出现使水稻产量增加了10%[3]。目前已经育成了一批优质的超级杂交稻品种, 并且得到广泛应用。国际上对于超级杂交水稻的遗传基础、生理特征以及栽培模式等方面均已开展相关研究并取得进展[4-8]。然而, 在实际生产中超级稻经常由于生长条件不良、田间管理不当等原因难以发挥其超高产潜能[9]。
我国长江下游6月多发梅雨天气, 此时水稻正值分蘖期, 遭遇弱光环境会严重影响其正常分蘖, 最终导致水稻减产[10]。研究该时期弱光胁迫对不同品种水稻生长发育的影响十分重要。前人研究多集中于弱光胁迫下超级杂交稻干物质的累计特性与产量形成规律, 弱光会抑制超级稻的光合速率及叶片生长, 最终导致超级稻生物量的显著降低[11]。然而, 关于超级稻叶片对弱光胁迫的光合响应过程及机制的研究却鲜有报道。因此, 通过研究分蘖期超级稻在弱光胁迫下的叶片光合特性, 对于认识超级稻产量形成机制具有重要意义。
本研究以超级杂交稻品种'国稻6号''Ⅱ优084'为供试材料, 以常规稻品种'扬稻6号'为对照材料, 通过比较不同光照条件下处于分蘖期的超级杂交水稻与常规品种水稻的光合生理特性, 阐明弱光胁迫下超级杂交水稻品种与常规品种光合生理特性的差异, 为进一步研究提升超级杂交水稻产量提供理论依据。
1 材料与方法 1.1 试验材料与设计本研究选取超级杂交稻'国稻6号'和'Ⅱ优084'以及常规稻'扬稻6号'作为试验材料。种子经10%(体积分数)H2O2溶液消毒浸泡后进行避光发芽, 待幼苗生长至2叶1心时, 选择长势一致的幼苗移栽到容积6 L周转箱中, 给幼苗依次供应1/4、1/2、全量营养液(铵、硝物质的量比为1:1的混合营养液)。预培养7 d后进行不同光照处理。营养液配方采用国际水稻所(IRRI)常规营养液配方[12], 每隔3 d更换1次营养液, 控制营养液的pH值为5.45~5.55。
试验于2017年6月在南京农业大学资源与环境科学学院温室试验基地进行, 白天室内温度为28~35 ℃。选取长势一致的3个品种水稻幼苗, 分别设置800 μmol·m-2·s-1正常光照强度处理(T100处理)和200 μmol·m-2·s-1弱光照强度处理(悬挂遮光布, T25处理), 处理30 d后对不同处理水稻进行相关指标测定, 每个处理设置4个重复, 每项指标的测定进行3次重复试验。
1.2 测定项目与方法 1.2.1 植株生物量的测定将植株按叶片、茎鞘和根系3个部分进行采样, 于105 ℃杀青30 min后, 置于75 ℃烘箱中烘干至恒质量, 称量各个部分的质量。
1.2.2 叶面积及比叶重(SLW)的测定采用印相法[13]测定叶面积, 先假设所有叶片为均质, 再用印相法测定单位新完全展开叶叶片面积的干质量, 总叶面积=总叶片干质量/SLW。
1.2.3 光合速率、气孔导度、胞间二氧化碳浓度的测定采用Li-Cor 6400光合作用测定仪普通叶室测定水稻主茎新完全展开叶的光合参数, 测定时间为09:00—15:00。叶室内光照强度为1 500 μmol·m-2·s-1, CO2浓度为大气CO2浓度, 约为400~420 μmol·mol-1, 空气相对湿度调节在45%, 叶片温度控制在30 ℃左右。将新完全展开叶夹入叶室, 等待约10 min, 数据显示稳定, 记录数据。
1.2.4 羧化效率的测定采用Li-Cor 6400光合作用测定仪普通叶室测定主茎新完全展开叶的羧化效率, 测定时间为09:00—15:00, 叶室内光照强度为1 500 μmol·m-2·s-1, 空气相对湿度调节在40%~50%, 叶片温度控制在30 ℃左右。叶室内CO2浓度由CO2注入钢瓶控制, 待校准标定后, 首先将叶室内的CO2浓度调至400 μmol·mol-1, 当叶片气孔导度稳定后将叶室内CO2浓度设定为以下梯度:1 500、1 200、1 000、800、600、400、200、150、100和50 μmol·mol-1。每个CO2浓度下测定叶片的光合速率并自动记录数据, 整个程序测定时间为30 min。测定结束后, 以胞间CO2浓度为横坐标, 净光合速率为纵坐标, 绘制净光合速率-胞间CO2浓度(A/Ci)曲线, 该曲线的初始斜率即为羧化效率。
1.2.5 光合荧光参数的测定采用Li-Cor 6400光合作用测定仪荧光叶室测定水稻主茎新完全展开叶的荧光参数, 测定时间为09:00—15:00。仪器开机稳定后调用预先保存好的荧光测定程序进行测定。叶室内光照强度为1 500 μmol·m-2·s-1, CO2浓度为大气CO2浓度, 约为400~420 μmol·mol-1, 空气相对湿度调节在45%, 叶片温度控制在30 ℃左右。将叶片夹入叶室后, 等数据稳定后(约15 min), 用饱和脉冲光照射叶片, 脉冲光模式为多闪模式, 同时, 光照强度不低于8 000 μmol·m-2·s-1。光系统Ⅱ的量子效率(ΦPSⅡ)=1-Fs/F'm。式中:Fs和F'm分别表示稳态荧光和最大荧光。
1.2.6 Γ*的测定采用Li-Cor 6400光合作用测定仪普通叶室测定主茎新完全展开叶的Γ*, 测定时间为00:00—04:00。在测定前首先将水稻植株放置于暗处保证气孔关闭。待仪器稳定后开始测定, 叶室内光照强度为600 μmol·m-2·s-1, 空气相对湿度调节在40%~50%, 叶片温度控制在30 ℃左右。叶室内CO2浓度由CO2注入钢瓶控制, 待校准标定后, 将叶室内的CO2浓度调至100 μmol·mol-1。将叶片夹入叶室后30 min以诱导气孔的开放。待气孔开放后, 将光合仪的光照强度调整至150 μmol·m-2·s-1, 开始测定, 数据稳定后记录数据, 之后依次将叶室内CO2浓度调整至75、50和25 μmol·mol-1测定光合速率。待4个CO2浓度下的光合速率测定完毕后, 将叶室内光照强度调整为300 μmol·m-2·s-1重复上述过程, 之后再调整为600 μmol·m-2·s-1继续测定。测定完成后, 分别绘制每个光照强度下的A-Ci直线, 这3条直线的交点处横坐标即为Ci*, Γ*=Ci*+Rd/gm。式中:Rd为光下线粒体呼吸, 是Γ*测定过程中Ci*所对应交点的纵坐标; gm为叶肉导度。
1.2.7 叶肉导度及叶绿体内CO2浓度(Cc)的测定叶肉导度(gm)和Cc根据下列公式求得:
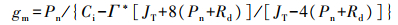
|
(1) |
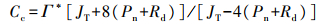
|
(2) |
式中:Pn为净光合速率; Ci为胞间CO2浓度; JT为电子传递速率, 由荧光叶室测得。
1.2.8 叶绿素含量的测定在黑暗处取0.2 g新鲜的新完全展开叶于研钵中, 加入少量碳酸钙粉末和石英砂, 再加入2 mL乙醇(体积分数为95%), 研磨至呈匀浆状后, 继续加入乙醇并研磨直至叶片变为白色为止。静置, 过滤, 并将滤纸上绿色洗涤干净, 滤液储于棕色瓶中, 定容, 混匀, 以乙醇为空白, 分别在665、649和470 nm下测定吸光值。
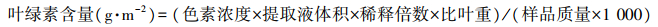
|
(3) |
采用SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE)及考马斯亮蓝法测定Rubisco含量。称取新鲜的新完全展开叶0.5 g, 置于预冷研钵中, 之后加入5 mL提取缓冲液[50 mmol·L-1 Tris-HCl, pH8.0, 5 mmol·L-1巯基乙醇, 12.5%(体积分数)甘油], 样品充分研磨匀浆后转移到10 mL离心管中, 4 ℃、15 000 g离心15 min。吸取1 mL上清液于新离心管中, 加入等体积1 mL样品溶解液[20 g·L-1十二烷基硫酸钠, 4%(体积分数)巯基乙醇, 10%(体积分数)甘油, 1 g·L-1溴酚蓝], 沸水浴中煮5 min后待测。
电泳采用不连续缓冲系统, 浓缩胶及分离胶分别为4%和12.5%, 上样量为15 μL, 电压135 V, 电泳结束后, 取出电泳胶, 用自来水冲洗3次后再用超纯水洗3次, 采用固定液固定30 min后, 加入2.5 g·L-1的考马斯亮蓝R250溶液对胶面染色12 h。之后加入脱色液脱色至背景胶无色。用超纯水将电泳胶洗净后, 采用双面刀将Rubisco的大、小亚基切下置于10 mL离心管中, 加入2 mL甲酰胺后50 ℃水浴洗脱10 h, 最后在595 nm下测定吸光值。用牛血清蛋白溶液为标准蛋白绘标准曲线, 计算Rubisco含量。
1.3 数据统计与分析数据用Excel 2016和SPSS 17.0软件进行ANOVA方差分析和处理, 并用多重比较的方法比较不同处理之间的差异。
2 结果与分析 2.1 光照强度对不同品种水稻生物量、分蘖数以及比叶重的影响从表 1可知:与T100处理相比, T25处理下茎秆和根系干质量下降幅度显著高于叶片; 分蘖数分别下降34%、42%和61%, '国稻6号''Ⅱ优084'分蘖数显著高于'扬稻6号'; '扬稻6号'叶面积下降28%, 而超级稻品种无明显变化。同时, T25处理3个水稻品种根冠比分别下降23%、27%和10%, 比叶重分别下降22%、31%和18%, 且'国稻6号''Ⅱ优084'根冠比和比叶重均显著低于'扬稻6号'。
| 品种 Varieties |
处理 Treatment |
根系干质量/g Root dry weight |
茎干质量/g Stem dry weight |
叶片干质量/g Leaf dry weight |
根冠比 Root-shoot ratio |
分蘖数 Numbers of tillers per plant |
叶面积/cm2 Leaf area |
比叶重/(g·m-2) Specific leaf weight |
| 国稻6号 | T100 | 0.92±0.14a | 2.22±0.32a | 1.96±0.22a | 0.22±0.01a | 6.4±0.55a | 513±43a | 38.34±3.22a |
| Guodao 6 | T25 | 0.44±0.16c | 0.98±0.18c | 1.58±0.09b | 0.17±0.05c | 4.2±0.45c | 530±32a | 29.75±1.75c |
| Ⅱ优084 | T100 | 0.84±0.06ab | 2.02±0.18ab | 1.72±0.18b | 0.22±0.01a | 6.6±0.89a | 426±37b | 40.49±3.52a |
| Liangyou 084 | T25 | 0.34±0.11c | 0.90±0.18c | 1.16±0.10c | 0.16±0.03c | 3.8±0.45c | 414±26b | 28.09±1.75c |
| 扬稻6号 | T100 | 0.74±0.12b | 1.76±0.30b | 1.80±0.06ab | 0.21±0.03ab | 5.6±0.55b | 436±38b | 41.40±3.64a |
| Yangdao 6 | T25 | 0.34±0.10c | 0.64±0.12c | 1.06±0.16c | 0.19±0.04ab | 2.2±0.45d | 314±24c | 34.04±2.64b |
| 注:T100:光照强度Light density 800 μmol·m-2·s-1; T25:光照强度Light density 200 μmol·m-2·s-1.不同字母表示在0.05水平差异显著。下同。Different small letters indicate significant difference at 0.05 level. The same as follows. | ||||||||
由图 1-A可知:水稻叶片的光合速率受到光照强度的影响。相对于T100处理, T25处理'国稻6号''Ⅱ优084''扬稻6号'叶片光合速率分别下降了18%、20%和26%。T25处理'国稻6号''Ⅱ优084'叶片光合速率显著高于'扬稻6号'。

|
图 1 光照强度对不同水稻品种光合速率(A)和叶绿素含量(B)的影响 Fig. 1 Effect of light density on rice photosynthetic rate(A)and chlorophyll content(B)of different varieties 不同字母表示在0.05水平差异显著。下同。 The different letters above the bars mean significant difference at 0.05 level. The same as follows. |
从图 1-B可知:相对T100处理, T25处理'国稻6号''扬稻6号'叶片叶绿素含量分别增加50%和17%, 而'Ⅱ优084'无明显变化。
2.3 光照强度对不同品种水稻叶绿素荧光参数的影响从表 2可知:相对T100处理, T25处理'扬稻6号'叶片的基础荧光出现显著下降, 而超级稻品种无明显变化; '国稻6号''Ⅱ优084'的稳态荧光分别升高14%和17%, '扬稻6号'却无明显变化。T100处理'Ⅱ优084'叶片的稳态荧光显著低于'扬稻6号', 而T25处理不同品种间稳态荧光无显著差异。T25处理3个供试水稻品种叶片的ΦPSⅡ和ETR均有不同程度下降, '国稻6号''Ⅱ优084'的ΦPSⅡ分别下降17%和29%, ETR分别下降20%和29%, 下降比例均显著高于'扬稻6号'。
| 品种 Varieties |
处理 Treatment |
基础荧光 F'o |
最大荧光 F'm |
稳态荧光 Fs |
光系统Ⅱ实际光化学量子效率 ΦPSⅡ |
光化学猝灭系数 qP |
非光化学猝灭系数 qN |
电子传递速率 ETR |
| 国稻6号 | T100 | 569.67ab | 1 210.03a | 851.43bc | 0.293ab | 0.55a | 2.12a | 187.10abc |
| Guodao 6 | T25 | 585.90a | 1 274.67a | 974.13a | 0.236bc | 0.44b | 2.18a | 150.40bc |
| Ⅱ优084 | T100 | 552.60ab | 1 189.60a | 817.37c | 0.313a | 0.58a | 2.15a | 199.27a |
| Liangyou 084 | T25 | 555.70ab | 1 227.83a | 955.80ab | 0.221c | 0.40b | 2.21a | 140.94c |
| 扬稻6号 | T100 | 607.77a | 1 389.43a | 961.17ab | 0.306ab | 0.55a | 2.28a | 195.28ab |
| Yangdao 6 | T25 | 521.93b | 1 193.43a | 863.27abc | 0.275abc | 0.49ab | 2.28a | 175.43abc |
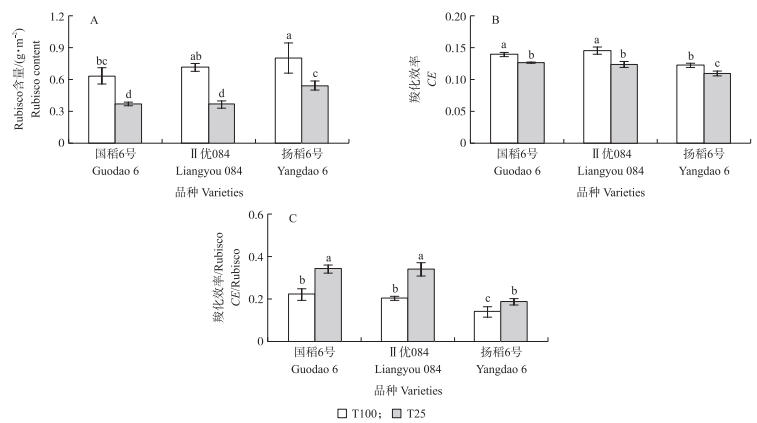
从图 2可知:相对T100处理, T25处理3个水稻品种叶片中Rubisco含量及羧化效率均显著下降, 其中, Rubisco含量下降32%~49%, 羧化效率下降9%~15%。而在不同光照强度下, '国稻6号'Rubisco含量低于对照'扬稻6号'。'国稻6号''Ⅱ优084'羧化效率均显著高于'扬稻6号'。T25处理3个水稻品种叶片中羧化效率/Rubisco均显著上升, 且在不同光照强度下, 超级稻品种Rubisco活性均显著高于对照。
|
图 2 光照强度对不同品种水稻Rubisco含量、羧化效率、羧化效率/Rubisco的影响 Fig. 2 Effect of light density on rice Rubisco content, carboxylation efficiency(CE) and the ratio of CE to Rubisco in different varieties |
从表 3可知:相对T100处理, T25处理3个品种水稻叶片气孔导度与叶肉导度均不同程度降低, 气孔导度下降19%~36%, 叶肉导度下降22%~50%, 且无论是气孔导度还是叶肉导度, '国稻6号'和'Ⅱ优084'的下降幅度均显著低于'扬稻6号'。T25处理不同水稻品种胞间CO2浓度无显著差异, 而'国稻6号''Ⅱ优084'的叶肉导度显著高于对照'扬稻6号', 因此, '国稻6号'和'Ⅱ优084'叶绿体内CO2浓度高于'扬稻6号'。
| 品种 Varieties |
处理 Treatment |
气孔导度/ (mol ·m-2·s-1) gs | 胞间CO2浓度/ (μmol·mol-1) Ci | 叶肉导度/ (mol·m-2·s-1) gm | 叶绿体内CO2浓度/ (μmol·mol-1) Cc |
| 国稻6号 | T100 | 0.63±0.06a | 297.50±19.00a | 0.18±0.02a | 176.22±13.34ab |
| Guodao 6 | T25 | 0.49±0.14ab | 305.50±10.21a | 0.14±0.02bc | 180.04±7.43a |
| Ⅱ优084 | T100 | 0.54±0.12ab | 296.75±18.93a | 0.18±0.02a | 171.71±12.07ab |
| Liangyou 084 | T25 | 0.44±0.07bc | 314.25±9.03a | 0.12±0.02c | 167.60±8.20ab |
| 扬稻6号 | T100 | 0.50±0.16ab | 293.25±33.21a | 0.16±0.01ab | 178.20±15.69ab |
| Yangdao 6 | T25 | 0.32±0.04c | 298.75±8.38a | 0.08±0.01d | 149.00±12.79b |
植物为了适应光照环境会改变叶片乃至整体的生化成分及形态。弱光照强度条件下, 植物将更多的生物量分配至叶片, 并且会通过降低比叶重以及叶片厚度以提高叶面光截获能力[14]。本研究中, 相对于茎秆与根系, 叶片在弱光胁迫下生物量下降幅度较小, 同时比叶重较正常光照条件下显著降低。以上结果说明弱光胁迫下, 植物通过生物量分配及叶片形态的改变以获得尽可能大的光合作用面积, 降低光照强度下降对植物光合作用的影响。与常规水稻品种'扬稻6号'相比, 超级稻品种'国稻6号'和'Ⅱ优084'根冠比及比叶重下降幅度更大, 可见超级稻生物量分配及叶片形态对光照强度响应更为敏感。
植物生长在弱光胁迫条件下, 为提高光捕获效率, 通常会提高叶片中叶绿素含量以促进对光能的捕获[15-16]。本研究中, T25处理'国稻6号'与'扬稻6号'叶片叶绿素含量均显著升高, 而'Ⅱ优084'叶片叶绿素含量升高不明显。这可能是由于在弱光胁迫下其比叶重下降, 导致叶片单位面积叶绿素含量升高不明显。
由于弱光下光合碳代谢对ATP及NADPH需求的减小, PSⅡ原初光化学反应光合电子传递下降[17]。本研究中, T25处理3个供试品种水稻的ETR与ΦPSⅡ均出现不同程度下降, 且表现出光反应过程中品种间对弱光胁迫敏感程度的差异, '国稻6号''Ⅱ优084'下降幅度大于'扬稻6号', 且'Ⅱ优084'的ETR及ΦPSⅡ下降幅度显著, 可能是由于qP下降。这说明PSⅡ中完全开放的反应中心所占比例下降, 从而限制光合碳代谢的电子供应, 影响光合作用中光反应的进行。
气孔导度(gs)及叶肉导度(gm)共同决定到达羧化位点——叶绿体的CO2的浓度。前人研究表明, 光照胁迫会降低叶肉导度[18]。本研究中, T25处理gs下降的同时, gm亦出现下降, 导致细胞间隙的CO2向叶肉中传导的阻力增加, 因此Ci无明显变化。gm取决于扩散途径的距离以及扩散途径的特性, 包括气相、液相以及脂相[19-20]。T25处理中gm下降可能与弱光胁迫下叶片厚度降低, 从而导致单位叶面积叶肉细胞与CO2接触面积下降有关[21]。在许多植物中, gm作为光合的重要限制因子, 普遍与光合速率存在显著正相关关系[22]。本试验中, T25处理'国稻6号''Ⅱ优084'的gm显著高于对照, 与光合速率的趋势类似。喜光植物相对耐荫植物通常在弱光条件下具有更高的叶肉孔隙度, 促进了CO2在叶肉中气相的传导, 常拥有更大的gm[23]。这与我们研究结果一致, 说明弱光胁迫下'国稻6号''Ⅱ优084'与'扬稻6号'gm的差异, 可能是由它们光喜好特性造成的。
Rubisco活性与叶肉导度是影响叶片羧化效率的2个主要因素。Rubisco是卡尔文循环的关键酶, 也是含量最为丰富的酶[24]。然而Rubisco活性非常低, 在C3植物中, Rubisco活性仅为最大活力的25%[25-26], 大量的Rubisco以失活的氮库状态存在, 而不是以酶的形式存在[27]。本研究中, T25处理Rubisco含量显著降低, 这与之前报道叶片变薄导致较低的叶片Rubisco含量[28]相符。T25处理中Rubisco活性升高, 所以叶片叶肉导度下降是弱光胁迫下羧化效率下降的主要原因。T100处理中, 由于3个水稻品种间叶肉导度无明显差异, 而超级稻品种相比常规品种拥有更高的Rubisco活性; T25处理中超级稻品种由于叶肉导度及Rubisco活性高于常规品种, 因此超级稻品种相对常规品种, 无论是在正常光照还是弱光胁迫下都具有更高的羧化效率。
综上所述, 弱光胁迫下由于叶片叶绿素含量的增加, 水稻叶片提高了对光的截获能力, 一定程度上补偿了弱光胁迫对叶片光合作用中光反应过程的影响。叶片光合速率下降的主要原因是, 暗反应过程中叶肉导度下降导致羧化效率下降, 影响了光合作用的进行。弱光胁迫下超级杂交稻'国稻6号''Ⅱ优084'光合速率高于常规稻'扬稻6号', 是因为弱光胁迫下其Rubisco活性及叶肉导度均高于常规品种, 从而使其在弱光胁迫下拥有更高的羧化效率, 进而获得更高的光合速率。适当提高氮素供给可以增加弱光胁迫条件下植株叶片的叶肉导度[29]。因此, 可以通过适当增加蘖肥和穗肥的氮肥施用量来减少分蘖期弱光胁迫对水稻生长的不利影响。
| [1] |
朱德峰, 张玉屏, 陈惠哲, 等. 中国水稻高产栽培技术创新与实践[J]. 中国农业科学, 2015, 48(17): 3404-3414. Zhu D F, Zhang Y P, Chen H Z, et al. Innovation and practice of high-yield rice cultivation technology in China[J]. Scientia Agricultura Sinica, 2015, 48(17): 3404-3414 (in Chinese with English abstract). DOI:10.3864/j.issn.0578-1752.2015.17.008 |
| [2] |
龚金龙, 张洪程, 李杰, 等. 超级稻生态育种及超高产栽培特征与途径的研究进展[J]. 中国农业科技导报, 2011(1): 25-33. Gong J L, Zhang H C, Li J, et al. Research progress ecological breeding and cultivation characteristics of super rice and approaches of super high yield[J]. Journal of Agricultural Science and Technology, 2011(1): 25-33 (in Chinese with English abstract). DOI:10.3969/j.issn.1008-0864.2011.01.05 |
| [3] |
Zhang Y, Tang Q, Zou Y, et al. Yield potential and radiation use efficiency of"super"hybrid rice grown under subtropical conditions[J]. Field Crops Research, 2009, 114(1): 91-98. DOI:10.1016/j.fcr.2009.07.008 |
| [4] |
Zhang H, Xue Y G, Wang Z Q, et al. Morphological and physiological traits of roots and their relationships with shoot growth in"super"rice[J]. Field Crops Research, 2009, 113(1): 31-40. DOI:10.1016/j.fcr.2009.04.004 |
| [5] |
Katsura K, Maeda S, Horie T, et al. Analysis of yield attributes and crop physiological traits of Liangyoupeijiu, a hybrid rice recently bred in China[J]. Field Crops Research, 2007, 103(3): 170-177. DOI:10.1016/j.fcr.2007.06.001 |
| [6] |
Yang J C, Zhang J H. Grain-filling problem in"super"rice[J]. Journal of Experimental Botany, 2010, 61(1): 1-5. DOI:10.1093/jxb/erp348 |
| [7] |
Sheehy J E, Dionora M J A, Mitchell P L. Spikelet numbers, sink size and potential yield in rice[J]. Field Crops Research, 2001, 71(2): 77-85. DOI:10.1016/S0378-4290(01)00145-9 |
| [8] |
李杰, 张洪程, 常勇, 等. 高产栽培条件下种植方式对超级稻根系形态生理特征的影响[J]. 作物学报, 2011, 37(12): 2208-2220. Li J, Zhang H C, Chang Y, et al. Influence of planting methods on root system morphological and physiological characteristics of super rice under high-yielding cultivation condition[J]. Acta Agronomica Sinica, 2011, 37(12): 2208-2220 (in Chinese with English abstract). |
| [9] |
洪彬艺. 超级稻推广的主要制约因素和对策措施[J]. 福建农业科技, 2010(4): 1-2. Hong B Y. The main constraints and countermeasures of the super rice promotion[J]. Fujian Agricultural Science and Technology, 2010(4): 1-2 (in Chinese). DOI:10.3969/j.issn.0253-2301.2010.04.001 |
| [10] |
蔡昆争, 骆世明. 不同生育期遮光对水稻生长发育和产量形成的影响[J]. 应用生态学报, 1999, 10(2): 193-196. Cai K Z, Luo S M. Effect of shading on growth, development and yield formation of rice[J]. Chinese Journal of Applied Ecology, 1999, 10(2): 193-196 (in Chinese with English abstract). DOI:10.3321/j.issn:1001-9332.1999.02.017 |
| [11] |
付景, 王志琴, 杨建昌. 抽穗灌浆期低温与弱光对超级稻结实率和生理性状的影响[J]. 扬州大学学报(农业与生命科学版), 2014, 35(4): 68-74. Fu J, Wang Z Q, Yang J C. Effects of low temperature and weak light during heading and grain filling on the seed-setting rate and physiological traits of super rice[J]. Journal of Yangzhou University(Agricultural and Life Science Edition), 2014, 35(4): 68-74 (in Chinese with English abstract). |
| [12] |
Lu Z J, Neumann P M. Water-stressed maize, barley and rice seedlings show species diversity in mechanisms of leaf growth inhibition[J]. Journal of Experimental Botany, 1998, 49(329): 1945-1952. DOI:10.1093/jxb/49.329.1945 |
| [13] |
张志良, 瞿伟菁. 植物生理学实验指导[M]. 3版. 北京: 高等教育出版社, 1986: 11. Zhang Z L, Qu W J. Experimental Guidance on Plant Physiology[M]. 3rd ed. Beijing: Higher Education Press, 1986: 11 (in Chinese). |
| [14] |
Terashima I, Hikosaka K. Comparative ecophysiology of leaf and canopy photosynthesis[J]. Plant, Cell and Environment, 1995, 18(10): 1111-1128. DOI:10.1111/pce.1995.18.issue-10 |
| [15] |
Dai Y J, Shen Z G, Liu Y, et al. Effects of shade treatments on the photosynthetic capacity, chlorophyll fluorescence, and chlorophyll content of Tetrastigma hemsleyanum Diels et Gilg[J]. Environmental and Experimental Botany, 2009, 65(2): 177-182. |
| [16] |
Yamori W, Evans J R, van Caemmerer S. Effects of growth and measurement light intensities on temperature dependence of CO2 assimilation rate in tobacco leaves[J]. Plant, Cell and Environment, 2010, 33(3): 332-343. DOI:10.1111/pce.2010.33.issue-3 |
| [17] |
周艳虹, 黄黎锋, 喻景权. 持续低温弱光对黄瓜叶片气体交换、叶绿素荧光碎灭和吸收光能分配的影响[J]. 植物生理与分子生物学学报, 2004, 30(2): 153-160. Zhou Y H, Huang L F, Yu J Q. The effects of low temperature and low light on the gas exchange, chlorophyll fluorescence and absorption spectra of cucumber leaves[J]. Journal of Plant Physiology and Molecular Biology, 2004, 30(2): 153-160 (in Chinese with English abstract). |
| [18] |
Ivanova L A, Ivanov L A, Ronzhina D A, et al. Shading-induced changes in the leaf mesophyll of plants of different functional types[J]. Russian Journal of Plant Physiology, 2008, 55(2): 211-219. DOI:10.1134/S1021443708020076 |
| [19] |
Evans J R, Kaldenhoff R, Terashima I. Resistances along the CO2 diffusion pathway inside leaves[J]. Journal of Experimental Botany, 2009, 60: 2235-2248. DOI:10.1093/jxb/erp117 |
| [20] |
Terashima I, Hanba Y T, Tholen D, et al. Leaf functional anatomy in relation to photosynthesis[J]. Plant Physiology, 2011, 155(1): 108-116. DOI:10.1104/pp.110.165472 |
| [21] |
Terashima I, Hanba Y T, Tazoe Y, et al. Irradiance and phenotype:comparative eco-development of sun and shade leaves in relation to photosynthetic CO2 diffusion[J]. Journal of Experimental Botany, 2006, 57(2): 343-354. DOI:10.1093/jxb/erj014 |
| [22] |
Tosens T, Niinemets V, Vislap V, et al. Developmental changes in mesophyll diffusion conductance and photosynthetic capacity under different light and water availabilities in Populus tremula:how structure constrains function[J]. Plant, Cell and Environment, 2012, 35(5): 839-856. DOI:10.1111/pce.2012.35.issue-5 |
| [23] |
Hanba Y T, Kogami H, Terashima I. The effect of growth irradiance on leaf anatomy and photosynthesis in Acer species differing in light demand[J]. Plant, Cell and Environment, 2002, 25(8): 1021-1030. DOI:10.1046/j.1365-3040.2002.00881.x |
| [24] |
Jin S H, Hong J, Li X Q, et al. Antisense inhibition of rubisco activase increases rubisco content and alters the proportion of rubisco activase in stroma and thylakoids in chloroplasts of rice leaves[J]. Annals of Botany, 2006, 97(5): 739-744. DOI:10.1093/aob/mcl025 |
| [25] |
Galmés J, Ribas-Carbó M, Medrano H, et al. Rubisco activity in Mediterranean species is regulated by the chloroplastic CO2 concentration under water stress[J]. Journal of Experimental Botany, 2011, 62(2): 653-665. DOI:10.1093/jxb/erq303 |
| [26] |
Sage R F, Pearcy R W. The nitrogen use efficiency of C3 and C4 plants[J]. Plant Physiology, 1987, 84(3): 959-963. DOI:10.1104/pp.84.3.959 |
| [27] |
Manter D K. A/Ci curve analysis across a range of woody plant species:influence of regression analysis parameters and mesophyll conductance[J]. Journal of Experimental Botany, 2004, 55(408): 2581-2588. DOI:10.1093/jxb/erh260 |
| [28] |
Niinemets V. Photosynthesis and resource distribution through plant canopies[J]. Plant, Cell and Environment, 2007, 30(9): 1052-1071. DOI:10.1111/pce.2007.30.issue-9 |
| [29] |
Yamori W, Nagai T, Makino A. The rate-limiting step for CO2 assimilation at different temperatures is influenced by the leaf nitrogen content in several C3 crop species[J]. Plant, Cell and Environment, 2011, 34(5): 764-777. DOI:10.1111/pce.2011.34.issue-5 |




