文章信息
- 刘龙, 孙丽英, 王敦
- LIU Long, SUN Liying, WANG Dun
- RBSDV P7-2基因重组AcMNPV的构建及其对sf9细胞的致死作用
- Construction of recombinant AcMNPV with P7-2 gene of RBSDV and its lethal effect on sf9 cells
- 南京农业大学学报, 2019, 42(1): 81-87
- Journal of Nanjing Agricultural University, 2019, 42(1): 81-87.
- http://dx.doi.org/10.7685/jnau.201803035
-
文章历史
- 收稿日期: 2018-03-19
目前, 害虫防治主要依靠化学合成农药, 但是随着化学农药大量不合理的使用, 造成了环境污染、害虫抗药性增加、危害人类健康等问题。不污染环境、对人类安全、具有靶标特异性的生物农药成为人们关注的焦点[1-3]。
杆状病毒作为一种生物杀虫剂具有对脊椎动物、植物安全, 不污染环境, 具有靶标特异性及控制昆虫种群数量等优点, 在20世纪就被广泛应用于农业和森林害虫防治[4-5]。但是由于其杀虫速度慢、成本高、害虫在死亡前仍会大量取食植物等缺点限制了其商业化的使用[6-7]。因此, 加快杀虫速度对于杆状病毒的广泛使用具有重要意义。通过基因工程构建重组病毒, 不仅可以克服杆状病毒的固有缺点, 也为扩大病毒杀虫功能提供了潜在可能[8-9]。为提高杆状病毒的杀虫效果, 来源于苏云金芽胞杆菌(Bacillus thuringiensis, Bt)、蝎子等的昆虫特异性毒素基因已被成功插入到杆状病毒基因组中, 其杀虫速度相比于野生型病毒显著提高[10-13]。将诱导细胞凋亡基因插入到杆状病毒基因组中却未见报道。
水稻黑条矮缩病毒(Rice black-streaked dwarf virus, RBSDV)是一种由灰飞虱(Laodelphax striatellus)传播的病毒, 隶属呼肠孤病毒科(Reoviridae), 斐济病毒属(Fijivirus)。该病毒基因组由10个双链RNA片段组成, 其中片段s7的P7-2基因编码1个高度保守的非结构蛋白P7-2[14]。P7-2基因编码的蛋白具有诱导细胞凋亡的功能, 在本研究中, 首次将诱导细胞凋亡基因P7-2重组到苜蓿银纹夜蛾核型多角体病毒(Autographa californica multiple nucleopolyhedrovirus, AcMNPV)基因组中, 观察了重组病毒多角体在sf9细胞内的形成和重组病毒对sf9细胞的致死作用, 以期为改善杆状病毒的杀虫效果和构建重组杆状病毒奠定基础。
1 材料与方法 1.1 材料 1.1.1 细胞、病毒、载体及菌株sf9细胞系、野生型苜蓿银纹夜蛾核型多角体病毒(Autographa californica multiple nucleopolyhedrovirus, AcMNPV)vAc-WT、野生型AcMNPV bacmid Ac-WT、含有AcMNPV基因组(bacmid bMON14272)和Helper质粒(pMON7124)的菌株DH10Bac、大肠杆菌E.coli TG1、供体质粒pFastBac-HTB均为西北农林科技大学植物保护学院昆虫与微生物资源利用实验室保存。含有AcMNPV多角体基因ph和AcMNPV ie-1启动子的pFBPG质粒由中山大学杨凯教授馈赠。含有P7-2基因的质粒pBIN由西北农林科技大学孙丽英教授馈赠。克隆载体pGEM-T Easy购自Promaga公司。
1.1.2 培养基、限制性内切酶、DNA聚合酶及试剂TNM-FH昆虫细胞培养基购自Sigma公司。罗氏(Roche)转染试剂X-tremeGENE HP DNA Transfection Reagent购自陕西易飞生物公司。限制性内切酶、rTaq DNA聚合酶、dNTPs、DNA分子质量标准maker DL2000和DL15000购自TaKaRa公司。T4 DNA ligase购自Promaga公司。琼脂糖、胰蛋白胨、酵母提取物、抗生素、RNase、IPTG、X-gal均购自西安沃尔森公司。其他化学试剂均为国产分析纯, 购自杨凌天成化玻站。
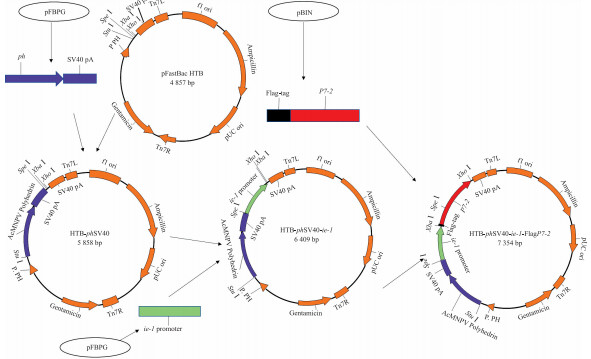
1.2 方法 1.2.1 供体质粒HTB-phSV40-ie-1-FlagP7-2的构建在pFPBG中, ph基因后连接有SV40终止子, 用以终止ph基因的转录。以pFBPG质粒为模板, 使用引物ph-F和SV40-R(表 1), PCR扩增长1 015 bp的phSV40片段, 使用SV40终止子终止ph基因的转录。将phSV40片段连入pGEM-T Easy载体, StuⅠ、SpeⅠ双酶切鉴定并测序。将测序正确的phSV40片段连入pFastBac-HTB载体, StuⅠ、SpeⅠ双酶切鉴定, 构建形成HTB-phSV40。以pFBPG质粒为模板, 使用引物ie-1-F和ie-1-R(表 1), PCR扩增得到长567 bp的AcMNPV ie-1启动子, 连入pGEM-T Easy载体, SpeⅠ、XbaⅠ双酶切鉴定并测序。将测序正确的ie-1启动子连入HTB-phSV40载体, SpeⅠ、XbaⅠ及StuⅠ、XbaⅠ双酶切鉴定, 构建形成HTB-phSV40-ie-1。以pBIN为模板, 以Flag-P7-2-F和P7-2-R(表 1)为引物, 通过PCR将Flag标签序列添加到P7-2基因的C端, 并得到长954 bp的FlagP7-2片段, 将其连入pGEM-T Easy载体, XbaⅠ、XhoⅠ双酶切鉴定并测序。将测序正确的FlagP7-2片段连入HTB-phSV40-ie-1, 经XbaⅠ、XhoⅠ及StuⅠ、XhoⅠ双酶切鉴定, 最终构建形成供体质粒HTB-phSV40-ie-1-FlagP7-2(图 1)。
| 引物名称Primer name | 引物序列Primer sequences |
| ph-F | 5'-AGGCCTATGCCGGATTATTCATAC-3'(StuⅠ) |
| SV40-R | 5'-ACTAGTAGATCCAGACATGATAAG-3'(SpeⅠ) |
| ie-1-F | 5'-ACTAGTGTAGGTTATTGATAAAATGAACGG-3'(SpeⅠ) |
| ie-1-R | 5'-TCTAGAAGTCACTTGGTTGTTCAC-3'(XbaⅠ) |
| Flag-P7-2-F | 5'-TCTAGAATGGATTACAAGGATGACGACGATAAGAATTACACTTTAGGTGATC-3'(XbaⅠ) |
| P7-2-R | 5'-CTCGAGTTAAGAATTCAGTATCT-3'(XhoⅠ) |
| M13-F | 5'-CCCAGTCACGACGTTGTAAAACG-3' |
| M13-R | 5'-AGCGGATAACAATTTCACACAGG-3' |
| 注:下划线为酶切位点; 斜体加粗部分为Flag-tag, 通过PCR添加到P7-2基因的C端。 Note:Underlined indicates restriction sites. Bold italic part indicates the Flag-tag which is added to C-terminal of the P7-2 gene by PCR. |
|
|
图 1 供体质粒HTB-phSV40-ie-1-FlagP7-2构建示意图 Fig. 1 Schematic diagram of construction of HTB-phSV40-ie-1-FlagP7-2 |
将10 μL供体质粒HTB-phSV40-ie-1-FlagP7-2加入到200 μL DH10Bac感受态细胞中, 并轻柔吹打混匀, 冰上孵育30 min, 42 ℃热击90 s, 立即冰浴5 min。加入800 μL LB培养基, 37 ℃、225 r·min-1振荡培养4 h。原液10倍稀释2次后, 将原液、10倍稀释液、100倍稀释液涂布在含卡那霉素(50 μg·mL-1)、庆大霉素(14 μg·mL-1)、四环素(10 μg·mL-1)、X-gal(100 μg·mL-1)和IPTG(40 μg·mL-1)的LB平板上, 放置在37 ℃培养箱中48 h, 挑取白色克隆, 使用M13-F/M13-R(表 1)引物PCR鉴定。
1.2.3 sf9细胞的转染bacmid Ac-P7-2及Ac-WT按照X-tremeGENE HP DNA Transfection Reagent(Roche)说明书转染sf9细胞。
1.2.4 P7-2蛋白表达的鉴定使用Western blot检测P7-2蛋白的表达。Ac-P7-2转染sf9细胞72 h后收集细胞, 加入100 μL ddH2O重悬细胞; 加入100 μL 5× SDS-PAGE上样缓冲液, 沸水浴10 min, 12 000 g离心10 min; 取10 μL上清液利用120 g·L-1 SDS-PAGE胶进行蛋白分离。使用伯乐半干转印槽(Biorad Trans-Blot SD Semi-Dry Transfer Cell)将蛋白转移至硝酸纤维素膜。免疫印迹采用标准方法进行。一抗为鼠源抗Flag标签的单克隆抗体(稀释比例1:5 000), 二抗为HRP标记的单克隆抗体山羊抗小鼠lgG(稀释比例1:6 000), 蛋白条带在化学发光系统观察并拍照。同时, 以AcMNPV gp64基因(Ac-gp64)作为阳性对照, 蛋白大小约为59×103, 一抗为鼠源抗gp64的单克隆抗体(Santa Cruz Biotechnology), 稀释比例为1:5 000, 二抗为HRP标记的单克隆抗体山羊抗小鼠lgG(稀释比例1:6 000)。以野生型AcMNPV bacmid Ac-WT转染sf9细胞作为阴性对照, 一抗为鼠源抗Flag标签的单克隆抗体(稀释比例1:5 000), 二抗为HRP标记的单克隆抗体山羊抗小鼠lgG(稀释比例1:6 000)。
1.2.5 重组bacmid Ac-P7-2转染sf9细胞的光学显微观察与细胞死亡时间分析接种1×106个sf9细胞到直径35 mm的细胞培养皿中, 分别将1 μg Ac-P7-2和Ac-WT bacmid DNA转染sf9细胞, 每种bacmid重复转染3次。每隔24 h观察多角体的形成和细胞破裂情况, 并在Nikon eclipse TE2000-S(400×)光学显微镜下随机观察30个视野, 记录死亡细胞数量。所得结果使用SPSS 23.0进行差异显著性分析。
1.2.6 病毒生长曲线的测定分别将1 μg Ac-P7-2和Ac-WT bacmid DNA转染铺制好的sf9细胞, 分别在转染sf9细胞24、48、72、96、120 h后收集含有出芽病毒(budded virus, BV)的病毒上清液, 采用半数组织感染剂量(tissue culture infective dose, TCID50)测定转染sf9细胞后不同时间的病毒滴度。将生长良好的sf9细胞铺于96孔板中, 每孔100 μL, 当细胞长到80%~90%时用于测定病毒的滴度。将待测样品用细胞培养基依次稀释为10-1、10-2、10-3、10-4、10-5、10-6、10-7、10-8、10-9、10-10和10-11共11个浓度梯度, 每个浓度梯度为8个复孔, 每个复孔100 μL, 另外设8个复孔为对照孔, 加入100 μL培养基。混合均匀后, 于27 ℃培养5~7 d, 统计每个复孔是否有病毒感染。计算出每个浓度梯度8个复孔中感染复孔所占的百分比, 找到相邻的稀释梯度中高浓度复孔感染率(X%)大于50%而低浓度复孔感染率(Y%)低于50%的2个感染孔的百分比, 根据下列公式计算得出待测病毒的滴度。
距离比例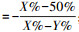
lg TCID50=距离比例+lg稀释倍数(临界高于50%感染率的稀释倍数);
TCID50=10lg TCID50(病毒液稀释到10lg TCID50梯度后100 μL所含的病毒量为1个TCID50);
TCID50(每mL病毒原液所含的病毒量)=10×10lg TCID50。
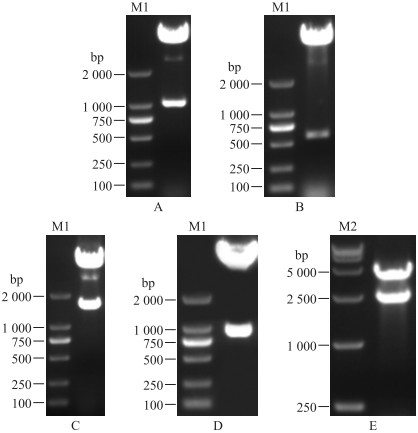
2 结果与分析 2.1 供体质粒HTB-phSV40-ie-1-FlagP7-2及重组bacmid Ac-P7-2的构建与鉴定将测序正确的phSV40片段连入pFastBac-HTB载体, StuⅠ、SpeⅠ双酶切后, 在1 000 bp附近有单一条带(图 2-A), 表明phSV40正确连入pFastBac-HTB载体, 成功构建了HTB-phSV40。将测序正确的ie-1启动子连入HTB-phSV40载体, 经SpeⅠ、XbaⅠ双酶切后, 在500 bp和750 bp之间有单一条带(图 2-B), StuⅠ、XbaⅠ双酶切后, 在1 600 bp附近有单一条带(图 2-C), 表明ie-1启动子正确连入HTB-phSV40, 成功构建了HTB-phSV40-ie-1。将测序正确的FlagP7-2片段连入HTB-phSV40-ie-1, XbaⅠ、XhoⅠ双酶切后, 在1 000 bp附近有单一条带(图 2-D), StuⅠ、XhoⅠ双酶切后, 在2 500 bp附近有单一条带(图 2-E), 表明FlagP7-2片段正确连入HTB-phSV40-ie-1, 成功构建了供体质粒HTB-phSV40-ie-1-FlagP7-2。
|
图 2 HTB-phSV40、HTB-phSV40-ie-1、HTB-phSV40-ie-1-FlagP7-2酶切鉴定 Fig. 2 Restriction endonuclease analysis of HTB-phSV40, HTB-phSV40-ie-1 and HTB-phSV40-ie-1-FlagP7-2 A. HTB-phSV40 StuⅠ、SpeⅠ双酶切; B. HTB-phSV40-ie-1 SpeⅠ、XbaⅠ双酶切; C. HTB-phSV40-ie-1 StuⅠ、XbaⅠ双酶切; D. HTB-phSV40-ie-1-FlagP7-2 XbaⅠ、XhoⅠ双酶切; E.HTB-phSV40-ie-1-FlagP7-2 StuⅠ、XhoⅠ双酶切。M1. DL2000 marker; M2. DL15000 marker。 A. Restriction endonuclease digestion of HTB-phSV40 by StuⅠand SpeⅠ; B. Restriction endonuclease digestion of HTB-phSV40-ie-1 by SpeⅠand XbaⅠ; C. Restriction endonuclease digestion of HTB-phSV40-ie-1 by StuⅠand XbaⅠ; D. Restriction endonuclease digestion of HTB-phSV40-ie-1-FlagP7-2 by XbaⅠand XhoⅠ; E. Restriction endonuclease digestion of HTB-phSV40-ie-1-FlagP7-2 by StuⅠand XhoⅠ. M1. DL2000 marker; M2. DL15000 marker. |
将供体质粒HTB-phSV40-ie-1-FlagP7-2转入DH10Bac细胞后, 通过转座获得重组bacmid Ac-P7-2, 以M13-F/M13-R为引物PCR鉴定后得到与预期大小一致的条带, 表明重组bacmid Ac-P7-2构建成功(图 3)。

|
图 3 重组bacmid Ac-P7-2 PCR鉴定 Fig. 3 PCR analysis of the recombinantbacmid Ac-P7-2 M. DL15000 marker; 1. Ac-P7-2(primers M13-F/M13-R). |
将构建好的重组bacmid Ac-P7-2转染sf9细胞72 h后, 利用鼠源单克隆抗Flag抗体进行Western blot分析, 得到了与预期分子质量大小一致的约37×103的蛋白条带, 表明P7-2蛋白能够正常表达(图 4)。

|
图 4 P7-2蛋白表达的Western blot鉴定 Fig. 4 Detection of expression of P7-2 protein by Western blot M.蛋白marker; 1.阴性对照Ac-WT; 2. Ac-P7-2; 3.阳性对照Ac-gp64。 M. Protein marker; 1. Negative control Ac-WT; 2. Ac-P7-2; 3. Positive control Ac-gp64. |
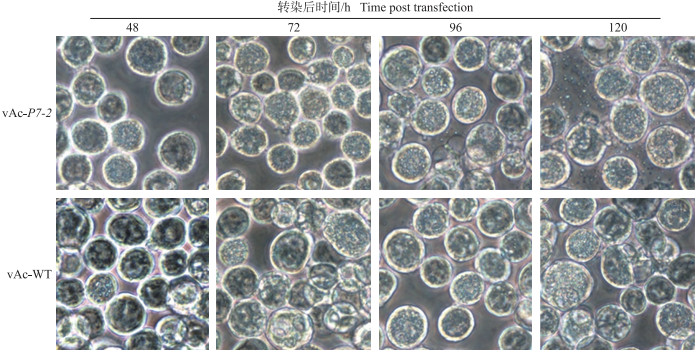
分别以1 μg Ac-P7-2和Ac-WT bacmid DNA转染sf9细胞, 在转染sf9细胞后每隔24 h观察多角体的形成并统计死亡细胞数量。由图 5可见, 重组病毒vAc-P7-2多角体从形成到最终细胞破裂释放的速度快于野生型病毒vAc-WT。由图 6可见, 在转染sf9细胞后48、72、96、120 h, Ac-P7-2转染sf9细胞后的细胞死亡个数显著高于Ac-WT, 表明相比于野生型病毒vAc-WT, 重组病毒vAc-P7-2可显著加快寄主细胞的死亡。
|
图 5 sf9细胞中vAc-P7-2和vAc-WT的光学显微镜观察(光学显微镜为Nikon eclipse TE2000-S, ×400) Fig. 5 Light microscopy observation of virus-transfected sf9 cells by using a Nikon eclipse TE2000-S(×400) |

|
图 6 Ac-P7-2和Ac-WT转染sf9细胞后细胞死亡数量统计 Fig. 6 Number of dead cells post transfected by Ac-P7-2 and Ac-WT **P<0.01. The same as follows. |
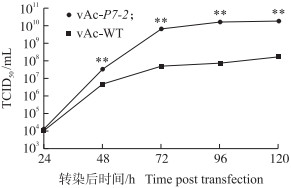
|
图 7 vAc-P7-2和vAc-WT病毒增长曲线 Fig. 7 Viral growth curve of vAc-P7-2 and vAc-WT |
用TCID50的方法测定不同时间点重组病毒vAc-P7-2及野生型病毒vAc-WT的滴度, 绘制病毒生长曲线(图 7), 结果显示, 在转染48、72、96、120 h后, vAc-P7-2的增殖速度显著快于vAc-WT(P<0.01)。
3 讨论构建重组杆状病毒的目的之一是提高杆状病毒的杀虫效果。目前, 构建重组杆状病毒的主要方式为插入外源毒素基因、影响昆虫代谢过程的激素基因和酶类基因, 对杆状病毒自身基因的删除[15]以及扩大杆状病毒的寄主域[16]。前期研究表明, 水稻黑条矮缩病毒的P7-2蛋白可以诱导细胞凋亡(未公开发表)。本研究首次将诱导细胞凋亡基因P7-2重组到AcMNPV中, 使用AcMNPV早期启动子ie-1启动其表达, 希望P7-2蛋白能够在早期表达并诱导细胞凋亡, 以期为改善杆状病毒杀虫效果和构建重组杆状病毒提供新的思路。
具有感染性的病毒粒子产生在感染末期, 在感染的极晚期多角体启动子和p10启动子非常活跃从而将病毒粒子包装成多角体, 目前构建的重组杆状病毒虽然加快了杀虫速度, 但是寄主昆虫的快速死亡会导致最终产生的多角体数量减少, 不利于杆状病毒后续在昆虫种群中的流行。本研究将重组bacmid Ac-P7-2转染sf9细胞后发现, 重组病毒vAc-P7-2形成多角体并释放的速度快于野生型病毒vAc-WT。为探究以上现象的原因, 本研究测定了2种病毒的生长曲线, 结果表明, vAc-P7-2的出芽病毒(budded virus, BVs)的增殖速度显著快于vAc-WT。用重组bacmid Ac-P7-2和野生型病毒bacmid Ac-WT转染sf9细胞48 h后, Ac-P7-2转染sf9细胞后的细胞死亡数显著高于Ac-WT, 表明重组病毒可显著加快寄主细胞的死亡。因此, 本研究构建的重组病毒在改善杆状病毒毒力的同时, 又加快了多角体的包装速度, 将来作为杀虫剂可在短时间产生大量多角体, 更加有利于对害虫种群的控制。重组病毒vAc-P7-2可以迅速产生多角体的可能原因为:病毒通过改变寄主细胞的环境来促进增殖和诱导发病; 同时, 细胞也会有相应的内源性途径反抗病毒的感染, 例如细胞损伤反应(DNA damage response, DDR)。DDR可以检测到进入细胞的或者是正在复制的病毒DNA, 并激活有效的抗病毒防御机制。核染色质相关的组蛋白H2AX磷酸化后的γ-H2AX在调节和放大DDR途径中发挥着重要作用[17]。AcMNPV在侵染寄主的过程中抑制了γ-H2AX的聚集, 其通过一个或者几个基因来抑制H2AX的磷酸化促进病毒的增殖[18]。Mitchell等[19]通过缺失和恢复AcMNPV的LEF-7基因发现, 缺失LEF-7基因后, BVs产量明显下降并抑制γ-H2AX的聚集, 证明LEF-7基因促进了病毒的增殖; 除此之外, 还发现LEF-7基因是细胞核的F-box蛋白, 而F-box蛋白是SKP1/Cullin/F-box(SCF)泛素连接酶复合物的组成部分, 推测LEF-7基因通过调节DDR某个组件的泛素多聚化进而调节γ-H2AX的聚集。Wang等[20]研究发现P7-2基因可能编码F-box蛋白, 作为SCF复合物的重要组成部分, 通过泛素化的途径与寄主互作。推测P7-2蛋白可能也具有类似LEF-7蛋白的功能, 在AcMNPV基因组中插入P7-2基因后, 在早期启动子AcMNPV ie-1的启动下, 打破了寄主细胞的防御, 并加快病毒的增殖。
本研究首次构建了含有诱导细胞凋亡基因的重组杆状病毒, 在细胞水平上证明其具有更强的毒力, 这为今后遗传改良杆状病毒提供了新的思路, 也为杆状病毒作为生物杀虫剂的广泛应用提供了新的素材。
致谢: 中山大学杨凯教授馈赠pFBPG质粒。
| [1] |
Gupta S, Dikshit A K. Biopesticides:an ecofriendly approach for pest control[J]. Journal of Biopesticides, 2010, 3(1): 186-188. |
| [2] |
Lacey L A, Frutos R, Kaya H K, et al. Insect pathogens as biological control agents:do they have a future?[J]. Biological Control, 2001, 21(3): 230-248. DOI:10.1006/bcon.2001.0938 |
| [3] |
Chandler D, Bailey A S, Tatchell G M, et al. The development, regulation and use of biopesticides for integrated pest management[J]. Phil Trans R Soc B, 2011, 366(1573): 1987-1998. DOI:10.1098/rstb.2010.0390 |
| [4] |
Beascatena A, Sánchezmirón A, Garcíacamacho F, et al. Baculovirus biopesticides:an overview[J]. Journal of Animal & Plant Sciences, 2014, 24(2): 362-373. |
| [5] |
Inceoglu A B, Kamita S G, Hammock B D. Genetically modified baculoviruses: a historical overview and future outlook[M]//Inceoglu A B, Kamita S G, Hammock B D. Advances in Virus Research. Amsterdam: Elsevier, 2006: 323-360.
|
| [6] |
Inceoglu A B, Kamita S G, Hinton A C, et al. Recombinant baculoviruses for insect control[J]. Pest Management Science, 2001, 57(10): 981-987. DOI:10.1002/(ISSN)1526-4998 |
| [7] |
McCutchen B F, Choudary P V, Crenshaw R, et al. Development of a recombinant baculovirus expressing an insect-selective neurotoxin:potential for pest control[J]. Bio/technology, 1991, 9(9): 848-852. |
| [8] |
李坚, 王敦. 生物防治杆状病毒基因工程研究进展[J]. 生物技术通讯, 2009, 20(4): 587-593. Li J, Wang D. Research progress in genetic engineering of baculovirus for biological control[J]. Letters in Biotechnology, 2009, 20(4): 587-593 (in Chinese with English abstract). DOI:10.3969/j.issn.1009-0002.2009.04.039 |
| [9] |
Bonning B C, Hammock B D. Development of recombinant baculoviruses for insect control[J]. Annual Review of Entomology, 1996, 41(1): 191-210. DOI:10.1146/annurev.en.41.010196.001203 |
| [10] |
Chang J H, Choi J Y, Jin B R, et al. An improved baculovirus insecticide producing occlusion bodies that contain Bacillus thuringiensis insect toxin[J]. Journal of Invertebrate Pathology, 2003, 84(1): 30-37. DOI:10.1016/S0022-2011(03)00121-6 |
| [11] |
王福山, 黄永秀, 齐义鹏, 等. 多角体完整重组病毒的构建及苏芸金杆菌截短δ内毒素基因的表达[J]. 科学通报, 1995, 40(20): 1896-1900. Wang F S, Huang Y X, Qi Y P, et al. The construction of polyhedrin positive recombinant virus and expression of Bt truncated endotoxin gene[J]. Chinese Science Bulletin, 1995, 40(20): 1896-1900 (in Chinese). DOI:10.3321/j.issn:0023-074X.1995.20.020 |
| [12] |
Stewart L M D, Hirst M, Ferber M L, et al. Construction of an improved baculovirus insecticide containing an insect-specific toxin gene[J]. Nature, 1991, 352(6330): 85-88. DOI:10.1038/352085a0 |
| [13] |
Zlotkin E, Fishman Y, Elazar M. AaIT:from neurotoxin to insecticide[J]. Biochimie, 2000, 82: 869-881. DOI:10.1016/S0300-9084(00)01177-9 |
| [14] |
Isogai M, Uyeda I, Lee B C. Detection and assignment of proteins encoded by rice black streaked dwarf fijivirus S7, S8, S9 and S10[J]. Journal of General Virology, 1998, 79(6): 1487-1494. DOI:10.1099/0022-1317-79-6-1487 |
| [15] |
Karabörklü S, Azizoglu U, Azizoglu Z B. Recombinant entomopathogenic agents:a review of biotechnological approaches to pest insect control[J]. World Journal of Microbiology and Biotechnology, 2018, 34: 14. DOI:10.1007/s11274-017-2397-0 |
| [16] |
Wu C, Deng Z, Long Z, et al. Generating a host range-expanded recombinant baculovirus[J]. Scientific Reports, 2016, 6: 28072. DOI:10.1038/srep28072 |
| [17] |
Weitzman M D, Lilley C E, Chaurushiya M S. Genomes in conflict:maintaining genome integrity during virus infection[J]. Annual Review of Microbiology, 2010, 64(1): 61-81. DOI:10.1146/annurev.micro.112408.134016 |
| [18] |
Mitchell J K, Friesen P D. Baculoviruses modulate a proapoptotic DNA damage response to promote virus multiplication[J]. Journal of Virology, 2012, 86(24): 13542-13553. DOI:10.1128/JVI.02246-12 |
| [19] |
Mitchell J K, Byers N M, Friesen P D. Baculovirus F-box protein LEF-7 modifies the host DNA damage response to enhance virus multiplication[J]. Journal of Virology, 2013, 87(23): 12592-12599. DOI:10.1128/JVI.02501-13 |
| [20] |
Wang Q, Tao T, Han Y H, et al. Nonstructural protein P7-2 encoded by Rice black-streaked dwarf virus, interacts with SKP1, a core subunit of SCF ubiquitin ligase[J]. Virology Journal, 2013, 10(1): 325. DOI:10.1186/1743-422X-10-325 |



