文章信息
- 安聪, 张一, 张皖皖, 张婷, 蒋甲福, 陈发棣, 房伟民, 陈素梅
- AN Cong, ZHANG Yi, ZHANG Wanwan, ZHANG Ting, JIANG Jiafu, CHEN Fadi, FANG Weimin, CHEN Sumei
- 菊花CmPAL基因的克隆及表达分析
- Cloning and expression analysis of CmPAL gene in Chrysanthemum morifolium
- 南京农业大学学报, 2019, 42(1): 73-80
- Journal of Nanjing Agricultural University, 2019, 42(1): 73-80.
- http://dx.doi.org/10.7685/jnau.201802032
-
文章历史
- 收稿日期: 2018-02-28
在植物苯丙氨酸代谢途径中, 苯丙氨酸解氨酶(PAL)是苯丙烷代谢途径的第1个限速酶, 是初级代谢与次级代谢之间的重要节点[1]。PAL是易受外部环境影响的胞内诱导酶, 其酶活性和基因的转录受多种环境因素影响, 尤其与苯丙氨酸参与的应激反应有关[2]。干旱、病虫害和机械损伤等环境胁迫以及茉莉酸甲酯(MeJA)、水杨酸(SA)等激素都会诱发其选择性表达[3-4]。研究表明PAL参与了辣椒(Capsicum annuum)[5]、短柄草(Brachypodium distachyon)[6]等多种植物的病原攻击及胁迫响应, 说明其可参与植物免疫应答, 是植物抗逆反应过程中的关键酶。目前, 菊科蒿属植物黄花蒿(Artemisia annua)中的AaPAL1基因已被克隆[7]。而菊花中CmPAL基因的克隆及表达特性研究尚未见报道。
菊花(Chrysanthemum morifolium)是世界四大切花之一, 栽培应用历史悠久, 然而在生产中, 各种生物、非生物胁迫限制了菊花的栽培和推广, 尤其是以蚜虫为主的生物胁迫更是影响菊花产量和质量的主要限制因素之一。本研究对菊花'神马’中的CmPAL进行了克隆和生物信息学分析。采用实时荧光定量PCR(RT-qPCR)技术对该基因在不同组织的表达量进行分析, 并进一步分析该基因在蚜虫接种、干旱(PEG6000模拟)等胁迫处理及MeJA、SA、独脚金内酯类似物GR24激素处理下的表达变化, 为进一步开展菊花CmPAL基因的功能鉴定, 特别是其在应答地上部害虫蚜虫及干旱胁迫导致的地上部伤害中的功能提供初步信息和依据。
1 材料与方法 1.1 供试材料供试菊花品种'神马’取自南京农业大学中国菊花种质资源保存中心。选取生长健壮、长势一致的插穗进行扦插繁殖, 待其生根后移栽定植至含蛭石、珍珠岩和营养土(体积比为1:1:1)的塑料杯中, 在22 ℃, 光照/黑暗为16 h/8 h条件下培养2周, 选取6~8叶龄的幼苗作为供试材料。
1.2 cDNA合成及基因全长克隆植物样品总RNA提取采用Trizol法, 用RNAiso Plus试剂盒(TaKaRa)进行提取。以RNA为模板, 按照PrimeScript RT reagent Kit(TaKaRa)说明书合成cDNA。
依据菊花'神马’转录组库的PAL同源序列设计引物, 采用Phusion高保真DNA聚合酶(ThermoFisher)进行PCR扩增, 克隆基因全长, 引物序列见表 1。PCR产物加尾后连接于pMD19-T载体, 转化大肠杆菌DH5α菌株进行测序。
| 名称 Names | 序列 Sequence | 用途 Usage |
| CmPAL-PCR | TTGTCGAACTCTTCACCCGG/CCCCAACAGGATCAAGGCAT | CmPAL全长扩增 Amplification of full-length of CmPAL |
| CmPAL-qPCR | TACATTTTGGACGGGAGTGA/AGCGTATCGGTCTTGTTTGG | CmPAL荧光定量 PCR RT-qPCR of CmPAL |
| CmEF1α | TTTTGGTATCTGGTCCTGGAG/CCATTCAAGCGACAGACTCA | 内参基因引物 Primer of reference gene |
序列检索及比对采用BLAST在线程序进行。其他物种中的同源氨基酸序列由NCBI网站下载。采用DNAMAN v6.0及Muscle软件进行序列同源性比对分析。系统发育进化树利用MEGA 7.0软件, 用最大似然法进行构建, 并设置bootstrap重复值为500进行检验。
分别采用ProtParam Tool(https://web.expasy.org/protparam/)及ProtScale(https://web.expasy.org/protscale/)在线软件对蛋白理化性质和亲疏水性进行分析, 用NetPhos 3.1(http://www.cbs.dtu.dk/services/NetPhos/)在线软件进行潜在磷酸化位点分析, Predict Protein(https://open.predictprotein.org/)在线软件进行蛋白二级结构预测, 利用SWISS-MODEL(https://swissmodel.expasy.org/)在线软件及PyMol软件进行蛋白三级结构建模成像。
1.4 植物材料处理以长势一致的'神马’植株为材料, 取其根、茎、叶、管状花及舌状花, 液氮速冻后保存于-80 ℃, 用于CmPAL基因组织定量检测。每个样品重复3次。
蚜虫处理:将20头菊姬长管蚜(Macrosiphoniella sanborni)的2龄若虫接种于植株自顶部向下的第3片完全展开叶上。为防止蚜虫逃逸, 接种蚜虫的叶片使用透光、透气微虫笼遮罩。取样前将接种的蚜虫从叶片表面扫除[8]。
PEG6000模拟干旱处理:将植株根部洗净后, 浸入200 g·L-1 PEG6000水溶液中进行培养, 以去离子水作为对照。
激素处理:分别将MeJA、SA溶于乙醇, GR24溶于丙酮, 配制母液。使用前用去离子水将处理液稀释至10 μmol·L-1, 并加入终质量浓度为1 g·L-1的Triton X-100。MeJA和SA处理以含0.1%(体积分数)乙醇和1 g·L-1Triton X-100的去离子水为对照, GR24处理以含0.1%(体积分数)丙酮和1 g·L-1Triton X-100的去离子水作对照。分别将处理液均匀喷施至'神马’植株。
参考Xia等[8]的方法, 采集植株自顶部向下第3片完全展开叶用于基因表达定量检测。基于本实验室前期对菊姬长管蚜的取食行为的刺吸电位监测研究[9], 参考Li等[10]的方法, 在蚜虫接种后0、1、3、6、12、24 h进行取样。采集的叶片样品用液氮速冻后于-80 ℃保存。每个时间点包括3株单株重复, 取样重复3次。
1.5 基因定量表达分析根据克隆得到的CmPAL基因cDNA序列, 利用Primer Premier 5.0设计荧光定量PCR特异性引物CmPAL-qPCR, 内参基因为CmEF1α, 引物序列见表 1。使用Mastercycler ep realplex(Eppendorf)实时荧光定量系统, SYBR Premix Ex TaqⅡ(TaKaRa)荧光染料, 依说明书采取标准三步法进行荧光定量PCR。相对表达量计算采用2-ΔΔCT法[11]。
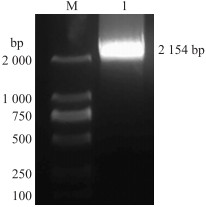
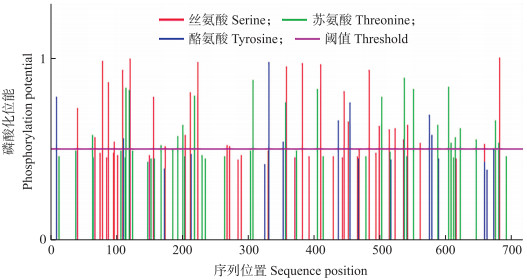
2 结果与分析 2.1 菊花'神马’PAL基因克隆及蛋白结构分析依据菊花'神马’转录组信息, 克隆得到CmPAL基因(图 1), 其最大开放阅读框(ORF)为2 154 bp。CmPAL基因编码氨基酸717个, 其中酸性氨基酸80个, 碱性氨基酸67个, 理论等电点(pI)为5.75。预测其蛋白相对分子质量为77.73×103, 分子式C3432H5475N945O1054S28。CmPAL蛋白不稳定指数为28.16, 归类为稳定蛋白。平均亲水性系数为-0.135, 为疏水性蛋白(图 2)。蛋白共有潜在磷酸化位点58处, 其中Ser磷酸化位点29处, Thr磷酸化位点21处, Thy磷酸化位点8处(图 3)。
|
图 1 CmPAL基因PCR扩增产物 Fig. 1 The PCR product of CmPAL gene M. DL2000 marker; 1. CmPAL. |

|
图 2 CmPAL蛋白的亲、疏水性 Fig. 2 The hydrophilicity and hydrophobicityof CmPAL protein |
|
图 3 CmPAL蛋白的潜在磷酸化位点 Fig. 3 The predicted phosphorylation sites of CmPAL protein |
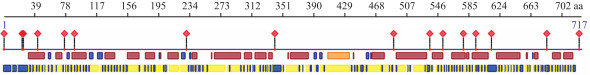
蛋白二级结构预测表明, 在CmPAL中, α-螺旋占49.65%, β-折叠占3.35%, 无规则卷曲占47.00%。同时预测到CmPAL具有16个蛋白结合位点, 不存在跨膜现象(图 4)。
|
图 4 CmPAL蛋白的结合位点及二级结构预测 Fig. 4 The predicted binding sites and secondary structure of CmPAL protein |
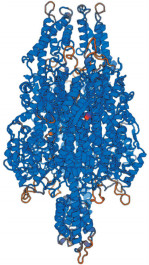
利用SWISS-MODEL对CmPAL蛋白进行三级结构预测, 软件数据库使用欧芹(Petroselinum crispum)PcPAL蛋白结构作为模板, 预测结构如图 5所示, 两者蛋白结构相似性达到86.50%。亚细胞定位预测CmPAL蛋白定位于细胞质中。
|
图 5 CmPAL蛋白的三级结构预测 Fig. 5 The prediction of tertiary structureof CmPAL protein |
利用NCBI数据库对CmPAL氨基酸同源序列进行了检索和比对, 发现CmPAL与黄花蒿、泡黄金菊、向日葵、拟南芥、大豆及水稻的氨基酸序列同源性分别为97.94%、91.88%、91.20%、80.74%、80.33%和69.88%(图 6)。序列比对结果表明, PAL氨基酸中间区域保守性较高, 两端的氨基酸序列差异较大。

|
图 6 CmPAL氨基酸序列与其他物种PAL的氨基酸比对 Fig. 6 Alignment of the predicted amino acid sequences of CmPAL compared with those from other plants At:拟南芥Arabidopsis thaliana; Aa:黄花蒿Artemisia annua; Cb:泡黄金菊Chrysanthemum boreale; Gm:大豆Glycine max; Ha:向日葵Helianthus annuus; Os:水稻Oryza sativa.下同。The same as follows. |
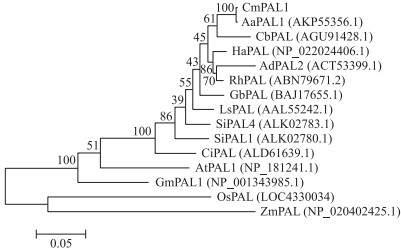
通过氨基酸序列比对, 构建了13个物种的PAL氨基酸序列系统发育进化树(图 7), 发现菊科植物PAL聚类较近, 特别是与黄花蒿、泡黄金菊等的PAL亲缘关系最近, 而与玉米、水稻等单子叶植物的PAL相距较远。
|
图 7 不同物种PAL氨基酸序列的系统进化分析 Fig. 7 Phylogenetic analysis of amino acid sequences ofPAL from different species Ad:紫茎泽兰Ageratina adenophora; Rh:黑心菊Rudbeckia hirta; Gb:红凤菜Gynura bicolor; Ls:莴苣Lactuca sativa; Si:雪莲花Saussurea involucrata; Ci:菊苣Cichorium intybus; Zm:玉米Zea mays. |
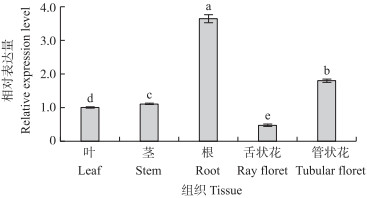
由图 8可见:CmPAL在根中相对表达量最高, 为叶片的3.66倍; 管状花中CmPAL表达量次之, 为叶片的1.81倍; 茎中表达量为叶片表达量的1.11倍; 舌状花中表达量最低, 仅为叶中表达量的47%。
|
图 8 CmPAL在菊花'神马’不同组织中的表达量 Fig. 8 The expression level of CmPAL in differenttissues of chrysanthemum'Jinba' 不同小写字母表示差异显著(P<0.05)。下同。 Different small letters indicate significant difference at 0.05 level. The same as follows. |
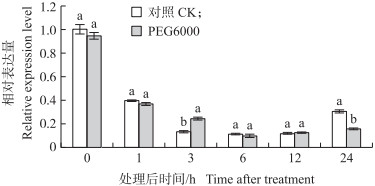
由图 9可见:蚜虫处理可以诱导CmPAL的表达。接种蚜虫后, CmPAL产生迅速而明显的响应, 1 h时CmPAL表达量比对照提高了73.37%, 至3 h时达到最高值, 此时是对照的1.82倍, 之后表达量迅速下降, 至6 h时与对照已无明显差异。在接种蚜虫12 h后CmPAL表达量则低于对照。由图 10可见:PEG6000模拟干旱处理总体上对CmPAL表达的影响不大, 处理6和12 h时, 处理组与对照相比表达量无明显差异; 3 h时, 处理组CmPAL表达量比对照高82.17%;而24 h时表达量明显低于对照。

|
图 9 接种蚜虫后CmPAL的表达量变化 Fig. 9 The change of relative expression level ofCmPAL after aphid inoculation |
|
图 10 PEG6000模拟干旱处理后CmPAL的表达量变化 Fig. 10 The change of relative expression level of CmPALafter the treatment of PEG6000 simulated drought |
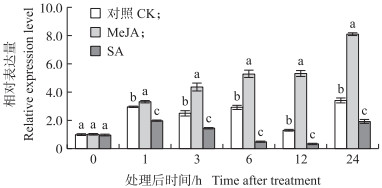
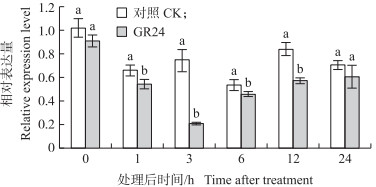
由图 11可见:MeJA处理可以持续诱导CmPAL的表达, 3 h时, CmPAL表达量比对照提高了74.54%, 至24 h时比对照提高了136.67%。而SA处理后, CmPAL表达量与对照相比明显下降, 1 h时比对照降低了33.56%, 至6 h时相比对照下降了82.47%, 24 h时仍稳定在较低水平。由图 12可见:CmPAL的表达在处理后1~12 h受独脚金内酯人工合成类似物GR24抑制。3 h时, CmPAL的表达量出现显著下降, 较对照降低了72.57%, 24 h时, 处理组的表达量与对照相比无明显差异。
|
图 11 茉莉酸甲酯(MeJA)和水杨酸(SA)处理后CmPAL的表达量变化 Fig. 11 The change of relative expression level of CmPALafter the treatment of methyl jasmonate(MeJA)and salicylic acid(SA) |
|
图 12 独脚金内酯类似物GR24处理后CmPAL的表达量变化 Fig. 12 The change of relative expression levelof CmPAL after the treatment of thestrigolactone analogue GR24 |
本研究对菊花'神马’CmPAL基因的克隆及分析表明, 该基因ORF为2 154 bp, 编码717个氨基酸, 蛋白相对分子质量为77.73×103。氨基酸序列比对和进化树分析显示, CmPAL与蒿属植物黄花蒿和同属植物泡黄金菊的PAL同源性最高, 其中黄花蒿AaPAL1编码716个氨基酸, 泡黄金菊CbPAL编码709个氨基酸, 与紫茎泽兰、黑心菊、红凤菜等菊科植物的PAL同源性也明显高于其他植物, 表明菊科植物PAL高度保守。此外, CmPAL与多数植物如拟南芥、大豆、水稻等的PAL同源性也较高, 表明不同物种中PAL也具有保守性。亚细胞定位预测CmPAL定位在细胞质中, 这与柑橘等其他物种的PAL亚细胞定位结果类似[12]。
在植物体内, PAL作为初生代谢向次生代谢转化的开关, 催化L-苯丙氨酸脱氨基转化为反式肉桂酸, 开启苯丙烷代谢途径的第1步[1]。不同中间产物在后续多种酶的催化下, 最终转化为木质素、黄酮和花青素等。研究表明, 与木质素合成相关的PAL表达是维管发育过程中部分木质化的早期标记[13]。在柳属植物青刚柳(Salix viminalis)木质化的根中, PAL家族的3个基因SvPAL1、SvPAL2和SvPAL3表达量较高[14]; 在拟南芥成年植株的根和叶的维管组织中, 均检测到了较高的PAL表达量, 并且PAL1-GUS融合基因在拟南芥的花萼、花药和心皮中均有表达, 但在不含色素的白色花瓣中则不表达[13]。推测PAL的高表达可能与花色素的合成相关。研究发现, 烟草内源PAL表达量的降低导致色素含量减少, 使得花粉活力降低, 数量减少[15]。在其他植物中, 如欧芹的花粉壁, 包括绒毡层和花药内壁等多个部位也发现PAL基因的高表达[16]。本试验中, CmPAL在不同组织中的表达量分析显示, CmPAL在根中表达量最高, 其次是管状花、茎、叶片, 茎和叶中表达量相近。具有花药的两性管状花中CmPAL表达量显著高于单性舌状花中的CmPAL表达量, 但CmPAL是否与花粉壁的木质化和纤维化相关, 尚待进一步验证。
植物遭到植食性昆虫取食时, 植物通过自身结构和体内次生代谢物质改变以阻碍害虫入侵及影响害虫生长繁殖, 从而增强对害虫的防御[17]。其中, 木质素的积累使细胞壁加厚, 对昆虫的取食构成机械障碍[18]。在化学防御方面, 苯丙氨酸途径的一些酚类代谢产物, 对害虫也具有一定毒害和防御作用。如松皮素和槲皮素等黄酮类化合物可以有效抑制草地贪夜蛾(Spodoptera frugiperda)对植物的取食[19]。本研究中, CmPAL表达迅速响应蚜虫取食, 表达量约为对照植株的2倍, 表明CmPAL参与菊花对蚜虫的胁迫响应, 可能在菊花防御蚜虫取食中起作用。
研究发现, 过表达拟南芥中的类黄酮合成相关转录因子可以增强植株的抗氧化性, 原花青素的积累可以提高拟南芥的抗旱性, 减轻黄瓜幼苗在强光和PEG胁迫下的损伤[20-21]。在本研究中, PEG6000模拟干旱处理3 h后, CmPAL表达量较对照组高, 推测CmPAL可能在干旱胁迫特定过程起作用。但在处理后24 h, 处理组的CmPAL基因表达量为何下降尚不清楚。
茉莉酸甲酯(MeJA)是广泛存在于植物体内的一种生长调节剂, 调控植物的生长、发育、成熟及衰老, 并参与植物的多种胁迫响应[22]。外源MeJA可提高植物防御酶活性和酚类物质含量, 并增加植物组织木质素含量[23]。MeJA还对线虫具有直接杀灭作用[24]。水杨酸也是参与植物系统性抗病反应的重要信号分子, 与茉莉酸甲酯在防卫反应中存在相互拮抗作用[25]。拟南芥通过增强水杨酸信号路径, 从而与茉莉酸信号路径拮抗, 抑制植物对甘蓝蚜的抗性[26-27]。在本研究中, 喷施MeJA和SA后, 植株CmPAL基因迅速响应, 24 h后仍与对照植株有明显差异, 且2种激素分别诱导或抑制CmPAL的表达。但CmPAL是否作为节点基因参与了MeJA与SA拮抗作用的交互, 有待进一步研究。近年来, 独角金内酯在植物抗逆中的作用逐步得到认识[28-30], 而有关独角金内酯调控CmPAL的研究未见报道。本研究发现, 独角金内酯类似物GR24抑制CmPAL的表达, 推测该激素可能调控植物苯丙氨酸代谢路径及其参与的防御反应。
| [1] |
Vogt T. Phenylpropanoid biosynthesis[J]. Molecular Plant, 2010, 3(1): 2-20. DOI:10.1093/mp/ssp106 |
| [2] |
Irisarri P, Zhebentyayeva T, Errea P, et al. Differential expression of phenylalanine ammonia lyase(PAL) genes implies distinct roles in development of graft incompatibility symptoms in Prunus[J]. Scientia Horticulturae, 2016, 204: 16-24. DOI:10.1016/j.scienta.2016.03.025 |
| [3] |
Dixon R A, Paiva N L. Stress-induced phenylpropanoid metabolism[J]. The Plant Cell, 1995, 7(7): 1085-1097. DOI:10.1105/tpc.7.7.1085 |
| [4] |
Shang Q M, Li L, Dong C J. Multiple tandem duplication of the phenylalanine ammonia-lyase genes in Cucumis sativus L.[J]. Planta, 2012, 236(4): 1093-1105. DOI:10.1007/s00425-012-1659-1 |
| [5] |
Kim D S, Hwang B K. An important role of the pepper phenylalanine ammonia-lyase gene(PAL1) in salicylic acid-dependent signalling of the defence response to microbial pathogens[J]. Journal of Experimental Botany, 2014, 65(9): 2295-2306. DOI:10.1093/jxb/eru109 |
| [6] |
Cass C L, Peraldi A, Dowd P F, et al. Effects of PHENYLALANINE AMMONIA LYASE(PAL) knockdown on cell wall composition, biomass digestibility, and biotic and abiotic stress responses in Brachypodium[J]. Journal of Experimental Botany, 2015, 66(14): 4317-4335. DOI:10.1093/jxb/erv269 |
| [7] |
Zhang Y, Fu X, Hao X, et al. Molecular cloning and promoter analysis of the specific salicylic acid biosynthetic pathway gene phenylalanine ammonia-lyase(AaPAL1) from Artemisia annua[J]. Biotechnology and Applied Biochemistry, 2016, 63(4): 514-524. DOI:10.1002/bab.2016.63.issue-4 |
| [8] |
Xia X, Shao Y, Jiang J, et al. Gene expression profiles responses to aphid feeding in chrysanthemum(Chrysanthemum morifolium)[J]. BMC Genomics, 2014, 15(1): 1050-1066. DOI:10.1186/1471-2164-15-1050 |
| [9] |
王银杰.独脚金内酯调控菊花抗蚜性机制研究[D].南京: 南京农业大学, 2017. Wang Y J. The roles of strigolactone in resistance of chrysanthemum to aphid[D]. Nanjing: Nanjing Agricultural University, 2017(in Chinese with English abstract). |
| [10] |
Li P, Song A, Gao C, et al. The over-expression of a chrysanthemum WRKY transcription factor enhances aphid resistance[J]. Plant Physiology and Biochemistry, 2015, 95: 26-34. DOI:10.1016/j.plaphy.2015.07.002 |
| [11] |
Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [12] |
Yang H Y, Dong T, Li J F, et al. Molecular cloning, expression, and subcellular localization of a PAL gene from Citrus reticulata under iron deficiency[J]. Biologia Plantarum, 2016, 60(3): 482-488. DOI:10.1007/s10535-016-0625-3 |
| [13] |
Ohl S, Hedrick S A, Chory J, et al. Functional properties of a phenylalanine ammonia-lyase promoter from Arabidopsis[J]. The Plant Cell, 1990, 2(9): 837-848. DOI:10.1105/tpc.2.9.837 |
| [14] |
de Jong F, Hanley S J, Beale M H, et al. Characterisation of the willow phenylalanine ammonia-lyase(PAL) gene family reveals expression differences compared with poplar[J]. Phytochemistry, 2015, 117: 90-97. DOI:10.1016/j.phytochem.2015.06.005 |
| [15] |
Elkind Y, Edwards R, Mavandad M, et al. Abnormal plant development and down-regulation of phenylpropanoid biosynthesis in transgenic tobacco containing a heterologous phenylalanine ammonia-lyase gene[J]. Proc Natl Acad Sci USA, 1990, 87(22): 9057-9061. DOI:10.1073/pnas.87.22.9057 |
| [16] |
Li W, Tian Z, Yu D. WRKY13 acts in stem development in Arabidopsis thaliana[J]. Plant Science, 2015, 236: 205-213. DOI:10.1016/j.plantsci.2015.04.004 |
| [17] |
Dar S A, Wani A R, Rather B A, et al. Resistance against insect pests by plant phenolics and their derivative compounds[J]. Chem Sci Rev Lett, 2017, 6(22): 1073-1081. |
| [18] |
Villada E S, González E G, López-Sesé A I, et al. Hypersensitive response to Aphis gossypii Glover in melon genotypes carrying the Vat gene[J]. Journal of Experimental Botany, 2009, 60(11): 3269-3277. DOI:10.1093/jxb/erp163 |
| [19] |
Napal G N D, Palacios S M. Bioinsecticidal effect of the flavonoids pinocembrin and quercetin against Spodoptera frugiperda[J]. Journal of Pest Science, 2015, 88(3): 629-635. DOI:10.1007/s10340-014-0641-z |
| [20] |
Nakabayashi R, Yonekura-Sakakibara K, Urano K, et al. Enhancement of oxidative and drought tolerance in Arabidopsis by overaccumulation of antioxidant flavonoids[J]. The Plant Journal, 2014, 77(3): 367-379. DOI:10.1111/tpj.2014.77.issue-3 |
| [21] |
Zhu L J, Deng X G, Zou L J, et al. Enhancement of stress tolerance in cucumber seedlings by proanthocyanidins[J]. Biologia Plantarum, 2017, 61(2): 323-332. DOI:10.1007/s10535-016-0663-x |
| [22] |
Ahmad P, Rasool S, Gul A, et al. Jasmonates:multifunctional roles in stress tolerance[J]. Frontiers in Plant Science, 2016, 7: 813. |
| [23] |
Glowacz M, Roets N, Sivakumar D. Control of anthracnose disease via increased activity of defence related enzymes in 'Hass' avocado fruit treated with methyl jasmonate and methyl salicylate[J]. Food Chemistry, 2017, 234: 163-167. DOI:10.1016/j.foodchem.2017.04.063 |
| [24] |
Schouteden N, Lemmens E, Stuer N, et al. Direct nematicidal effects of methyl jasmonate and acibenzolar-S-methyl against Meloidogyne incognita[J]. Natural Product Research, 2017, 31(10): 1219-1222. DOI:10.1080/14786419.2016.1230111 |
| [25] |
Caarls L, Pieterse C M J, van Wees S. How salicylic acid takes transcriptional control over jasmonic acid signaling[J]. Frontiers in Plant Science, 2015, 6: 170. |
| [26] |
Kusniercayk A, Winge P E R, Jrstad T S, et al. Towards global understanding of plant defence against aphids-timing and dynamics of early Arabidopsis defence responses to cabbage aphid(Brevicoryne brassicae) attack[J]. Plant, Cell and Environment, 2008, 31(8): 1097-1115. DOI:10.1111/pce.2008.31.issue-8 |
| [27] |
Thaler J S, Humphrey P T, Whiteman N K. Evolution of jasmonate and salicylate signal crosstalk[J]. Trends in Plant Science, 2012, 17(5): 260-270. DOI:10.1016/j.tplants.2012.02.010 |
| [28] |
Bu Q, Lü T, Shen H, et al. Regulation of drought tolerance by the F-box protein MAX2 in Arabidopsis[J]. Plant Physiology, 2014, 164(1): 424-439. DOI:10.1104/pp.113.226837 |
| [29] |
Piisilä M, Keceli M A, Brader G, et al. The F-box protein MAX2 contributes to resistance to bacterial phytopathogens in Arabidopsis thaliana[J]. BMC Plant Biology, 2015, 15(1): 53-70. |
| [30] |
Cooper J W, Hu Y, Beyyoudh L, et al. Strigolactones positively regulate chilling tolerance in pea and in Arabidopsis[J]. Plant, Cell and Environment, 2018, 41(6): 1298-1310. DOI:10.1111/pce.v41.6 |




