文章信息
- 王海彦, 成城, 安立昆, 秦佳, 严远鑫
- WANG Haiyan, CHENG Cheng, AN Likun, QIN Jia, YAN Yuanxin
- 玉米内源茉莉酸调节干旱胁迫下的光合作用和抗旱生理反应
- Endogenous JA regulates leaf photosynthesis and drought-tolerance response under drought condition in maize
- 南京农业大学学报, 2019, 42(1): 30-38
- Journal of Nanjing Agricultural University, 2019, 42(1): 30-38.
- http://dx.doi.org/10.7685/jnau.201803015
-
文章历史
- 收稿日期: 2018-03-08
光合特性变化是反映植物耐旱能力的主要指标之一[1-2]。过氧化物酶(POD)、过氧化氢酶(CAT)、总超氧化物酶(T-SOD)的增加能减少植株体内活性氧含量, 进而降低活性氧对细胞膜系统的损害[3-4]; 丙二醛(MDA)含量是衡量植物脂质过氧化程度的重要指标[5]。
植物激素如脱落酸(ABA)、茉莉酸(JA)等, 是植物响应干旱胁迫的重要激素[6-8]。干旱胁迫能够诱导植物体内ABA水平的提高, ABA积累或外施ABA能促进气孔关闭, 增强渗透调节物质的合成, 提高抗氧化酶活性[9-11]。JA广泛存在于高等植物体内, 能够显著增强植株抗虫、抗病能力[12-13]。但JA对干旱胁迫的调控作用尚未明确。董桃杏等[14]研究发现, 外施茉莉酸甲酯(MeJA)在一定程度上能减缓干旱胁迫对水稻幼苗造成的伤害。但Dhakarey等[15]利用水稻茉莉酸合成缺少突变体cpm2研究发现, 干旱胁迫下突变体水分利用率更高, 新陈代谢更强, 次生代谢物显著增多, 表明内源茉莉酸在干旱胁迫下是负调控因子。
12-氧-植物二烯酸(12-oxophytodienoic acid, OPDA)是茉莉酸合成通路中的重要中间产物, 丙二烯氧化合酶(allene oxide synthase, AOS)和丙二烯环化酶(allene oxide cyclase, AOC)能将13-氢过氧化亚麻酸(13-hydroperoxylinoleic acid, 13-HPOT)催化为OPDA[16-17], OPDA还原酶(12-oxophytodienoic acid reductase, OPR)是OPDA的主要代谢酶, 能将OPDA还原为OPC-8:0[18]。干旱不能引起拟南芥茉莉酸合成缺少突变体aos植株OPDA含量增加, 而拟南芥茉莉酸合成缺少突变体opr3在干旱条件下植株内源OPDA含量显著增加, 气孔开度更小, 存活率更高, 而且外施OPDA能促进气孔关闭, 进而增强拟南芥抗旱性, 干旱胁迫下OPDA作为气孔关闭的调节因子与ABA功能趋同[19]。
ZmOPR7和ZmOPR8是AtOPR3的同源基因, 是编码OPDA还原酶的主要基因[20]。ZmOPR7和ZmOPR8同时被敲除的opr7opr8(opr)突变体植株的JA含量显著降低。植株表现多种JA缺失性状[21]。本研究以B73和opr为材料, 研究干旱胁迫及复水过程中, B73和opr叶片相对含水量, 光合作用参数, 渗透调节物质游离脯氨酸及可溶性蛋白含量, 活性氧清除物质POD、T-SOD、CAT活性以及MDA含量的变化差异, 以此了解内源JA在玉米抗旱性中的作用; 并通过RT-qPCR方法检测干旱过程中B73与opr的ABA合成通路关键基因ZmZEP1、ZmNCED1、ZmAO1的表达差异, 以了解玉米叶片中内源JA对ABA合成的影响。
1 材料与方法 1.1 试验材料以玉米(Zea mays L.)自交系B73和茉莉酸合成缺少突变体opr为试验材料。opr是B73的近等基因系, 是玉米茉莉酸合成途径中的关键酶基因OPR7和OPR8的双突变体。原始的opr已与B73回交至BC4, 在BC4的F2世代, 性状分离得到本研究所用的试验材料opr[21]。
1.2 试验设计与取样时间土壤干旱处理:供试土壤为人工混合营养土(蛭石、有机基质、泥土体积比为1:1:1), 混匀后装入植物生长桶(高30 cm, 直径20.5 cm)中, 玉米幼苗于穴盘中生长至3叶1心期(V3时期), 选取长势一致的植株移栽至生长桶, 每桶3株, 置于玻璃温室中定期浇水。玻璃温室温度26~32 ℃, 相对湿度70%~85%, 自然光照时间12~14 h。正常生长至7叶1心期(V7时期)的玉米植株浇水至土壤饱和含水量。对照组B73和opr每天正常浇水, 干旱胁迫的B73和opr在13 d内不再浇水, 并于处理13 d复水。每个处理3个重复, 分别在处理后1、4、7、10、13、16、19 d采集叶片样品。快速干旱处理:玉米幼苗于穴盘中生长至V3时期, 用手术刀将地上部分快速切下, 离体植株插入空试管中作为快速干旱处理, 插入装有无菌水的试管中作为对照。干旱处理和对照均置于植物生长箱(温度28 ℃, 相对湿度60%, 光照强度10 000 lx), 每个处理3个重复, 分别在处理后的0、1、3、6、9、12 h取样, 迅速用锡箔纸包好放入液氮固定, 保存于-80 ℃待用。
1.3 测定项目与方法 1.3.1 植物叶片气孔密度观察B73与opr各选3株7叶1心期幼苗, 每株幼苗取第7片叶中段, 用指甲油固定气孔分布, 利用OLYMPUS(AHBS)显微摄影仪, 每片叶选取10个视野, 分别在80倍及240倍显微镜下拍照。
1.3.2 植物含水率和土壤含水量的测定各处理选取3株7叶1心期幼苗第5片叶分别测定鲜质量, 105 ℃杀青, 60 ℃烘干至恒质量。叶片含水率=(单株鲜质量-单株干质量)/单株鲜质量×100%。使用取土器获得土壤, 每桶3个重复。称量土壤鲜质量, 60 ℃烘干至恒质量, 称量干质量。土壤含水量=(鲜质量-干质量)/鲜质量×100%。
1.3.3 光合作用参数测定用LI-6400便携式光合作用测定仪, 在晴天自然光照下, 上午09:30进行光合作用参数的测定, 测定内容包括叶片净光合速率(Pn)、气孔导度(Gs)、蒸腾速率(Tr)和胞间CO2浓度(Ci)。每个处理3个重复, 每个重复测2株玉米叶片。
1.3.4 生理生化指标测定采用南京建成生物公司测试盒测定总超氧化物歧化酶(T-SOD)、过氧化物酶(POD)、过氧化氢酶(CAT)活性以及脯氨酸和丙二醛(MDA)含量。可溶性总蛋白含量测定采用考马斯亮蓝染色法[22]。
1.3.5 RNA的提取及cDNA合成RNA提取按TransZol Up试剂说明书进行。反转录参照北京全式金公司EasyScript First-Strand cDNA Synthesis SuperMix说明书进行。
1.3.6 实时荧光定量PCR(Real-time quantitative PCR)分析根据Maize GDB上提供的基因序列, 设计RT-qPCR引物(表 1), 对基因ZmZEP1、ZmNCED1、ZmAO1进行实时荧光定量PCR扩增。每个反应设3次重复。根据2-ΔΔCT计算基因的相对表达量。试验设3个生物学重复。反应体系:上、下游引物各1.0 μL(10 pmol·μL-1), cDNA 2.0 μL(相当于50 ng总RNA), THUNDERBIRD SYBR qPCR Mix 10 μL, ddH2O 6.0 μL, 共20 μL。内参基因为Actin-2。
| 基因名称 Gene name |
引物序列(5'→3') Primer sequence |
退火温度/℃ Annealing temperature |
| ZmZEP1-F | AATGAAGAGGCTGGTGGCACT | 58 |
| ZmZEP1-R | CATAGCATGGACAGAATCACCAAG | 58 |
| ZmNCED1-F | ACAGCTTTGAGTTCGAGCTCCC | 59 |
| ZmNCED1-R | TGTTGTTGGTGTGGTGGTCTGT | 58 |
| ZmAO1-F | AACACAGCGAAAGCATAGATCCA | 58 |
| ZmAO1-R | TAGTGCGTGGGAGATGTGCA | 58 |
| Actin-2-F | CTGAGGAACTATTCCAGCCTACC | 62 |
| Actin-2-R | CCACCACTGAGGACAACTTACC | 61 |
数据采用Excel 2016进行分析。
2 结果与分析 2.1 叶片气孔数目差异通过显微镜观察, 放大80倍的视野内B73和opr叶片气孔数目分别为71和52个(图 1-A, B), 放大240倍的视野内B73和opr叶片气孔数目分别为20和14个(图 1-C, D)。在放大80倍的30个视野中, B73和opr的平均气孔数分别为64和53个, 在0.05水平上差异显著。说明内源JA调节玉米气孔发育, JA缺少导致气孔密度大幅下降。

|
图 1 ZmOPR7和ZmOPR8基因突变对气孔密度的影响 Fig. 1 Effect of ZmOPR7 and ZmOPR8 gene mutations on stomatal density A, B.显微观察放大80倍Microscopic observation magnified 80 times; C, D.显微观察放大240倍Microscopic observation magnified 240 times. |
从图 2-A可见:对照组opr和B73的土壤相对含水量基本相同。干旱组opr和B73的土壤相对含水量随干旱时间的延长呈降低趋势, 但无显著差异。处理13 d土壤相对含水量达到最低, B73和opr均为6.30%, 复水后恢复到与对照组一致。

|
图 2 在玉米干旱及复水过程中土壤相对含水量(A)和叶片相对含水量(B)的变化
Fig. 2 Variation of water content in the soil(A)and leaves(B)under drought stress and re-watered
1)箭头表示处理13 d复水。The arrow indicates rehydration on 13 day after treatment.
2)不同小写字母表示在0.05水平上差异显著。Different letters are significantly different at 0.05 probability level. The same as below. |
干旱胁迫导致叶片相对含水量降低(图 2-B), B73和opr叶片相对含水量在处理4 d后出现下降趋势。干旱处理4~13 d, opr的叶片相对含水量持续高于B73, 处理10 d相对含水量差异最大, opr的叶片相对含水量比B73高17.85%。随复水时间延长, B73和opr的叶片含水量逐渐恢复到正常水平。以上结果说明:玉米茉莉酸缺少突变体opr在干旱过程中蒸腾作用损失的水分少, 能维持体内较高的含水量, 更有利于忍耐干旱胁迫。
2.3 干旱及复水对光合作用参数的影响从图 3-A可见:对照组opr叶片的Gs比B73略低, 但差异不显著。干旱组中, opr的Gs持续低于B73。处理4 d, B73和opr的Gs差异最大, opr的Gs降低55.64%, B73降低26.31%。随着干旱程度的加强, 两者Gs差异逐渐减小。处理13 d, opr和B73的Gs值均接近0。复水后, 处理16 d, B73的Gs值已恢复至正常水平; 但opr的Gs值显著低于B73, 处理19 d, opr的Gs恢复至正常水平。
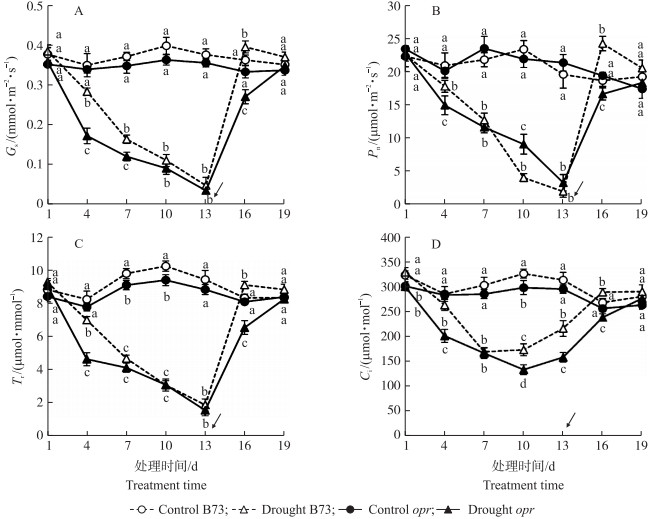
|
图 3 干旱及复水过程中玉米叶片气孔导度(Gs)(A)、净光合速率(Pn)(B)、蒸腾速率(Tr)(C)和胞间二氧化碳浓度(Ci)(D)的变化 Fig. 3 The change of stomatal conductance(Gs)(A), net photosynthetic(Pn)(B), transpiration rate(Tr)(C) and intercellular CO2 concentration(Ci)(D)of maize during drought and rehydration |
从图 3-B可见:对照组opr和B73叶片Pn无显著差异。干旱胁迫显著抑制opr和B73的Pn, 处理4 d, B73的Pn下降21.07%, opr的Pn下降34.37%。随着干旱程度的持续增加, opr的Pn下降速度逐渐变缓, 而B73下降速度加快。处理10 d, opr的Pn为9.07 μmol·m-2·s-1, B73的Pn为4.04 μmol·m-2·s-1。处理13 d, B73与opr的Pn差异不明显。处理16 d, B73的Pn显著高于opr, 随着复水时间延长, B73和opr的Pn都能够恢复正常。
图 3-C显示:对照组中, opr叶片的Tr低于B73, 这是因为opr叶片气孔数目比B73少。干旱胁迫使B73和opr的Tr下降, opr的Tr先于B73下降, 随着干旱程度的增加, B73和opr的Tr差异逐渐缩小。处理13 d, B73和opr的Tr接近。复水后, 处理16 d, B73的Tr高于opr, 处理19 d, 两者Tr均恢复至对照水平。
图 3-D中, 对照组opr叶片Ci略低于B73, 处理10 d时, 差异显著, 原因与气孔数目对Tr的影响一致。B73与opr的Ci随干旱时间延长呈先下降后上升趋势。B73和opr的Ci分别于处理后的7 d和10 d达到最低点, 随后开始增加。复水后两者水平相近。
2.4 干旱及复水对渗透调节物质的影响图 4-A中, 对照组opr和B73叶片游离脯氨酸含量无显著差异。干旱组中, opr和B73叶片游离脯氨酸含量随干旱程度的增加而增加, 且B73从处理7 d后持续高于opr。干旱处理10 d和13 d, B73叶片中游离脯氨酸含量比处理1 d的增长了5.47倍和7.14倍, opr增加了2.09倍和6.01倍。复水后两者均呈下降趋势, B73的游离脯氨酸含量仍然高于opr。
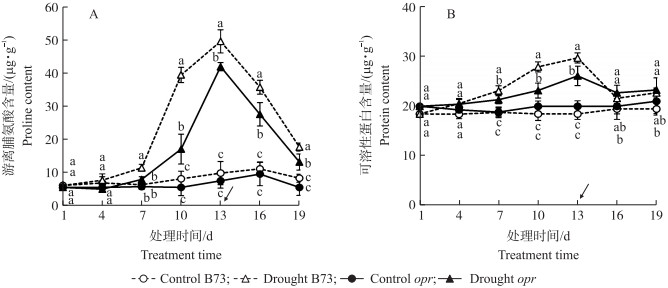
|
图 4 旱和复水过程中玉米叶片游离脯氨酸(A)及可溶性蛋白含量(B)的变化 Fig. 4 The change of proline content(A)and protein content(B)of maize during drought and rehydration |
图 4-B中, 对照组中opr和B73叶片可溶性蛋白含量无显著差异。干旱条件下, B73和opr叶片可溶性蛋白含量随着干旱程度的增加均呈上升趋势, 但opr的增加晚于B73, 处理13 d, B73与opr叶片可溶性蛋白含量均达到最大水平。复水后两者无显著差异。
2.5 干旱及复水对抗氧化保护酶活性和丙二醛(MDA)含量的影响由图 5-A和图 5-B可见:对照组opr和B73的T-SOD和POD活性无显著性差异, 并且T-SOD和POD活性表现出相似的变化规律。随着干旱时间的延长这2种酶活性均呈先增高后降低趋势, 复水后逐渐恢复正常水平。但opr中T-SOD和POD活性最大值出现时间比B73均推迟3 d。
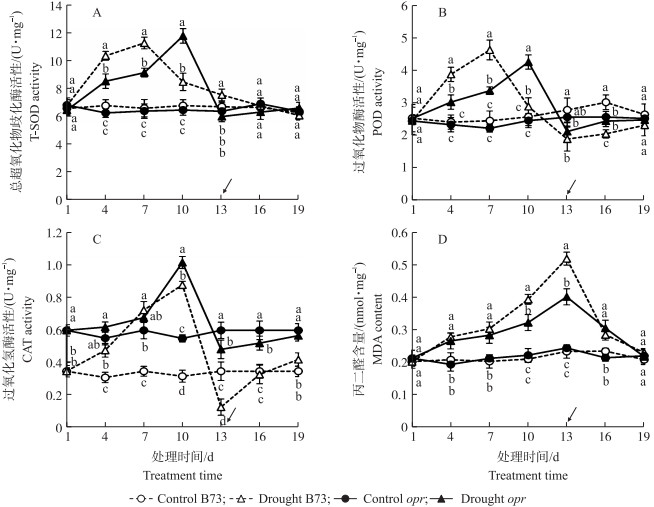
|
图 5 干旱及复水过程中玉米叶片中总超氧化物歧化酶(A)、过氧化物酶(B)、过氧化氢酶(C)活性和丙二醛(D)含量变化 Fig. 5 The change of T-SOD(A), POD(B), CAT(C)activities and MDA content(D) in maize during drought and rehydration |
图 5-C中, CAT活性变化趋势与SOD和POD活性相似, 但B73与opr叶片中CAT初始活性有所不同。对照组opr叶片中CAT活性在所有时间点均高于B73, 说明玉米内源JA可能是CAT基因表达的负调控因子, 在没有干旱胁迫的情况下, opr体内的CAT活性已显著高于野生型B73。干旱胁迫后B73和opr中CAT活性明显增加, 在处理10 d达到最高, 而后B73和opr的CAT活性出现骤降, 并于复水后逐渐上升到正常水平。
图 5-D显示, 对照组opr和B73叶片中MDA含量无显著差异。干旱后opr和B73叶片中MDA含量都上升, 但B73中MDA含量的增加幅度显著高于opr, 处理13 d, B73和opr叶片中MDA含量分别比处理1 d增加156.78%和88.84%。复水后, 两者变化无明显区别。
2.6 快速干旱对基因ZmNCED1、ZmZEP1、ZmAO1表达量的影响从图 6可见:对照组opr和B73叶片中ZmNCED1相对表达量无明显差异。干旱处理后, opr和B73叶片中ZmNCED1相对表达量随干旱时间的延长均呈先上升后下降趋势, 并于干旱处理3 h达到最大值, 与对照相比分别提高了15.6倍和27.6倍, opr极显著低于B73。干旱处理6和9 h, opr叶片中ZmNCED1相对表达量均显著低于B73。对照组opr与B73叶片中ZmZEP1相对表达量无明显差异。处理组opr与B73叶片中ZmZEP1相对表达量均随干旱时间的延长不断升高, 但B73于干旱12 h相对表达量提高了6.6倍, opr叶片中ZmZEP1相对表达量低于B73, 干旱处理后1和3 h差异达到显著水平(P<0.05), 6、9、12 h差异达到极显著水平(P<0.01)。对照组opr与B73叶片中ZmAO1相对表达量均相对较低。干旱条件下, 基因ZmAO1相对表达量在opr和B73叶片中均呈先上升后下降趋势, 并于干旱处理后3 h均达到最大值, opr叶片中的相对表达量提高3倍, B73叶片中的相对表达量提高5倍。两者差异达到极显著水平。
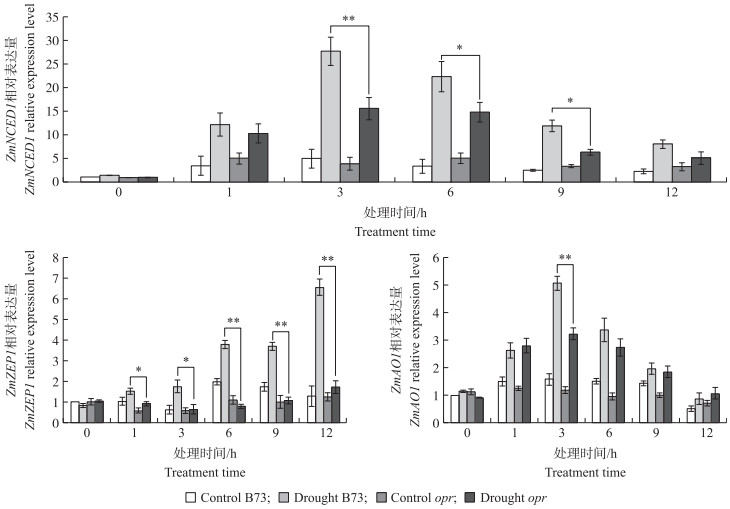
|
图 6 快速干旱处理对叶片中基因ZmZEP1、ZmNCED1和ZmAO1相对表达量的影响 Fig. 6 Relative expression level of ZmZEP1, ZmNCED1 and ZmAO1 of maize in leaf under short drought *P<0.05, **P<0.01. |
干旱条件下, Pn下降有气孔因素与非气孔因素, 气孔因素表现为Gs、Tr和Ci降低, 非气孔因素通常由光合结构受损所致[23]。Ci可作为区分光合作用下降原因的重要参数。本研究中发现, 正常生长状态下, opr叶片气孔数目显著低于B73, 说明玉米内源JA可能参与气孔发育。干旱后, opr气孔数目少, 水分损失少, 因此opr叶片含水量高于B73。在干旱前7 d, opr的Pn、Gs、Tr和Ci均低于B73。处理7 d后, B73的Ci开始升高, opr的Pn逐渐高于B73。干旱10 d, opr的Ci开始升高。说明本试验干旱前期主要是气孔因素影响光合作用, 后期由于opr中水分损失较慢, 导致光合作用元件受损推迟。复水后, B73和opr都能恢复到正常水平且B73表现出更高的光合能力, 说明B73干旱胁迫后的恢复能力更强。
植物在干旱胁迫下通过提高POD、SOD、CAT等酶活性从而减少活性氧对植物的伤害[24-25]。本研究中, 在干旱胁迫时, B73和opr叶片中POD、SOD、CAT活性均表现为先升高后下降的趋势, 这与张仁和等[4]研究结果一致。复水后, B73和opr均能够恢复到与对照相同的水平。但在胁迫过程中, opr的POD、SOD下降时间比B73晚。推测是opr和B73叶片含水量变化不同步所引起。MDA含量变化反映出opr在整个胁迫过程中植株受损伤的程度低于B73。在正常水分条件下, opr叶片中CAT高于B73, 可能是基因突变导致的生理变化。B73与opr在干旱条件下, 叶片中可溶性蛋白与游离脯氨酸含量均表现为持续升高。但opr上升的速度与最大值均小于B73, 这种现象是含水量降低不同步而引起的。
OPDA属于多重不饱和脂肪酸氧化产物, 该类物质大量存在于细胞膜上, 同时也是植物对胁迫响应的调节器, 能使植物快速应对多种胁迫造成的损害。Savchenko等[19]研究证明, 干旱胁迫下, 拟南芥茉莉酸缺少突变体opr3内源OPDA含量增加, 气孔开度小于野生型, 且OPDA和ABA在促进气孔关闭方面具有协同作用。本研究中玉米茉莉酸缺少突变体可能由于OPDA的积累而延缓抗旱反应。快速干旱处理过程中, ABA合成关键基因ZmZEP1、ZmNCED1、ZmAO1的RT-qPCR结果表明, 随干旱时间的延长, opr叶片中ABA合成通路关键基因ZmZEP1、ZmNCED1的表达量显著低于B73。推测玉米叶片中内源JA通过影响ZmZEP1、ZmNCED1的表达进而影响内源ABA的合成。
本研究结果表明, 正常生长条件下, opr比B73的叶片气孔密度低, 在土壤干旱条件下能够维持更高的叶片含水量、光合作用效率和抗氧化酶活性, 细胞膜损伤较低。说明玉米内源JA参与气孔发育, 内源JA含量的大量降低能够减少植物在干旱条件下的水分损失, 提高植株生存能力。且内源JA含量的缺少能够降低叶片中ABA合成关键基因的表达, 影响ABA的合成及其调控的植物抗旱反应进程。
| [1] |
孙成韬, 焦仁海, 番兴明. 玉米抗旱育种的研究进展[J]. 玉米科学, 2006, 14(6): 71-74. Sun C T, Jiao R H, Pan X M. Advances of maize drought tolerance breeding[J]. Journal of Maize Sciences, 2006, 14(6): 71-74 (in Chinese with English abstract). DOI:10.3969/j.issn.1005-0906.2006.06.019 |
| [2] |
Eberhard S, Finazzi G, Wollman F A. The dynamics of photosynthesis[J]. Annual Review of Genetics, 2008, 42(1): 463-515. DOI:10.1146/annurev.genet.42.110807.091452 |
| [3] |
Reddy A R, Chaitanya K V, Vivekanandan M. Drought-induced responses of photosynthesis and antioxidant metabolism in higher plants[J]. Journal of Plant Physiology, 2004, 161(11): 1189-1202. DOI:10.1016/j.jplph.2004.01.013 |
| [4] |
张仁和, 郑友军, 马国胜, 等. 干旱胁迫对玉米苗期叶片光合作用和保护酶的影响[J]. 生态学报, 2011, 31(5): 1303-1311. Zhang R H, Zheng Y J, Ma G S, et al. Effects of drought stress on photosynthetic traits and protective enzyme activity in maize seedling[J]. Acta Ecologica Sinica, 2011, 31(5): 1303-1311 (in Chinese with English abstract). |
| [5] |
Smirnoff N. The role of active oxygen in the response of plants to water deficit and desiccation[J]. New Phytologist, 1993, 125(1): 27-58. DOI:10.1111/nph.1993.125.issue-1 |
| [6] |
高辉, 张红芳, 袁思安, 等. 植物内源激素对干旱胁迫的响应研究[J]. 绿色科技, 2013(11): 5-7. Gao H, Zhang H F, Yuan S A, et al. Response of plant endogenous hormone to drought threat stress[J]. Journal of Green Science and Technology, 2013(11): 5-7 (in Chinese). DOI:10.3969/j.issn.1674-9944.2013.11.002 |
| [7] |
沈慧, 林琳, 李群, 等. ABA与SA信号通路交互作用的研究[C]//中国植物逆境生理生态与分子生物学学术研讨会.乌鲁木齐, 2006. Shen H, Lin L, Li Q, et al. Study on the interaction between ABA and SA signaling pathway[C]//Symposium on physiological ecology and molecular biology of Chinese plants. Urumqi, 2006(in Chinese). |
| [8] |
蔡昆争, 董桃杏, 徐涛. 茉莉酸类物质(JAs)的生理特性及其在逆境胁迫中的抗性作用[J]. 生态环境学报, 2006, 15(2): 397-404. Cai K Z, Dong T X, Xu T. The physiological roles and resistance control in stress environment of jasmonates[J]. Ecology and Environment, 2006, 15(2): 397-404 (in Chinese with English abstract). DOI:10.3969/j.issn.1674-5906.2006.02.041 |
| [9] |
Zhu J K. Salt and drought stress signal transduction in plants[J]. Annu Rev Plant Biol, 2002, 53: 247-273. DOI:10.1146/annurev.arplant.53.091401.143329 |
| [10] |
Finkelstein R. Abscisic acid synthesis and response[J]. The Arabidopsis Book, 2013, 11: e0166. DOI:10.1199/tab.0166 |
| [11] |
Roychoudhury A, Paul S, Basu S. Cross-talk between abscisic acid-dependent and abscisic acid-independent pathways during abiotic stress[J]. Plant Cell Rep, 2013, 32(7): 985-1006. DOI:10.1007/s00299-013-1414-5 |
| [12] |
桂连友, 刘树生, 陈宗懋. 外源茉莉酸和茉莉酸甲酯诱导植物抗虫作用及其机理[J]. 昆虫学报, 2004, 47(4): 507-514. Gui L Y, Liu S S, Chen Z X. Plant resistance to insects induced by application of exogenous jasmonic acid and methyl jasmonate[J]. Acta Entomologica Sinica, 2004, 47(4): 507-514 (in Chinese with English abstract). DOI:10.3321/j.issn:0454-6296.2004.04.016 |
| [13] |
王瑜, 吴丽芳, 余增亮. 茉莉酸及其甲酯在植物诱导抗病性中的作用[J]. 生物学杂志, 2000, 17(1): 11-12. Wang Y, Wu L F, Yu Z L. The role of jasmonic acid and methy jasmonate in plant induced disease resistance[J]. Journal of Biology, 2000, 17(1): 11-12 (in Chinese with English abstract). DOI:10.3969/j.issn.2095-1736.2000.01.005 |
| [14] |
董桃杏, 蔡昆争, 张景欣, 等. 茉莉酸甲酯(MeJA)对水稻幼苗的抗旱生理效应[J]. 生态环境, 2007, 16(4): 1261-1265. Dong T X, Cai K Z, Zhang J X, et al. The physiological roles of methyl jasmonate(MeJA) in drought resistance of rice seedlings[J]. Ecology and Environment, 2007, 16(4): 1261-1265 (in Chinese with English abstract). DOI:10.3969/j.issn.1674-5906.2007.04.038 |
| [15] |
Dhakarey R, Raorane M L, Treumann A. Physiological and proteomic analysis of the rice mutant cpm2 suggests a negative regulatory role of jasmonic acid in drought tolerance[J]. Frontiers in Plant Science, 2017, 8: 1903. DOI:10.3389/fpls.2017.01903 |
| [16] |
Schaller F, Schaller A, Stintzi A. Biosynthesis and metabolism of jasmonates[J]. Journal of Plant Growth Regulation, 2005, 23(3): 179-199. |
| [17] |
Ziegler J, Stenzel I, Hause B, et al. Molecular cloning of allene oxide cyclase:the enzyme establishing the stereochemistry of octadecanoids and jasmonates[J]. Journal of Biological Chemistry, 2000, 275(25): 19132-19138. DOI:10.1074/jbc.M002133200 |
| [18] |
Schaller F, Biesgen C, Müssig C, et al. 12-oxophytodienoate reductase 3(OPR3) is the isoenzyme involved in jasmonate biosynthesis[J]. Planta, 2000, 210(6): 979-984. DOI:10.1007/s004250050706 |
| [19] |
Savchenko T, Kolla V A, Wang C Q. Functional convergence of oxylipin and abscisic acid pathways controls stomatal closure in response to drought[J]. Plant Physiology, 2014, 164(3): 1151-1160. DOI:10.1104/pp.113.234310 |
| [20] |
Zhang J, Simmons C, Yalpani N, et al. Genomic analysis of the 12-oxo-phytodienoic acid reductase gene family of Zea mays[J]. Plant Molecular Biology, 2005, 59(2): 323-343. DOI:10.1007/s11103-005-8883-z |
| [21] |
Yan Y C, Christensen S, Isakeit T, et al. Disruption of OPR7 and OPR8 reveals the versatile functions of jasmonic acid in maize development and defense[J]. Plant Cell, 2012, 24(4): 1420-1436. DOI:10.1105/tpc.111.094151 |
| [22] |
Sedmak J J, Grossberg S E. A rapid, sensitive, and versatile assay for protein using coomassie brilliant blue G250[J]. Analytical Biochemistry, 1977, 79(1/2): 544-552. |
| [23] |
徐俊增, 彭世彰, 魏征, 等. 节水灌溉水稻叶片胞间CO2浓度及气孔与非气孔限制[J]. 农业工程学报, 2010, 26(7): 76-80. Xu J Z, Peng S Z, Wei Z, et al. Intercellular CO2 concentration and stomatal or non-stomatal limitation of rice under water saving irrigation.[J]. Transactions of the Chinese Society of Agricultural Engineering, 2010, 26(7): 76-80 (in Chinese with English abstract). DOI:10.3969/j.issn.1002-6819.2010.07.013 |
| [24] |
刘海艳, 杨丽洁, 丁艳锋, 等. NO对水稻孕穗期干旱胁迫下叶片光合及产量的影响[J]. 南京农业大学学报, 2017, 40(2): 195-202. Liu H Y, Yang L J, Ding Y F, et al. Effects of nitric oxide on photosynthesis and yield of rice under drought stress at booting stage[J]. Journal of Nanjing Agricultural University, 2017, 40(2): 195-202 (in Chinese with English abstract). DOI:10.7685/jnau.201605012 |
| [25] |
马旭凤.水分亏缺对玉米生理指标、形态特性及解剖结构的影响[D].杨凌: 西北农林科技大学, 2010. Ma X F.Effect of water deficit on maize physiology, morphology and anatomical structure[D]. Yangling: Northwest A&F University, 2010(in Chinese with English abstract). |




