文章信息
- 王致远, 刘子文, 谷晗, 游佳, 朱泽, 胡曼曼, 周时荣, 江玲, 刘玲珑
- WANG Zhiyuan, LIU Ziwen, GU Han, YOU Jia, ZHU Ze, HU Manman, ZHOU Shirong, JIANG Ling, LIU Linglong
- 水稻白条纹叶突变体wsl7的表型鉴定及候选基因分析
- Phenotypic identification and candidate genes analysis of white striped leaf7(wsl7) mutant in rice
- 南京农业大学学报, 2019, 42(1): 21-29
- Journal of Nanjing Agricultural University, 2019, 42(1): 21-29.
- http://dx.doi.org/10.7685/jnau.201803028
-
文章历史
- 收稿日期: 2018-03-15
叶色突变性状极易识别, 并且通常在苗期表达, 因此可将叶色表型作为水稻制种过程中不育系的标记性状, 在杂交水稻种子生产过程中有效鉴定和去除假杂种, 提高育种效率[1-2]。Yoo等[3]根据苗期的叶色表型将叶色突变体分为:转绿型(virescent)、条纹(stripe)、白化(albino)、黄化(chlorina)、斑马纹(zebra)和黄色斑点(yellow variegated)6种类型。
目前在水稻中已发现的白化叶突变体有virescent-1(v1)[4]、virescent-2(v2)[5]、virescent-3(v3)[3]、al1[6]、al2[7]等。叶色白化多与水稻叶绿素代谢和质体发育受阻有关, 白化叶突变体v1、v2、v3表型对温度敏感, 低温下失绿现象更加显著[3-5]; al1和al2对温度不敏感且苗期致死[6-7]。尽管目前已经分离了以上基因, 但水稻叶绿体发育受到自身编码基因和核基因的双向调控[8], 分子机制极其复杂, 很多调控环节还不清楚。因此, 分离鉴定新的叶绿体发育相关突变体并克隆其基因, 有助于进一步了解叶绿体发育调控机制。
本研究通过对wsl7进行生理特性分析, 并通过透射电镜进行表型观察, 利用图位克隆的方法获得叶片白条纹转绿的控制基因, 并对叶绿素合成及其质体发育相关基因的表达进行分析, 为该基因对叶绿素合成及叶绿体发育过程的功能研究提供参考。
1 材料与方法 1.1 供试材料和主要农艺性状调查本研究利用甲基磺酸乙酯(EMS)诱变水稻栽培品种'93-11’, 从中筛选出1个水稻白条纹叶突变体white striped leaf7(wsl7)。2014年南京正季于南京农业大学土桥实验基地配制突变体wsl7与粳稻品种'02428’(江苏省农业科学院选育的广亲和粳型种质)的杂交组合。2015年上半年于海南省陵水县南京农业大学科研基地种植亲本和F1, 采用1行10株宽窄行交替的种植模式, 株距为16.5 cm, 窄行行距为16.5 cm, 宽行行距为23.5 cm, 采用常规田间栽培管理。在野生型和wsl7抽穗期时, 分别调查它们的株高、分蘖数、穗长、剑叶长和剑叶宽。种子收获以后, 烘干数日至恒质量, 测定千粒质量。每个性状20个重复, 取平均值。
1.2 表型观察野生型和wsl7种植于生长室。生长室条件设置如下:恒温25 ℃, 昼夜光照时间为14 h/10 h, 光照强度180 μmol·m-2·s-1, 相对湿度为60%。当植株长至2叶1心时取最上面1片完整的叶片进行叶绿体超微结构的透射观察以及叶绿素自发荧光观察。首先避开叶脉将叶片切为2 mm长宽的小块, 配制2.5%戊二醛溶液(25%戊二醛溶液10 mL, 0.2 mol·L-1 Na2HPO4-NaH2PO4 50 mL, pH7.2, ddH2O定容至100 mL, 4 ℃避光保存), 放入叶片并在室温下固定24 h后4 ℃保存; 1% OsO4固定; 醋酸氧铀染色, 丙酮梯度脱水(50%、70%、80%、90%, 每梯度15 min, 100%丙酮脱水30 min, 重复3次); 在环氧树脂SPURR中包埋聚合, 使用LEICA超薄切片机将样品切成50~90 nm的切片, 再次染色后在Hitachi H-7650透射电镜下观察、拍照。使用FluorCam叶绿素荧光成像机测定野生型和wsl7的荧光参数, 首先将样品置于黑暗条件下处理15 min, 将样品置于荧光灯下, 打开Flashes灯并调整Shutter和Sensitivity, 保证样品的荧光值为200~500, 拍摄并选中待分析区域, 测定Fo(暗适应后的初始荧光参数)和Fm(暗适应后的最大荧光参数), QYmax(最大光量子效率)=(Fm-Fo)/Fm。
1.3 温度敏感性和光合色素含量测定将野生型与wsl7种子浸种2 d后播于盛有营养土和蛭石(体积比为1:3)的2个中转箱中, 分别置于恒温25 ℃和20 ℃的GXZ智能光照培养箱中萌发生长, 相对湿度60%, 昼/夜光照时间14 h/10 h, 光照强度180 μmol·m-2·s-1, 10 d后观察表型。
叶绿素含量测定参照Lichtenthaler[9]的方法。取50~200 mg叶片剪碎, 置于15 mL离心管中, 加入5 mL 95%乙醇, 黑暗处理48 h。然后离心去除其中沉淀, 上清液用分光光度计(Beckman DU800 USA)测定665、649和470 nm处的光密度值, 重复3次。根据公式计算叶绿素a含量:Ca=13.95D665-6.88D640; 叶绿素b含量:Cb=24.96D649-7.32D665; 类胡萝卜素含量:Cx=(1 000D470-2.05Ca-114Cb)/245。最后换算出单位质量的叶绿素含量。
1.4 遗传分析与基因定位2014年南京正季, 配制wsl7与'02428’正、反交组合。2015年上半年于海南省陵水县南京农业大学科研基地种植wsl7/02428的F1种子, 观察F1植株表型, 并自交获得F2种子。将杂交组合wsl7/02428和02428/wsl7繁种得到的F2群体种子浸种2 d后播于盛有营养土和蛭石(体积比为1:3)的2个中转箱中, 放置GXZ智能光照培养箱中萌发生长, 培养箱设置为恒温25 ℃, 昼/夜光照时间14 h/10 h, 光照强度180 μmol·m-2·s-1, 相对湿度60%。出苗10 d后统计正常和白条纹叶表型的单株数目, 并利用卡方测验检验两者分离是否符合3:1的分离比, 验证白条纹叶表型是否由1对隐性核基因控制。
2015年南京正季, 于南京农业大学土桥实验基地种植亲本和F2, 亲本'93-11’和wsl7各种植4行, F2群体种植5 000株, 采用常规田间栽培管理。苗期挑选F2分离群体中1 400个白条纹叶单株用于基因定位。亲本和F2白条纹叶极端个体均用CTAB法提取基因组DNA。将极端叶片置于2.0 mL离心管中, 液氮冻20 min后磨成粉末; 加入600 μL预热的CTAB提取液, 混匀后置于65 ℃水浴锅中30 min, 每隔10 min翻转数次; 加入600 μL氯仿-异戊醇溶液(体积比24:1), 上下颠倒数次, 静置15 min; 4 ℃、12 000 r·min-1离心5 min, 吸取400 μL上清液至新的1.5 mL离心管中, 加入-20 ℃预冷的无水乙醇800 mL, 混匀后-20 ℃冰箱放置30 min以上; 4 ℃、12 000 r·min-1离心5 min, 弃上清液, 置于超净工作台上风干; 每管加入200 μL的ddH2O, 作为母液保存于4 ℃冰箱。
根据McCouch等[10]公布的水稻SSR标记, 从本实验室已有的SSR和InDel标记中筛选出多态性良好且均匀分布于12条染色体的标记119对, 然后选取10个隐性极端单株进行连锁分析, 确定连锁位点后再挑选1 360个极端单株进行精细定位。同时参考网上公布的'日本晴’和'93-11’基因组序列, 利用Primer Premier 5.0软件设计区间内的标记, 选择碱基差异数≥3 bp, 扩增产物为80~240 bp的引物用于试验。精细定位所用引物序列见表 1。
| 标记 Marker | 正向引物序列 Forward primer sequence(5'→3') | 反向引物序列 Reverse primer sequence(5'→3') |
| VF-746 | TCCTGTGATACCAGCACTGT | GCCAACCTTATAGCTAATCTGTCA |
| VF-419 | TGAAGACAAAAACAGGTTGCTCT | ACTGAAACATAAACCTGCTGCT |
| VF-110 | GTTAGGCCCACGTTGTTGAG | AGTGAATCTGTTTGTGATCATG |
| VF-908 | ACAAAACTGCACTACGGCTG | CCATCGTCTCCTTCCTCCTC |
| VF-823 | GCTCTCGGGTTTTTTCCTGG | TACCACGGTTCAGAGAGCAG |
| VF-536 | GAAGAGGCACCCCATCTTCT | AGGGGATTATCTGCAGGTGT |
采用RNA Prep Pure Plant Kit(天根生化有限公司)提取生长至2叶1心期的水稻幼苗叶片总RNA。RNA反转录采用SuperScript Ⅱ Kit(TaKaRa公司)。定量RT-PCR采用SYBR® Premix Ex TaqTM Kit(TaKaRa公司), 运行仪器为ABI prism 7500定量RT-PCR系统。定量PCR反应体系(20 μL)为:SYBR Premix Ex Taq Ⅱ 10 μL, 10 μmol·L-1前、后引物各0.8 μL, ROX Reference Dye Ⅱ(50×)0.4 μL, 模板DNA 2 μL(<100 ng), ddH2O 6 μL。定量反应程序为:95 ℃ 30 s; 95 ℃ 5 s, 60 ℃ 34 s, 循环40次; 95 ℃ 15 s, 60 ℃ 1 min, 95 ℃ 15 s。
以水稻ubiquitin(Os03g0234200)基因作为内参。试验数据采用2-ΔΔCT方法[11]分析处理, 每个样品重复3次。叶绿素合成相关基因和质体发育相关基因的定量引物参照文献[12]。
2 结果与分析 2.1 突变体wsl7的表型在大田条件下, 与野生型(图 1-A)相比, wsl7在早期营养生长阶段表现出明显的白条纹叶表型(图 1-B); 随着植株生长, 突变体开始由下向上转绿, 且新长出的叶片颜色较为正常。在光照培养箱中生长至2叶1心期时, 白条纹叶表型最为明显(图 1-C)。抽穗期时, 相比野生型, wsl7的株高下降6.7%, 其他农艺性状无显著差异, wsl7在暗适应后最小荧光和最大荧光参数均极显著低于野生型, 最大光量子效率也显著降低(表 2)。

|
图 1 野生型(WT)和突变体wsl7的表型特征 Fig. 1 Morphological characteristics of the wild type(WT)and wsl7 mutant A、B.田间条件下萌发20 d的野生型(左)和wsl7(右)的幼苗表型, 比例尺为1.5 cm; C. 25 ℃光照培养箱中生长7 d的野生型(左)和wsl7(右)的幼苗表型, 虚线框内为野生型(左)和wsl7(右)叶片放大图, 比例尺为2 cm。 A, B. The seedling phenotype of wild type(left)and wsl7(right)germinated for 20 days under field conditions, bar=1.5 cm; C. Seedling phenotypes of wild type(left)and wsl7(right)grown in 25 ℃ light incubator for 7 days, magnified views of the wild type(left)and wsl7(right)leaves within the dashed box, bar=2 cm. |
| 农艺性状 Agronomic traits | WT | wsl7 |
| 株高/cm Plant height | 128.75±3.25 | 120.06±3.50* |
| 分蘖数Number of tillers | 4.80±1.33 | 4.53±1.12 |
| 穗长/cm Panicle length | 27.24±0.34 | 27.03±0.90 |
| 剑叶面积/cm2 Flag leaf area | 85.07±2.54 | 87.58±11.26 |
| 粒长/mm Grain length | 8.93±0.52 | 8.45±0.57 |
| 粒宽/mm Grain width | 2.16±0.21 | 2.11±0.23 |
| 千粒质量/g 1 000-grain weight | 31.26±0.48 | 30.95±0.23 |
| 暗适应后初始荧光参数Fo | 3 814 | 1 253** |
| 暗适应后最大荧光参数Fm | 17 571 | 3 685** |
| 最大光量子效率QYmax | 0.78 | 0.66* |
| Note:*P<0.05, **P<0.01. The same as follows. | ||
从图 2可见, 培养箱温度为20 ℃时wsl7的白化表型更为明显。25 ℃和20 ℃条件下wsl7叶绿素a、叶绿素b和类胡萝卜素含量与野生型相比均极显著降低, 其中25 ℃时wsl7的总光和色素含量下降78.7%, 20 ℃时wsl7的总光合色素含量下降94.3%。
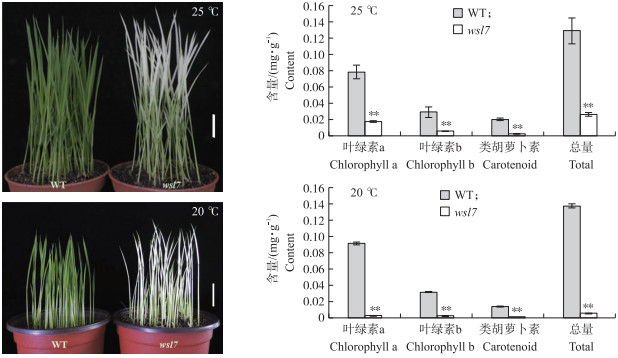
|
图 2 WT与wsl7在不同温度下的表型对比以及色素含量测定 Fig. 2 Phenotypic comparison and pigment content of WT and wsl7 at different temperatures Bar=2 cm. **P < 0.01. The same as follows. |
利用透射电镜对野生型和wsl7进行叶绿体超微结构的观察。结果显示:野生型的叶绿体发育正常, 具有完好的类囊体片层结构, 基粒堆叠紧密(图 3-A, B); wsl7的幼苗叶绿体中没有完整的类囊体的片层结构, 而是出现大量的空泡状结构(图 3-C, D)。

|
图 3 WT(A, B)和wsl7(C, D)的叶绿体超微结构比较 Fig. 3 Comparison of chloroplast ultrastructure between WT(A, B)and wsl7(C, D) CP:叶绿体Chloroplast; SG:淀粉颗粒Starch granule; Thy:类囊体片层Thylakoid lamellar; OB:嗜锇体Osmiophilic body. |
wsl7与粳稻品种'02428’正、反交得到的F1植株都表现出正常的叶色表型; F2种子苗期出现叶色表型的分离, 一类为野生型正常叶色表型, 另外一类出现白条纹叶表型; 卡方测验表明:正常植株数与白条纹叶植株数符合3:1分离比(表 3)。上述结果表明wsl7的表型受1对隐性核基因的控制。
| 杂交组合 Crossing combinations |
总株数 number of plants |
正常植株数 No. of normal plants |
白条纹植株数 No. of white striped leaf plants |
χ2 (3:1) |
| wsl7/02428 | 1 021 | 784 | 237 | 1.65 |
| 02428/wsl7 | 967 | 741 | 226 | 1.28 |
| 注: χ(0.05, 1)2=3.84. | ||||
从图 4可见:随机选取的10株白条纹叶单株的突变基因初步定位在第6染色体短臂上标记RM3827和RM528之间, 物理距离约为4.25 Mb。进一步扩大群体至330株, 极端单株将区间缩小到标记VF-746至VF-536之间, 在此区间设计了4个多态性的Indel标记, 再取1 030个极端白条纹叶植株进行精细定位, 最终将基因定位在标记VF-746和VF-110之间(72.3 kb)。根据Gramene(http://www.gramene.org/)网站预测, 在该区间内一共有8个开放阅读框(open reading frame, ORF)。将72.3 kb内的8个ORF扩增并测序, 发现wsl7与野生型相比仅在第4个ORF(MSU号为LOC_Os06g40050)的基因编码区存在1个非同义突变。LOC_Os06g40050的大小为2.9 kb, 包含3个外显子和2个内含子。
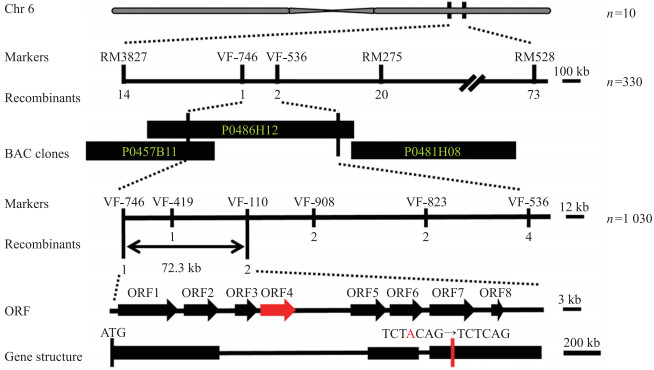
|
图 4 wsl7突变基因的定位
Fig. 4 Mapping of wsl7 mutant gene
1. n:极端隐性单株数The number of extreme recessive plants; Chr:染色体Chromosome; ORF:开放阅读框Open reading frame.
2.定位区间包含8个开放阅读框, 在第4个开放阅读框(用红色标注)的第3外显子上检测到1个碱基的缺失, 缺失的碱基用红色标注。The mapping region contains 8 open reading frames and a single nucleotide deletion is detected in the third exon of the fourth open reading frame(marked in red arrow). The missing base is marked in red. |
与野生型相比, wsl7编码区第3外显子第155位碱基'A’缺失, 导致编码蛋白翻译提前终止(图 5), 产生包含351个氨基酸的截短蛋白。WSL7编码1个MCF(mitochondrial carrier family)家族的假定转运蛋白。对WSL7基因的氨基酸序列进行分析, 发现该基因具有6个跨膜结构域和3个非常典型且保守的METS(mitochondrial energy transfer signatures)结构域。该基因在高粱(Sorghum bicolor)、大豆(Glycine max)和拟南芥(Arabidopsis thaliana)中均有同源基因, 蛋白序列高度相似。

|
图 5 WSL7同源蛋白的氨基酸序列比对 Fig. 5 Comparison of amino acid sequence of WSL7 homologous proteins 黑线代表 6个假定的跨膜结构域(H1—H6), 在每一个奇数的跨膜结构域后面存在1个保守的线粒体能量转移信号(METS), 用矩形表示。红框内为wsl7突变体截短的蛋白部分。 The black line represents the six putative transmembrane domains(H1-H6), and there is a conserved mitochondrial energy transfer signal(METS)behind each odd-numbered transmembrane domain, represented by rectangle. The red box is the truncated protein portion in the wsl7 mutant. |
在20 ℃条件下WSL7在突变体中的表达量为野生型的18.6%(图 6-A), 25 ℃条件下WSL7在突变体中的表达量为野生型的39.3%(图 6-B)。低温导致突变体的WSL7表达更低, 这与温敏试验的结果(图 2)相符。综上所述, 初步确定LOC_Os6g40050为wsl7的突变基因。
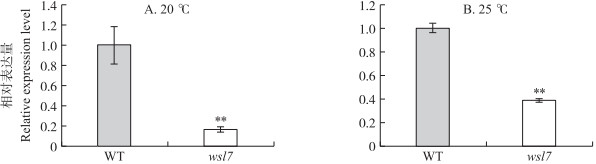
|
图 6 不同温度条件下WSL7在野生型(WT)和突变体wsl7中转录水平的比较 Fig. 6 Transcriptional levels of WSL7 in wild type(WT)and mutant wsl7 at different temperatures |
由于wsl7光合色素含量下降, 且叶绿体形态结构异常, 推测在wsl7中叶绿素合成和质体发育相关基因的表达也同样受到影响。为了验证这一猜想, 使用荧光定量PCR的方法比较野生型和wsl7中叶绿素合成和质体发育相关基因的转录水平。结果(图 7)表明:在叶绿素合成相关基因中, 除了编码镁离子螯合酶亚基的基因CHLM和细胞色素互作因子PIF3的转录水平增加以外, 其他基因的转录水平均下降。值得注意的是, HEMA编码的谷氨酰-tRNA还原酶、GUN4编码的镁离子螯合酶H亚基结合蛋白和CAO编码的叶绿素a单加氧酶均是叶绿素合成的关键酶[13-15]。
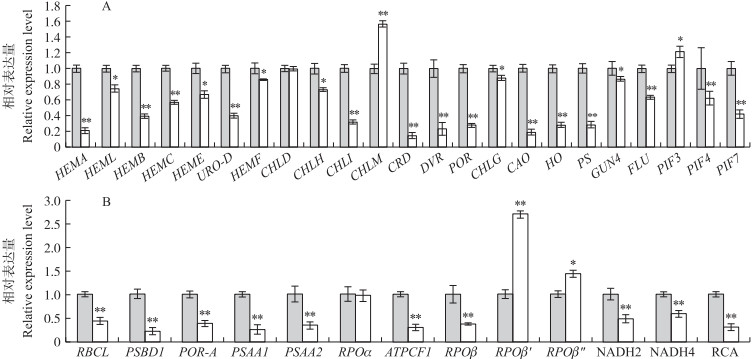
|
图 7 叶绿素合成相关基因(A)和质体发育相关基因(B)在WT和wsl7中的转录水平 Fig. 7 Transcriptional level of chloroplast related genes(A)and plastid development related genes(B)in WT and wsl7 |
wsl7中光系统ⅠP700叶绿素a载脂蛋白A1的编码基因PSAA1和光系统ⅠP700叶绿素a载脂蛋白A2的编码基因PSAA2的转录水平较野生型极显著下降。这些蛋白是维持叶绿体正常生理功能, 保证其顺利完成光合作用的物质基础[16-17]。
3 讨论叶片是植物主要的光合作用器官。叶色突变往往是由于控制叶绿素生物合成和叶绿体发育的基因失活或沉默, 从而导致叶绿素含量改变, 因此叶色突变体是研究水稻叶绿素合成和叶绿体功能的理想材料。
叶绿体的发育分为3步:1)叶片原基分化为分生组织, 激活质体复制和质体DNA的合成; 2)叶绿体遗传系统建立, 叶绿体翻译和转录活性大大增加; 3)叶绿体分化完成, 光合作用元件转录启始[18]。PsaA1和PsaA2分别编码光系统ⅠP700叶绿素a载脂蛋白A1和A2[16-17], PsbD1编码光系统ⅡD2蛋白[18], 这类基因对叶绿体的结构和功能完整性起重要作用, 叶绿体功能丧失往往会导致光系统结构受损, 如类囊体发生异常等[19]。wsl7中PsaA1、PsaA2、PsbD1的相对表达量均极显著下降, 类囊体存在异常, 这说明wsl7叶绿体分化确实受到影响。叶绿素位于类囊体膜上, 是植物进行光合作用的主要色素。叶绿素的合成是一个复杂的酶促反应, 其步骤大致为谷氨酸(Glu)→5-氨基乙酰丙酸(ALA)→胆色素原(PBG)→尿卟啉原Ⅲ(urogen Ⅲ)→粪卟啉原Ⅲ(coprogen Ⅲ)→原卟啉原Ⅸ(proto Ⅸ)→镁卟啉原Ⅸ(Mg-proto Ⅸ)→原脱植基叶绿素(Pchl)→叶绿素a(Chl a)→叶绿素b(Chl b)[20-21]。任何一个环节出问题都会导致叶绿素合成异常, 产生叶色突变表型[22]。在wsl7中, 编码谷氨酰-tRNA还原酶(GluTR)的HEMA、调控镁卟啉原Ⅸ合成的GUN4、编码叶绿素a单加氧酶基因CAO等叶绿素合成关键基因的表达量均比野生型显著降低, 这可能是wsl7光合色素含量降低的重要原因。
目前水稻中已经克隆14个白条纹叶或白化叶基因, 其中AL1、AL2导致水稻苗期致死, V1、V2、V3表型对温度具有依赖性, YSA表现出白化转绿[3-7, 23]。本研究中, wsl7幼苗生长前期出现白条纹叶, 5叶期后转绿。低温可以加重白条纹叶表型。wsl7穗长、分蘖数、籽粒长宽、千粒质量与野生型均无显著差异。通过图位克隆发现在wsl7中LOC_Os6g40050的最后1个外显子+950位碱基'A’缺失, 导致编码蛋白翻译提前终止。RT-PCR检测表明LOC_Os6g40050在wsl7的表达量极显著低于野生型, 初步确定该基因的突变导致野生型出现白条纹叶表型。
WSL7与已报道的OsBrittle3(简称OsBT3)为同一基因[24]。bt3突变体在LOC_Os6g40050第1外显子上有1个单碱基的缺失, 导致蛋白翻译提前终止, 产生包含217个氨基酸的截短蛋白。与wsl7相似, bt3突变体苗期出现白条纹叶表型, 光合色素含量极显著低于野生型, 且叶绿体结构异常。但与wsl7不同的是, bt3千粒质量比野生型下降8%左右, 且差异极显著; 而wsl7几乎不影响水稻的千粒质量, 这可能与wsl7编码的截短蛋白包含大多数功能域有关。因此, WSL7是OsBT3的新等位突变基因。
WSL7编码1个线粒体载体蛋白家族的转运蛋白, 该家族成员负责ATP、ADP和AMP等腺苷能量物质及其衍生物的跨膜运输[25]。ATP作为细胞中最主要的能量来源, 为植物的新陈代谢提供能量, 同时ATP也常常作为细胞间的信号分子调节生物的代谢活动。研究表明, WSL7与叶绿素合成和叶绿体发育有关, 但其具体如何影响水稻叶色的机制还不清楚, 仍需进一步探究。
本文报道的wsl7水稻突变体在3叶期之前出现明显的白条纹叶表型, 低温下与野生型相比, 差异更明显。在正常生长条件下, wsl7对分蘖数、穗长、籽粒长宽、千粒质量等重要农艺性状没有影响, 因此wsl7有望在两系杂交稻制种中发挥一定作用。
致谢: 农业部长江中下游粳稻生物学与遗传育种重点实验室, 江苏省现代作物生产协同创新中心和南方粳稻研究开发有限公司(应用基础研究方向)对本研究给予支持。
| [1] |
Su N, Hu M L, Wu D X, et al. Disruption of a rice pentatricopeptide repeat protein causes a seedling-specific albino phenotype and its utilization to enhance seed purity in hybrid rice production[J]. Plant Physiology, 2012, 159(1): 227-238. DOI:10.1104/pp.112.195081 |
| [2] |
Zhao Y, Wang M L, Zhang Y Z, et al. A chlorophyll-reduced seedling mutant in oilseed rape, Brassica napus, for utilization in F1 hybrid production[J]. Plant Breeding, 2000, 119(2): 131-135. DOI:10.1046/j.1439-0523.2000.00453.x |
| [3] |
Yoo S, Cho S, Sugimoto H, et al. Rice virescent-3 and stripe1 encoding the large and small subunits of ribonucleotide reductase are required for chloroplast biogenesis during early leaf development[J]. Plant Physiology, 2009, 150(1): 388-401. DOI:10.1104/pp.109.136648 |
| [4] |
Kusumi K, Sakata C, Nakamura T, et al. A plastid protein NUS1 is essential for build-up of the genetic system for early chloroplast development under cold stress conditions[J]. The Plant Journal, 2011, 68(6): 1039-1050. DOI:10.1111/tpj.2011.68.issue-6 |
| [5] |
Sugimoto H, Kusumi K, Noguchi K, et al. The rice nuclear gene, VIRESCENT-2, is essential for chloroplast development and encodes a novel type of guanylate kinase targeted to plastids and mitochondria[J]. The Plant Journal, 2007, 52(3): 512-527. DOI:10.1111/j.1365-313X.2007.03251.x |
| [6] |
Zhang Z M, Tan J J, Shi Z Y, et al. Albino leaf1 that encodes the sole octotricopeptide repeat protein is responsible for chloroplast development[J]. Plant Physiology, 2016, 171(2): 1182-1191. |
| [7] |
Liu C H, Zhu H T, Xing Y, et al. Albino Leaf2 is involved in the splicing of chloroplast groupⅠand Ⅱ introns in rice[J]. Journal of Experimental Botany, 2016, 67(18): 5339-5347. DOI:10.1093/jxb/erw296 |
| [8] |
Naested H, Holm A, Jenkins T, et al. Arabidopsis VARIEGATED3 encodes a chloroplast targeted, zinc-finger protein required for chloroplast and palisade cell development[J]. Journal of Cell Science, 2004, 117(20): 4807-4818. DOI:10.1242/jcs.01360 |
| [9] |
Lichtenthaler H K. Chlorophylls and carotenoids:pigments of photosynthetic biomembranes[J]. Methods in Enzymology, 1987, 148: 350-382. DOI:10.1016/0076-6879(87)48036-1 |
| [10] |
McCouch S R, Teytelman L, Xu Y, et al. Development and mapping of 2240 new SSR markers for rice(Oryza sative L.)[J]. DNA Research, 2002, 9(6): 199-207. DOI:10.1093/dnares/9.6.199 |
| [11] |
Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [12] |
刘喜, 周春雷, 任雅琨, 等. 水稻叶色白化转绿突变体WGL的遗传分析与基因定位[J]. 南京农业大学学报, 2015, 38(5): 712-719. Liu X, Zhou C L, Ren Y K, et al. Genetic analysis and gene mapping of virescent albino leaf mutant WGL in rice[J]. Journal of Nanjing Agricultural University, 2015, 38(5): 712-719 (in Chinese with English abstract). DOI:10.7685/j.issn.1000-2030.201505003 |
| [13] |
Ujwal M L, McCormac A C, Goulding A, et al. Divergent regulation of the HEMA gene family encoding glutamyl-tRNA reductase in Arabidopsis thaliana:expression of HEMA2 is regulated by sugars, but is independent of light and plastid signaling[J]. Plant Molecular Biology, 2002, 50(1): 83-91. |
| [14] |
Larkin R M, Alonso J M, Ecker J R, et al. GUN4, a regulator of chlorophyll synthesis and intracellular signaling[J]. Science, 2003, 299(5608): 902-906. DOI:10.1126/science.1079978 |
| [15] |
Yang Y L, Xu J, Huang L C, et al. PGL, encoding chlorophyllide a oxygenase 1, impacts leaf senescence and indirectly affects grain yield and quality in rice[J]. Journal of Experimental Botany, 2016, 67(5): 1297-1310. DOI:10.1093/jxb/erv529 |
| [16] |
Girard-Bascou J, Choquet Y, Schneider M, et al. Characterization of a chloroplast mutation in the psaA2 gene of Chlamydomonas reinhardtii[J]. Current Genetics, 1987, 12(7): 489-495. DOI:10.1007/BF00419557 |
| [17] |
Lefebvre-Legendre L, Choquet Y, Kuras R, et al. A nucleus-encoded chloroplast protein regulated by iron availability governs expression of the photosystemⅠsubunit PsaA in Chlamydomonas reinhardtii[J]. Plant Physiology, 2015, 167(4): 1527-1540. DOI:10.1104/pp.114.253906 |
| [18] |
Kusumi K, Chono Y, Shimada H, et al. Chloroplast biogenesis during the early stage of leaf development in rice[J]. Plant Biotechnology, 2010, 27: 85-90. DOI:10.5511/plantbiotechnology.27.85 |
| [19] |
Mate Z, Sass L, Szekeres M, et al. UV-B-induced differential transcription of psbA genes encoding the D1 protein of photosystem Ⅱ in the Cyanobacterium synechocystis 6803[J]. Journal of Biological Chemistry, 1998, 273(28): 17439-17444. DOI:10.1074/jbc.273.28.17439 |
| [20] |
Terry M J, Kendrick R E. Feedback inhibition of chlorophyll synthesis in the phytochrome chromophore-deficient aurea and yellow-green-2 mutants of tomato[J]. Plant Physiology, 1999, 119(1): 143-152. DOI:10.1104/pp.119.1.143 |
| [21] |
Oster U, Tanaka R, Tanaka A, et al. Cloning and functional expression of the gene encoding the key enzyme for chlorophyll b biosynthesis(CAO) from Arabidopsis thaliana[J]. The Plant Journal, 2000, 21(3): 305-310. DOI:10.1046/j.1365-313x.2000.00672.x |
| [22] |
Ling Q H, Huang W H, Baldwin A, et al. Chloroplast biogenesis is regulated by direct action of the ubiquitin-proteasome system[J]. Science, 2012, 338(6107): 655-659. DOI:10.1126/science.1225053 |
| [23] |
Su N, Hu M L, Wu D X, et al. Disruption of a rice rentatricopeptide repeat protein causes a seedling-specific albino phenotype and its utilization to enhance seed purity in hybrid rice production[J]. Plant Physiology, 2012, 159(1): 227-238. DOI:10.1104/pp.112.195081 |
| [24] |
吕佳.水稻质体ATP/ADP转运蛋白OsBT3的双重功能研究[D].南京: 南京农业大学, 2015. Lü J.The dual function analysis of OsBT3, a novel plastid ATP/ADP transporter, in rice(Oryza Sativa L.)[D]. Nanjing: Nanjing Agricultural University, 2015(in Chinese with English abstract). |
| [25] |
Kirchberger S, Leroch M, Huynen M, et al. Molecular and biochemical analysis of the plastidic ADP-glucose transporter(ZmBT1) from Zea mays[J]. Journal of Biological Chemistry, 2007, 282(31): 22481-22491. DOI:10.1074/jbc.M702484200 |




