文章信息
- 陶蓉, 潘根, 江玲, 程遐年, 刘裕强, 万建民
- TAO Rong, PAN Gen, JIANG Ling, CHENG Xianian, LIU Yuqiang, WAN Jianmin
- 籼稻品种‘BP360e’抗褐飞虱遗传分析及基因定位
- Genetic analysis and mapping of the gene conferring brown planthopper resistance in indica rice cultivar 'BP360e'
- 南京农业大学学报, 2019, 42(1): 14-20
- Journal of Nanjing Agricultural University, 2019, 42(1): 14-20.
- http://dx.doi.org/10.7685/jnau.201803053
-
文章历史
- 收稿日期: 2018-03-27
2. 中国农业科学院作物科学研究所, 北京 100081
2. Institute of Crop Sciences, Chinese Academy of Agricultural Sciences, Beijing 100081, China
褐飞虱[Nilaparvata lugens(Stål)]是危害亚洲稻区水稻生产最严重的害虫之一。褐飞虱的危害具有暴发性、毁灭性和隐蔽性。成虫及若虫栖息于稻丛基部, 刺吸取食水稻茎叶韧皮部汁液, 致使植株枯萎。严重时, 导致稻株基部取食部位变黑、腐烂发臭、瘫痪倒状, 稻田出现大面积"虱烧", 俗称"冒穿", 致使水稻减产甚至绝收[1]。
目前水稻生产中, 对褐飞虱的防治主要依赖化学农药。杀虫剂的长期过量使用, 不仅严重污染环境, 破坏生态平衡, 还导致褐飞虱抗药性的产生, 同时还严重影响稻米品质, 对粮食安全造成了较大隐患[2-3]。因此, 从稻种资源中发掘抗褐飞虱基因, 培育抗褐飞虱水稻品种, 是防治褐飞虱最经济、有效、环境友好和生态安全的首选措施。
自20世纪70年代以来, 各国研究者致力于水稻抗褐飞虱基因的发掘与利用工作[4-14]。目前, 已相继定位抗褐飞虱主基因34个。自2009年克隆出第1个抗褐飞虱基因Bph14以来[10], 已有8个抗褐飞虱基因被成功克隆, 分别是Bph14[10]、Bph26[11]、Bph3[4]、bph29[12]、Bph18[13]、Bph9[6]、Bph32[7]、Bph6[8]。由于褐飞虱对抗性基因具有较强的适应性, 常导致品种抗性的丧失[15-16]。因此, 通过多基因聚合, 选育具有持久抗虫性的水稻品种, 已成为防治褐飞虱危害的重要任务。
本研究利用抗褐飞虱籼稻品种'BP350e’与感虫品种'02428’构建遗传群体, 进行褐飞虱基因的遗传分析及定位。旨在发掘新的抗褐飞虱基因, 为通过分子标记辅助选择抗褐飞虱新品种提供新抗源。
1 材料与方法 1.1 材料供试抗虫亲本为印尼籼稻品种'BP360e’, 感虫品种为广亲和粳稻品种'02428’。以携带Bph3的斯里兰卡籼稻品种'Rathe Heenati’('RH’)为抗虫对照, '9311’为感虫品种对照。
1.2 遗传分析及定位群体的构建以'BP360e’为母本、'02428’为父本构建了1个包含85个单株的F2分离群体, 自交, 分单株收种, 获得F2:3家系; 以'02428’为轮回亲本, 利用高抗F2:3家系与'02428’进行回交构建1个包含98个单株的BC2F2次级分离群体, 自交, 获得BC2F2:3家系。
1.3 褐飞虱虫源虫源于2015年采集于南京土桥镇水稻田, 于南京农业大学温室内, 在感虫品种'9311’植株上饲养并大量繁殖作为供试虫源。
1.4 褐飞虱抗性鉴定| 死苗率/% Seeding mortality rate |
危害级 Damage rating |
抗性水平 Resistance level |
| <1.0 | 0 | 高抗High resistance |
| 1.1~10.0 | 1 | 抗Resistance |
| 10.1~30.0 | 3 | 中抗Mediate resistance |
| 30.1~50.0 | 5 | 中感Mediate susceptible |
| 50.1~70.0 | 7 | 感Susceptible |
| >70.1 | 9 | 高感High susceptible |
褐飞虱抗性鉴定采用改进的标准苗期集团筛选法(standard seed box screening test, SSST)[17-18], 分别对'BP360e’'02428’'RH’和85个F2:3家系及98个BC2F2:3家系进行抗虫鉴定。每个品种(家系)30粒种子装入网袋内浸种2 d, 催芽1 d, 以确保各品种(家系)生长一致。待种子露白后, 分别播种于直径8.5 cm、高9.0 cm, 盛满营养土的圆形塑料钵中(钵底部有1个小孔, 便于渗透吸水)。每个品种(家系)设2次重复, 完全随机排列。每60个塑料钵(包括抗虫对照和感虫对照各2钵)置于65 cm×44 cm×14 cm的周转箱内, 箱内保持2 cm左右水层。待苗生长到2叶1心期, 接种前3 d, 剔除病苗、弱苗, 保证每钵剩余25~30株长势均匀的健壮苗。平均每株接入2~3龄褐飞虱若虫5~7头, 放入罩有尼龙网的养虫笼内, 让褐飞虱自由取食。自然光照, 室温25~28 ℃, 相对湿度60%。当感虫亲本死亡率达到95%以上时统计各品种(家系)的死苗率, 对每个品种(家系)参照国际水稻所鉴定标准[19-20]进行0~9级评定(表 1)。
1.5 DNA样品制备采用CTAB法制备DNA样品。取新鲜水稻叶片200~300 mg, 研磨成细粉; 加入600 μL的CTAB提取液, 置65 ℃水浴30 min; 加入700 μL氯仿, 12 000 r·min-1离心5 min; 转移上清液至另一离心管中, 加入240 μL异丙醇, 13 000 r·min-1离心5 min; 弃上清液, 加400 μL体积分数为70%的乙醇, 12 000 r·min-1离心5 min; 弃70%的乙醇, 风干; 加100~200 μL Tris-EDTA Buffer(TE), 溶解后4 ℃保存。
1.6 SSR标记分析10 μL反应体系:10 mmol·L-1 Tris-HCl(pH8.3), 50 mmol·L-1 KCl, 1.5 mmol·L-1MgCl2, 50 μmol·L-1 dNTPs, 0.2 μmol·L-1引物, 0.5 U Taq polymerase和20 ng DNA模板。在PCR仪中进行扩增反应:95 ℃ 5 min; 95 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 1 min, 35个循环; 72 ℃ 7 min。扩增产物经80 g·L-1非变性PAGE胶分离, 银染显色。利用灯箱观察DNA条带, 将扩增产物在双亲间表现明显多态的引物用于F2及BC2F2群体的分析。
1.7 连锁图谱的构建及QTL分析采用极端个体分组法, 从85个F2:3家系中选取12个极端抗虫单株(抗性级别0级)和12个极端感虫单株(抗性级别8~9级)用于初步连锁分析。发现连锁迹象后, 构建相应染色体的连锁图谱, 进行QTL检测。携带抗虫亲本'BP360e’带型的个体赋值为1, 具有感虫亲本'02428’带型的个体赋值为2, 同时具有双亲带型(杂合型)的个体赋值为3, 数据缺失赋值为0。利用MAPMAKER/EXP Version 3.0软件构建遗传图谱并进行抗褐飞虱QTL检测, 以LOD≥2.0判断阈值QTL是否存在[21]。
2 结果与分析 2.1 '02428’和'BP360e’苗期褐飞虱抗性比较如图 1所示:褐飞虱取食7 d后, 感虫亲本'02428’死苗率高达97%, 而抗虫亲本'BP360e’死苗率不到10%, 抗虫对照品种'Rathe Heenati’的死苗率为0。上述结果表明, '02428’高感褐飞虱, 'BP360e’对褐飞虱表现较高抗性, 但略低于抗虫对照'Rathe Heenati’。

|
图 1 抗虫品种'BP360e’和感虫品种'02428’对褐飞虱的抗性对比 Fig. 1 Comparison of brown planthopper(BPH)resistance of resistant cultivar'BP360e' and susceptible cultivar'02428' RH:抗虫对照品种'Rathe Heenati’。不同小写字母表示在0.05水平差异显著。下同。 RH:Resistant control cultivar'Rathe Heenati’. Different letters indicate significant difference at 0.05 level.The same as follows. |
从图 2可见:各F2:3家系表现出明显的抗感分离。根据F2:3家系的抗性等级可将相应的F2植株分为抗(RR)、中抗(Rr)和感虫(rr)3个种类。卡方检验表明, F2群体RR:Rr:rr的分离比符合1:2:1(χ2=0.003), 表明'BP360e’中存在1个抗褐飞虱主基因(表 2)。
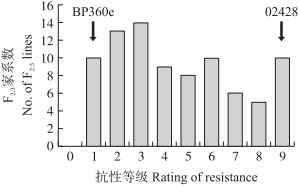
|
图 2 BP360e/02428 F2:3群体抗褐飞虱等级次数分布图 Fig. 2 Frequency distribution of BPH-resistance scores in BP360e/02428 F2:3 lines |
| F2基因型 F2 genotypes |
F2个体数 Number of F2 individuals |
相应F2:3家系表型 Phenotype of corresponding F2:3 lines |
| RR | 23 | 0≤RS≤2 |
| Rr | 41 | 2<RS<7 |
| rr | 21 | 8≤RS≤9 |
| 注:RR:纯合抗虫Homozygous resistance; Rr:杂合抗虫Heterozygous resistance; rr:纯合感虫Homozygous susceptibility; RS:抗虫级别Resistance rating. | ||
选取分布在水稻12条染色体上的513个分子标记, 进行亲本'BP360e’和'02428’多态性筛选。发现有151个标记在亲本间存在较好的多态性。从85个F2:3家系中分别选取12个极端抗虫家系(抗性级别0级)和12个极端感虫家系(抗性级别8~9级), 进行初连锁分析, 在第4染色短臂发现了连锁迹象。利用85个F2:3家系和分布在第4染色体上的9个分子标记, 构建水稻第4染色体连锁图谱(图 3)。结合各F2:3家系的抗褐飞虱表型数据, 利用MAPMAKER/EXP Version 3.0软件, 在第4染色体标记RM16382和INDEL4-5间, 约15.3 cM的区间检测到1个抗褐飞虱基因, LOD值为14.4, 贡献率为56%, 命名为QBph4。

|
图 3 BP360e/02428 F2群体检测到的抗褐飞虱QTL位点在第4染色体上的位置 Fig. 3 The location of the QTL for BPH resistance on the fourth chromosome detected in BP360e/02428 F2 population |
为了进一步验证QBph4的可靠性, 以'02428’为轮回亲本, 利用极抗F2:3家系与其进行回交构建了包含QBph4位点的BC2F2次级分离群体, 该群体包含了98个单株。对该BC2F2:3家系进行了抗褐飞虱表型鉴定, 结果(图 4)显示:利用该群体同样在第4染色体标记RM16382和INDEL4-5之间重复检测到1个抗褐飞虱基因, LOD值为13.1, 贡献率为52.1%。
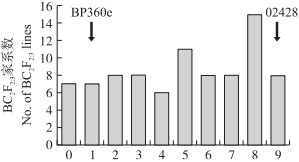
|
图 4 BP360e/02428//02428 BC2F2群体抗褐飞虱等级次数分布 Fig. 4 Frequency distribution of BPH-resistance rating in BP360e/02428//02428 BC2F2 population |
通过与Liu等[4]的研究比较发现, QBph4区间包含广谱、持久抗褐飞虱基因Bph3位点。Bph3位点包含4个凝集素类受体激酶基因(OsLecRK1—OsLecRK4), Bph3对褐飞虱的抗性由该基因簇共同控制。为验证QBph4是否与Bph3等位, 对'BP360e’中的OsLecRK1、OsLecRK2、OsLecRK3和OsLecRK4进行了测序分析, 结果如图 5所示。通过氨基酸序列比对, 'BP360e’和'Rathe Heenati’中的OsLecRK3序列完全一致, 而OsLecRK1和OsLecRK2分别在第90位和155位存在1处氨基酸差异; OsLecRK4因第471位碱基的缺失而导致其在'BP360e’中翻译提前终止。根据定位区间以及氨基酸比较分析, 推测QBph4可能为Bph3的1个新的等位基因。
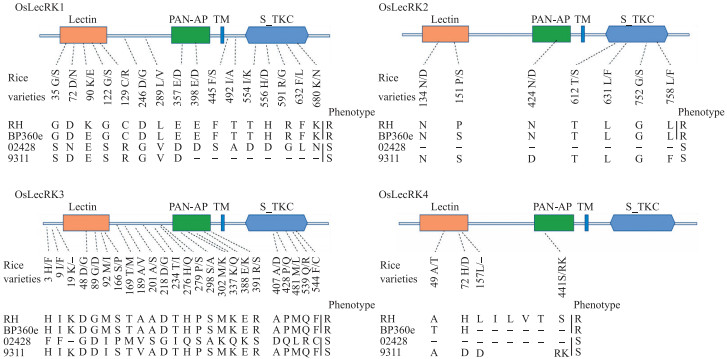
|
图 5 'Rathe Heenati’'BP360e’'02428’和'9311’中OsLecRK氨基酸序列比较 Fig. 5 Amino acid sequence comparison of OsLecRK in'Rathe Heenati''BP360e''02428'and'9311' 不同颜色图形表示OsLecRK的4个保守结构域, 分别为B-凝集素结构域、PAN-AP蛋白互作结构域、跨膜结构域和丝氨酸-苏氨酸激酶结构域。 Different boxes representing four conserved domains of OsLecRK, were B-lectin domain, PAN-AP domain, transmembrane domain(TM)and serine/threnine kinase domain(S-TKC), respectively. |
褐飞虱对水稻的危害日益严重, 发掘抗性水稻资源、培养抗性品种是防治褐飞虱最经济有效的措施。1969年, 菲律宾国际水稻所鉴定出第1个抗褐飞虱水稻品种'Mudgo’, 该品种携带抗褐飞虱基因Bph1。利用该抗源, 1973年成功选育出第1个携带Bph1的水稻品种'IR26’。随后又培育了多个携带Bph1的水稻品种, 并大范围推广应用, 在一定程度上防治了褐飞虱危害。但是上述品种仅推广3年左右, Bph1的抗性便被一种新的褐飞虱种群克服了。随后, 研究人员又选育了携带抗褐飞虱基因Bph2的水稻品种'IR36’和'IR42’, 推广种植初期对褐飞虱的防治起到了良好的效果。然而在1981年, 该品种的抗性再次被褐飞虱新种群所克服。因此, 通过多基因聚合, 选育具有持久、广谱抗性的水稻品种, 已成为防治褐飞虱危害的重要任务[22-23]。
供试材料'BP360e’表现较高的褐飞虱抗性。为解析该品种抗褐飞虱的遗传基础, 发掘抗褐飞虱新基因, 本研究构建了'BP360e’与感虫品种'02428’的遗传群体, 并在第4染色体标记RM16382和INDEL4-5之间检测到1个抗褐飞虱基因QBph4。通过比较分析, 发现该区间包含1个已克隆的抗褐飞虱基因Bph3[4]。进一步对Bph3位点凝集素类受体蛋白激酶(lectin receptor kinase)OsLecRK基因簇测序分析发现, 'BP360e’和'Rathe Heenati’中的OsLecRK3的氨基酸序列完全一致, 而OsLecRK1和OsLecRK2在2个品种中分别存在1处氨基酸的差异, 它们与感虫品种'9311’和'02428’的差异较大。而OsLecRK4因第471位碱基的缺失, 导致其在'BP360e’中翻译提前终止。据此推测, QBph4可能为Bph3的1个新的等位基因, 'BP360e’对褐飞虱的抗性可能是由于OsLecRK4的翻译提前终止及OsLecRK1和OsLecRK2两处氨基酸差异造成的。
相对植物抗病研究, 植物的抗虫研究较为滞后。笔者也研究报道了籼稻抗白背飞虱的QTL定位[24]。有研究发现刺吸式害虫取食可引起植物产生与病原菌侵染类似的抗性反应, 植物对病原菌和刺吸式害虫的抗性存在一定程度的交叉。植物对病原菌的先天免疫系统分为效应子激发的免疫响应(effector-triggered immunity, ETI)和病原体相关分子模式介导的免疫应答反应(patterns-triggered immunity, PTI)。诱导植物ETI的R蛋白大多属于NBS-LRR蛋白家族。目前已克隆的多个抗褐飞虱基因, 如Bph14、Bph18、Bph9和Bph26等均编码NB-CC-LRR蛋白, 暗示ETI可能也参与了植物的抗褐飞虱反应。R蛋白介导的ETI存在基因对基因的关系, 常因病原菌效应子变异导致抗性丧失。相对于ETI, 由病原菌或细菌相关分子模式(pathogen or microbe associated molecular patterns, PAMP or MAMP)诱导产生的PTI抗性更为持久。PAMP or MAMP一般是由细胞膜上的模式识别受体(pattern recognition receptors, PRR)识别, 再激活下游的免疫反应。目前鉴定的大多数PRR蛋白都属于类受体蛋白激酶(receptor-like kinases, RLK)[25-26]。越来越多的研究表明, 凝集素类受体蛋白激酶(LecRK)作为一类RLK, 不仅参与了植物的生长发育调控, 而且在植物耐盐等非生物胁迫、抗病虫等反应中具有重要作用[27]。Bph3对目前鉴定的绝大多数褐飞虱致害性种群均表现较高的抗性, 且携带该基因的品种在菲律宾等地区种植了近30年, 仍然保持较高的抗性, 表明Bph3为一持久、广谱抗褐飞虱基因。Liu等[4]完成了该基因的图位克隆, 发现Bph3位点包含1个由4个OsLecRK组成的抗性基因簇, 其抗性由4个基因共同控制。该基因的克隆暗示PTI可能作为重要组成部分也参与了植物对刺吸类昆虫的抗性反应。LecRK一般包含胞外凝集素域、跨膜域和细胞质激酶域3个结构域。通常认为LecRK的胞外凝集素结构域参与PAMP或MAMP的识别, 在LecRK介导的防御反应中具有重要作用。如拟南芥LecRK-I.9被证实为胞外ATP的受体, 通过胞外凝集素结构域结合胞外ATP触发钙离子内流, 激活下游抗性反应[28]。'BP360e’和'Rathe Heenati’中OsLecRK1和OsLecRK2分别在胞外凝集素结构域存在一处氨基酸的差异, 该氨基酸的差异是否影响其对不同褐飞虱致害性种群释放的相关分子模式的识别, 从而影响其对不同褐飞虱致害性种群的抗性, 有待进一步研究。
本研究利用籼稻品种'BP360e’发掘了1个抗褐飞虱主基因, 分析表明该基因可能为Bph3的1个新的等位基因。该基因的发掘不仅为利用分子标记辅助选择培育抗褐飞虱水稻新品种, 同时为深入研究Bph3的功能, 解析水稻抗褐飞虱的分子机制提供了有用的基因资源。
致谢: 农业部长江中下游粳稻生物学与遗传育种重点实验室/长江流域杂交水稻协同创新中心/江苏省现代作物生产中心对本研究给予资助。
| [1] |
程遐年, 吴进才, 马飞. 褐飞虱研究与防治[M]. 北京: 中国农业出版社, 2003: 27-58. Cheng X N, Wu J C, Ma F. Research and prevention of brown planthopper[M]. Beijing: China Agriculture Press, 2003: 27-58 (in Chinese). |
| [2] |
王彦华, 王强, 沈晋良, 等. 褐飞虱抗药性研究现状[J]. 昆虫知识, 2009, 46(4): 518-524. Wang Y H, Wang Q, Shen J L, et al. Current status of insecticide resistance in the brown planthopper, Nilaparvata lugens[J]. Chinese Bulletin of Entomology, 2009, 46(4): 518-524 (in Chinese with English abstract). DOI:10.3969/j.issn.0452-8255.2009.04.004 |
| [3] |
王鹏, 甯佐苹, 张帅, 等. 我国主要稻区褐飞虱对常用杀虫剂的抗性监测[J]. 中国水稻科学, 2013(2): 191-197. Wang P, Ning Z P, Zhang S, et al. Resistance monitoring to conventional insecticides in brown planthopper, Nilaparvata lugens in main rice growing regions in China[J]. Chinese Journal of Rice Science, 2013(2): 191-197 (in Chinese with English abstract). DOI:10.3969/j.issn.1001-7216.2013.02.012 |
| [4] |
Liu Y, Wu H, Chen H, et al. A gene cluster encoding lectin receptor kinases confers broad-spectrum and durable insect resistance in rice[J]. Nature Biotechnology, 2015, 33(3): 301-305. DOI:10.1038/nbt.3069 |
| [5] |
Shang G X, Zhang J, Liu B, et al. A mucin-like protein of planthopper is required for feeding and induces immunity response in plants[J]. Plant Physiology, 2018, 176(1): 552-555. DOI:10.1104/pp.17.00755 |
| [6] |
Zhao Y, Huang J, Wang Z, et al. Allelic diversity in an NLR gene BPH9 enables rice to combat planthopper variation[J]. Proc Natl Acad Sci USA, 2016, 113(45): 12850-12855. DOI:10.1073/pnas.1614862113 |
| [7] |
Ren J, Gao F, Wu X, et al. Bph32, a novel gene encoding an unknown SCR domain-containing protein, confers resistance against the brown planthopper in rice[J]. Scientific Reports, 2016, 6(1): 37645. DOI:10.1038/srep37645 |
| [8] |
Guo J, Xu C, Wu D, et al. Bph6 encodes an exocyst-localized protein and confers broad resistance to planthoppers in rice[J]. Nature Genetics, 2018, 50(2): 297-306. DOI:10.1038/s41588-018-0039-6 |
| [9] |
Cha Y S, Ji H, Yun D W, et al. Fine mapping of the rice bph1 gene, which confers resistance to the brown planthopper, and development of STS markers for marker-assisted selection[J]. Molecular Cell, 2008, 26(2): 146-151. |
| [10] |
Du B, Zhang W, Liu B, et al. Identification and characterization of Bph14, a gene conferring resistance to brown planthopper in rice[J]. Proc Natl Acad Sci USA, 2009, 106(52): 22163-22168. DOI:10.1073/pnas.0912139106 |
| [11] |
Tamura Y, Hattori M, Yoshioka H, et al. Map-based cloning and characterization of a brown planthopper resistance gene BPH26 from Oryza sativa L. ssp. indica cultivar ADR52[J]. Scientific Reports, 2015, 4(1): 5872. DOI:10.1038/srep05872 |
| [12] |
Wang Y, Cao L, Zhang Y, et al. Map-based cloning and characterization of BPH29, a B3 domain-containing recessive gene conferring brown planthopper resistance in rice[J]. Journal of Experimental Botany, 2015, 66(19): 6035-6045. DOI:10.1093/jxb/erv318 |
| [13] |
Ji H, Kim S R, Kim Y H, et al. Map-based cloning and characterization of the BPH18 gene from wild rice conferring resistance to brown planthopper(BPH) insect pest[J]. Scientific Reports, 2016, 6(1): 36688. DOI:10.1038/srep36688 |
| [14] |
肖聪.水稻褐飞虱抗性基因的遗传定位及近等基因系的构建和抗性评价[D].武汉: 华中农业大学, 2017: 21-36. Xiao C. Mapping brown planthopper resistance genes and development and evaluation of near isogenic lines for brown planthopper resistance in rice[D]. Wuhan: Huazhong Agricultural University, 2017: 21-36(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10504-1017171670.htm |
| [15] |
周亦红, 韩召军. 褐飞虱生物型研究进展:致害性变异的遗传机制[J]. 昆虫知识, 2003, 40(3): 199-203. Zhou Y H, Han Z J. The brown planthopper biotypes:on the genetic mechanism of virulence[J]. Entomological Knowledge, 2003, 40(3): 199-203 (in Chinese with English abstract). DOI:10.3969/j.issn.0452-8255.2003.03.002 |
| [16] |
任西明, 向聪, 雷东阳, 等. 水稻抗褐飞虱育种研究进展与展望[J]. 作物研究, 2017, 31(4): 453-457. Ren X M, Xiang C, Lei D Y, et al. Present status and prospect of resistance breeding of brown planthopper in rice[J]. Crop Research, 2017, 31(4): 453-457 (in Chinese with English abstract). |
| [17] |
Kumar K, Sarao P S, Bhatia D, et al. High resolution genetic mapping of a novel brown planthopper resistance locus, Bph34 in Oryza sativa L.×Oryza nivara(Sharma & Shastry) derived interspecifc F2 population[J]. Theoretical and Applied Genetics, 2018, 131(5): 1163-1171. DOI:10.1007/s00122-018-3069-7 |
| [18] |
Huang D, Qiu Y, Zhang Y, et al. Fine mapping and characterization of BPH27, a brown planthopper resistance gene from wild rice(Oryza rufipogon Griff.)[J]. Theoretical and Applied Genetics, 2013, 126(1): 219-229. DOI:10.1007/s00122-012-1975-7 |
| [19] |
Qiu Y, Guo J, Jing S, et al. High-resolution mapping of the brown planthopper resistance gene Bph6 in rice and characterizing its resistance in the 9311 and Nipponbare near isogenic backgrounds[J]. Theoretical and Applied Genetics, 2010, 121(8): 1601-1611. DOI:10.1007/s00122-010-1413-7 |
| [20] |
IRRI. Standard Evaluation System For Rice[M]. Manila: International Rice Research Institute, Philippines, 1988: 1-56.
|
| [21] |
刘仁虎, 孟金陵. MapDraw, 在Excel中绘制遗传连锁图的宏[J]. 遗传, 2003, 25(3): 317-321. Liu R H, Meng J L. MapDraw:a Microsoft Excel macro for drawing genetic linkage maps based on given genetic linkage data[J]. Hereditas, 2003, 25(3): 317-321 (in Chinese with English abstract). DOI:10.3321/j.issn:0253-9772.2003.03.019 |
| [22] |
高希武, 彭丽年, 梁帝允. 对2005年水稻褐飞虱大发生的思考[J]. 植物保护, 2006, 32(2): 23-24. Gao W X, Peng L N, Liang D Y. Factors causing the outbreak of brown planthopper(BHP), Nilapavata lugens Stål in China in 2005[J]. Plant Protection, 2006, 32(2): 23-24 (in Chinese with English abstract). DOI:10.3969/j.issn.0529-1542.2006.02.006 |
| [23] |
陈建明.水稻品种对褐飞虱为害的耐性及其生理机制研究[D].杭州: 浙江大学, 2004: 19-41. Chen J M. Tolerance of rice varieties to the brown planthopper, Nilaparvata lugens Stål and its physiological[D]. Hangzhou: Zhejiang University, 2004: 19-41(in Chinese with English abstract). |
| [24] |
沈子杰, 范德佳, 何俊, 等. 籼稻品种'IR13427-45-2-1-2-2-2'抗白背飞虱QTL定位[J]. 南京农业大学学报, 2017, 40(6): 957-962. Shen Z J, Fan D J, He J, et al. Mapping of the quantitative trait locus conferring white-backed planthopper resistance in indica cultivar 'IR13427-45-2-1-2-2-2'[J]. Journal of Nanjing Agricultural University, 2017, 40(6): 957-962. DOI:10.7685/jnau.201704027 |
| [25] |
吴寒.水稻抗褐飞虱基因Bph3的图位克隆和功能研究[D].南京: 南京农业大学, 2013: 8-37. Wu H. Map-based cloning and functional analysis of brown planthopper resistance gene Bph3 in rice[D]. Nanjing: Nanjing Agricultural University, 2013: 8-37(in Chinese with English abstract). |
| [26] |
Lehti-Shiu M D, Shiu S H. Diversity, classification and function of the plant protein kinase superfamily[J]. Philosophical Transactions of the Royal Society B, 2012, 367(1602): 2619-2639. DOI:10.1098/rstb.2012.0003 |
| [27] |
Vaid N, Pandey P K, Tuteja N. Genome-wide analysis of lectin receptor-like kinase family from Arabidopsis and rice[J]. Plant Molecular Biology, 2012, 80(4/5): 365-388. |
| [28] |
Choi J, Tanaka K, Cao Y R, et al. Identification of a plant receptor for extracellular ATP[J]. Science, 2014, 343(6168): 290-294. DOI:10.1126/science.343.6168.290 |




