文章信息
- 刘红林, 孟繁星
- LIU Honglin, MENG Fanxing
- 氧化应激对动物有腔卵泡闭锁的影响及机制
- Effect of oxidative stress on antral follicular atresia in animals and its mechanism
- 南京农业大学学报, 2019, 42(1): 6-13
- Journal of Nanjing Agricultural University, 2019, 42(1): 6-13.
- http://dx.doi.org/10.7685/jnau.201803060
-
文章历史
- 收稿日期: 2018-03-30
氧化应激是指体内、外不良刺激造成机体氧化自由基的产生与抗氧化防御之间严重失衡, 从而导致组织与细胞氧化损伤的现象。诱发氧化应激的自由基主要为活性氧(ROS), 低浓度的ROS是重要的第二信使, 调控基因的表达; 高浓度的ROS引起氧化应激。氧化应激被认为是损伤动物繁殖性能和造成人类不孕不育的重要因素。对于家养动物而言, 随着我国养殖业集约化程度的提高, 养殖环境与动物生物学特性的背离增加, 从而造成环境应激的增加, 养殖生产中的多种环境应激往往造成机体与组织氧化自由基的升高, 氧化应激是多种应激因素损害繁殖性能的共同机制; 动物繁殖活动伴随氧化应激水平升高, 因此, 氧化应激被认为是动物繁殖的代价。卵泡发育与闭锁是动物繁殖的生理基础, 氧化应激对卵泡发育与闭锁的影响受到了研究人员的重点关注。氧化应激损伤细胞增殖能力, 诱导细胞凋亡, 因而氧化应激诱导卵泡闭锁可能是其影响卵泡发育的重要途径。现将氧化应激影响动物有腔卵泡闭锁的相关研究进展综述如下。
1 卵泡闭锁实质是卵泡颗粒细胞的凋亡卵泡闭锁是指卵泡退化从卵巢消失的现象。卵泡闭锁是一个广泛发生的生殖生理现象, 是绝大部分卵泡命运的终点; 在哺乳动物和人类, 70.0%~99.9%的卵泡在发育的不同阶段发生闭锁。以猪为例, 99%以上的卵泡在生长发育过程中闭锁消失, 并且大部分卵泡在直径达到6 mm前消失[1]。猪原始卵泡需要84 d才能生长发育成三级卵泡, 三级卵泡再经过19 d的生长达到排卵前的体积, 直径约为10 mm[2]。三级卵泡的选择大约发生在发情周期的第13~14天(发情周期为21 d), 在卵泡最后成熟期间三级卵泡的直径从3 mm增长为10 mm, 平均每天增加1.14 mm[3]。在发情周期第16天, 猪卵巢大约有160~200个三级卵泡[4], 有150~190个卵泡通过闭锁退化从卵巢消失[5], 在发情周期的第21天, 大约有10个成熟卵泡排卵。在发情周期的第16天, 梅山母猪比大约克母猪拥有更多的三级卵泡, 而发情周期第16~19天消失的闭锁卵泡数则是大约克猪显著多于梅山猪, 因此梅山猪较高的排卵率可能归因于其较多的卵泡募集与较少的卵泡闭锁[6]。与梅山猪相反, Mangalica猪排卵率与产仔数(窝产仔约5头)远低于大约克猪, 其卵泡期募集卵泡数少于大约克猪, 而闭锁卵泡数则高于大约克猪。
长期以来人们围绕卵泡闭锁进行了大量的研究工作。早期的研究主要集中在卵泡闭锁的形态学以及生化特征变化上, 主要包括:不同程度闭锁卵泡的外部形态变化; 卵巢组织学变化; 激素以及生长因子等水平的变化[5, 7]。随着对卵泡闭锁研究的深入, 人们发现卵泡闭锁伴随着卵泡颗粒细胞调亡。卵泡闭锁时颗粒细胞凋亡表现为DNA规律性降解, 切口端标记技术(TUNEL)染色阳性, 半胱天冬酶(Caspase)被激活以及凋亡蛋白1(Fas)和类胰岛素结合蛋白5(IGFBP-5)等细胞凋亡标记表达。此外, 还发现卵泡闭锁过程中颗粒细胞DNA合成下降, 间隙连接蛋白、芳香化酶和促性腺激素受体表达减少等[8]。进一步研究发现, 颗粒细胞凋亡的出现远早于卵泡闭锁的形态学变化, 颗粒细胞凋亡达到一定程度后才表现为卵泡闭锁现象, 由此确认卵泡闭锁的实质就是颗粒细胞凋亡。从此, 卵泡闭锁的研究进入了一个全新阶段, 即卵泡闭锁过程中颗粒细胞凋亡的分子机制研究阶段。该阶段的研究结果可以总结为[9-10]:1)众多分子参与卵泡凋亡过程, 比如Fas、Caspases、肿瘤坏死因子(TNF)、蛋白酶激活受体4(Par4)、p53(一种肿瘤抑制蛋白)、抑制素(prohibitin)、内皮素(endothelins)、激活素(activin)、原癌基因产物(cMyc)、干扰素(IFN)、干细胞因子(SCF)、同源盒蛋白(NOBOX)等; 2)这些分子既包括促进存活分子, 如SCF、activin、NOBOX等, 也包括促凋亡的分子, 如Caspases、p53、cMyc、Fas及抑制素等; 3)卵泡闭锁与否依赖于这些分子间精确的平衡关系, 而这种平衡关系受到精细的分子调控, 这些调控因子既有促性腺激素释放激素(GnRH)、促卵泡素(FSH)、促黄体素(LH)、性腺激素、抑制素等生殖激素, 也包括类胰岛素生长因子(IGF)、类胰岛素生长因子结合蛋白(IGFBP)、表皮生长因子(EGF)、转化生长因子(TGF)等细胞因子以及其他因子, 如存在于颗粒细胞中的卵巢卵泡液多肽(oFFR)、存在于卵母细胞中的组织型纤溶酶激活因子(tPA)等。
卵泡闭锁的表观遗传学调控也有一些研究报道, 主要集中在卵泡闭锁的miRNA调控方面。2017年Worku等[11]系统总结了miRNA调控卵泡闭锁的研究进展(表 1)。我们课题组也开展了一些对于猪卵泡闭锁的miRNA调控的研究, 主要包括:采用miRNA芯片筛选出了数十个与猪卵泡闭锁相关的miRNA, 并对部分miRNA影响颗粒细胞凋亡的机制进行了深入研究, 如发现miR-26b通过抑制靶基因ATM和Smad4的表达促进猪卵泡颗粒细胞凋亡[12-13], let-7g通过靶向MAP3K1和TGFβR1诱导猪卵泡颗粒细胞凋亡[14-15], miR-92a通过靶向Smad7抑制猪卵泡颗粒细胞凋亡[16]。
| miRNA名称 Name of miRNA |
在凋亡/闭锁中的作用 Role in apoptosis/atresia |
靶基因 Target gene |
模型动物 Model animal |
| let-7g | 抑制TGF-β1活性, 诱导颗粒细胞凋亡 抑制MAPK1活性, 诱导颗粒细胞凋亡 |
TGFβR1 MAP3K1 |
猪猪 |
| miR-125a | 增加Caspase-3裂解, 促进颗粒细胞凋亡 | STAT3 | 小鼠 |
| miR-34a | 抑制INHBB, 促进颗粒细胞凋亡 | INHBB | 猪 |
| miR-22 | 抑制SIRT1与细胞凋亡 | SIRT1 | 小鼠 |
| miR-23a、miR-27a | 增加Caspase-8与Caspase-3裂解, 促进颗粒细胞凋亡 | Smad5 | 人类 |
| miR-23a | 增加Caspase-3裂解, 降低Caspase-3蛋白表达量, 促进颗粒细胞凋亡 | XIAP | 人类 |
| miR-26b | 增加DNA断裂, 抑制ATM功能, 促进颗粒细胞凋亡 抑制BCL-2与SMAD4功能, 促进颗粒细胞凋亡 抑制HAS2, 提高Caspase-3, 促进颗粒细胞凋亡 |
ATM Smad4 HAS2 |
猪 猪 猪 |
| miR-92a | 抑制SMAD7, 抗细胞凋亡 | Smad7 | 猪 |
| miR-21 | 减少Caspase-3裂解, 抑制凋亡 | 小鼠 |
动物卵泡闭锁研究虽已取得重大进展, 但对卵泡闭锁与颗粒细胞凋亡的机制尚缺乏根本性认识, 主要是没有能够回答"何种因素选择性地启动了部分卵泡闭锁?"这一核心问题。
2 氧化应激可能是动物有腔卵泡闭锁的启动因素就有腔卵泡而言, 近年来的氧化应激与卵泡凋亡相关性研究结果提示, 氧化应激可能是有腔卵泡选择性闭锁的启动因素。该假说基于以下试验证据:1)有腔卵泡生长发育过程中伴随氧化自由基的大量产生; 2)体内、外氧化应激能够有效诱导卵泡颗粒细胞凋亡以及卵泡闭锁; 3)对抗氧化酶基因敲除母鼠卵巢发育检测证实, 多种抗氧化酶对卵泡的发育与生存具有重要调控作用; 4)氧化应激诱导剂, 如γ射线、化疗药物、多环芳香烃等能够有效诱导有腔卵泡凋亡, 而卵泡促凋亡信号出现之前首先检测到ROS水平的显著上升, 并且这些因素诱导的凋亡均能为抗氧化剂所抑制。详细的试验证据论述如下。
2.1 家畜卵泡发育过程伴随活性氧簇(ROS)的大量产生活性氧(ROS)是生物体在有氧代谢过程中产生的中间产物。卵泡是周期性生长发育的组织, 卵泡生长发育过程中, 卵母细胞直径不断增大, 颗粒细胞增殖与基础代谢十分活跃, 这为活性氧的大量产生提供了条件。同时, 卵巢为类固醇激素生成组织, 而类固醇激素生成相关芳香族酶P450对颗粒细胞产生ROS具有促进作用[17]。此外, 由于卵泡血管不能穿透基底膜进入颗粒细胞层, 从而造成氧分压随着颗粒细胞层增厚不断下降[18], 而氧分压的下降可以通过NADH和DADPH氧化酶造成超氧阴离子水平的上升[19]。卵泡发育过程伴随ROS的大量产生已为近期的试验结果所证实。Gupta等[20]发现, 发情周期不同阶段、不同大小的牛有腔卵泡中卵泡液的H2O2水平平均值都超过1 000 ng·mL-1。Margo等[21]在牛卵泡液中也检测到类似浓度的H2O2水平, 两项研究均发现, 牛健康有腔卵泡间卵泡液H2O2水平差异巨大, 最大值与最小值相差10倍以上。人类健康卵泡每400 μL卵泡液ROS平均浓度达到95 cps(每秒光子数, 化学发光法标定ROS浓度单位)以上[22], 而每400 μL卵泡液的ROS浓度107 cps被认为是损伤卵母细胞发育能力的临界值[23]。对猪卵泡液ROS水平的测定目前仅见1篇报道:在猪卵巢各选择12个不同大小的卵泡测定卵泡液ROS水平, 发现小卵泡(直径小于3 mm)、中卵泡(3~5 mm)、大卵泡(大于5 mm)卵泡液H2O2平均水平分别为10.7、8.5和7.5 μmol·L-1[24]。然而, 我们课题组对猪卵泡液H2O2水平的测定未能重复出上述结果, 相反, 我们检测发现健康卵泡的卵泡液H2O2平均水平高达98.2 μmol·L-1, 不同卵泡间差异巨大, 变异范围为18.3~272.1 μmol·L-1; 还发现100 μmol·L-1H2O2能够有效诱导体外培养猪颗粒细胞的凋亡。
2.2 氧化应激对卵泡闭锁具有重要的调控作用氧化应激损害卵泡发育已为一系列研究所证实。抗氧化相关基因敲除小鼠模型的建立为研究氧化应激对卵泡发育的影响提供了良好条件。Matzuk等[25]报道, 超氧化物歧化酶基因(sod1)敲除成年母鼠卵巢上排卵前卵泡数以及黄体数减少, 而Ho等[26]则在sod1敲除母鼠上观察到附植后胚胎死亡率提高。超氧化物歧化酶的铜伴侣蛋白敲除小鼠的SOD1铜结合能力下降, 该基因敲除对母鼠繁殖性能的影响与Matzuk等[25]在sod1基因敲除鼠的发现一致:有腔卵泡发育异常, 无黄体出现, 可见, SOD1对有腔卵泡的发育具有重要作用。γ-谷酰基转肽酶1基因敲除小鼠母鼠繁殖性能出现严重障碍, 缺乏大的有腔卵泡、黄体以及对促性腺激素的反应; 进一步检测发现, 卵巢半胱氨酸(抗氧化氨基酸)水平下降, 而且母鼠繁殖性能的异常完全能够为添加半胱氨酸所挽救[27-28]。谷氨酸、半胱氨酸连接酶为GSH合成的限速酶, 是由催化亚基和调节亚基构成的异二聚体, 调节亚基敲除纯合子小鼠卵巢的GSH含量与野生型小鼠相比下降20%, 成年鼠卵巢凋亡颗粒细胞比例显著上升, 由氧化应激引起的卵巢老化加快, 母鼠繁殖能力下降[29]。对以上基因小鼠模型的研究均证明抗氧化能力的下降与有腔卵泡的凋亡相关。另一方面, 在gpx1(谷胱甘肽过氧化物酶1)、catalase(过氧化氢酶)、sod2等基因敲除鼠中未能检测到母鼠繁殖性能的显著变化, 似乎说明卵巢与抗氧化物之间存在补偿等复杂的相互作用[30]。
除了遗传修饰小鼠模型外, 大量研究也证实了氧化应激对有腔卵泡的促凋亡作用。我们课题组利用小鼠卵巢特异性氧化应激模型研究发现, 卵巢氧化应激显著促进了卵巢颗粒细胞凋亡与大卵泡闭锁, 并且发现卵泡氧化应激影响了卵母细胞的体内、外发育能力[31]。一系列研究表明, ROS参与了多种化学与物理试剂引起的有腔卵泡凋亡的启动[32]。化学试剂, 如环磷酰胺、二甲基苯并蒽、甲氧滴滴涕等增加了促凋亡信号, 而这种促凋亡信号的增加是在卵泡ROS水平上升以及诱发氧化应激后发生的, 而且这些化学试剂诱导的凋亡增加能够为抗氧化剂所抑制[30]。GSH在卵泡抗凋亡中具有重要作用, 小鼠与大鼠卵巢GSH含量约3~4 μmol·mg-1。在成年大鼠的发情周期或动情前期采用GSH合成特异性抑制剂BSO(丁硫氨酸亚砜胺)处理2次(间隔12 h, 剂量5 μmol·kg-1), 卵巢组织GSH浓度与对照组相比下降50%以上, 导致卵泡闭锁率显著上升[33]。卵泡体外培养试验也证明, GSH在阻止有腔卵泡闭锁方面具有重要作用。在无促性腺激素的培养基中, 大鼠大、小有腔卵泡自发闭锁, 而添加FSH能够有效阻止这些卵泡凋亡的启动。卵泡培养液中促卵泡素(FSH)的撤除导致卵泡液ROS水平显著升高, 而且ROS水平升高早于任何凋亡信号的出现, 提示氧化应激启动了凋亡信号[34-35]。FSH抑制了大卵泡中ROS的生成, 促进GSH的生成。在卵泡培养液中添加GSH抑制剂BSO能够显著抑制FSH对卵泡颗粒细胞的抗凋亡作用。并且, 在不含促性腺激素的培养基中添加抗氧化剂(如SOD、过氧化氢酶、N-乙酰基半胱氨酸等)能够阻止大有腔卵泡凋亡的发生。
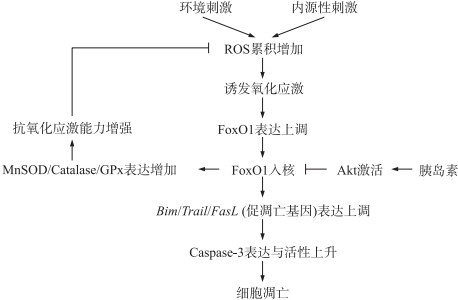
3 氧化应激诱导有腔卵泡闭锁的分子机制氧化应激诱导卵泡颗粒细胞凋亡的机制研究已取得重要进展。我们课题组研究发现, 叉头盒转录因子O1(FoxO1)是氧化应激诱导卵泡颗粒细胞凋亡的关键调控因子[36](图 1)。试验表明:小鼠腹腔注射诱导剂过氧化氢或3-硝基丙酸(3-NPA)后, 卵泡颗粒细胞内ROS水平显著升高, 对卵巢切片进行TUNEL染色, 发现伴随着颗粒细胞ROS水平的升高, 卵泡颗粒细胞凋亡和卵泡闭锁率上升; 与此同时免疫组织化学检测到FoxO1蛋白在处理小鼠卵巢卵泡颗粒细胞中大量表达, RT-PCR检测到FoxO1下游凋亡相关基因表达水平显著升高。上述试验结果提示, FoxO1可能在氧化应激引起的卵泡颗粒细胞凋亡中发挥重要作用。使用过氧化氢处理体外培养小鼠卵泡颗粒细胞, 诱发细胞ROS水平和凋亡率显著升高并呈剂量依赖效应。氧化应激处理, 不仅引起了FoxO1 mRNA和蛋白表达水平显著上升, 而且检测到FoxO1蛋白大量入核和FoxO1下游凋亡相关基因表达显著提高。采用RNAi敲减FoxO1表达后, 氧化应激诱导的颗粒细胞凋亡大幅下降, FoxO1蛋白入核显著减少, 下游凋亡相关基因的表达水平下降。FoxO1在氧化应激诱导的颗粒细胞凋亡中的关键性作用为胰岛素试验所证实:颗粒细胞在氧化应激协迫后采用胰岛素处理, FoxO1磷酸化增加, 蛋白质出核失活, 与此相一致, 颗粒细胞凋亡率和凋亡相关基因的表达显著下降。进一步研究发现, 氧化应激诱导的FoxO1表达上调与入核受到C-Jun氨基末端激酶(JNK)的调控。JNK, 又名SAPK(应激蛋白活化激酶), 可以为多种环境应激所激活。试验证实, 体外培养的卵泡颗粒细胞中JNK活性能够为H2O2所激活, 并且具有剂量依赖效应, 采用JNK抑制剂抑制其活性后, 氧化应激诱导的FoxO1表达上调, 入核以及颗粒细胞凋亡均显著下降[37]。虽然已有研究证明, JNK调控了FoxO4 Thr447和Thr451的磷酸化, 但调控FoxO1出入核的2个关键磷酸化位点Ser256和Ser319却不受JNK调控[38]。有研究报道, 14-3-3蛋白具有辅助FoxO1细胞质定位的功能, 而14-3-3蛋白Ser186位点的磷酸化受JNK调控[39]。最近的研究表明, 卵泡颗粒细胞中14-3-3蛋白与FoxO1存在相互结合, 氧化应激处理后两者的结合减少, 并且JNK激酶活性抑制剂能够显著抑制氧化应激引起的14-3-3蛋白与FoxO1的分离, 因此, 氧化应激诱导颗粒细胞FoxO1入核的机制可能是氧化应激通过激活JNK活性导致14-3-3蛋白与FoxO1的分离, 从而促进FoxO1入核[40]。
卵泡液是有腔卵泡生长发育的微环境, 已经发现卵泡液中的多种因子对卵泡的发育与闭锁具有调控作用, 部分因子能够调控颗粒细胞对氧化应激的反应。卵巢卵泡含有丰富的抗氧化物, 调控卵泡氧化与抗氧化平衡。卵泡抗氧化物包括非酶类(维生素C、维生素E以及半胱氨酸、谷胱苷肽)和酶类, 后者如超氧化物歧化酶(SOD)、谷胱苷肽过氧化物酶(GPx)、谷胱苷肽-S-转移酶(GST)、过氧化氢酶(CAT)、过氧化物还原酶(PRDX)、硫氧化还原蛋白(TXN)[22]。对猪卵泡而言, 主要的酶类抗氧化物包括SOD、GPx、CAT, SOD负责清除超氧阴离子并生成H2O2, 而H2O2的清除则由GPx和/或CAT催化完成; 非酶类抗氧化物包括维生素C、维生素E、半胱氨酸、谷胱苷肽等, 维生素E与维生素C可以直接与ROS反应, 消除氧化毒害作用, 而GSH既可以与ROS直接化学反应, 清除自由基, 也可以作为过氧化物酶的还原剂发挥作用[24]。卵巢卵泡的抗氧化系统直接影响卵泡ROS的种类与水平, 从而可能对颗粒细胞的凋亡产生不同的影响。近年来, 卵泡液中高水平褪黑素的抗氧化作用引起关注。松果体是褪黑素合成与分泌的主要器官, 然而最近研究发现生殖系统局部(如卵母细胞)也具有合成褪黑素的能力[41]。Tamura等[42-43]研究发现, 人排卵前卵泡液中褪黑素水平显著高于同期血清中的水平, 并且与卵泡体积大小正相关。卵巢局部高水平褪黑素已被证明可通过抑制氧化损伤促进排卵前卵泡的发育以及通过上调颗粒细胞LH受体的表达水平促进排卵[44]。研究证实, 褪黑素能够提高猪、牛、羊卵母细胞的成熟质量, 并且能够通过抑制细胞凋亡和上调谷胱甘肽的表达, 缓解热应激对猪卵母细胞的氧化损伤[45-48]。
FSH已被证明能够保护卵泡颗粒细胞免受氧化损伤[49-50]。FSH保护作用的发挥至少存在2种机制:抑制凋亡途径和抑制自噬途径。体内、外试验证实, FSH能够显著抑制氧化应激诱导的小鼠颗粒细胞凋亡, 并且这种抑制作用是通过提高颗粒细胞氧化应激耐受程度实现的。具体的机制可能是:FSH显著抑制了氧化应激诱导的颗粒细胞FoxO1表达水平的上调, 而FoxO1是氧化应激诱导颗粒细胞凋亡关键性调控因子; 不仅如此, FSH还通过改变FoxO1磷酸化抑制该蛋白的活性。采用FSH信号通路的抑制剂抑制蛋白激酶A(PKA)、磷脂酰肌醇3激酶(PI3K)或者蛋白激酶B(AKT)的活性, 从而抑制FSH对颗粒细胞凋亡的挽救以及对FoxO1的下调作用, 而且抑制PKA或PI3K活性阻断了FSH对AKT的激活作用; 与此相一致, AKT的3个作用位点替代后的FoxO1, 其活性不受FSH调控。颗粒细胞过表达外源FoxO1促进了内源FoxO1的表达, 荧光素酶载体试验与ChIP试验均证明FoxO1能够与自身基因的启动子结合。以上试验结果证明, FSH通过PKA-PI3K-AKT-FoxO1信号通路以及FoxO1-FoxO1自身正反馈下调FoxO1依赖的颗粒细胞凋亡(图 2)。
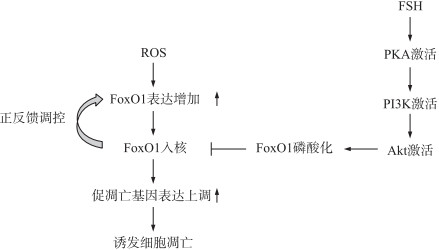
|
图 2 促卵泡素(FSH)通过抑制卵泡颗粒细胞凋亡抵抗氧化损伤的分子机制 Fig. 2 Molecular mechanism of follicle-stimulating hormone(FSH) against oxidative damagein follicular granulosa cells by repressing apoptosis |
FSH还可以通过调控一些新的信号分子抑制氧化应激诱导的颗粒细胞自噬, 从而减少颗粒细胞的氧化损伤[50-51]。体内、外FSH处理显著抑制了氧化应激导致的细胞活力下降以及细胞自噬活性的提高; 并且自噬抑制剂处理对细胞活力下降的抑制作用与FSH处理的效果类似, 而在自噬抑制剂处理后FSH对细胞活力的提升作用消失。进一步研究发现, FSH对颗粒细胞自噬的抑制依赖PI3K-AKT-mTOR信号通路, 并且PI3K-AKT还通过磷酸化靶蛋白FoxO1影响颗粒细胞自噬活性对FSH的响应; 此外, FSH通过抑制FoxO1的乙酰化解除其与Atg蛋白的相互作用, 从而抑制自噬的发生(图 3)。
在卵泡体外培养试验中, 同样观察到FSH对颗粒细胞凋亡与卵泡闭锁的抑制作用, 不同的是添加FSH降低了卵泡液ROS水平, 这种作用可能归因于FSH对GSH合成的促进作用[34]。卵泡液中存在的另一种繁殖激素雌二醇(E2)也被认为对卵泡氧化应激与颗粒细胞凋亡产生影响, 在小鼠有腔卵泡体外培养液中添加大剂量的E2能够降低卵泡ROS水平, 抑制卵泡闭锁的发生; 而添加孕酮、睾酮、皮质醇等则无影响[52]。
卵巢产生的类胰岛素生长因子1(IGF-1)及类胰岛素生长因子结合蛋白(IGFBP)在卵泡发育中起重要作用[53]。卵泡颗粒细胞存在IGF-1受体, 而在卵泡液中检测到颗粒细胞合成的IGFBP, 并且IGFBP-2在闭锁卵泡中的浓度高于健康卵泡。已经证明IGF-1能够抑制卵泡颗粒细胞凋亡, 而存在于卵泡液中的IGFBP能够中和IGF-1, 解除其对颗粒细胞凋亡的抑制作用。卵泡液存在的EGF、TGF-α也被证明对体外培养的颗粒细胞凋亡具有抑制作用, 利用酪氨酸激酶抑制剂阻断这2个因子的信号转导通路能够完全解除它们的凋亡抑制作用[54]。卵泡液中对卵泡凋亡具有重要调控作用的生长因子(IGF-1、EGF、TGF-α等)是否影响颗粒细胞对氧化应激的反应尚未见研究报道, 有待进一步研究阐明。
总之, 氧化应激是动物有腔卵泡闭锁的重要诱导因素。一方面, 氧化应激通过上调转录因子FoxO1在卵泡颗粒细胞中的表达与入核, 诱导下游细胞凋亡相关基因的表达, 从而导致颗粒细胞的凋亡与卵泡闭锁; 另一方面, 卵泡的氧化损伤受到卵泡液因子的复杂调控, FSH是卵泡发育最为重要的调控因子, 其可通过抑制自噬与抑制凋亡途径减轻卵泡颗粒细胞的氧化损伤。
| [1] |
Grant S A, Hunter M G, Foxcroft G R. Morphological and biochemical characteristics during ovarian follicular development in the pig[J]. J Reprod Fertil, 1989, 86: 171-183. DOI:10.1530/jrf.0.0860171 |
| [2] |
Morbech D E, Esbenshade K L, Flowers W L, et al. Kinetics of follicle growth in the prepuberal gilt[J]. Biol Reprod, 1992, 47: 485-491. DOI:10.1095/biolreprod47.3.485 |
| [3] |
Dailey R A, Clark J R, Staigmiller R B, et al. Growth of new follicles following electrocautery in four genetic groups of swine[J]. J Anim Sci, 1976, 43: 175-183. DOI:10.2527/jas1976.431175x |
| [4] |
Foxcroft G R, Hunter M G. Basic physiology of follicular maturation in the pig[J]. J Reprod Fertil, 1985, 33: 1-19. |
| [5] |
Guthrie H D, Cooper B S, Welch G R, et al. Atresia in follicles grown after ovulation in the pig:measurement of increased apoptosis in granulosa cells and reduced follicular fluid estradiol-17 beta[J]. Biol Reprod, 1995, 52(4): 920-927. DOI:10.1095/biolreprod52.4.920 |
| [6] |
Miller A T, Picton H M, Craigon J, et al. Follicle dynamics and aromatase activity in high-ovulating Meishan sows and in Large-White hybrid contemporaries[J]. Biol Reprod, 1998, 58: 1372-1378. DOI:10.1095/biolreprod58.6.1372 |
| [7] |
Manabe N, Imai Y, Ohno H, et al. Apoptosis occurs in granulosa cells but not cumulus cells in the atretic antral follicles in pig ovaries[J]. Experientia, 1996, 52(7): 647-651. DOI:10.1007/BF01925566 |
| [8] |
Manabe N, Goto Y, Matsuda-Minehata F, et al. Regulation mechanism of selective atresia in porcine follicles:regulation of granulosa cell apoptosis during atresia[J]. J Reprod Dev, 2004, 50(5): 493-514. DOI:10.1262/jrd.50.493 |
| [9] |
Nakayama M, Manabe N, Inoue N, et al. Changes in the expression of tumor necrosis factor(TNF) alpha, TNFalpha receptor(TNFR) 2, and TNFR-associated factor 2 in granulosa cells during atresia in pig ovaries[J]. Biol Reprod, 2003, 68(2): 530-535. DOI:10.1095/biolreprod.102.004820 |
| [10] |
Inoue N, Maeda A, Matsuda-Minehata F, et al. Expression and localization of Fas ligand and Fas during atresia in porcine ovarian follicles[J]. J Reprod Dev, 2006, 52(6): 723-730. DOI:10.1262/jrd.18043 |
| [11] |
Worku T, Rehman Z, Talpur H, et al. MicroRNAs:new insight in modulating follicular atresia:a review[J]. Int J Mol Sci, 2017, 18(2): 333. DOI:10.3390/ijms18020333 |
| [12] |
Lin F, Li R, Pan Z X, et al. miR-26b promotes granulosa cell apoptosis by targeting ATM during follicular atresia in porcine ovary[J]. PLoS One, 2012, 7(6): e38640. DOI:10.1371/journal.pone.0038640 |
| [13] |
Liu J, Du X, Zhou J, et al. MicroRNA-26b functions as a proapoptotic factor in porcine follicular granulosa cells by targeting Sma and Mad-related protein 4[J]. Biol Reprod, 2014, 91(6): 1-12. |
| [14] |
Cao R, Wu W, Zhou X, et al. Let-7g induces granulosa cell apoptosis by targeting MAP3K1 in the porcine ovary[J]. Int J Biochem Cell Biol, 2015, 68: 148-157. DOI:10.1016/j.biocel.2015.08.011 |
| [15] |
Zhou J L, Liu J Y, Pan Z X, et al. The let-7g microRNA promotes follicular granulosa cell apoptosis by targeting transforming growth factor-β type 1 receptor[J]. Molecular and Cellular Endocrinology, 2015, 409: 103-112. DOI:10.1016/j.mce.2015.03.012 |
| [16] |
Liu J, Yao W, Yao Y, et al. MiR-92a inhibits porcine ovarian granulosa cell apoptosis by targeting Smad7 gene[J]. FEBS Letters, 2014, 588: 4497-4503. DOI:10.1016/j.febslet.2014.10.021 |
| [17] |
Cassano E, Tosto L, Balestrieri M, et al. Antioxidant defense in the follicular fluid of water buffalo[J]. Cell Physiol Biochem, 1999, 9(2): 106-116. DOI:10.1159/000016307 |
| [18] |
Giuseppina B, Federico B, Francesca G, et al. The effects of reduced oxygen tension on swine granulosa cell[J]. Regulatory Peptides, 2004, 120: 69-75. DOI:10.1016/j.regpep.2004.02.013 |
| [19] |
Lopez-Barneo J, Pardal R, Ortega-Saenz P. Cellular mechanism of oxygen sensing[J]. Annu Rev Physiol, 2001, 63: 259-287. DOI:10.1146/annurev.physiol.63.1.259 |
| [20] |
Gupta S, Choi A, Yu H Y, et al. Fluctuations in total antioxidant capacity, catalase activity and hydrogen peroxide levels of follicular fluid during bovine folliculogenesis[J]. Reprod Fertil Dev, 2011, 23(5): 673-680. DOI:10.1071/RD10270 |
| [21] |
Margo L, Hope H, Yu Y, et al. Follicular fluid hydrogen peroxide and lipid hydroperoxide in bovine antral follicles of various size, atresia, and dominance status[J]. J Assist Reprod Genet, 2013, 30: 333-340. DOI:10.1007/s10815-012-9925-5 |
| [22] |
Singh A K, Chattopadhyay R, Chakravarty B, et al. Markers of oxidative stress in follicular fluid of women with endometriosis and tubal infertility undergoing IVF[J]. Reprod Toxicol, 2013, 42: 116-124. DOI:10.1016/j.reprotox.2013.08.005 |
| [23] |
Jana S K, Chattopadhyay R, Chakravarty B, et al. Upper control limit of reactive oxygen species in follicular fluid beyond which viable embryo formation is not favorable[J]. Reprod Toxicol, 2010, 29(4): 447-451. DOI:10.1016/j.reprotox.2010.04.002 |
| [24] |
Basini G, Simona B, Santini S E, et al. Reactive oxygen species and anti-oxidant defences in swine follicular fluids[J]. Reprod Fertil Dev, 2008, 20: 269-274. DOI:10.1071/RD07147 |
| [25] |
Matzuk M M, Dionne L, Guo Q, et al. Ovarian function in superoxide dismutase 1 and 2 knockout mice[J]. Endocrinology, 1998, 139: 4008-4011. DOI:10.1210/endo.139.9.6289 |
| [26] |
Ho Y S, Gargano M, Cao J, et al. Reduced fertility in female mice lacking copper-zinc superoxide dismutase[J]. J Biol Chem, 1998, 273: 7765-7769. DOI:10.1074/jbc.273.13.7765 |
| [27] |
Wong P C, Waggoner D, Subramaniam J R, et al. Copper chaperone for superoxide dismutase is essential to activate mammalian cu/zn superoxide dismutase[J]. Proc Natl Acad Sci USA, 2000, 97: 2886-2891. DOI:10.1073/pnas.040461197 |
| [28] |
Kumar T R, Wiseman A L, Kala G, et al. Reproductive defects in γ-glutamyl transpeptidase deficient mice[J]. Endocrinology, 2000, 141: 4270-4277. DOI:10.1210/endo.141.11.7760 |
| [29] |
Lin J, Nakamura B N, Mohar L, et al. Glutamate cysteine ligase modifier subunit(Gclm) null mice have increased ovarian oxidative stress and accelerated age-related ovarian failure[J]. Endocrinology, 2015, 156(9): 3329-3343. DOI:10.1210/en.2015-1206 |
| [30] |
Patrick J D, Sally D P, Luderer U. Role of reactive oxygen species and antioxidants in ovarian toxicity[J]. Biol Reprod, 2012, 86(2): 1-10. |
| [31] |
Zhang J Q, Shen M, Zhu C C, et al. 3-nitropropionic acid induces ovarian oxidative stress and impairs follicle in mouse[J]. PLoS One, 2014, 9(2): e86589. DOI:10.1371/journal.pone.0086589 |
| [32] |
Luderer U. Ovarian toxicity from reactive oxygen species[J]. Vitam Horm, 2014, 94: 99-127. DOI:10.1016/B978-0-12-800095-3.00004-3 |
| [33] |
Lopez S G, Luderer U. Effects of cyclophosphamide and buthionine sulfoximine on ovarian glutathione and apoptosis[J]. Free Radic Biol Med, 2004, 36: 1366-1377. DOI:10.1016/j.freeradbiomed.2004.02.067 |
| [34] |
Tsai-Turton M, Luderer U. Gonadotropin regulation of glutamate cysteine ligase catalytic and modifier subunit expression in rat ovary is subunit and follicle stage specific[J]. Am J Physiol Endocrinol Metab, 2005, 289: E391-E402. DOI:10.1152/ajpendo.00531.2004 |
| [35] |
Tsai-Turton M, Luderer U. Opposing effects of glutathione depletion and FSH on reactive oxygen species and apoptosis in cultured preovulatory rat follicles[J]. Endocrinology, 2006, 147: 1224-1236. DOI:10.1210/en.2005-1281 |
| [36] |
Shen M, Lin F, Zhang J Q, et al. Involvement of the up-regulated FoxO1 expression in follicular granulosa cell apoptosis induced by oxidative stress[J]. J Biol Chem, 2012, 287(31): 25727-25740. DOI:10.1074/jbc.M112.349902 |
| [37] |
Liu Z Q, Shen M, Wu W J, et al. Expression of PUMA in follicular granulosa cells regulated by FoxO1 activation during oxidative stress[J]. Reprod Sci, 2015, 22(6): 696-705. DOI:10.1177/1933719114556483 |
| [38] |
Essers M A G, Weijzen S, de Vries-Smits A M M, et al. FOXO transcription factor activation by oxidative stress mediated by the small GTPase Ral and JNK[J]. The EMBO Journal, 2004, 23(24): 4802-4812. DOI:10.1038/sj.emboj.7600476 |
| [39] |
Sunayama J, Tsuruta F, Masuyama N, et al. JNK antagonizes Akt-mediated survival signals by phosphorylating 14-3-3[J]. The Journal of Cell Biology, 2005, 170(2): 295-304. DOI:10.1083/jcb.200409117 |
| [40] |
Weng Q, Liu Z, Li B, et al. Oxidative stress induces mouse follicular granulosa cells apoptosis via JNK/FoxO1 pathway[J]. PLoS One, 2016, 11(12): e0167869. DOI:10.1371/journal.pone.0167869 |
| [41] |
He C J, Wang J, Zhang Z Z, et al. Mitochondria synthesize melatonin to ameliorate its function and improve mice oocyte's quality under in vitro conditions[J]. International Journal of Molecular Sciences, 2016, 17(6): 939-945. DOI:10.3390/ijms17060939 |
| [42] |
Tamura H, Takasaki A, Taketani T, et al. Melatonin and female reproduction[J]. Journal of Obstetrics and Gynaecology, 2014, 40(1): 1-11. |
| [43] |
Tamura H, Takasaki A, Taketani T, et al. Melatonin as a free radical scavenger in the ovarian follicle[J]. Endocrine Journal, 2013, 60(1): 1-13. |
| [44] |
Woo M M M, Tai C J, Kang K, et al. Direct action of melatonin in human granulosa-luteal cells[J]. The Journal of Clinical Endocrinology & Metabolism, 2001, 86(10): 4789-4797. |
| [45] |
Shi J M, Tian X Z, Zhou G B, et al. Melatonin exists in porcine follicular fluid and improves in vitro maturation and parthenogenetic development of porcine oocytes[J]. Journal of Pineal Research, 2009, 47(4): 318-323. DOI:10.1111/jpi.2009.47.issue-4 |
| [46] |
Tian X Z, Wang F, He C J, et al. Beneficial effects of melatonin on bovine oocytes maturation:a mechanistic approach[J]. Journal of Pineal Research, 2014, 57(3): 239-247. DOI:10.1111/jpi.2014.57.issue-3 |
| [47] |
Tian X Z, Wang F, Zhang L, et al. Beneficial effects of melatonin on the in vitro maturation of sheep oocytes and its relation to melatonin receptors[J]. International Journal of Molecular Sciences, 2017, 18: 834. DOI:10.3390/ijms18040834 |
| [48] |
Li Y, Zhang Z Z, He C J, et al. Melatonin protects porcine oocyte in vitro maturation from heat stress[J]. Journal of Pineal Research, 2015, 59(3): 365-375. DOI:10.1111/jpi.12268 |
| [49] |
Shen M, Liu Z, Li B, et al. Involvement of FoxO1 in the effects of follicle stimulating hormone on inhibition of apoptosis in mouse granulosa cells[J]. Cell Death and Disease, 2014, 5: e1475. DOI:10.1038/cddis.2014.400 |
| [50] |
Shen M, Jiang Y, Guan Z, et al. Protective mechanism of FSH against oxidative damage in mouse ovarian granulosa cells by repressing autophagy[J]. Autophagy, 2017, 13(8): 1364-1385. DOI:10.1080/15548627.2017.1327941 |
| [51] |
王文绍, 程玲, 赵肖, 等. miR-15a对猪卵泡颗粒细胞BDNF基因表达的影响[J]. 畜牧与兽医, 2018, 50(3): 14-19. Wang W S, Cheng L, Zhao X, et al. MiR-15a inhibits the levels of porcine ovarian granulosa cell's BDNF[J]. Animal Husbandry & Veterinary Medicine, 2018, 50(3): 14-19 (in Chinese with English abstract). |
| [52] |
Murdoch W J. Inhibition by oestradiol of oxidative stress-induced apoptosis in pig ovarian tissues[J]. J Reprod Fertil, 1998, 114: 127-130. DOI:10.1530/jrf.0.1140127 |
| [53] |
Besnard N, Pisselet C, Monniaux D, et al. Expression of messenger ribonucleic acids of insulin-like growth factor binding protein-2, -4, and -5 in the ovine ovary:localization and changes during growth and atresia of antral follicles[J]. Biol Reprod, 1996, 55(6): 1356-1367. DOI:10.1095/biolreprod55.6.1356 |
| [54] |
Teerds K J, Dorrington J H. Immunolocalization of transforming growth factor alpha and luteinizing hormone receptor in healthy and atretic follicles of the adult rat ovary[J]. Biol Reprod, 1995, 52(3): 500-508. DOI:10.1095/biolreprod52.3.500 |