文章信息
- 朱电锋, 张娅菲, 储小燕, 陈晓芳, 刘秦, 冯士彬, 李玉, 吴金节, 王希春
- ZHU Dianfeng, ZHANG Yafei, CHU Xiaoyan, CHEN Xiaofang, LIU Qin, FENG Shibin, LI Yu, WU Jinjie, WANG Xichun
- 脱氧雪腐镰刀菌烯醇对断奶仔猪生长性能、血清细胞因子及肠道免疫水平的影响
- Effects of deoxynivalenol on growth performance, serum cytokine and intestinal immune levels in weanling piglets
- 南京农业大学学报, 2018, 41(6): 1126-1132
- Journal of Nanjing Agricultural University, 2018, 41(6): 1126-1132.
- http://dx.doi.org/10.7685/jnau.201711002
-
文章历史
- 收稿日期: 2017-11-01
脱氧雪腐镰刀菌烯醇(deoxynivalenol, DON), 又称呕吐毒素, 是一种广泛存在于小麦、玉米等农作物中的单端孢霉烯族类毒素[1], 具有神经毒性、免疫毒性及细胞毒性等多种毒性作用[2]。DON不仅可以导致农作物霉败变质而引起产量和品质降低, 还可以通过对人和动物体内细胞结构的破坏而引起DON中毒[3-4]。近年来, 关于DON污染粮食作物的报道屡见不鲜。史建荣等[5]调查发现南京市场部分小麦样品中DON含量超过1 mg·kg-1; 王伟等[6]选取中国13个省44个市(区、县)的107个超市或市场为采样点, 分别采集小麦粉和玉米制品样品292和347份, 调查发现小麦粉和玉米制品中DON污染率高达100%和97.4%, 超过国家限量标准的分别占1.7%和4.6%。杨雪丽等[7]调查发现新疆市售小麦粉中DON检出率为51.2%。人及畜禽食用DON污染的谷物制品会出现恶心、呕吐、腹泻、厌食及胃肠道出血等肠胃炎症状, 导致采食量下降、日增重减少等[8]。在畜禽中, 猪对DON最为敏感[9]。研究发现, DON浓度越高, 鸡淋巴细胞白细胞介素2(IL-2)及白细胞介素4(IL-4)的含量越低[10]。张婷等[11]在小鼠日粮中添加一定量DON后, 其血清细胞因子IL-2、IL-4及IL-6水平显著降低, 胸腺指数、脾脏指数、淋巴细胞转化率等均显著降低。目前关于DON对畜禽免疫毒性的机制研究尚不完善, 尤其在DON对仔猪免疫机能影响方面的研究还未见系统报道。本试验通过断奶仔猪DON体内试验, 研究其对仔猪生长性能、血清细胞因子水平、肠道黏膜分泌型IgA(sIgA)水平以及小肠组织IgA、IgM、IgG mRNA相对表达量的影响, 为DON对仔猪免疫毒性的研究提供试验依据。
1 材料与方法 1.1 主要试剂和仪器禾谷镰刀菌由南京农业大学动物医学院张海彬教授惠赠; 玉米购自合肥市农贸市场; 猪IFN-γ、IL-2、IL-4、IL-6及sIgA ELISA试剂盒, 均购自南京森贝迦生物技术有限公司; 600 E分析型高效液相色谱仪, 美国Waters公司; 微量移液器购自美国Eppendorf公司; Multiskan Mk3型酶标仪购自上海赛默飞世尔仪器有限公司; TGL-18R台式高速离心机购自珠海黑马医学仪器有限公司; qPCR仪, 美国Applied biosystems应用生物系统公司。
1.2 DON饲料的制备将保存于4 ℃的禾谷镰刀菌接种到马铃薯葡萄糖琼脂培养基平板上, 25 ℃下复苏培养, 观察禾谷镰刀菌的生长情况。将复苏好的禾谷镰刀菌接种察氏液体培养基, 置于恒温振荡培养箱内, 以120 r·min-1转速25 ℃培养5~7 d。取孢子液于细胞计数板上, 显微镜下观察计数后计算孢子液浓度。将150 g烘干的玉米装入150 mm的玻璃培养皿, 调节水分含量至45%, 置于恒温振荡培养箱中, 27 ℃培养20 d使其霉变后, 取出培养皿, 灭菌后烘干备用。将烘干的霉玉米粉碎, 按照姜云晶等[12]报道的方法, 进行DON的提取、纯化及含量测定, 然后与基础饲料进行混合, 制成DON含量分别为1和2 mg·kg-1的DON饲料。经高效液相色谱法检测, DON饲料与DON标准品的色谱图曲线基本一致, 且基础饲料中未发现DON及其他毒素。
1.3 动物分组与饲养管理“杜洛克猪×长白猪×大白猪”三元杂交断奶仔猪, 由安徽省青阳县五星畜牧种猪场提供。选取30头21日龄临床检查健康的断奶仔猪[(6.87±0.41)kg], 随机分为3组, 每组10头, 分别为饲喂基础饲粮(对照)组、1 mg·kg-1DON饲粮(低剂量)组、2 mg·kg-1 DON饲粮(高剂量)组。试验期为60 d。仔猪于同一栋猪舍不同栏内饲养, 自由采食、饮水, 每天观察仔猪的采食和健康状况, 消毒及免疫程序严格按照猪场管理方案进行。
1.4 日粮组成仔猪基础饲粮组成为:玉米、豆粕、面粉、鱼粉、乳清粉、豆油、石粉、磷酸氢钙、氧化锌、氯化钠等。其各成分含量(质量分数)为:粗蛋白质≥18.0%(0~30 d), 粗蛋白质≥17.0%(31~60 d), 粗纤维≤7.0%, 水分≤14.0%, 粗灰分≤8.0%, 钙0.4%~1.2%, 总磷0.4%~0.85%, 氯化钠0.3%~1.0%, 赖氨酸≥1.1%。
1.5 样品采集 1.5.1 血清制备分别于试验开始后的0、14、28、42、60 d的08:00—09:00对每头仔猪进行前腔静脉采血, 2 500 r·min-1离心10 min, 分离血清, -20 ℃保存, 用于测定细胞因子IFN-γ、IL-2、IL-4和IL-6水平。
1.5.2 肠道组织样品的采集与保存在试验结束时, 各组随机选取5头仔猪剖杀, 取小肠组织, 用于测定组织IgA、IgM和IgG mRNA相对表达量; 刮取肠黏膜, 用于测定sIgA水平。
1.6 检测指标与方法 1.6.1 生长性能测定分别于试验开始后的0、14、28、42和60 d的08:00—09:00对各试验组仔猪称体质量。试验期间记录给料量与剩余料量, 计算平均日增重、平均日采食量及料重比。
1.6.2 血清细胞因子及肠黏膜sIgA水平的测定分别用IFN-γ、IL-2、IL-4、IL-6及分泌型IgA(sIgA)ELISA检测试剂盒测定血清细胞因子和肠黏膜sIgA水平, 检测过程中严格按照试剂盒说明进行。
1.7 仔猪小肠各段IgA、IgM、IgG mRNA相对表达量测定依据GenBank中的猪IgA、IgM、IgG及内参Actin基因的序列, 利用Primer Premier 5.0软件设计引物(表 1), 通过RT-qPCR法检测IgA、IgM、IgG mRNA的相对表达量。
| 引物对名称 Primer pairs name |
基因登录号 GenBank accession No. |
引物对序列(5′→3′) Primers pairs sequences |
扩增片段长度/bp Amplification size |
| IgA-F/R | U12594.1 | CGTGATTCCTGTGGCTGCTA/TTAGCGCGCTCTTCAACTCA | 118 |
| IgM-F/R | M59321.1 | AGTGGGTCAGGCACAGATTT/GCGGGAAGATGAAGACGGAT | 166 |
| IgG-F/R | AB205105.1 | GAGCTGTCCAGGAGCAAAGT/CTCCGGCTGTCCGTTTCTTT | 96 |
| β-Actin-F/R | XM_003124280.5 | AGATCAAGATCATCGCGCCT/ATGCAACTAACAGTCCGCCT | 170 |
试验结果以“平均值±标准差(x±SD)”表示, 采用SPSS 17.0统计软件中的ANOVA过程进行方差分析, 采用Duncan ’ s法进行多重比较。
2 结果与分析 2.1 DON对断奶仔猪生长性能的影响由表 2可知:在60 d时, 高剂量组仔猪的平均体质量显著低于低剂量组与对照组(P < 0.05)。平均日增重方面, 在14~28 d, 高剂量组显著低于对照组(P < 0.05);在28~42 d, 高剂量组极显著低于低剂量组与对照组(P < 0.01), 且低剂量组显著低于对照组(P < 0.05);在42~60 d, 高剂量组极显著低于低剂量组与对照组(P < 0.01), 且低剂量组极显著低于对照组(P < 0.01)。平均日采食量方面, 在28~42 d, 高剂量组极显著低于对照组(P < 0.01), 显著低于低剂量组(P < 0.05), 低剂量组显著低于对照组(P < 0.05);在42~60 d, 高剂量组极显著低于低剂量组与对照组(P < 0.01), 低剂量组极显著低于对照组(P < 0.01)。料重比方面, 14~28 d, 高剂量组显著高于对照组(P < 0.05);在28~42 d, 高剂量组与低剂量组极显著高于对照组(P < 0.01), 且高剂量组显著高于低剂量组(P < 0.05);在42~60 d, 由于高剂量组仔猪出现严重的厌食反应, 低剂量组也出现相应的厌食反应, 所以高剂量组与低剂量组仔猪的采食量相对降低, 导致料重比也相应降低, 但是, 高剂量组与低剂量组仔猪的料重比还是显著高于对照组(P < 0.05)。
| 指标 Indexes |
t/d | 对照组 Control group |
低剂量组(1 mg·kg-1 DON) Low dose group |
高剂量组(2 mg·kg-1 DON) High dose group |
| 平均体质量/kg | 0 | 6.83±0.32 | 6.88±0.53 | 6.91±0.45 |
| Average weight | 60 | 29.65±1.60a | 28.08±0.95a | 25.03±1.31b |
| 平均日增重/(g·d-1) | 0~14 | 195.95±12.63 | 189.66±16.50 | 184.56±12.33 |
| Average daily gain | 14~28 | 355.67±10.91a | 340.53±8.01ab | 324.25±12.44b |
| 28~42 | 452.34±9.09Aa | 397.04±8.01Ab | 355.55±14.52Bc | |
| 42~60 | 559.28±11.14A | 477.09±9.40B | 417.99±6.46C | |
| 平均日采食量/(g·d-1) | 0~14 | 321.12±7.17 | 321.54±5.15 | 320.73±2.74 |
| Average daily feed intake | 14~28 | 592.28±5.96 | 592.05±5.37 | 586.05±8.00 |
| 28~42 | 784.88±11.55Aa | 737.85±11.46ABb | 677.51±21.10Bc | |
| 42~60 | 906.85±11.64A | 803.39±10.45C | 699.13±12.07B | |
| 料重比 | 0~14 | 1.64±0.07 | 1.70±0.13 | 1.74±0.12 |
| The ratio of feed to gain | 14~28 | 1.67±0.03b | 1.77±0.03ab | 1.81±0.05a |
| 28~42 | 1.74±0.11B | 1.86±0.01Ab | 1.91±0.02Aa | |
| 42~60 | 1.62±0.15b | 1.68±0.11a | 1.67±0.01a | |
| 注:同行不同小写字母表示差异显著(P < 0.05), 不同大写字母表示差异极显著(P < 0.01)。 Note: The data with different small letters indicate significant difference at 0.05 level, the data with different capital letters indicate significant difference at 0.01 level. |
||||
由图 1-A可见:在42 d时, 高剂量组与低剂量组仔猪血清IFN-γ水平显著低于对照组(P < 0.05);在60 d时, 高剂量组与低剂量组仔猪血清IFN-γ水平极显著低于对照组(P < 0.01), 且高剂量组仔猪的IFN-γ水平显著低于低剂量组(P < 0.05)。表明DON可降低仔猪血清IFN-γ水平。
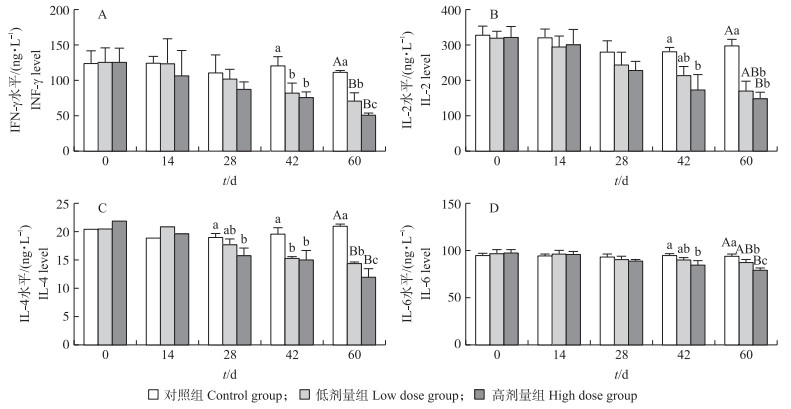
|
图 1 DON对断奶仔猪血清细胞因子水平的影响 Figure 1 Effect of DON on the levels of serum cytokines in weanling piglets 不同大、小写字母表示同时间处理间在0.01和0.05水平差异显著。下同。 The different capital and small letters mean significant difference at 0.01 and 0.05 levels in different treatments of the same time. The same as follows. |
由图 1-B可见:在42 d时, 高剂量组仔猪血清IL-2水平显著低于对照组(P < 0.05);在60 d时, 高剂量组仔猪血清IL-2水平极显著低于对照组(P < 0.01), 低剂量组仔猪血清IL-2水平显著低于对照组(P < 0.05)。表明DON可降低仔猪血清IL-2水平。
2.2.3 DON对血清IL-4水平的影响由图 1-C可见:在28 d时, 高剂量组仔猪血清IL-4水平显著低于对照组(P < 0.05);在42 d时, 高剂量组与低剂量组仔猪血清IL-2水平显著低于对照组(P < 0.05);在60 d时, 高剂量组和低剂量组仔猪血清IL-4水平均极显著低于对照组(P < 0.01), 且高剂量组显著低于低剂量组(P < 0.05)。表明DON可降低仔猪血清IL-4水平。
2.2.4 DON对血清IL-6水平的影响由图 1-D可见:在42 d时, 高剂量组仔猪血清IL-6水平显著低于对照组(P < 0.05);在60 d时, 高剂量组仔猪血清IL-6水平极显著低于对照组(P < 0.01), 低剂量组仔猪血清IL-6水平显著低于对照组(P < 0.05), 高剂量组仔猪血清IL-6水平显著低于低剂量组(P < 0.05)。表明DON可降低仔猪血清IL-6水平。
2.3 DON对断奶仔猪小肠黏膜sIgA水平的影响由图 2可见:高剂量组仔猪十二指肠、空肠前段、空肠中段黏膜sIgA水平显著低于对照组(P < 0.05);高剂量组仔猪空肠后段sIgA水平显著低于低剂量组与对照组(P < 0.05);高剂量组仔猪回肠sIgA水平极显著低于对照组(P < 0.01), 显著低于低剂量组(P < 0.05), 低剂量组仔猪回肠sIgA水平显著低于对照组(P < 0.05)。表明DON可降低仔猪小肠黏膜sIgA水平。
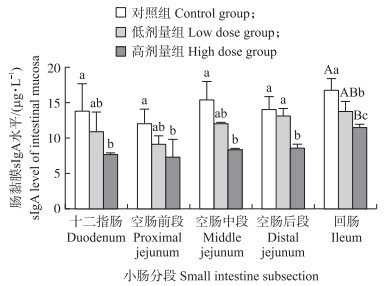
|
图 2 DON对断奶仔猪小肠黏膜sIgA水平的影响 Figure 2 Effect of DON on sIgA levels of intestinal mucosa in weanling piglets |
由图 3-A可见:高剂量组仔猪十二指肠、空肠前段、空肠中段IgA mRNA相对表达量显著低于对照组(P < 0.05);高剂量组和低剂量组仔猪空肠后段IgA mRNA相对表达量显著低于对照组(P < 0.05), 高剂量组仔猪回肠IgA mRNA相对表达量低于对照组(P < 0.05)。表明DON可降低仔猪小肠IgA mRNA相对表达量。
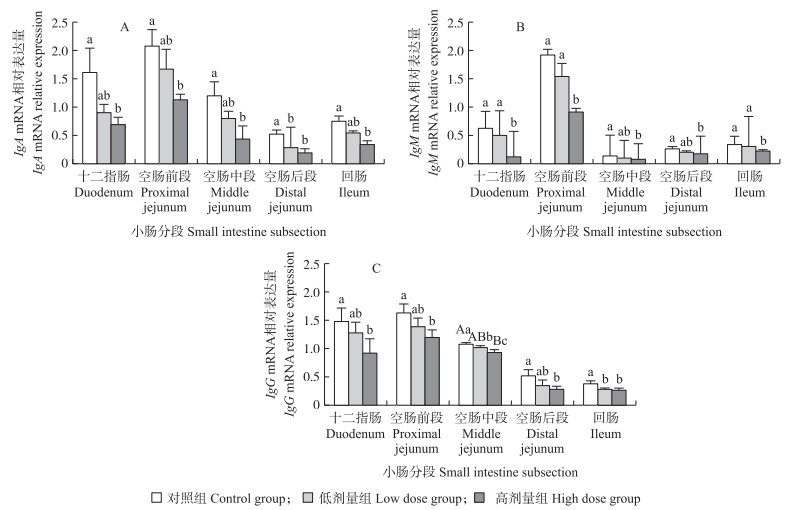
|
图 3 DON对断奶仔猪小肠免疫球蛋白mRNA相对表达量的影响 Figure 3 Effect of DON on intestinal immunoglobulin mRNA relative expression in weanling piglets |
由图 3-B可见:高剂量组仔猪十二指肠、空肠前段IgM mRNA相对表达量显著低于低剂量组与对照组(P < 0.05);高剂量组仔猪空肠中段、空肠后段IgM相对表达量显著低于对照组(P < 0.05);高剂量组仔猪回肠IgM mRNA相对表达量显著低于低剂量组与对照组(P < 0.05)。表明DON可降低仔猪小肠IgM mRNA相对表达量。
2.4.3 DON对断奶仔猪小肠IgG mRNA相对表达量的影响由图 3-C可见:高剂量组仔猪十二指肠、空肠前段IgG mRNA相对表达量显著低于对照组(P < 0.05);高剂量组仔猪空肠中段IgG mRNA相对表达量显著低于低剂量组(P < 0.05), 极显著低于对照组(P < 0.01), 低剂量组显著低于对照组(P < 0.05);高剂量组仔猪空肠后段IgG mRNA相对表达量显著低于对照组(P < 0.05);高剂量组与低剂量组仔猪回肠IgG mRNA相对表达量显著低于对照组(P < 0.05)。表明DON可降低仔猪小肠IgG mRNA相对表达量。
3 讨论DON是农产品及饲料的主要污染源之一, 对人和动物的健康造成严重威胁[13]。中国《饲料卫生标准:GB 13078—2017》中规定饲料中DON允许量小于1 mg·kg-1。因此, 本试验选取含1和2 mg·kg-1的DON饲粮, 开展DON对断奶仔猪免疫机能的毒性研究。研究表明, 镰刀菌污染的饲粮可以降低仔猪的采食量及体增重[14]。蒋竹英等[15]用3.78 mg·kg-1的DON污染饲粮饲喂仔猪, 发现DON可以降低仔猪的生长性能。本试验结果表明, DON能显著或极显著降低断奶仔猪的平均日采食量与平均日增重, 增加料重比, 这与上述研究结果一致。另外, 本试验中还发现, 饲喂2 mg·kg-1的DON饲粮28 d左右, 仔猪开始出现厌食、腹泻等反应, 而饲喂1 mg·kg-1的DON饲粮42 d左右开始出现毒性反应, 说明短期内饲料中DON允许量1mg·kg-1对仔猪是安全的, 但是长期饲喂可能由于蓄积作用会引起中毒。
细胞因子是由活化的免疫细胞和某些基质细胞分泌, 具有免疫活性的多功能小分子物质。IL-2由Th1细胞产生, 可诱导T细胞、B细胞增殖分化, 并刺激B淋巴细胞分泌Ig[16]; IL-4主要由Th2分泌, IL-6则可由Th2细胞、成纤维细胞和巨噬细胞产生, 两者均可以作用于B细胞。Yan等[17]饲喂B6C3F1雄性小鼠DON毒素, 发现DON能显著降低小鼠IL-6水平。蔡国栋等[18]用不同浓度DON处理CTLL-2细胞, 发现DON能够抑制CTLL-2细胞IFN-γ的分泌, 降低免疫细胞杀伤活力。本试验得到了相似的结果, 经过60 d的DON体内试验发现, DON可以显著或极显著降低断奶仔猪血清细胞因子IFN-γ、IL-2、IL-4、IL-6水平。
sIgA为肠道免疫屏障的主要效应因子, 其功能是阻抑细菌、病毒等病原体在肠黏膜表面定殖及繁殖, 防止感染的发生[19]。小肠黏膜sIgA水平显著降低时, 食源性抗原经肠黏膜入侵[20], 从而引起肠道菌群失调, 消化吸收受阻, 发生肠源性感染[21]。本试验结果表明, DON能显著或极显著降低断奶仔猪十二指肠, 空肠前段、中段、后段及回肠黏膜sIgA水平, 降低肠道黏膜免疫能力。
血液和体液中分布着大量的免疫球蛋白, 其在体液免疫过程中具有重要作用[22]。IgA具有维持黏膜上皮结构和功能完整性的作用; IgM是在抗感染中起着“先锋”作用; IgG是机体自然感染和人工主动免疫后所产生的介导体液免疫的主要抗体。宫佳杰等[23]通过DON暴露雏鸡体内毒理试验, 发现DON可以显著降低雏鸡体内免疫球蛋白水平。Ren等[24]对成年健康小鼠腹腔注射DON, 发现DON能降低血清中IgA、IgM及IgG含量。Abbès等[25]研究, 发现DON能导致小鼠血清中IgA和IgG水平显著降低。本试验结果表明, DON能显著或极显著降低仔猪十二指肠, 空肠前段、中段、后段和回肠IgA、IgM、IgG mRNA的相对表达量, 降低断奶仔猪肠道免疫水平。
综上所述, 饲喂1 mg·kg-1的DON饲粮在短期内对断奶仔猪的各项指标并无明显影响, 但长期饲喂会降低断奶仔猪的生长性能及血清细胞因子, 抑制肠道黏膜sIgA分泌, 并降低小肠组织IgA、IgM及IgG mRNA相对表达量。2 mg·kg-1的DON饲粮比1 mg·kg-1的DON饲粮对断奶仔猪的毒副作用更加明显。
| [1] |
Tran S T, Smith T K. A survey of free and conjugated deoxynivalenol in the 2009, 2010 and 2011 cereal crops in Australia[J]. Animal Production Science, 2013, 53(5): 407-412. DOI:10.1071/AN12081 |
| [2] |
Ebrahem M, Kersten S, Valenta H, et al. Effects of feeding deoxynivalenol (DON)-contaminated wheat to laying hens and roosters of different genetic background on the reproductive performance and health of the newly hatched chicks[J]. Mycotoxin Research, 2014, 30(3): 131-140. DOI:10.1007/s12550-014-0197-z |
| [3] |
Ren Z H, Wang Y C, Deng H D, et al. Deoxynivalenol induces apoptosis in chicken splenic lymphocytes via the reactive oxygen species-mediated mitochondrial pathway[J]. Environmental Toxicology and Pharmacology, 2015, 39(1): 339-346. DOI:10.1016/j.etap.2014.11.028 |
| [4] |
He C H, Fan Y H, Wang Y, et al. The individual and combined effects of deoxynivalenol and aflatoxin b1 on primary hepatocytes of Cyprinus carpio[J]. International Journal of Molecular Sciences, 2010, 11(10): 3760-3768. DOI:10.3390/ijms11103760 |
| [5] |
史建荣, 刘馨, 仇剑波, 等. 小麦中镰刀菌毒素脱氧雪腐镰刀菌烯醇污染现状与防控研究进展[J]. 中国农业科学, 2014, 47(18): 3641-3654. Shi J R, Liu X, Qiu J B, et al. Deoxynivalenol contamination in wheat and its management[J]. Scientia Agricultura Sinica, 2014, 47(18): 3641-3654 (in Chinese with English abstract). DOI:10.3864/j.issn.0578-1752.2014.18.012 |
| [6] |
王伟, 朱江辉, 邵兵, 等. 中国居民小麦粉与玉米制品中脱氧雪腐镰刀烯醇与玉米赤霉烯酮暴露水平评估[J]. 中国预防医学杂志, 2015, 49(3): 223-227. Wang W, Zhu J H, Shao B, et al. Probabilistic assessment of dietary exposure to both deoxynivalenol and zearalenone from cerea-based products in Chinese populations[J]. Chinese Journal of Preventive Medicine, 2015, 49(3): 223-227 (in Chinese with English abstract). |
| [7] |
杨雪丽, 张格祥, 杨勤德, 等. 新疆市售小麦粉中脱氧雪腐镰刀菌烯醇的污染水平调查[J]. 中国卫生检验杂志, 2016, 26(4): 578-581. Yang X L, Zhang G X, Yang Q D, et al. Contamination survey of the deoxynivalenols in wheat flour from in the market of Xinjiang[J]. Chinese Journal of Health Laboratory Technology, 2016, 26(4): 578-581 (in Chinese with English abstract). |
| [8] |
许伟, 范梦雪, 孟婷婷, 等. 脱氧雪腐镰刀菌烯醇对PC12细胞凋亡的影响[J]. 南京农业大学学报, 2016, 29(5): 838-844. Xu W, Fan M X, Meng T T, et al. Effect of deoxynivalenol on apoptosis of PC12 cells[J]. Journal of Nanjing Agricultural University, 2016, 29(5): 838-844 (in Chinese with English abstract). DOI:10.7685/jnau.201508040 |
| [9] |
Danicke S, Brosig B, Klunker L R, et al. Systemic and local effects of the Fusarium toxin deoxynivalenol (DON)are not alleviated by dietary supplementation of humic substances (HS)[J]. Food and Chemical Toxicology, 2012, 50(3): 979-988. |
| [10] |
Ren Z H, Wang Y C, Deng H D, et al. Deoxynivalenol-induced cytokines and related genes in concanavalin A-stimulated primary chicken splenic lymphocytes[J]. Toxicology in Vitro, 2015, 29(3): 558-563. DOI:10.1016/j.tiv.2014.12.006 |
| [11] |
张婷, 朱风华, 高晨, 等. 脱氧雪腐镰刀菌烯醇对小鼠免疫功能的影响[J]. 中国兽医杂志, 2014, 50(9): 28-30. Zhang T, Zhu F H, Gao C, et al. Effects of DON on the immune function in mice[J]. Chinese Journal of Veterinary Medicine, 2014, 50(9): 28-30 (in Chinese with English abstract). DOI:10.3969/j.issn.0529-6005.2014.09.009 |
| [12] |
姜云晶, 许伟, 陈晓芳, 等. 脱氧雪腐镰刀菌烯醇提取、纯化及含量检测[J]. 中国兽医学报, 2017, 37(9): 1771-1777. Jiang Y J, Xu W, Chen X F, et al. Extraction, purification and concentration determination of deoxynivalenol[J]. Chinese Journal of Veterinary Science, 2017, 37(9): 1771-1777 (in Chinese with English abstract). |
| [13] |
耿芳芳, 许伟, 范梦雪, 等. 脱氧雪腐镰刀烯醇对雏鸡脂质过氧化反应及脑部形态结构的影响[J]. 南京农业大学学报, 2016, 39(3): 460-466. Geng F F, Xu W, Fan M X, et al. Effects of deoxynivalenol on lipid peroxidation reaction and brain morphology in chicken[J]. Journal of Nanjing Agricultural University, 2016, 39(3): 460-466 (in Chinese with English abstract). DOI:10.7685/jnau.201510024 |
| [14] |
Döll S, Dänicke S. The fusarium toxins deoxynivalenol (DON) and zearalenone (ZEN)in animal feeding[J]. Preventive Veterinary Medicine, 2011, 102(2): 132-145. DOI:10.1016/j.prevetmed.2011.04.008 |
| [15] |
蒋竹英, 范觉鑫, 陈明洪, 等. 脱氧雪腐镰刀菌烯醇污染饲粮对断奶仔猪血液生理生化指标的影响及竹炭和竹醋液的干预作用[J]. 动物营养学报, 2012, 24(12): 2459-2468. Jiang Z Y, Fan J X, Chen M H, et al. Effects of diets contaminated by deoxynivalenol on blood physiological and biochemical indexes and intervention effects of bamboo-carbon and bamboo vinegar in weaner piglets[J]. Chinese Journal of Animal Nutrition, 2012, 24(12): 2459-2468 (in Chinese with English abstract). DOI:10.3969/j.issn.1006-267x.2012.12.021 |
| [16] |
Mingari M C, Gerosa F, Carra G, et al. Human interleukin-2 promotes proliferation of activated B cells via surface receptors similar to those of activated T cells[J]. Nature, 1984, 312(5995): 641-643. DOI:10.1038/312641a0 |
| [17] |
Yan D, Zhou H R, Brooks K H, et al. Potential role for IL-5 and IL-6 in enhanced IgA secretion by Peyer's patch cells isolated from mice acutely exposed to vomitoxin[J]. Toxicology, 1997, 122(1/2): 145-158. |
| [18] |
蔡国栋, 潘顺叶, 王凤丽, 等. ZEA、DON及其联合染毒对CTLL-2细胞因子分泌的影响[J]. 中国畜牧兽医, 2017, 44(5): 1533-1540. Cai G D, Pan S Y, Wang F L, et al. Effects of ZEA, DON and their combined effects on secretion of cytokine in CTLL-2 cells[J]. China Animal Husbandry & Veterinary Medicine, 2017, 44(5): 1533-1540 (in Chinese with English abstract). |
| [19] |
李茜, 岑雪, 潘顺叶, 等. 脱氧雪腐镰刀菌烯醇诱导CTLL-2细胞凋亡的信号途径研究[J]. 畜牧与兽医, 2016, 48(12): 12-18. Li Q, Cen X, Pan S Y, et al. Deoxynivalenol-induced pathway of apoptosis in CTLL-2 cells[J]. Animal Husbandry & Veterinary Medicine, 2016, 48(12): 12-18 (in Chinese with English abstract). |
| [20] |
Brandtzaeg P. Role of secretory antibodies in the defence against infections[J]. International Journal of Medical Microbiology, 2003, 293(1): 3-15. DOI:10.1078/1438-4221-00241 |
| [21] |
Wijburg O L C, Uren T K, Simpfendorfer K, et al. Innate secretory antibodies protect against natural Salmonella typhimurium infection[J]. Journal of Experimental Medicine, 2006, 203(1): 21-26. DOI:10.1084/jem.20052093 |
| [22] |
左涛, 律迎春, 曹露, 等. 冰岛参对小鼠肠道黏膜SIgA分泌的影响[J]. 食品工业科技, 2012, 33(1): 373-375. Zuo T, Lü Y C, Cao L, et al. Promotion effect of Cucumaria frondosa on the secretion of mice intestinal SIgA[J]. Science and Technology of Food Industry, 2012, 33(1): 373-375 (in Chinese with English abstract). |
| [23] |
宫佳杰, 耿芳芳, 许伟, 等. DON暴露对雏鸡免疫功能的影响[J]. 中国兽医学报, 2016, 36(11): 1923-1928. Gong J J, Geng F F, Xu W, et al. Effects of DON exposure on immunity function in chicken[J]. Chinese Journal of Veterinary Science, 2016, 36(11): 1923-1928 (in Chinese with English abstract). |
| [24] |
Ren Z H, Zhou R, Deng J L, et al. Effects of the Fusarium toxin zearalenone (ZEA) and/or deoxynivalenol (DON)on the serum IgA, IgG and IgM levels in mice[J]. Food and Agricultural Immunology, 2014, 25(4): 600-606. DOI:10.1080/09540105.2013.867928 |
| [25] |
Abbès S, Salah-Abbès J B, Ouanes Z, et al. Preventive role of phyllosilicate clay on the immunological and biochemical toxicity of zearalenone in Balb/c mice[J]. International Immunopharmacology, 2006, 6(8): 1251-1258. DOI:10.1016/j.intimp.2006.03.012 |




