文章信息
- 袁晨, 张恩, 王佳璐, 黄璐璐, 杨倩
- YUAN Chen, ZHANG En, WANG Jialu, HUANG Lulu, YANG Qian
- 猪肠黏膜PP结中树突状细胞的分离与鉴定
- Isolation and idetification of dendritic cells from porcine intestinal mucosal PP
- 南京农业大学学报, 2018, 41(6): 1107-1112
- Journal of Nanjing Agricultural University, 2018, 41(6): 1107-1112.
- http://dx.doi.org/10.7685/jnau.201802005
-
文章历史
- 收稿日期: 2018-02-02
树突状细胞(dendritic cell,DC)是体内最主要的抗原递呈细胞(antigen presenting cell,APC),能够显著刺激幼稚型T细胞进行增殖、分化,诱导逐步放大的级联特异性免疫,在天然免疫系统和获得性免疫系统之间起着桥梁作用[1-3]。按细胞谱系DC可分为髓系起源的经典树突状细胞(conventional DC or classical DC,cDC)和淋巴系起源的浆细胞样树突状细胞(plasmacytoid DC,pDC)。cDC主要来源于骨髓中的CD34+多向性造血干细胞和CD14+外周血单核细胞。cDC能高表达MHC-Ⅱ类分子,是主要的抗原呈递细胞,在病毒特异性T细胞反应中发挥主要作用[4]。pDC主要来源于血液、浆细胞样细胞,能够迅速对病毒作出反应并分泌高水平的抗病毒Ⅰ型干扰素,因此pDC在病毒感染中至关重要[5]。
肠道是机体最主要的免疫器官,肠黏膜被认为是执行局部特异性免疫反应的主要场所[6]。通过口服免疫可诱导肠道产生免疫应答,保护肠黏膜免受病原微生物的入侵和感染。肠道黏膜免疫的基础是肠相关淋巴组织(gut associated lymphoid tissue,GALT),该组织是诱导黏膜免疫反应主要部位,其中分布于派尔集合淋巴结(Peyer ’ s patch,PP结)、肠上皮及固有层淋巴组织中的DC在黏膜免疫反应中起着重要调节作用[7-10]。PP结是初次接触抗原并引发起始反应的位点,是肠黏膜免疫系统的重要组成部分,主要呈带状分布于回肠肠系膜对侧黏膜或黏膜下层,包括T细胞、B细胞、M细胞和DC等。其中黏膜上皮下分布的DC时刻监视着病原微生物的入侵,当肠腔内出现病原微生物时DC可伸出树突摄取相关抗原,经其加工处理并递呈给淋巴细胞,从而有效地对抗原产生免疫反应[7, 11]。目前用于研究参与肠道免疫的DC只能通过从骨髓细胞诱导的cDC或是从血液单核细胞诱导的pDC[12-15]。但通过体外诱导的DC并不能代表黏膜下处于正常状态下的DC。因此,建立黏膜下DC的分离和培养方法具有重要作用。
近年来,猪肠道传染病的爆发和流行给我国养猪业造成巨大的经济损失。通过口服免疫可有效阻止病原微生物的传播,有效控制肠道传染病[16-17]。肠道黏膜下分布的DC在摄取和递呈抗原给淋巴细胞启动免疫反应中发挥关键作用。基于DC在肠道免疫的重要作用,如何分离提取肠黏膜PP结中高纯度的DC成为首要任务。免疫磁珠法分离细胞是根据细胞表面抗原能与连接有磁珠的特异性单抗结合,在外加磁场中,经抗体与磁珠相连的细胞能够吸附而滞留在磁场中,无该种表面抗原的细胞由于不能与连接着磁珠的特异性单抗结合而没有磁性,不在磁场中停留,从而使细胞得以分离。免疫磁珠细胞分选方法可以在几分钟内从复杂的细胞混合物中分离出很高纯度的细胞,这种方法能够分离出较纯的细胞群体,而且有较好的存活率,但是只能根据一种细胞表面抗原进行分选。流式细胞术是目前应用最为广泛的细胞鉴定技术,该技术不仅有免疫磁珠的优点,还能根据细胞表面多种抗原分选细胞。本研究将肠黏膜细胞经密度梯度离心,然后根据细胞表面标志MHC-Ⅱ和SWC3a分别结合免疫磁珠分选、流式细胞术分选猪肠黏膜PP结DC,达到了比较理想的分离效果,为进一步研究猪肠黏膜处DC的生物学特性及其功能奠定物质基础。
1 材料与方法 1.1 材料 1.1.1 试验动物2月龄健康三元杂交猪(杜洛克×长白×大白)由江苏省农业科学院提供。
1.1.2 主要试剂RPMI 1640培养基(Gibco公司),美国澳洲胎牛血清(FBS)(维森特公司),青(链)霉素(鼎国生物有限公司),FITC(异硫氰荧光素,fluorescein isothiocyanate)标记小鼠抗猪MHC-Ⅱ抗体、PE(藻红蛋白,Phycoerythrin)标记小鼠抗猪SWC3a抗体(Abcam公司),Ca2+/Mg2+ Hank ’ s平衡盐溶液(Hank ’ s Balanced Salt Solution)(Gibco公司),乙二胺四乙酸(EDTA),percoll原液(索莱宝有限公司),CFSE(羟基荧光素二醋酸盐琥珀酰亚胺脂carboxyfluorescein succinimidyl amino ester),活细胞标记染料(Invitrogen公司),anti-PE磁珠(Miltenyi Biotec GmbH)。
1.2 试验方法 1.2.1 解剖和分离猪回肠PP结剪取含PP结的猪回肠,用镊子去除肠系膜和结缔组织,使用剪刀纵向剪开回肠,生理盐水洗掉肠腔内的粪便和黏液,经充分洗涤后使用剪刀和镊子剪取回肠处PP结,然后将其置于含5 mmol·L-1 EDTA的50 mL离心管中,再将离心管水平放置于摇床上,4 ℃孵育30 min。
1.2.2 组织消化和猪回肠淋巴细胞的分离将50 mL离心管中的液体弃掉,然后尽可能剪碎消化剩余物,在50 mL离心管中用15 mL消化液(4%胎牛血清、2 mg·mL-1 DNA酶、2 mg·mL-1胶原酶D、100 U·mL-1分散酶)37 ℃、200 r·min-1消化20 min,用含2% BSA的PBS终止消化,使用孔径为200 μm铜筛将消化产物进行机械研磨,然后使用75 μm的细胞滤器过滤至一个新的50 mL离心管中。用含2% BSA的PBS洗涤,并用8 mL 40%的Percoll溶液重悬并转移到15 mL离心管中;用长针头注射器在离心管底部缓慢加入5 mL 70%的Percoll溶液,2 000 r·min-1离心20 min;小心吸取中间层的淋巴细胞,转移到15 mL离心管中,用含2% BSA的PBS洗涤后,将细胞用适量PBS重悬,即得到初步分离肠道淋巴细胞。
1.2.3 磁珠分选法(MACS)富集SWC3a+细胞根据细胞特异性标志,采用磁珠分选法(magnetic activated cell sorting,MACS)分选细胞,调整细胞数为107 mL-1,将细胞表面标记抗体PE-SWC3a与单细胞悬液于4 ℃孵育20 min,用1 mL冰冷PBS洗涤,然后4 ℃、20 min偶联磁珠(anti-PE),再次用1 mL冰冷PBS洗涤,将细胞悬浮于500 μL分选缓冲液中,选用MS+柱,将细胞缓慢上柱,以缓冲液淋洗2次后从磁力架上取下分选柱,置于收集管,以1 mL缓冲液洗脱细胞,完成SWC3a+细胞1次分选。为提高纯度,将洗脱下来的细胞再过新柱分选纯化1次,应用流式细胞仪评估通过磁珠分选下来的细胞纯度。
1.2.4 抗体标记并流式细胞仪分选DC将1.2.2节所获得的单个细胞悬液与细胞表面标记抗体FITC-MHC-Ⅱ、PE-SWC3a冰上避光孵育20 min,用1 mL预冷的PBS洗涤,去除上清液后将细胞重新用500 μL流式缓冲液重悬,通过细胞滤网后进行流式细胞分析。根据DC在流式细胞仪中的大小以及颗粒度等特征,限定分选条件,获取DC。同时用流式细胞仪对MHC-Ⅱ+/SWC3a+细胞进行回测,鉴定分选DC的纯度。
1.2.5 猪肠黏膜PP结中DC形态观察在细胞培养期间,采用光学倒置显微镜对培养的DC形态进行观察并拍照。
1.2.6 混合淋巴细胞反应在同种异体的混合淋巴细胞反应(mixed lymphocyte reaction,MLR)试验中,应用羧基荧光素二酯酸盐琥珀酰亚胺酯(CFSE)活细胞染料按照Invitrogen试剂盒说明书标记淋巴细胞,然后与分选的DC按照1 : 5的比例进行混合并铺至24孔细胞板中,于37 ℃ 5% CO2培养箱中反应5 d,收集细胞,PBS清洗后流式细胞术检测CFSE标记的淋巴细胞增殖情况。
2 结果与分析 2.1 MACS分选PP结DC纯度MACS分选前和分选后SWC3a+细胞纯度分别为69.1%和90.2%(图 1-a)。由于仅标记细胞表面分子标志SWC3a+不能鉴定为DC,因此我们对MACS分选SWC3a+细胞同时标记细胞表面分子标志MHC-Ⅱ。结果显示:MACS分选SWC3a+细胞前和后,细胞表面分子SWC3a+/MHC-Ⅱ+双阳性细胞分别为26.4%和50.5%(图 1-b)。
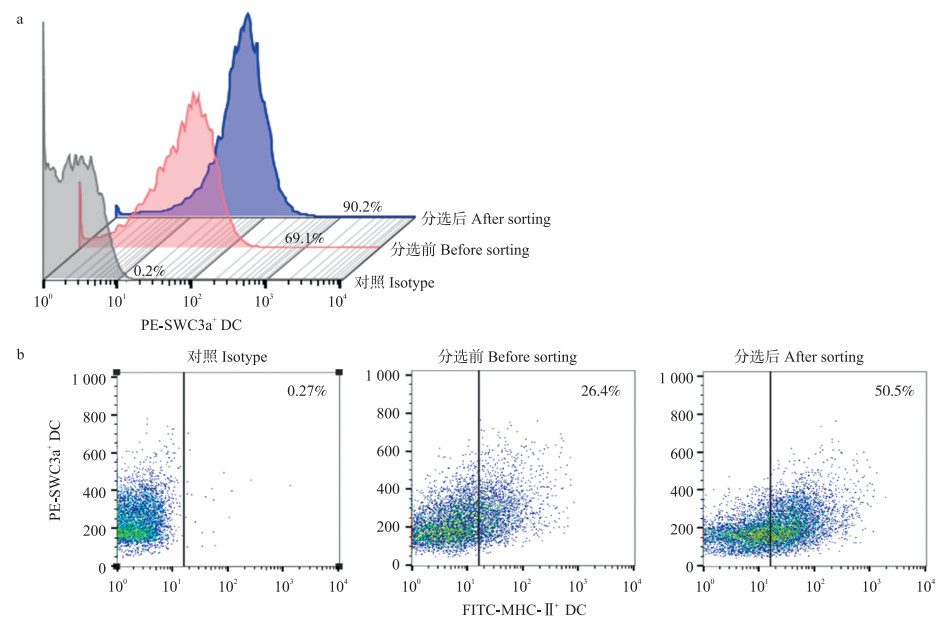
|
图 1 磁珠分选(MACS)派尔集合淋巴结(PP结)DC的纯度鉴定 Figure 1 The identification of Peyer ' s patches(PP)DC purity by magnetic cell sorting(MACS) a. MACS分选SWC3a+ DC的纯度。SWC3a+ DC purity by MACS sorting;b. MACS分选SWC3a+/MHC-Ⅱ+ DC的纯度。SWC3a+/MHC-Ⅱ+ DC purity by MACS sorting. |
通过密度梯度离心得到的肠黏膜细胞数量约为108,根据细胞表面分子标志SWC3a和MHC-Ⅱ,用流式细胞仪分选猪肠黏膜中PP结中DC,所得到的细胞数为5×106,回测结果显示猪肠黏膜PP结SWC3a+/MHC-Ⅱ+ DC的纯度高达95.6%(图 2)。
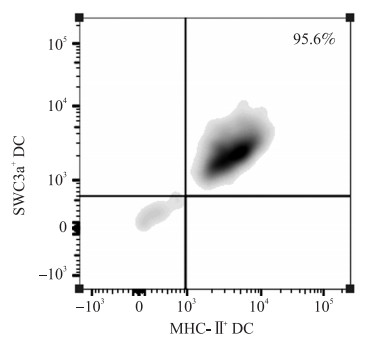
|
图 2 流式细胞术分选PP结DC纯度的鉴定 Figure 2 The identification of PP DC purity by flow sorting |
猪肠黏膜中PP结DC经流式细胞术分选2 d后,低倍镜下细胞培养板底部可见大部分细胞开始贴壁生长,细胞色泽明亮,体积较小,并且部分细胞聚集(图 3-a、b)。高倍镜下细胞表面不规则,略有突起(图 3-c)。
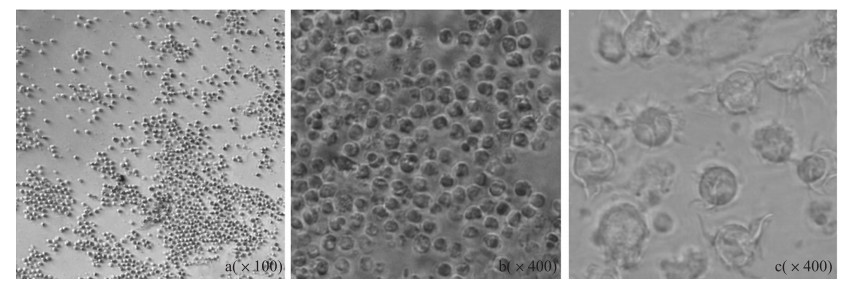
|
图 3 光镜下猪肠黏膜中PP结DC的形态观察 Figure 3 Morphology of DC from porcine PP under a light microscope |
猪DC具有强大的刺激同种异体淋巴细胞增殖的能力。我们检测了猪肠黏膜中PP结DC诱导同种异体淋巴细胞增殖情况。结果表明:DC与CFSE标记的淋巴细胞共培养5 d后,淋巴细胞增殖水平显著升高(图 4),这说明本试验所分离的肠黏膜中PP结DC具有一定活力,并能够刺激淋巴细胞增殖。
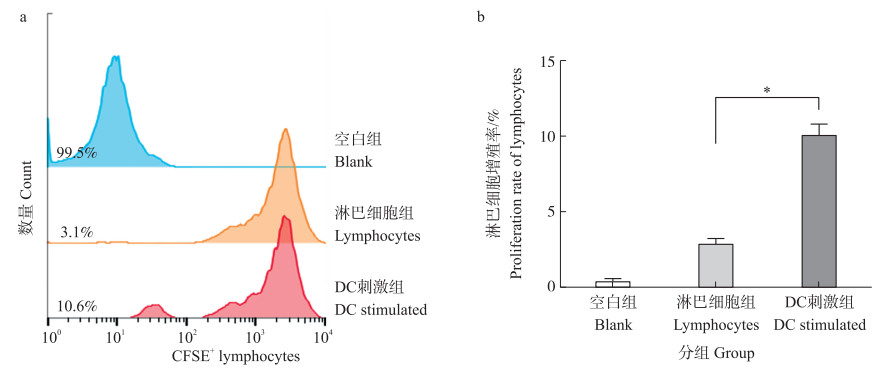
|
图 4 猪PP结DC刺激同种异体混合淋巴细胞的增殖反应 Figure 4 Proliferation reaction of allogenic mixed lymphocytes stimulated by porcine PP DC a.流式细胞仪检测DC刺激淋巴细胞增殖的结果The results of DC-stimulated lymphocyte proliferation by flow;b. DC刺激淋巴细胞增殖的统计结果The statistical results of DC-stimulated lymphocyte proliferation. *P<0.05. |
1973年加拿大科学家Steinman发现了DC,并在以后的研究中发现DC是抗原递呈能力最强大的细胞,DC不仅具有其他抗原递呈细胞所有的摄取、加工处理抗原并递呈抗原给T淋巴细胞,还是非特异性和特异性免疫的桥梁,具有重要的免疫调节作用。DC因其成熟时伸出许多树突样、毛刺样或伪足样突起而得名[3, 18]。DC分布在多种组织中,但DC数量极少,因此建立一种体外培养技术以获得足够数量的有功能的DC就显得非常重要。目前主要通过体外诱导血液和髓样细胞成DC,但体外诱导的DC不能代表机体的真实免疫状态。猪肠道DC不但能对致病菌产生免疫应答,而且能对肠腔内共生菌及各类食物蛋白产生免疫耐受[13]。肠道内DC主要定殖于PP结和肠系膜淋巴结(mesenteric lymph node,MLN),肠道上皮黏膜固有层只有少量DC分布,而PP结是肠道重要的免疫器官[7-9, 19]。因此,建立一种完善的体外分离培养猪肠黏膜中PP结DC的方法,对于研究猪肠黏膜处DC的生物学特性及其功能具有重要的意义。
细胞表面分子特异性标志是分离细胞的关键,找到DC的特异性免疫学标志,对DC的鉴定有着十分重要的意义。然而,到现在为止人们对DC的来源并不是非常确定,并且由于DC的复杂性和多变性,使人们尚未发现一种特异性表面标志是所有DC都携带的,这就导致鉴定DC十分困难和复杂。SWC3a(CD172a)主要表达在由骨髓发育而来的细胞上,该细胞表面分子主要用于区别DC和B细胞。MHCⅡ主要表达在抗原递呈细胞上,是外源性抗原递呈分子。Bimczok等[19]和Haverson等[20]通过免疫荧光发现猪肠黏膜中PP结DC高表达SWC3a和MHCⅡ;王振生等[21]通过选择CD1a+/SWC3a+双色流式细胞术结合形态观察,对分离的猪皮肤源DC进行了鉴定。因此,本试验分离猪肠黏膜中PP结DC所选用的细胞表面分子是SWC3a和MHCⅡ。
本试验首次应用密度梯度离心结合流式细胞术技术分选猪肠黏膜PP结DC,达到了比较理想的分离效果。在本试验中,猪肠黏膜中PP结细胞首先经EDTA、DNA酶、胶原酶D和分散酶处理,然后经Percoll溶液密度梯度离心制备成单细胞悬液,从而获得了包括DC、巨噬细胞、单核细胞和淋巴细胞等低密度单个核细胞,继续通过SWC3a磁珠的免疫磁性吸附和洗脱,有效纯化富集了SWC3a细胞,其中富集SWC3a细胞的纯度达到90%以上。然后,我们对富集的SWC3a细胞同时标记细胞表面分子MHC-Ⅱ,结果显示DC纯度为50.5%,达到了一个较理想的分选效果,但是这种纯度的细胞不能用于后续试验。流式细胞术是目前应用最为广泛的细胞鉴定技术,我们根据细胞表面分子标志SWC3a和MHC-Ⅱ选用流式细胞术分选肠黏膜中PP结DC,经鉴定分选的SWC3a+/MHC-Ⅱ+DC达到了理想纯度。经流式分选和纯化肠黏膜中PP结DC的生长状态良好,部分形成分散的细胞集落,并且分选到的DC具有刺激淋巴细胞增殖的能力。
小鼠是使用最多的动物模型,但小鼠的体型小,肠黏膜PP结中的DC含量也较少,并且小鼠的免疫系统与人类的相似度不足10%。而人肠黏膜PP结中DC的分离又难以实现。因此,目前关于肠黏膜PP结的研究较少。猪与人类在解剖学、遗传学和生理学上非常相似,其免疫系统和人的免疫系统相似度高达80%以上[22],大量试验证明猪可作为建立人类疾病感染的理想动物模型,分离、鉴定猪肠黏膜PP结中DC的特性、功能,不仅可以为猪的肠黏膜免疫奠定基础,也为人类相关疾病的研究提供一定的理论和实践基础。
| [1] |
Song L, Dong G, Guo L, et al. The function of dendritic cells in modulating the host response[J]. Molecular Oral Microbiology, 2018, 33(suppl 3): 13-21. |
| [2] |
Lanzavecchia A, Sallusto F. Regulation of T cell immunity by dendritic cells[J]. Cell, 2001, 106(3): 263-266. DOI:10.1016/S0092-8674(01)00455-X |
| [3] |
Akira S, Takeda K, Kaisho T. Toll-like receptors:critical proteins linking innate and acquired immunity[J]. Nature Immunology, 2001, 2(8): 675-680. DOI:10.1038/90609 |
| [4] |
Sozzani S, Del P A, Bosisio D. Dendritic cell recruitment and activation in autoimmunity[J]. Journal of Autoimmunity, 2017, 85: 126. DOI:10.1016/j.jaut.2017.07.012 |
| [5] |
Chen Y C, Rosenblum M D, Shinkai K. Plasmacytoid dendritic cells (pDCs) and regulatory T (Treg)cells may be the key to viral reactivation in drug-induced hypersensitivity syndrome (DIHS)[J]. Journal of the American Academy of Dermatology, 2016, 74(6): 1288-1289. DOI:10.1016/j.jaad.2015.11.031 |
| [6] |
Swiatczak B, Rescigno M. How the interplay between antigen presenting cells and microbiota tunes host immune responses in the gut[J]. Seminars in Immunology, 2012, 24(1): 43-49. |
| [7] |
Rescigno M, Di S A. Dendritic cells in intestinal homeostasis and disease[J]. Journal of Clinical Investigation, 2009, 119(9): 2441-2450. DOI:10.1172/JCI39134 |
| [8] |
Rescigno M. Chapter 4:intestinal dendritic cells[J]. Advances in Immunology, 2010, 107: 109-138. DOI:10.1016/B978-0-12-381300-8.00004-6 |
| [9] |
Chen V, Vallon-Eberhard A, Elinav E, et al. Intestinal lamina propria dendritic cell subsets have different origin and functions[J]. Immunity, 2009, 31(3): 502-512. DOI:10.1016/j.immuni.2009.06.025 |
| [10] |
Jung C, Hugot J P, Barreau F. Peyer's patches:the immune sensors of the intestine[J]. International Journal of Inflammation, 2010, 2010(3): 823710. |
| [11] |
Harman A N, Min K, Nasr N, et al. Tissue dendritic cells as portals for HIV entry[J]. Reviews in Medical Virology, 2013, 23(5): 319-333. DOI:10.1002/rmv.v23.5 |
| [12] |
Gao Q, Zhao S, Qin T, et al. Effects of porcine epidemic diarrhea virus on porcine monocyte-derived dendritic cells and intestinal dendritic cells[J]. Veterinary Microbiology, 2016, 179(34): 149-158. |
| [13] |
Zhao S, Gao Q, Qin T, et al. Effects of virulent and attenuated transmissible gastroenteritis virus on the ability of porcine dendritic cells to sample and present antigen[J]. Veterinary Microbiology, 2014, 171(1/2): 74-86. |
| [14] |
付佳, 梁金逢, 阴银燕, 等. 鸡骨髓源树突状细胞体外诱导培养及鉴定[J]. 南京农业大学学报, 2013, 36(2): 110-114. Fu J, Liang J F, Yin Y Y, et al. Culture and identification of chicken bone marrow-derived dendritic cells in vitro[J]. Journal of Nanjing Agricultural University, 2013, 36(2): 110-114 (in Chinese with English abstract). DOI:10.7685/j.issn.1000-2030.2013.02.017 |
| [15] |
刘芳, 乔艳艳, 薛洋, 等. 猪外周血单核细胞来源的树突状细胞体外诱导培养[J]. 江苏农业学报, 2016, 32(3): 588-592. Liu F, Qiao Y Y, Xue Y, et al. Porcine peripheral blood monocyte-derived dendritic cells cultured in vitro[J]. Jiangsu Journal of Agricultural Sciences, 2016, 32(3): 588-592 (in Chinese with English abstract). DOI:10.3969/j.issn.1000-4440.2016.03.016 |
| [16] |
Lin J, Tu C, Mou C, et al. CpG DNA facilitate the inactivated transmissible gastroenteritis virus in enhancing the local and systemic immune response of pigs via oral administration[J]. Veterinary Immunology & Immunopathology, 2016, 172: 1-8. |
| [17] |
Mou C, Zhu L, Xing X, et al. Immune responses induced by recombinant bacillus subtilis expressing the spike protein of transmissible gastroenteritis virus in pigs[J]. Antiviral Research, 2016, 131: 74-84. DOI:10.1016/j.antiviral.2016.02.003 |
| [18] |
Carrasco C P, Rigden R C, Schaffner R, et al. Porcine dendritic cells generated in vitro:morphological, phenotypic and functional properties[J]. Immunology, 2001, 104(2): 175-178. |
| [19] |
Bimczok D, Sowa E N, Faber-Zuschratter H, et al. Site-specific expression of CD11b and SIRPalpha (CD172a)on dendritic cells:implications for their migration patterns in the gut immune system[J]. European Journal of Immunology, 2005, 35(5): 1418-1427. DOI:10.1002/eji.v35:5 |
| [20] |
Haverson K, Singha S, Stokes C R, et al. Professional and non-professional antigen-presenting cells in the porcine small intestine[J]. Immunology, 2010, 101(4): 492-500. |
| [21] |
王振生, 遇奇, 李焕荣, 等. 猪皮肤源树突状细胞的分离和鉴定[J]. 中国农学通报, 2010, 26(17): 1-4. Wang Z S, Yu Q, Li H R, et al. Isolation and identification of swine skin-derived dendritic cells[J]. Chinese Agricultural Science Bulletin, 2010, 26(17): 1-4 (in Chinese). |
| [22] |
Dawson H. A comparative assessment of the pig, mouse and human genomes[J]. Veterinary Immunology and Immunopathology, 2009, 128: 211-347. |




