文章信息
- 高飞燕, 曹越, 艾昊, 刘秀丽, 杨晶, 冯冰, 徐国华, 孙淑斌
- GAO Feiyan, CAO Yue, AI Hao, LIU Xiuli, YANG Jing, FENG Bing, XU Guohua, SUN Shubin
- 水稻铁氧化酶基因OsLPR5对拟南芥根系发育和养分利用的影响
- Effects of rice ferroxidase gene OsLPR5 on root growth and nutrient utilization in Arabidopsis plants
- 南京农业大学学报, 2018, 41(6): 1054-1060
- Journal of Nanjing Agricultural University, 2018, 41(6): 1054-1060.
- http://dx.doi.org/10.7685/jnau.201803030
-
文章历史
- 收稿日期: 2018-03-15
2. 南京大学环境学院, 江苏 南京 210093
2. School of the Environment, Nanjing University, Nanjing 210093, China
磷(phosphorus,P)在植物体内含量约占植物干质量的0.05%~0.5%,是植物生长发育必需的大量营养元素之一[1]。它是生物体内生物膜、蛋白质、核酸、磷脂、ATP等重要物质的组成成分,广泛参与植物体内碳水化合物转运、糖类物质代谢及脂类物质代谢等代谢过程,在种子萌发、花粉发育和种子与果实的形成过程中起重要作用[2-5]。植物主要吸收土壤溶液中的正磷酸盐(inorganic orthophosphate,Pi)以满足自身需求,但其易被土壤中的钙、铁、铝等固定,因此土壤磷有效性低成为植物生长的重要限制因子[6]。
为了适应磷缺乏环境,植物在长期的进化过程中形成了一系列的适应性机制,包括改变根系构型、分泌有机酸、形成菌根及诱导磷转运蛋白表达等[7-9]。根形态构型改变是植株适应缺磷环境的重要机制。绝大多数植物根系感应到磷胁迫,其主根分生组织细胞分裂减缓,分生组织细胞减少,伸长区细胞增殖被抑制,伸长区长度变短,主根变短[10-12];侧根发育增强和侧根数增多,扩大根际的吸收面积,增强植物根系吸收的能力,获得较多的磷[13];根毛是植物在土壤缺磷条件下吸收磷营养的主要结构,传统理论认为足够多的根毛利于对磷素的吸收,植物在缺磷环境下根毛吸收了从外界获取的全部磷的90%[14-15]。近期的一则报道显示,单纯的增强根毛生长发育不一定能够增加植物对环境中磷的吸收,需要结合其他生理性状的改良[16]。关于植物根构型响应缺磷胁迫的分子机制,近些年来已有不少重要的基因被报道,其中铁氧化酶AtLPR1/2基因(LOW PHOSPHATE ROOT1/2)和P5型ATP酶PDR2(PHOSPHATE DEFFICIENCY ROOT2)相互作用,在调控根系构型响应磷胁迫的过程中起到重要作用,atlpr1/2突变体材料缺磷处理后与野生型相比主根增长,而atpdr2突变体与野生型相比主根变短,AtPDR2负调控AtLPR1/2 [17]。
根据已报道的拟南芥(Arabidopsis thaliana)AtLPR1 (At01g23010)与AtLPR 2 (At01g71040)基因,本实验室前期对水稻中LPR同源基因进行了比对和分析。Cao等[18]研究发现水稻含有5个LPR同源基因并命名为OsLPR1—OsLPR5,其中OsLPR5的基因结构、蛋白功能域分析等生物信息学特征与AtLPR1具有高度的一致性,而且表达模式分析发现其转录水平响应环境中磷饥饿胁迫。本研究通过体外原核表达确定OsLPR5基因编码蛋白铁氧化酶;构建OsLPR5基因全长转化atlpr1突变体的转基因材料,并对其根系构型和养分含量等方面进行了研究,旨在揭示水稻OsLPR5基因参与了响应环境磷胁迫下根系构型和养分利用等重要过程。
1 材料与方法 1.1 试验材料水稻(Oryza sativa L.)品种为‘日本晴’;拟南芥(Arabidopsis thaliana L.)哥伦比亚野生型Col-0和atlpr1突变体由法国国家科学研究中心(CNRS)生物微生物研究所提供。表达载体pTCK303和pGS-21a由本实验室保藏。
1.2 试验方法 1.2.1 pGS-21a-OsLPR5原核表达、纯化及酶活性测定Cao等[18]报道水稻基因组中具有5个LPR同源基因,根据相应基因序列号,在NCBI网站进行检索,获得OsLPR5基因生物信息学预测序列。构建pGS-21a-OsLPR5表达载体,转化Rosetta宿主菌制备表达菌株;采用GST标签蛋白纯化试剂盒(P2262)方法,诱导蛋白表达和纯化,获得目的蛋白;采用菲啰嗪法测定酶活性[19]。
1.2.2 拟南芥转基因材料的构建与培养根据表达载体pTCK303,设计PCR引物:F:5′- GGTACCATGAGCACACAGAGTGTCATT-3′;R:5′- GTCGACTTATTCGTCATGCACCATTTC-3′(下划线表示KpnⅠ和SalⅠ酶切位点)。以水稻cDNA为模板进行PCR扩增获得目的片段,利用限制性内切酶BamHⅠ/SpeⅠ双酶切及T4 DNA Ligase酶连体系,构建Ubi ∷ OsLPR5表达载体,并制备农杆菌转化菌株。
采用农杆菌花序侵染法转化拟南芥。将含有Ubi ∷ OsLPR5表达载体的农杆菌接种到200 mL的LB培养基(含终质量浓度为50 μg · mL-1氨苄青霉素、100 μg · mL-1利福平和100 μg · mL-1链霉素)中,28 ℃、200 r · min-1培养至D600值为1.2~1.6;4 000 g离心10 min,收集菌体;用渗透缓冲液重悬,调节到D600值为0.8~1.0;剪去拟南芥已部分长成型的长角果和部分已授粉的花序,于菌体重悬液中浸泡60 s,轻缓取出吸取多余重悬液,用塑料薄膜覆盖整株植株,在弱光或遮光条件下培养24 h,取下薄膜后在恒温光照培养箱中(温度:22 ℃;光照周期:光照16 h/黑暗8 h)继续培养至收获种子。
将收获的T0代种子低温春化3 d,用100 g · L-1 NaClO溶液消毒30 min,去离子水冲洗5~7次,放置含有潮霉素(20 mg · L-1)的MS培养基上,于恒温光照培养箱进行筛选,待拟南芥幼苗出芽后,阳性苗叶片颜色正常,并有实根长出,而非阳性苗叶片长出后发黄、枯萎,且未长出实根;剪下存活幼苗根尖部分,编号记录。幼苗根尖进行GUS染色鉴定,体式镜下观察染色后的拟南芥根尖,显蓝色即为阳性转化苗,未染出蓝色即为假阳性苗,获得转基因T1代苗;经过2代的遗传纯化磨合进一步鉴定筛选,获得多个纯合体转基因株系,根据表达效果,选出3个阳性株系进行进一步试验,并命名为OsLPR5/atlpr1 #1、OsLPR5/atlpr1 #2、OsLPR5/atlpr1 #3。
1.2.3 根系形态测定将拟南芥野生型、atlpr1突变体、OsLPR5转化株系在正常供磷(200 μmol · L-1 Pi)和低磷(10 μmol · L-1 Pi)的1/2 MS培养基上培养14 d后拍照、取样,并通过Expression 11000XL型根系扫描仪扫描,记录拟南芥植株根系形态,使用根系分析软件测量主根长度、侧根长度、侧根密度等根系指标。每个处理10个生物学重复。
1.2.4 总磷、总氮及其他矿质元素(钾、钠、铁、铜、锌)含量的测定将拟南芥野生型、atlpr1突变体、OsLPR5转化株系在正常供磷(200 μmol · L-1 Pi)和低磷(10 μmol · L-1 Pi)的1/2 MS培养基上培养14 d后,分别采集地上部和地下部植株样品,烘干,称质量,编号。用硫酸-双氧水消煮法消煮样品,利用钼锑抗比色法测定总磷含量[20];利用德国Bran+Luebbe AA3型连续流动分析仪测定总氮含量;利用安捷伦710型ICP-OES仪测定样品中的其他养分含量。每个处理3个生物学重复。
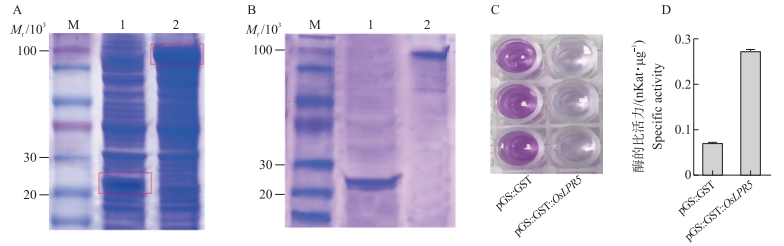
2 结果与分析 2.1 pGS-21a-OsLPR5融合蛋白表达、纯化及酶活性测定从图 1-A、B可知:GST标签蛋白相对分子质量约26×103;pGS-21a-OsLPR5融合蛋白相对分子质量约96×103。SDS-PAGE电泳结果显示,转入空载体pGS-21a和pGS-21a-OsLPR5的原核表达菌株裂解上清液均出现特异性条带(图 1-A)。通过BeyoGoldTM GST-tag Purification Resin对空载体pGS-21a和pGS-21a-OsLPR5表达上清液进行纯化,SDS-PAGE电泳分析发现均得到单一的条带(图 1-B)。菲啰嗪法测定蛋白的铁氧化酶活性,结果发现pGS-21a-OsLPR5融合蛋白的铁氧化酶活性明显高于空载体pGS-21a(图 1-C、D),说明OsLPR5编码蛋白具有铁氧化酶活性。
|
图 1 pGS-21a-OsLPR5融合蛋白表达、纯化产物及酶活性测定 Figure 1 Expression, purification products and specific activity analysis of pGS-21a-OsLPR5 fusion protein A. pGS-21a-OsLPR5表达产物SDS-PAGE电泳;B. pGS-21a-OsLPR5纯化产物SDS-PAGE电泳;C.纯化蛋白的铁氧化酶活性测定的显色结果;D.纯化蛋白的铁氧化酶比活力。M.蛋白标准分子质量;1. pGS ∷ GST;2. pGS ∷ GST ∷ OsLPR5。 A. SDS-PAGE analysis of pGS-21a-OsLPR5 expression product; B. SDS-PAGE analysis of pGS-21a-OsLPR5 purified product; C. Coloration results of ferroxidase activity assay of purified protein; D. Specific activity of ferroxidase enzyme of purified protein. M. Protein mark; 1. pGS ∷ GST; 2. pGS ∷ GST ∷ OsLPR5. |
我们构建了Ubiquitin启动子OsLPR5表达载体,对拟南芥atlpr1纯合突变体进行侵染,获得T0代转基因种子。潮霉素初步筛选确定为拟南芥转化株。GUS染色鉴定结果表明:野生型与atlpr1突变体根部均不显色,3株转化株根尖染出蓝色,均为阳性(图 2-A)。RT-PCR检测OsLPR5的表达情况(Actin作为内参基因),结果发现AtLPR1基因仅在野生型中检测到表达;OsLPR5在拟南芥野生型和atlpr1突变体中均未表达,阳性株系中均有表达(图 2-B)。这表明OsLPR5成功转入到拟南芥atlpr1突变体中,并在转化株系中具有较高的表达丰度。

|
图 2 OsLPR5转化拟南芥突变体材料的GUS检测(A)和RT-PCR分子鉴定(B) Figure 2 Histochemical analysis of GUS activity(A) and RT-PCR analysis(B) of OsLPR5 -overexpressing lines WT:野生型;OsLPR5/atlpr1 (#1、#2、#3):OsLPR5转化拟南芥atlpr1突变体材料。 WT:Wild type; OsLPR5/atlpr1 (#1, #2, #3):OsLPR5-overexpressing lines in Arabidopsis atlpr1 mutants. |
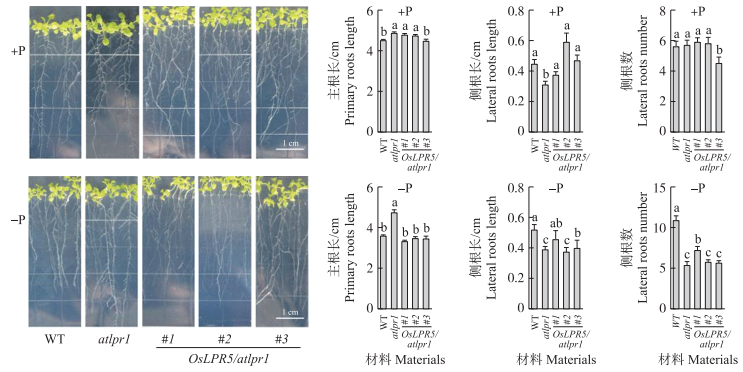
由图 3可见:正常供磷条件下,与野生型相比,OsLPR5/atlpr1 #1和OsLPR5/atlpr1 #2主根变长,分别增加了6.3%和5.2%,趋于atlpr1突变体;低磷条件下,atlpr1突变体主根长度与野生型相比增加了32.2%,而OsLPR5转化株系主根长均趋于野生型。正常供磷条件下,与野生型相比,atlpr1突变体侧根变短,降低27.1%, OsLPR5转化株系侧根长均无显著性变化;低磷条件下,与野生型相比,OsLPR5/atlpr1 (#2、#3)侧根长变短,分别降低33.9%和15.7%,趋于atlpr1突变体。对侧根数统计分析发现,正常供磷条件下,除OsLPR5/atlpr1 #3侧根数减少19.6%,其余之间无差异;低磷条件下,OsLPR5/atlpr1 (#2、#3)侧根数与atlpr1突变体相比无明显差异,少于野生型33.9%~48.0%。OsLPR5过量表达能够回补atlpr1突变体在低磷条件下主根特异变长的表型,说明OsLPR5在植株根系构型方面起到重要作用。
|
图 3 OsLPR5转化拟南芥突变体材料的根系表型分析 Figure 3 Root phenotype analysis of OsLPR5 -overexpressing lines +P:正常供磷Pi-sufficient; -P:低磷Pi-deficient.不同小写字母表示在0.05水平差异显著。Different lowercase letters indicate significant differences at 0.05 level. The same as follows. |
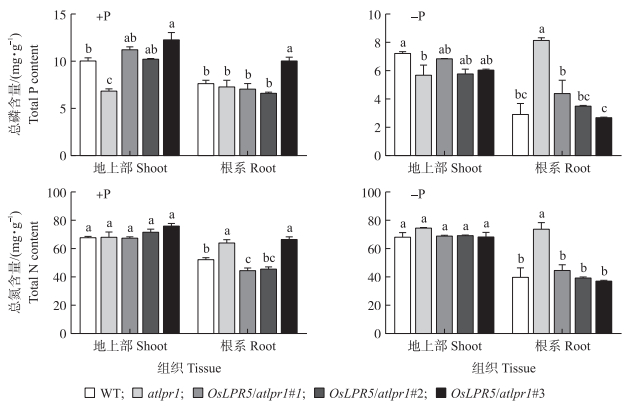
由图 4可见:正常供磷条件下,OsLPR5转化株地上部总磷含量高于突变体,除OsLPR5/atlpr1#3外与野生型无差异;低磷条件下,OsLPR5转化株地上部总磷含量与突变体或野生型均无差异。低磷条件下,atlpr1突变体根系总磷含量较野生型增加了约1.2倍,而OsLPR5转化株系磷含量较atlpr1突变体显著下降,与野生型相比均无显著差异。这说明OsLPR5基因在atlpr1突变体中过量表达影响植株对磷素的利用。
|
图 4 OsLPR5转化拟南芥突变体材料中总磷和总氮含量 Figure 4 Total phosphors and nitrogen contents of OsLPR5 -overexpressing lines |
从图 4可见:不论正常供磷还是低磷条件下,与野生型及突变体atlpr1相比,OsLPR5转化株系地上部的总氮含量均无显著性差异。正常供磷条件下,atlpr1突变体根系中总氮含量较野生型增加20%,OsLPR5/atlpr1#2根系的总氮含量与野生型相比无显著差异;低磷条件下,atlpr1突变体根系中总氮含量较野生型增加50%,OsLPR5转化株系根系的总氮含量与野生型相比无显著差异。这说明在不同磷水平处理条件下,OsLPR5基因在拟南芥中超表达影响植株对氮素的利用。
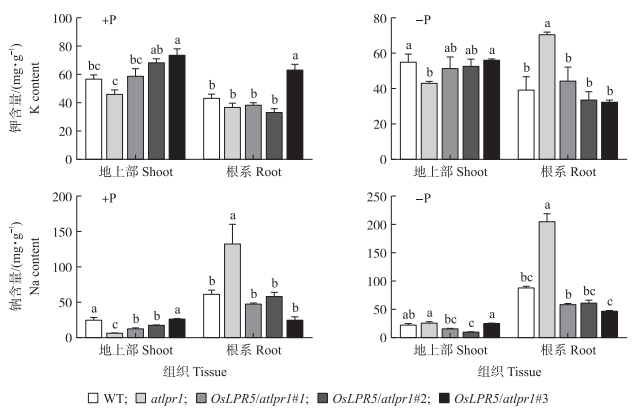
2.5 OsLPR5转化材料中多种矿质元素含量的测定由图 5可见:正常供磷条件下,除OsLPR5/atlpr1#3外,其他材料根系钾含量无差异;低磷条件下,OsLPR5转化株系根系钾含量较atlpr1突变体显著下降,与野生型相比没有明显差异。正常供磷、低磷条件下,OsLPR5转化株系根系钠含量较atlpr1突变体显著降低了约67%~78%,与野生型无显著差异。
|
图 5 OsLPR5转化拟南芥突变体材料中的钾和钠含量 Figure 5 Total potassium and sodium contents of OsLPR5 -overexpressing lines |
在正常供磷条件下,除了OsLPR5/atlpr1 (#2、#3)的根系总铜含量降低之外,其余材料中地上部和根系的总铁、铜及锌的含量均无明显差异(图 6)。低磷条件下,OsLPR5转化株系根系铁、铜及锌含量较atlpr1突变体显著降低,铁、铜、锌含量分别降低了50%~61%、61%~88%和39%~62%,趋于野生型(图 6)。
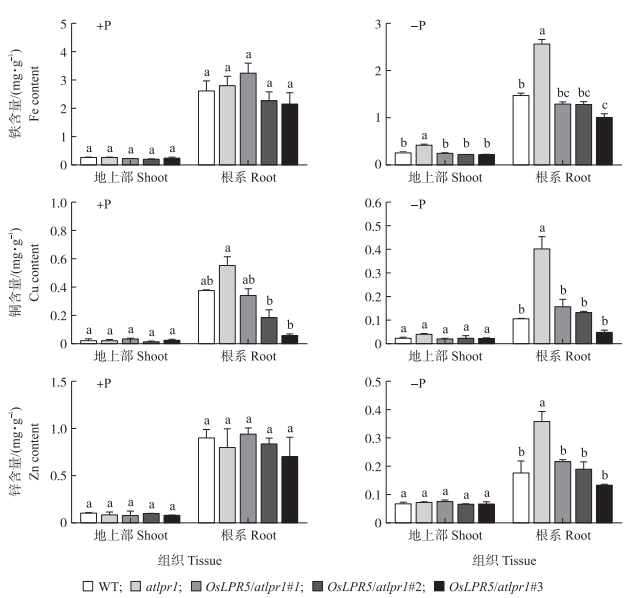
|
图 6 OsLPR5转化拟南芥突变体材料中铁、铜和锌含量 Figure 6 Total iron, copper and zinc contents of OsLPR5 -overexpressing lines |
以上结果说明,OsLPR5的过量表达显著抑制了低磷条件下atlpr1突变体根系中5种元素过量积累现象,表明在OsLPR5基因调控下,植株对这5种元素的利用可能受环境磷素水平的影响。
3 讨论在植物体中存在一类参与细胞内调控氧化还原系统作用的多铜氧化酶(multicopper oxidase,MCO),包括漆酶、抗坏血酸氧化酶、单铜氧化酶、铁氧化酶等。AtLPR1是植物中首个鉴定出的编码铁氧化酶基因,在低磷条件下会增强对根系细胞亚铁的氧化,从而抑制根细胞的分化和生长[19, 21]。Cao等[18]通过比对分析发现,OsLPR5氨基酸序列与AtLPR1具有很高的保守性,OsLPR5与AtLPR1含有3个铜氧化酶的典型结构域,这些生物信息学的特征表明,OsLPR5基因很可能编码铁氧化酶。我们前期工作中,通过酵母和本氏烟草的异源体系检测试验,发现OsLPR5可能为编码铁氧化酶基因,但存在的问题是无法排除酵母或烟草自身表达蛋白的影响,因此不能说明铁氧化酶活性来源于OsLPR5表达的蛋白。本研究中,通过体外原核表达系统纯化获得单一的OsLPR5编码蛋白,酶活性检测确定OsLPR5基因编码铁氧化酶。本研究还发现,在低磷条件下,OsLPR5过量表达株系中基因表达丰度不同导致主根变短,回补了atlpr1突变体在低磷环境中主根特异变长的表型,表明OsLPR5基因在植株根系发育方面发挥重要的作用,但要阐明其在水稻根系建成中的作用,还需要在水稻体系中进行验证。
植物对磷的吸收和转运,主要是通过磷酸盐转运蛋白实现的。拟南芥中磷转运蛋白家族成员的功能已鉴定,其中磷转运蛋白一家族成员负责不同组织器官、不同磷营养条件下磷酸盐的吸收与转运[22-23];磷转运蛋白二家族成员主要负责质体中的磷酸盐转运[24];磷转运蛋白五家族成员定位在液泡膜上,负责维持细胞内的磷稳态[25]。AtLPR1基因编码铁氧化酶类蛋白,生化功能上与植物磷转运过程无直接联系,但是其在磷局部信号响应、传递过程中起到重要作用[17]。本研究发现,在atlpr1突变体中,地上部转运磷的比例较野生型显著降低,OsLPR5过量表达株系地上部转运磷的比例与野生型非常接近。综上我们推测OsLPR5基因可能参与根系响应外界磷水平,从而影响植株对磷的利用。
AtLPR1编码铁氧化酶,直接影响根细胞质外体中铁的营养状况,说明LPR基因参与植物中铁营养代谢过程。而多酮氧化酶家族成员底物较为广泛,除亚铁离子外还能以铜离子等作为电子供体[26]。LPR基因表达水平沉默或者过量表达时,可能会影响植株中其他多酮氧化酶家族成员的表达丰度,其中可能包涵某些以其他金属为底物或构成辅酶的家族成员,从而对其他金属离子的吸收、积累产生影响。本研究中,在低磷胁迫下,OsLPR5影响5种金属元素的吸收,为研究OsLPR5基因参与响应环境磷胁迫下植物中这5种营养代谢过程提供了依据。
综上所述,OsLPR5基因编码铁氧化酶,参与响应环境磷胁迫下的植株根系构型和养分利用等重要过程,为进一步深入研究水稻基因OsLPR5在水稻生长发育过程中的作用奠定了基础。
| [1] |
Vance C P, Uhde-Stone C, Allan D L. Phosphorus acquisition and use:critical adaptations by plants for securing a nonrenewable resource[J]. New Phytologist, 2003, 157(3): 423-447. DOI:10.1046/j.1469-8137.2003.00695.x |
| [2] |
Raghothama K G, Karthikeyan A S. Phosphate acquisition[J]. Plant and Soil, 2005, 274: 37-49. DOI:10.1007/s11104-004-2005-6 |
| [3] |
Rausch C, Bucher M. Molecular mechanisms of phosphate transport in plants[J]. Planta, 2002, 216(1): 23-37. DOI:10.1007/s00425-002-0921-3 |
| [4] |
Jones D L, Rousk J, Edwards-Jones G, et al. Biochar-mediated changes in soil quality and plant growth in a three year field trial[J]. Soil Biology & Biochemistry, 2012, 45: 113-124. |
| [5] |
Marschner H. Mineral nutrition of higher plants[J]. The Journal of Ecology, 1988, 76(4): 1250. |
| [6] |
Richardson A E, Barea J M, McNeill A M, et al. Acquisition of phosphorus and nitrogen in the rhizosphere and plant growth promotion by microorganisms[J]. Plant and Soil, 2009, 321(1): 305-339. |
| [7] |
梁永书, 周军杰, 南文斌, 等. 水稻根系研究进展[J]. 植物学报, 2016, 51(1): 98-106. Liang Y S, Zhou J J, Nan W B, et al. Progress in rice root system research[J]. Bulletin of Botany, 2016, 51(1): 98-106 (in Chinese with English abstract). |
| [8] |
吴伟明, 程式华. 水稻根系育种的意义与前景[J]. 中国水稻科学, 2005, 19(2): 174-180. Wu W M, Cheng S H. Significance and prospects of breeding for root system in rice (Oryza sativa)[J]. Chinese Journal of Rice Science, 2005, 19(2): 174-180 (in Chinese with English abstract). DOI:10.3321/j.issn:1001-7216.2005.02.015 |
| [9] |
Ai P H, Sun S B, Zhao J N, et al. Two rice phosphate transporters, OsPht1; 2 and OsPht1; 6, have different functions and kinetic properties in uptake and translocation[J]. Plant Journal, 2009, 57(5): 798-809. DOI:10.1111/tpj.2009.57.issue-5 |
| [10] |
Ticconi C A, Abel S. Short on phosphate:plant surveillance and countermeasures[J]. Trends in Plant Science, 2004, 9(11): 548-555. DOI:10.1016/j.tplants.2004.09.003 |
| [11] |
Williamson L C, Ribrioux S P, Fitter A H, et al. Phosphate availability regulates root system architecture in Arabidopsis[J]. Plant Physiology, 2001, 126(2): 875-882. DOI:10.1104/pp.126.2.875 |
| [12] |
Hammond J P, White P J. Sucrose transport in the phloem:integrating root responses to phosphorus starvation[J]. Journal of Experimental Botany, 2008, 59(1): 93-109. |
| [13] |
Chevalier F, Pata M, Nacry P, et al. Effects of phosphate availability on the root system architecture:large-scale analysis of the natural variation between Arabidopsis accessions[J]. Plant Cell & Environment, 2003, 26(11): 1839-1850. |
| [14] |
Smith S E, Dickson S, Smith F A. Nutrient transfer in arbuscular mycorrhizas:how are fungal and plant processes integrated?[J]. Functional Plant Biology, 2001, 28(7): 685-696. DOI:10.1071/PP01033 |
| [15] |
Lynch J P, Brown K M. Topsoil foraging:an architectural adaptation of plants to low phosphorus availability[J]. Plant and Soil, 2001, 237(2): 225-237. DOI:10.1023/A:1013324727040 |
| [16] |
Zhang C, Simpson R J, Kim C M, et al. Do longer root hairs improve phosphorus uptake?Testing the hypothesis with transgenic Brachypodium distachyon lines overexpressing endogenous RSL genes[J]. New Phytologist, 2018, 217(4): 1654-1666. DOI:10.1111/nph.14980 |
| [17] |
Ticconi C A, Lucero R D, Sakhonwasee S, et al. ER-resident proteins PDR2 and LPR1 mediate the developmental response of root meristems to phosphate availability[J]. Proc Natl Acad Sci USA, 2009, 106(33): 14174-14179. DOI:10.1073/pnas.0901778106 |
| [18] |
Cao Y, Ai H, Jain A, et al. Identification and expression analysis of OsLPR family revealed the potential roles of OsLPR3 and 5 in maintaining phosphate homeostasis in rice[J]. BMC Plant Biology, 2016, 16(1): 210. DOI:10.1186/s12870-016-0853-x |
| [19] |
Müller J, Toev T, Heisters M, et al. Iron-dependent callose deposition adjusts root meristem maintenance to phosphate availability[J]. Developmental Cell, 2015, 33(2): 216-230. DOI:10.1016/j.devcel.2015.02.007 |
| [20] |
Li H J. Comparative study on determination of phosphorus content in two kinds of plants[J]. Modern Agricultural Science & Technology, 2012, 11: 16-17. |
| [21] |
Svistoonoff S, Creff A, Reymond M, et al. Root tip contact with low-phosphate media reprograms plant root architecture[J]. Nature Genetics, 2007, 39(6): 792-796. DOI:10.1038/ng2041 |
| [22] |
Shin H, Shin H S, Dewbre G R, et al. Phosphate transport in Arabidopsis:pht1; 1 and pht1; 4 play a major role in phosphate acquisition from both low-and high-phosphate environments[J]. Plant Journal, 2004, 39(4): 629-642. DOI:10.1111/tpj.2004.39.issue-4 |
| [23] |
Nagarajan V K, Jain A, Poling M D, et al. Arabidopsis Pht1; 5 mobilizes phosphate between source and sink organs and influences the interaction between phosphate homeostasis and ethylene signaling[J]. Plant Physiology, 2011, 156(3): 1149-1163. DOI:10.1104/pp.111.174805 |
| [24] |
Daram P, Brunner S, Rausch C, et al. Pht2; 1 encodes a low-affinity phosphate transporter from Arabidopsis[J]. Plant Cell, 1999, 11(11): 2153-2166. DOI:10.1105/tpc.11.11.2153 |
| [25] |
Liu T Y, Huang T K, Yang S Y, et al. Identification of plant vacuolar transporters mediating phosphate storage[J]. Nature Communications, 2016, 7: 11095. DOI:10.1038/ncomms11095 |
| [26] |
Solomon E I, Augustine A J, Yoon J. O2 reduction to H2O by the multicopper oxidases[J]. Dalton Transactions, 2008, 252(30): 3921-3932. |




