文章信息
- 张伟, 张琳, 李茹, 陈国奇, 董立尧
- ZHANG Wei, ZHANG Lin, LI Ru, CHEN Guoqi, DONG Liyao
- 不同遗传类群抗五氟磺草胺稗种子萌发对逆境条件的响应
- The response of seed germination of penoxsulam-resistant Echinochloa crusgalli (L.) P. Beauv from different genetic backgrounds to adverse conditions
- 南京农业大学学报, 2018, 41(6): 1045-1053
- Journal of Nanjing Agricultural University, 2018, 41(6): 1045-1053.
- http://dx.doi.org/10.7685/jnau.201712005
-
文章历史
- 收稿日期: 2017-12-04
2. 上海青浦区农业技术推广服务中心, 上海 201700;
3. 徐淮地区淮阴农业科学研究院, 江苏 淮安 223001
2. Shanghai Qingpu District Agricultural Technology Extension Service Center, Shanghai 201700, China;
3. Xuhuai District Huaiyin Academy of Agricultural Sciences, Huai'an 223001, China
稗[Echinochloa crusgalli (L.) P. Beauv]隶属禾本科, 为一年生杂草, 是18种世界性恶性杂草之一[1], 稗草发生与危害面积高达9.4×105 hm2, 占稻田总面积的43.5%[2]。相关试验表明, 稗草密度为1.67株· m-2时, 水稻分蘖数将降低5.63%, 水稻产量下降16.48%[3]。稗的防除现主要依赖化学药剂, 五氟磺草胺因杀草谱广、持效期长和对作物安全等特点在稻田广泛使用[4], 但长期使用使得多种杂草对其产生了抗药性, 目前已报道有稗、泽泻(Alisma plantago-aquatica)、水田稗(E. oryzoides)等9种杂草对五氟磺草胺产生抗药性[5]。
近几年,随着五氟磺草胺的使用, 东北、华中和华东等地区均有农户反映使用药剂后未能有效控制稻田稗的发生, 田间稗属杂草发生严重, 尤以华东地区发生最为严重。针对抗五氟磺草胺稗危害的扩大, 目前多数学者对其抗性状况[6-8]、抗性机制[9]或防除措施[10-12]进行研究, 但针对抗性稗的生物学特性鲜有报道。而种子萌发作为植物生活史的重要阶段[13], 种子在各环境条件下萌发能力的强弱很大程度上成为后期杂草种群能否成功建立的关键。萌发阶段作为杂草对外界条件刺激最敏感的时期, 种子萌发除受自身的种子活力和休眠情况等内部因素外, 还受到温度、水势和盐分含量等外界因素的影响[14-15]。温度是影响种子萌发和物种分布中最重要的环境信号[16], 杂草对温差变化的高适应性为其进行南北向长距离传播提供可能。水分、盐浓度、埋土深度和酸碱度变化对种子萌发也具有重要影响, 当其变化超过种子萌发的临界水平, 会产生一定的毒害作用, 导致萌发时间的延长和萌发率的降低[17-19]。若杂草对环境变化具有高度适应性, 则使其向外不断扩散, 造成大面积草害。目前虽有个别报道对稗的萌发特性进行了研究[20], 但缺少对抗五氟磺草胺稗萌发特性的研究, 因此本试验通过研究抗五氟磺草胺稗萌发特性, 旨在明确不同抗性稗在种子萌发上的差异性, 确定其抗性稗在萌发阶段是否存在适合度代价, 为进一步农田抗性杂草的综合治理和保障农业安全生产提供理论依据。
1 材料与方法 1.1 试验材料供试种子:根据前期对华东区稗遗传背景的研究, 该地区的稗可分为苏南、苏北和皖南3个遗传类群[21], 各遗传背景中选取1个抗性种群, 并选取其中1个遗传背景的敏感种群作为研究材料。抗性种群AXXZ-8[皖南, ED50值(以有效剂量计,以下同)为53.16 g · hm-2]、SSXB-1(苏南, ED50值为28.40 g · hm-2)、JHHZ-1(苏北, ED50值为20.44 g · hm-2)和敏感种群JLGY-3(苏北, ED50值为1.55 g · hm-2)(表 1), 田间推荐剂量处理下抗性种群植株死亡率为0, 敏感种群死亡率为100%。
| 种群 Population |
地区 Region |
温度范围/℃ Temperature range |
天气概况(2015-06—2015-10) Weather situation |
| AXXZ-8 | 安徽省宣城市宣州区 Xuanzhou, Xuancheng, Anhui |
9~37 | 晴18 d、多云61 d、阴9 d、雨65 d Clear 18 d, cloudy 61 d, overcast 9 d, rainy 65 d |
| SSXB-1 | 上海市松江区 Songjiang, Shanghai |
10~38 | 晴8 d、多云58 d、阴1 d、雨86 d Clear 8 d, cloudy 58 d, overcast 1 d, rainy 86 d |
| JHHZ-1 | 江苏省淮安市洪泽区 Hongze, Huai’an, Jiangsu |
8~35 | 晴10 d、多云90 d、阴5 d、雨48 d Clear 10 d, cloudy 90 d, overcast 5 d, rainy 48 d |
| JLGY-3 | 江苏省连云港市赣榆区 Ganyu, Lianyungang, Jiangsu |
5~36 | 晴7 d、多云93 d、阴6 d、雨47 d Clear 7 d, cloudy 93 d, overcast 6 d, rainy 47 d |
| 注:天气概况数据来源于天气网(http://lishi.tianqi.com)。 Note:The data of weather situation was obtained from the web(http://lishi.tianqi.com). |
|||
供试试剂:邻苯二甲酸氢钾(分析纯), 天津市科密欧化学试剂有限公司; 氢氧化钠(分析纯), 广东汕头市西陇化工厂; 浓盐酸(分析纯), 南京化学试剂股份有限公司; 聚乙二醇6000(PEG6000)(分析纯), 天津市科密欧化学试剂有限公司; N-3(羟甲基)甲基甘氨酸(tricine)、2-(N-吗啉)乙磺酸(MES)、4-羟乙基哌嗪乙磺酸(HEPES), Solarbio专业生化试剂供应商。
1.2 不同逆境胁迫下种子萌发的差异性将不同遗传类群的各稗种群种子置于放有2层滤纸的直径9 cm的玻璃培养皿中, 每皿20粒。每皿移入5 mL蒸馏水或处理液, 每隔1 d补充适量蒸馏水或处理液, 以防止处理条件变化。除水势和温度处理外, 其他处理均置于昼/夜温度为30 ℃/25 ℃、光/暗培养时间为12 h/12 h、光密度为250 μmol · m-2 · s-1的光照培养箱内培养, 每日记录相应萌发数直至播种后的21 d, 当种子胚根可见即认定为种子萌发, 之后萌发种子移出培养皿。各试验中每个处理均重复4次。
1.2.1 种子萌发对温度胁迫的响应昼/夜温度分别设定为7个变温处理(10 ℃/5 ℃、15 ℃/10 ℃、20 ℃/15 ℃、25 ℃/20 ℃、30 ℃/25 ℃、35 ℃/30 ℃和40 ℃/35 ℃), 光/暗培养时间为12 h/12 h, 光密度为250 μmol · m-2 · s-1。每日记录各处理种子萌发数。
1.2.2 种子萌发对盐胁迫的响应用氯化钠配制浓度分别为50、100、150、200、250、300、350和400 mmol · L-1的盐溶液, 并以蒸馏水为对照进行萌发试验, 每日记录各处理种子萌发数。
1.2.3 种子萌发对水势胁迫的响应根据公式(1)计算25 ℃下配置各水势所需PEG6000的质量, 分别配置成水势为-0.1、-0.2、-0.3、-0.4、-0.5和-0.6 MPa的溶液, 以蒸馏水为对照, 将培养皿置于恒温25 ℃光照培养箱中培养, 其他条件不变[22]。用蒸馏水为对照, 每皿移取对应水溶液5 mL, 每2 d更换1次滤纸, 以减少水势变动。各温度下水势计算公式如下:
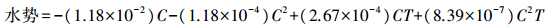
|
(1) |
式中:C为温度T时PEG6000的质量浓度(g · L-1)。
1.2.4 种子萌发对酸碱胁迫的响应将种子分别置于pH值为3~12的缓冲液中, 用2 mmol · L-1邻苯二甲酸氢钾与1 mol · L-1的HCl配制pH值为3、4的缓冲液, 用2 mmol · L-1的2-(N-吗啉)乙磺酸(MES)与1 mol · L-1的NaOH配制pH为5、6的缓冲液, 用2 mmol · L-1的4-羟乙基哌嗪乙磺酸(HEPES)与1 mol · L-1的NaOH配制pH值为7、8的缓冲液, 用2 mmol · L-1的N-3(羟甲基)甲基甘氨酸(tricine)与1 mol · L-1的NaOH配制pH值为9~12的缓冲液[23]。以蒸馏水(pH6.8)为对照, 其他条件不变。
1.2.5 种子萌发对埋土深度的响应在直径为12 cm、深度约13 cm的底部带孔的塑料盆钵内装入等高的有机质(0~6 mm微粒, pH6, 不含任何种子), 底部浸水至土壤湿润。每盆钵播种20粒稗种子, 设不覆土和覆土深度分别为1、2、4、6和8 cm,共6个处理。置于昼/夜温度为30 ℃/25 ℃、光/暗培养时间为12 h/12 h、光密度为250 μmol · m-2 · s-1的光照培养箱内培养, 每天记录种子出苗数。各处理均重复4次。各覆土处理均需上部喷水以保持有机质湿润。
1.3 数据计算与统计方法 1.3.1 种子萌发率萌发种子数占供试种子的比例。计算方法如下:

|
(2) |
式中:GP表示萌发率; SNm表示萌发种子数; SN0表示供试种子数。
1.3.2 种子发芽势最初7 d内的萌发率。发芽势的大小表示发芽速率的大小, 也表明种子活力的强弱。计算公式如下:

|
(3) |
式中:GE表示发芽势; SN7表示7 d内萌发种子数。
1.3.3 种子发芽指数反映种子发芽整齐程度的指标。计算方法如下:
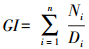
|
(4) |
式中:GI表示种子发芽指数; Ni表示第i天萌发种子数; Di表示相应的萌发时间(d); n表示萌发持续时间(d)。
1.3.4 数据处理试验数据采用SPSS 20.0软件进行方差分析, 并用独立样本t检验对相同遗传背景的敏感种群JLGY-3和抗性种群JHHZ-1的差异显著性进行比较, 采用新复极差法(Duncan ’ s)对不同遗传背景的抗性种群JHHZ-1、SSXB-1和AXXZ-8进行差异显著性比较。采用SigmaPlot 10.0软件进行非线性拟合。利用回归分析确定水势、盐胁迫及埋土深度与最终萌发率的拟合曲线,方程如下:
式中:x为水势、盐胁迫浓度或者埋土深度; G为水势、盐分胁迫和埋土深度为x条件下的萌发率(%); Gmax为最大萌发率(%); x50为最大萌发率50%时的水势、盐浓度或者埋土深度; Grate为方程的斜率。
2 结果与分析 2.1 种子萌发对温度变化的响应从表 2可知:当昼/夜温度为15 ℃/10 ℃及以下时, 同一遗传背景下的敏感种群JLGY-3萌发率和发芽指数显著高于抗性种群JHHZ-1, 敏感种群对低温胁迫表现为高适应性; 20 ℃/15 ℃及以上时, 两者各指标均无显著差异, 两者对高温胁迫具有相同的适应性; 当温度为40 ℃/35 ℃时, 不同遗传背景抗性种群间的AXXZ-8萌发率与发芽势均显著低于JHHZ-1和SSXB-1, JHHZ-1的萌发率和SSXB-1无显著差异并显著高于AXXZ-8。3种群的发芽指数差异性显著并表现为JHHZ-1最大, SSXB-1次之, AXXZ-8最小。通过比较, 3种群中的JHHZ-1对高温胁迫表现为高适应性, SSXB-1次之, AXXZ-8最低; 当温度为10 ℃/5 ℃时, 3个抗性种群的萌发率低于30%且无显著差异, 但JHHZ-1发芽指数显著高于其余两者, 对低温胁迫适应性较高; 在20 ℃/15 ℃至35 ℃/30 ℃的范围内, 除35 ℃/30 ℃下AXXZ-8的萌发率与其余两者无显著差异外, 其余各项指标均与JHHZ-1和SSXB-1有显著差异, 表明其种子萌发能力低于JHHZ-1与SSXB-1。
| 指标 Index |
种群 Population |
温度/℃ Temperature | ||||||
| 10/5 | 15/10 | 20/15 | 25/20 | 30/25 | 35/30 | 40/35 | ||
| JLGY-3 | 29.38±1.48 | 81.25±1.25 | 96.88±0.91 | 98.75±0.82 | 99.38±0.63 | 99.38±0.63 | 99.38±0.63 | |
| 萌发率/% | JHHZ-1 | 25.00±1.34a* | 76.25±1.57a* | 95.00±1.34ab | 97.50±0.94a | 98.75±0.82a | 99.38±0.63a | 99.38±0.63a |
| Germination rate | SSXB-1 | 24.38±1.99a | 72.50±2.67a | 97.51±0.34a | 97.51±0.34a | 97.50±0.94ab | 97.50±0.94a | 98.75±0.82a |
| AXXZ-8 | 20.63±1.99a | 75.63±1.48a | 91.25±1.83b | 93.75±1.25b | 95.63±1.13b | 97.50±0.94a | 56.25±2.06b | |
| JLGY-3 | 0.00±0.00 | 6.25±1.56 | 77.50±2.11 | 95.63±1.48 | 97.50±1.34 | 99.38±0.63 | 99.38±0.63 | |
| 发芽势/% | JHHZ-1 | 0.00±0.00a | 1.88±0.91a* | 75.00±2.31a | 93.13±0.91a | 95.00±1.34a | 99.38±0.63a | 99.38±0.63a |
| Germination energy | SSXB-1 | 0.00±0.00a | 0.00±0.00b | 55.63±1.99b | 90.00±2.11a | 95.63±0.63a | 97.50±0.95a | 98.75±0.82a |
| AXXZ-8 | 0.00±0.00a | 0.00±0.00b | 51.25±2.63c | 75.63±1.48b | 80.63±1.13b | 90.00±2.50b | 56.25±2.06b | |
| JLGY-3 | 0.47±0.02 | 1.43±0.03 | 3.34±0.05 | 5.11±0.10 | 5.28±0.07 | 7.45±0.13 | 11.57±0.13 | |
| 发芽指数 | JHHZ-1 | 0.39±0.02a* | 1.32±0.03a* | 3.21±0.08a | 4.92±0.14a | 5.23±0.09a | 7.38±0.17a | 11.58±0.12a |
| Germination index | SSXB-1 | 0.30±0.02b | 0.92±0.04b | 2.89±0.06b | 3.71±0.07b | 3.90±0.04b | 6.70±0.21b | 11.37±0.15b |
| AXXZ-8 | 0.25±0.02b | 0.98±0.02b | 2.55±0.05c | 3.19±0.05c | 3.58±0.05c | 4.23±0.07c | 4.55±0.22c | |
| 注: *表示同一遗传背景的敏感种群JLGY-3和抗性种群JHHZ-1在相同处理下0.05水平差异显著(独立样本t检验); 不同小写字母表示相同处理间不同遗传背景的3个抗性种群在0.05水平差异显著(Duncan ’ s新复极差法)。下同。 Note: * in the same column show the significant differences of sensitive population JLGY-3 and resistant population JHHZ-1 from the same genetic backgrounds under the same treatment at 0.05 level by t test. The different lowercase letters in the same column show the significant differences of three resistant populations from the different genetic backgrounds under the same treatment at 0.05 level by Duncan ’ s multiple range test. The same as follows. |
||||||||
根据公式(5)得出盐浓度与各种群种子萌发率的拟合曲线方程(图 1), 由此得出抑制JLGY-3、JHHZ-1、SSXB-1和AXXZ-8种群50%萌发率所需盐浓度分别为355.31、341.81、323.54和319.15 mmol · L-1。盐溶液浓度增至200 mmol · L-1后, 各种群萌发率、发芽势与发芽指数均逐渐降低, 表现为种子活力和萌发整齐度的降低(图 1)。当盐浓度不低于350 mmol · L-1时, 同一遗传背景下的敏感种群JLGY-3与抗性种群JHHZ-1各指标均表现为显著性差异, 敏感种群对盐胁迫的适应性更强; 在350 mmol · L-1的高盐溶液中, 不同遗传背景的3个抗性种群的萌发率、发芽势与发芽指数均表现为显著性差异, AXXZ-8的萌发率、发芽势与发芽指数均最低, JHHZ-1的萌发率、发芽势与发芽指数均最高。表明:3个抗性种群中的JHHZ-1对盐胁迫适应性最高, SSXB-1次之, AXXZ-8最低。

|
图 1 盐胁迫对不同遗传背景抗五氟磺草胺稗种子萌发的影响 Figure 1 Effect of salt stress on seed germination of E. crusgalli from different genetic backgrounds |
当水势降至-0.4 MPa及以下时, 同一遗传背景的敏感种群JLGY-3最终萌发率显著高于抗性种群JHHZ-1, -0.6 MPa处理下的2个种群的各指标均差异显著, 敏感种群对水势胁迫的适应性表现为更强。随着水势的下降, 不同遗传背景的3个抗性种群的萌发率、发芽势和发芽指数整体呈下降趋势。各水势处理下, AXXZ-8的发芽势与发芽指数均显著低于JHHZ-1和SSXB-1。-0.6 MPa水势下, JHHZ-1萌发率和SSXB-1无显著差异但均显著高于AXXZ-8(表 3), JHHZ-1种群的发芽指数与SSXB-1无显著差异但均显著高于AXXZ-8, 而3种群的发芽势均差异显著,表现为JHHZ-1最高, SSXB-1次之, AXXZ-8最低(表 3)。表明:JHHZ-1对水势胁迫适应性最高, SSXB-1次之, AXXZ-8最低。
| 指标 Index |
种群 Population |
水势/MPa Osmotic potential | ||||||
| 0 | -0.1 | -0.2 | -0.3 | -0.4 | -0.5 | -0.6 | ||
| JLGY-3 | 100.00±0.00 | 99.38±0.63 | 100.00±0.00 | 99.38±0.63 | 100.00±0.00 | 92.50±0.94 | 53.75±2.27 | |
| 萌发率/% | JHHZ-1 | 100.00±0.00a | 100.00±0.00a | 100.00±0.00a | 99.38±0.63a | 91.25±1.25a* | 82.51±0.34b* | 45.63±1.75a* |
| Germination rate | SSXB-1 | 100.00±0.00a | 100.00±0.00a | 100.00±0.00a | 100.00±0.00a | 94.38±1.75a | 91.88±1.88a | 48.13±1.32a |
| AXXZ-8 | 99.30±0.63a | 98.13±0.91b | 97.50±0.94b | 89.38±1.13b | 90.63±1.13a | 79.38±1.75b | 39.38±1.48b | |
| JLGY-3 | 100.00±0.00 | 100.00±0.00 | 100.00±0.00 | 90.00±2.99 | 77.50±1.64 | 37.50±2.50 | 28.75±2.45 | |
| 发芽势/% | JHHZ-1 | 100.00±0.00a | 100.00±0.00a | 100.00±0.00a | 90.00±1.34a | 77.50±2.83a | 38.13±4.11a | 17.50±1.64a* |
| Germination energy | SSXB-1 | 100.00±0.00a | 100.00±0.00a | 98.75±0.82a | 75.63±2.90b | 52.50±3.41b | 18.13±1.32b | 8.75±0.82b |
| AXXZ-8 | 95.00±1.34b | 61.88±2.10b | 62.50±5.09b | 34.38±5.30c | 25.00±1.64c | 9.38±1.13c | 0.00±0.00c | |
| JLGY-3 | 9.47±0.16 | 6.74±0.23 | 5.70±0.08 | 4.15±0.07 | 3.74±0.04 | 2.49±0.03 | 1.42±0.08 | |
| 发芽指数 | JHHZ-1 | 9.42±0.23a | 6.89±0.10a | 5.90±0.15a | 4.06±0.09a | 3.45±0.10a* | 2.31±0.05a* | 1.02±0.04a* |
| Germination index | SSXB-1 | 7.73±0.14b | 5.33±0.22b | 4.30±0.13b | 3.32±0.07b | 2.69±0.09b | 2.13±0.04a | 0.90±0.04a |
| AXXZ-8 | 5.66±0.10c | 3.29±0.07c | 2.96±0.08c | 2.30±0.06c | 2.07±0.04c | 1.58±0.02b | 0.59±0.04b | |
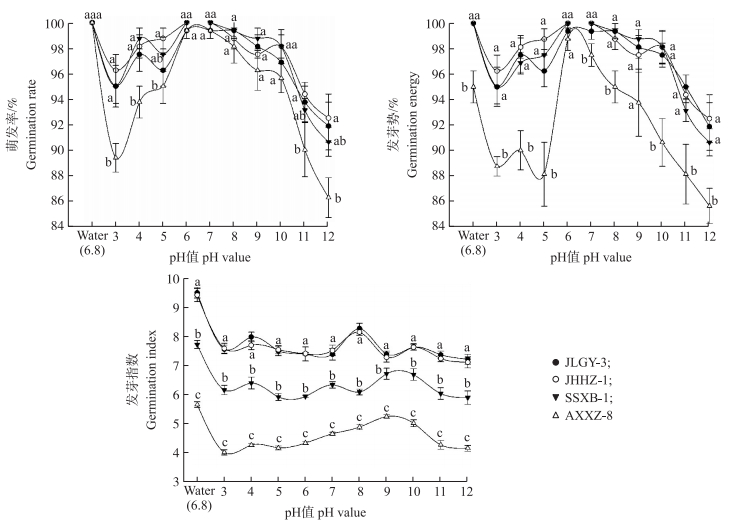
由图 2可知:同一遗传背景的敏感种群JLGY-3和抗性种群JHHZ-1在各pH值下的萌发率、发芽势和发芽指数均无显著性差异, 不同遗传背景的3个抗性种群在pH为3~12的区间内萌发率均高于85%, 表明酸碱度变化对抗性稗种子萌发无明显影响。pH为3的酸性环境中, JHHZ-1的萌发率和SSXB-1无显著差异但均显著高于AXXZ-8, JHHZ-1的发芽势与发芽指数和SSXB-1均无显著差异但均显著高于AZZX-8, 3种群的发芽指数差异显著,表现为JHHZ-1最高, SSXB-1次之, AXXZ-8最低。表明:不同遗传背景的3个抗性种群中的JHHZ-1对酸胁迫表现为高适应性, SSXB-1次之, AXXZ-8最低。pH为12的碱性环境中, JHHZ-1的萌发率和SSXB-1无显著差异但均显著高于AXXZ-8, JHHZ-1的发芽势和SSXB-1无显著差异但均显著高于AXXZ-8, 发芽指数显著性表现为JHHZ-1最高, SSXB-1次之, AXXZ-8最低。表明:3种群中的JHHZ-1对碱胁迫的适应性最强, SSXB-1次之, AXXZ-8最低。
|
图 2 pH值对不同遗传背景抗五氟磺草胺稗种子萌发的影响 Figure 2 Effect of pH value on seed germination of E. crusgalli from different genetic backgrounds |
根据公式(5)得出的埋土深度与各种群种子萌发率的拟合曲线方程, 得出抑制JLGY-3、JHHZ-1、SSXB-1和AXXZ-8种群50%萌发率的埋土深度分别为7.89、7.58、7.50和6.13 cm。随着埋土深度的增加,各种群萌发率、发芽势和发芽指数均逐渐降低(表 4)。当埋土深度为8 cm时, 同一遗传背景的敏感种群JLGY-3和抗性种群JHHZ-1的各指标无显著差异, 不同遗传背景的抗性种群JHHZ-1的萌发率与SSXB-1无显著差异而显著高于AXXZ-8(表 4), 发芽势与发芽指数均表现为JHHZ-1与SSXB-1相当, AXXZ-8最低。JLGY-3和JHHZ-1对埋土深度变化的适应性相同, JHHZ-1和SSXB-1对埋土深度的适应性相当,且两者均显著高于AXXZ-8。
| 指标 Index |
种群 Population |
埋土深度/cm Burial depth |
|||||
| 0 | 1 | 2 | 4 | 6 | 8 | ||
| JLGY-3 | 98.75±0.82 | 95.63±1.13 | 95.00±1.34 | 85.00±1.34 | 65.63±1.99 | 43.13±5.66 | |
| 萌发率/% | JHHZ-1 | 100.00±0.00a | 96.80±0.91a | 95.63±1.48a | 88.75±1.57a | 72.50±1.89a* | 46.88±1.62a |
| Germination rate | SSXB-1 | 99.38±0.63a | 95.63±1.13a | 92.50±1.89a | 86.88±1.32a | 66.25±2.06a | 43.75±3.63a |
| AXXZ-8 | 98.75±0.82a | 94.38±1.48a | 91.88±1.62a | 70.63±1.99b | 58.13±1.88b | 22.52±0.99b | |
| JLGY-3 | 100.00±0.00 | 96.88±0.86 | 80.00±2.95 | 70.63±1.39 | 32.50±2.95 | 21.88±2.17 | |
| 发芽势/% | JHHZ-1 | 99.38±0.59a | 95.63±1.07a | 74.38±3.14b | 63.13±2.66a* | 27.50±3.33a | 16.88±2.81a |
| Germination energy | SSXB-1 | 98.75±0.77a | 95.63±1.07a | 91.88±1.77a | 56.88±0.86a | 31.25±3.30a | 14.38±1.88a |
| AXXZ-8 | 94.38±1.07b | 90.63±2.08b | 75.63±3.50b | 43.75±2.64b | 10.63±1.39b | 0.00±0.00b | |
| JLGY-3 | 9.45±0.15 | 7.33±0.11 | 4.01±0.12 | 3.35±0.09 | 2.24±0.12 | 1.23±0.04 | |
| 发芽指数 | JHHZ-1 | 9.38±0.25a | 7.22±0.15a | 3.85±0.12a | 3.23±0.08a* | 2.14±0.13a | 1.10±0.11a |
| Germination index | SSXB-1 | 7.64±0.16b | 6.09±0.09b | 4.23±0.14a | 2.78±0.10b | 2.26±0.11a | 1.08±0.13a |
| AXXZ-8 | 5.64±0.08c | 4.62±0.13c | 3.96±0.19a | 2.28±0.07c | 1.29±0.05b | 0.43±0.05b | |
种子萌发对环境的高度适应性是杂草种群得以建立并向外扩散传播的前提[24], 了解抗性杂草萌发特性和出苗能力的差异有助于理解抗性传播的原因。多项研究表明:抗性植株对环境变化的适应性略低于敏感型, 表现出一定的适合度代价, 如Vila-Aiub等[25]发现具有P450代谢抗性或ACCase靶标位点抗性的瑞士黑麦草对低温适应性低于敏感型; Wu等[26]发现在盐胁迫方面, 抗精唑禾草灵的日本看麦娘的适应性比敏感型低, 该类抗性植株的萌发特性可使其抗性基因不易被发现, 从而得以不断积累和扩散, 造成潜在的草害。但与此同时, 部分研究则在抗性杂草中发现了相反的萌发特性, 抗性植株不但未在萌发阶段表现出适合度代价, 反而对环境的适应性有所增强, 如Martins等[27]发现抗草甘膦两耳草对温度和水势变化的适应性高于敏感型; Dinelli等[28]发现抗草甘膦三裂叶豚草对埋土深度的适应性要高于敏感型, 该萌发特点可使抗性基因在原发区快速积累, 造成突发性草害。两类抗性杂草萌发特性上的差异性突出了对抗五氟磺草胺稗萌发特性研究的重要性, 通过明确不同抗性水平稗在萌发阶段的差异性, 可为进一步田间抗性稗的治理提供理论依据, 在原发区采取相应措施控制其萌发, 减缓抗性基因扩散的可能, 避免草害爆发, 造成损失。
本试验中的各稗种群均可在5~40 ℃内萌发, 适宜萌发条件下萌发率可达90%以上, 与Kovach等[29]关于稗的试验结果相似。同一遗传背景的敏感型对低温的适应性比抗性稗更强, 两者对高温的适应性相同; 而不同遗传背景下的抗性稗JHHZ-1与SSXB-1在高温下的萌发率显著高于AXXZ-8, 表现出更高的耐高温性, 而低温条件下3个抗性种群略有差异, JHHZ-1的耐低温性略强, 该特性表明苏北遗传类群的JHHZ-1向高温或低温地区扩散的可能性高, 而AXXZ-8向此类地区扩散的可能性低。
盐胁迫会对植物生长产生多种负面影响, 在其产生渗透效应的同时还伴随有离子效应[30], 其中的钠离子会对植物造成毒害作用, 并替代土壤中的钙镁元素, 从而改变土壤结构, 造成养分缺失与水分胁迫[23]。对盐胁迫的高耐受性对杂草入侵农田、建立种群并扩散传播具有重要意义。辽河流域的滨海地区为我国盐分含量最高区, 其土壤含水量为1.6%, 大约相当于NaCl含量为280 mmol · L-1[31], 而抗性稗在350 mmol · L-1时仍可萌发的特性说明其可向全国各地区扩散, 进行抗性基因的传播。本研究表明JHHZ-1、SSXB-1和AXXZ-8向高盐地区扩散传播的可能性依次降低。土壤含水量是种子萌发的重要因素[32], 水势的变化也时刻影响种子的萌发, 本研究中JHHZ-1对水势变化适应能力最强, SSXB-1次之, AXXZ-8最弱, 这表明JHHZ-1更适应干旱环境, 向干旱地区扩散的可能性更高。我国长江中下游地区土壤pH值在5.0~10.0[33], 本研究中抗性稗在pH值为3~12的萌发率均高于85%, 说明其均可大范围向外扩散。种子大小一定程度上决定杂草是否能够突破深层土壤而成功出苗, 稗能在较深土壤中出苗归因于种子内含有充足的营养物质, 确保其能在较深土层下成功萌发, 覆土达8 cm时仍有相当数量个体成功出苗的特性也成为抗性能够传播的原因之一。AXXZ-8在8 cm时的萌发率低于JHHZ-1和SSXB-1, 说明其农田翻耕深度对后两者的影响小, 为降低其抗性杂草的出苗和其抗性基因的扩散, 在该抗性原发区应当进行深耕, 降低杂草的出苗。本试验结果显示出3个抗性种群稗的萌发对温度、水势、盐浓度、pH和埋土深度的适应性随其抗五氟磺草胺水平的高低呈一定的负相关性, 该抗性稗在萌发阶段存在适合度代价, 抗性越高其萌发能力相对越差, 适合度代价相对越明显。
种子萌发作为草害发生的第一步, 降低原发区杂草种子库中抗性种子的数量是控制抗性扩散和治理抗性杂草的有效方法, 播种前可适当稻田保水以降低土壤温度或放水以降低土壤水势来减少杂草种子的萌发; 施撒有机肥, 有效调节土壤酸碱度也能在一定程度上降低杂草萌发率。在原发区进行深翻耕作, 减少花粉及籽实的形成, 加强对使用农用机械的清理和过境检疫, 采用多次翻耕后播种或人工后期田间拔除的方式降低田间抗性杂草的密度, 同时降低同类药剂的使用并采用不同作用类型的药剂以降低选择压力[34], 来防止抗药性杂草的扩散及蔓延。
| [1] |
杨小育. 世界性恶性杂草的分布与危害[J]. 世界农业, 1992(4): 40-42. Yang X Y. Distribution and harm of worldwide malignant weeds[J]. World Agriculture, 1992(4): 40-42 (in Chinese). |
| [2] |
俞欣妍, 葛林利, 刘丽萍, 等. 直播稻田稗草对二氯喹啉酸、氰氟草醋与双草醚除草剂复合抗性的初步研究[J]. 江苏农业学报, 2010, 26(6): 1438-1440. Yu X Y, Ge L L, Liu L P, et al. Resistance of barnyardgrass (Echinochloa crusgalli)to multiple herbicides in direct-seeded rice[J]. Jiangsu Journal of Agricultural Sciences, 2010, 26(6): 1438-1440 (in Chinese). DOI:10.3969/j.issn.1000-4440.2010.06.060 |
| [3] |
朱文达. 稗对水稻生长和产量性状的影响及其经济阈值[J]. 植物保护学报, 2005, 32(1): 81-86. Zhu W D. Influence of barnyardgrass, Echinochloa crusgalli, on the growth and yield of paddy rice and its economic threshold[J]. Acta Phytophylacica Sinica, 2005, 32(1): 81-86 (in Chinese with English abstract). DOI:10.3321/j.issn:0577-7518.2005.01.017 |
| [4] |
顾林玲. 三唑并嘧啶磺酰胺类除草剂——五氟磺草胺[J]. 现代农药, 2015, 14(2): 46-51. Gu L L. Penoxsulam:a triazolopyrimidine sulfonamide herbicide[J]. Modern Agrochemicals, 2015, 14(2): 46-51 (in Chinese with English abstract). DOI:10.3969/j.issn.1671-5284.2015.02.015 |
| [5] |
Heap I. The international survey of herbicide resistant weeds[EB/OL].[2017-12-03]. http://www.weedscience.org/Summary/ResistbyActive.aspx.
|
| [6] |
刘兴林, 孙涛, 付声姣, 等. 水稻田除草剂的应用及杂草抗药性现状[J]. 西北农林科技大学学报(自然科学版), 2015, 43(7): 115-126. Liu X L, Sun T, Fu S J, et al. Herbicide application and weeds resistance in rice field in China[J]. Journal of Northwest A&F University (Natural Science Edition), 2015, 43(7): 115-126 (in Chinese with English abstract). |
| [7] |
Heap I. Global perspective of herbicide-resistant weeds[J]. Pest Management Science, 2014, 70: 1306-1315. DOI:10.1002/ps.2014.70.issue-9 |
| [8] |
Chen G Q, Wang Q, Yao Z W. Penoxsulam-resistant barnyardgrass (Echinochloa crusgalli)in rice fields in China[J]. Weed Biology and Management, 2016, 16(1): 16-23. DOI:10.1111/wbm.2016.16.issue-1 |
| [9] |
Matzenbacher F O, Bortoly E D, Kalsing A, et al. Distribution and analysis of the mechanisms of resistance of barnyardgrass (Echinochloa crus-galli)to imidazolinone and quinclorac herbicides[J]. Journal of Agricultural Science, 2015, 153(6): 1044-1058. DOI:10.1017/S0021859614000768 |
| [10] |
Beckie H J, Harker K N. Our top 10 herbicide-resistant weed management practices[J]. Pest Management Science, 2017, 73: 1045-1052. DOI:10.1002/ps.2017.73.issue-6 |
| [11] |
黄江宇, 田家顺, 严清平. 水稻水直播稻田抗药性稗草治理研究[J]. 湖南农业科学, 2017(8): 64-66. Huang J Y, Tian J S, Yan Q P. Drug resistance barnyardgrass management research of direct-seed rice filed[J]. Hunan Agricultural Sciences, 2017(8): 64-66 (in Chinese with English abstract). |
| [12] |
李善林, 倪汉文, 张丽. 耕翻对稗草、马唐、苋菜三种杂草的防治机理研究[J]. 中国农业大学学报, 1998, 3(增刊): 65-70. Li S L, Ni H W, Zhang L. Effects of ploughing on controlling redroot, amaranth and common crabgrass baryardgrass[J]. Journal of China Agricultural University, 1998, 3(Suppl): 65-70 (in Chinese with English abstract). |
| [13] |
王桔红, 杜国祯, 崔现亮, 等. 青藏高原东缘61种常见木本植物种子萌发特性及其与生活史的关联[J]. 植物生态学报, 2009, 33(1): 171-179. Wang J H, Du G Z, Cui X L, et al. Germination characteristics of 61 common woody species from the eastern QingHai-Tibet plateau of China and their life history correlates[J]. Chinese Journal of Plant Ecology, 2009, 33(1): 171-179 (in Chinese with English abstract). DOI:10.3773/j.issn.1005-264x.2009.01.019 |
| [14] |
Chauhan B S, Johnson D E. Influence of environmental factors on seed germination and seedling emergence of eclipta (Eclipta prostrata)in a tropical environment[J]. Weed Science, 2008, 56(3): 383-388. DOI:10.1614/WS-07-154.1 |
| [15] |
Rao N, Dong L Y, Li J, et al. Influence of environmental factors on seed germination and seedling emergence of American sloughgrass (Beckmannia syzigachne)[J]. Weed Science, 2008, 56(4): 529-533. DOI:10.1614/WS-07-158.1 |
| [16] |
Ebrahimi E, Eslami S V. Effect of environmental factors on seed germination and seedling emergence of invasive Ceratocarpus arenarius[J]. Weed Research, 2012, 52(1): 50-59. DOI:10.1111/wre.2011.52.issue-1 |
| [17] |
Chauhan B S, Johnson D E. Germination ecology of southern crabgrass (Digitaria ciliaris) and India crabgrass (Digitaria longiflora):two important weeds of rice in tropics[J]. Weed Science, 2008, 56(5): 722-728. DOI:10.1614/WS-08-049.1 |
| [18] |
Lim C A A, Awan T H, Sta. Cruz P C, et al. Influence of environmental factors, cultural practices, and herbicide application on seed germination and emergence ecology of Ischaemum rugosum Salisb[J]. PLoS One, 2015, 10(9): e0137256. DOI:10.1371/journal.pone.0137256 |
| [19] |
Chauhan B S, Johnson D E. Germination ecology of goosegrass (Eleusine indica):an important grass weed of rainfed rice[J]. Weed Science, 2008, 56(5): 699-706. DOI:10.1614/WS-08-048.1 |
| [20] |
Chauhan B S, Johnson D E. Ecological studies on Echinochloa crusgalli and the implications for weed management in direct-seeded rice[J]. Crop Protection, 2011, 30(11): 1385-1391. DOI:10.1016/j.cropro.2011.07.013 |
| [21] |
Chen G Q, Zhang W, Fang J P. Restriction site-associated DNA sequencing allows for the rapid identification of simple sequence repeat markers in Echinochloa crusgalli[J]. Weed Biology and Management, 2017, 17(2): 68-76. DOI:10.1111/wbm.2017.17.issue-2 |
| [22] |
Michel B E, Kaufmann M R. The osmotic potential of polyethylene glycol 6000[J]. Plant Physiology, 1973, 51(5): 914-916. DOI:10.1104/pp.51.5.914 |
| [23] |
Javaid M M, Tanveer A. Germination ecology of Emex spinosa and Emex australis, invasive weeds of winter crops[J]. Weed Research, 2014, 54(6): 565-575. DOI:10.1111/wre.12111 |
| [24] |
Tang W, Xu X Y, Shen G Q, et al. Effect of environmental factors on germination and emergence of aryloxyphenoxy propanoate herbicide-resistant and-susceptible Asia minor bluegrass (Polypogon fugax)[J]. Weed Science, 2015, 63(3): 669-675. DOI:10.1614/WS-D-14-00156.1 |
| [25] |
Vila-Aiub M M, Neve P, Steadman K J, et al. Ecological fitness of a multiple herbicide-resistant Lolium rigidum population:dynamics of seed germination and seedling emergence of resistant and susceptible phenotypes[J]. Journal of Applied Ecology, 2005, 42(2): 288-298. DOI:10.1111/j.1365-2664.2005.01017.x |
| [26] |
Wu X B, Zhang T, Pan L, et al. Germination requirements differ between fenoxaprop-P-ethyl resistant and susceptible Japanese foxtail (Alopecurus japonicus)biotypes[J]. Weed Science, 2016, 64(4): 653-663. DOI:10.1614/WS-D-16-00040.1 |
| [27] |
Martins J F, Barroso A A M, Alves P L C A. Effects of environmental factors on seed germination and emergence of glyphosate resistant and susceptible sourgrass[J]. Planta Daninha, 2017, 35: e017164499. |
| [28] |
Dinelli G, Marotti I, Catizone P, et al. Germination ecology of Ambrosia artemisiifolia L. and Ambrosia trifida L. biotypes suspected of glyphosate resistance[J]. Central European Journal of Biology, 2013, 8(3): 286-296. |
| [29] |
Kovach D A, Widrlechner M P, Brenner D M. Variation in seed dormancy in Echinochloa and the development of a standard protocol for germination testing[J]. Seed Science and Technology, 2010, 38(3): 559-571. DOI:10.15258/sst |
| [30] |
王娅, 张希明, 李利, 等. 四种猪毛菜种子萌发对主要生态因子的响应[J]. 种子, 2008, 27(8): 58-67. Wang Y, Zhang X M, Li L, et al. Seed on response of germination of four species of Salsola to main ecology factors[J]. Seed, 2008, 27(8): 58-67 (in Chinese). DOI:10.3969/j.issn.1001-4705.2008.08.016 |
| [31] |
巴逢辰, 赵羿. 中国海涂土壤资源[J]. 土壤通报, 1997, 28(2): 49-51. Ba F C, Zhao Y. The coastal soil resources in China[J]. Chinese Journal of Soil Science, 1997, 28(2): 49-51 (in Chinese). |
| [32] |
赵晓英, 任继周, 王彦荣, 等. 3种锦鸡儿种子萌发对温度和水分的响应[J]. 西北植物学报, 2005, 25(2): 211-217. Zhao X Y, Ren J Z, Wang Y R, et al. Germination responses to temperature and moisture in seed from three species of Caragana[J]. Acta Botanica Boreali-Occidentalia Sinica, 2005, 25(2): 211-217 (in Chinese with English abstract). DOI:10.3321/j.issn:1000-4025.2005.02.001 |
| [33] |
吴宪.棒头草种子生物学、生态适应性及其化学防除技术研究[D].南京: 南京农业大学, 2015: 28-29. Wu X. Seed biology, ecologcal adaptability and chemical control of Asia minor bluegrass[D]. Nanjing: Nanjing Agricultural University, 2015: 28-29 (in Chinese with English abstract). |
| [34] |
Baltazar A M. Herbicide-resistant weeds in the Philippines:status and resistance mechanisms[J]. Weed Biology and Management, 2017, 17: 57-67. DOI:10.1111/wbm.2017.17.issue-2 |




