文章信息
- 闫祺, 陈严, 刘晓龙, 李柏桦, 廖辉, 张小晴, 董双林
- YAN Qi, CHEN Yan, LIU Xiaolong, LI Baihua, LIAO Hui, ZHANG Xiaoqing, DONG Shuanglin
- 双委夜蛾3个信息素结合蛋白基因的分子鉴定及组织表达分析
- Molecular identification and tissue expression analysis of three pheromone binding protein genes in Athetis dissimilis
- 南京农业大学学报, 2018, 41(6): 1037-1044
- Journal of Nanjing Agricultural University, 2018, 41(6): 1037-1044.
- http://dx.doi.org/10.7685/jnau.201807055
-
文章历史
- 收稿日期: 2018-07-30
2. 安徽农业大学林业与园林学院, 安徽 合肥 230036
2. School of Forestry and Landscape Architecture, Anhui Agricultural University, Hefei 230036, China
蛾类昆虫的性信息素通讯系统具有高度的灵敏性和种特异性,保证了同种雌、雄两性个体间可以准确识别并交配,在种间生殖隔离中起到重要作用。信息素结合蛋白(pheromone binding protein,PBP)属于昆虫气味结合蛋白(odorant binding protein,OBP)家族,高浓度存在于雄蛾触角中,起到识别、结合和运送性信息素分子穿过感器淋巴液到达嗅觉神经树突膜表面受体的作用[1],对于雄蛾识别和感受同种雌蛾所释放的性信息素至关重要[2]。在分子水平上研究信息素的感受机制,对寻找新的靶标分子、开发更为高效的昆虫两性通讯阻断剂用于害虫防治,具有重要的指导意义。利用性信息素标记的方法,第1个昆虫PBP基因于1981年在多音天蚕蛾(Antheraea polyphemus)雄蛾触角中得到鉴定[3]。随着分子生物学及测序技术的发展,借助于转录组及基因组数据,多种昆虫的PBP基因得以鉴定。夜蛾科是鳞翅目第一大科,迄今在甜菜夜蛾(Spodoptera exigua)[4]、斜纹夜蛾(Spodoptera litura)[5-6]、小地老虎(Agrotis ypsilon)[7-8]、棉铃虫(Helicoverpa armigera)[9]等多种夜蛾中鉴定到1~3个不同的PBP基因(PBP1、PBP2和PBP3)。最近孙佳斌等[10]又从斜纹夜蛾中鉴定了第4个PBP基因(PBP4)。功能研究表明,不同PBP基因在性信息素感受中的重要性不同,如在斜纹夜蛾等昆虫中PBP1和PBP2起主要作用,PBP3起次要作用[11-12],而PBP4可能主要参与非嗅觉功能[10]。除感受性信息素外,PBP对一般气味(如寄主植物气味)可能也具有感受作用[13]。此外,PBP可增加信息素受体(pheromone receptor,PR)对性信息素的灵敏性和特异性,比如在二化螟(Chilo suppressalis)中,PBP明显增强PR对性信息素组分的敏感性从而降低对性信息素类似物的反应[14]。
双委夜蛾(Athetis dissimilis Hampson)属鳞翅目、夜蛾科、委夜蛾属,近年上升为玉米等作物害虫,2012年在山东首次发现,其后在河南、陕西、安徽等地陆续报道,危害范围逐年扩大[15]。该虫不仅危害玉米,还危害小麦、大豆、花生、甘薯等作物,常与二点委夜蛾(A.lepigone)混合发生,两者在形态上较难区分[16]。迄今,对于双委夜蛾的研究多在形态特征与生物学特性方面[16-18];在嗅觉感受方面,Dong等[19]鉴定了90个与化感相关的受体基因,Sun等[20]鉴定了15个与嗅觉相关的基因,但对于在性信息素感受中起重要作用的PBP基因,尚未见报道。本文基于成虫触角的转录组数据及RT-PCR分析,成功鉴定了双委夜蛾3个PBP基因的cDNA序列,并利用RT-qPCR对其组织表达谱及雌、雄表达差异进行了分析,为进一步研究这3个PBP基因在性信息素感受中的作用及鳞翅目PBP基因的进化奠定了基础。
1 材料与方法 1.1 试虫饲养及组织收集双委夜蛾蛹于2017年1月引自山东省农业科学院植物保护研究所,然后在养虫室进行继代饲养,饲养温度为(26±1)℃,相对湿度为(60±10)%,光/暗时间为14 h/10 h。羽化后的雌、雄蛾以1 : 1的比例置于塑料杯(直径72 mm,高105 mm,每杯1对)中交配产卵;低龄幼虫在塑料盒(长×宽×高=170 mm×115 mm×50 mm)中以人工饲料[21]进行饲养,4龄后转移至小塑料杯(直径35 mm,高28 mm)中单头饲养至化蛹;蛹期分雌、雄并分别放入羽化笼(长×宽×高=300 mm×250 mm×250 mm)内,羽化后喂10%的蜂蜜水。
为了测定基因的组织表达谱,收集2~3日龄处于暗期2~4 h未交配的雌、雄成虫不同组织,包括触角、去除触角的头部、胸、腹、足、翅等6个组织,迅速装入含有Trizol的2 mL离心管中。每个组织收集3个重复,每个重复分别为触角100根、头(去除触角后)20个、胸10个、腹5个、足60个、翅10个。所有收集的组织保存于-80 ℃冰箱中备用。
1.2 主要试剂Trizol购于西格玛奥德里奇贸易有限公司(美国);DEPC水装置购于北京索莱宝科技有限公司;反转录试剂盒PrimeScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time)和荧光定量试剂盒SYBR® Premix Ex TaqTM GC(Perfect Real Time)购于宝生物工程有限公司(TaKaRa,日本);PCR引物合成和测序由南京金斯瑞生物科技有限公司完成;2×Phanta® Max Master Mix、2×Rapid Taq Master Mix购于南京诺唯赞生物科技有限公司;AxyPrep DNA凝胶回收试剂盒购于爱思进生物技术有限公司(美国);Trans 2K® DNA Marker、6×DNA Loading Buffer、pEASY® Blunt 3 Cloning Kit、Trans1-T1 Phage Resistant化学感受态细胞均购于北京全式金生物技术有限公司;氯仿、异丙醇、75%乙醇等均为分析纯或由分析纯试剂配制。
1.3 总RNA提取和cDNA的合成双委夜蛾不同组织的总RNA使用Trizol提取,依照说明书操作。总RNA质量通过琼脂糖凝胶电泳检测,浓度用NanoDrop 2000检测,检测合格的RNA样品保存于-80 ℃冰箱。依据PrimeScriptTM RT reagent Kit with gDNA Eraser反转录试剂盒说明书操作流程,往PCR管中加入5×gDNA Eraser Buffer 2 μL、gDNA Eraser 1 μL、Total RNA 1 000 ng、RNase Free dH2O 10 μL,以及RNA样品,于PCR仪中42 ℃反应2 min。然后向10 μL反应液中加入RNase Free dH2O 4 μL、5×PrimeScript Buffer 4 μL、RT Primer Mix 1 μL、PrimerScript RT Enzyme MixⅠ1 μL,进行反转录反应。于PCR仪中37 ℃保持15 min,85 ℃保持5 s,合成第1链cDNA。合成的cDNA模板于-20 ℃保存备用。
1.4 引物设计对本实验室已有的双委夜蛾触角转录组数据进行BLASTx同源搜索,获得了3个PBP基因的cDNA序列。利用SnapGene Viewer 3.3.2和Beacon Designer 7.7软件设计引物用于序列验证、RT-PCR和RT-qPCR,内参基因选用甘油醛-3-磷酸脱氢酶基因(GAPDH),引物序列见表 1。对于RT-qPCR引物,需要进行特异性及扩增效率的检测:在模板稀释1、3、9和27倍下进行PCR,分别得到基因的CT值(重复3次),然后按照E=10(-1/斜率)-1, 计算引物的扩增效率。当PCR产物为单峰且E值为0.9~1.05、CT值为20~30时,引物可以用于RT-qPCR分析。
| 引物名称Primer name | 引物序列(5′→3′)Primer sequence |
| mRNA组织分布Tissue distribution of mRNA | |
| GAPDH-F/R | AATCGGTATCAACGGTTTCGG/TTCCAGAGGGTCCATCCACA |
| PBP1-F/R | ATGGCCGATTCAAGATGGCG/CTAATTGGCGGCGGCCAT |
| PBP2-F/R | ATGACGCATCCACCGG/CTACACTTCAGCCAAGACTTCTCCC |
| PBP3-F/R | ATGGGGACGTACAGAGTGCT/TCAAATCTCAACCAAGACTTCGCTG |
| 实时荧光定量PCR Real-time quantitative PCR | |
| GAPDH-F/R | CTGCTCATTTAGAGGGTGGTGC/TCTTCTGGGTAGCGGTGGTAG |
| GOBP1-F/R | CGGCAACACCGAGGAGTTCA/TCTCGCACGTGTGGATCAGC |
| GOBP2-F/R | TGGCAACGCAGGAGGTGATG/GGTGCACCACCTCGAAGTCC |
| PBP1-F/R | CTTGCGTGCGAATGCTGGAG/CCATGCTGGGAGCCCACTTT |
| PBP2-F/R | GGTGATTGCCAGTTTCGTCA/TCGTGAACTCGTAGCCTTCTTTC |
| PBP3-F/R | CGTCGAAGGATGCCATGAA/GGTGTTGCGGTCCAAGAGA |
PCR产物经琼脂糖凝胶电泳后,利用AxyPrep DNA凝胶回收试剂盒,按照说明书中的操作步骤进行胶回收。根据pEASY® Blunt 3 Cloing Kit说明书操作方法,在1.5 mL离心管中依次加入胶回收产物4 μL、pEASY® Blunt 3 Cloning Vector 1 μL,于室温(25±1)℃条件下反应10 min。连接产物采用热击法转化Trans1-T1感受态细胞,在含有氨苄青霉素的固体培养基上于37 ℃培养箱中培养过夜。过夜培养后筛选蓝、白斑,在1.5 mL离心管中加入500 μL LB液体培养基(含氨苄青霉素),每个平板选取4个白斑放入培养基中,在恒温培养振荡器内200 r · min-1、37 ℃培养4 h后进行菌液PCR扩增,扩增产物通过12 g · L-1的琼脂糖凝胶电泳检测,将呈现阳性结果的菌液送南京金斯瑞生物科技有限公司进行测序。
1.6 PBP基因序列分析和进化树构建利用基因探索者软件将核苷酸序列翻译成蛋白序列;利用ExPASy软件中的Compute pI/Mw程序预测蛋白的相对分子质量和等电点;利用SignalP 4.1软件预测AdisPBP1-3信号肽序列;采用GENEDOC软件分析双委夜蛾PBP基因与其他鳞翅目昆虫PBP基因氨基酸序列的同源性;序列相似性搜索使用BLAST工具,在NCBI网站获得鳞翅目其他昆虫60个PBP基因的氨基酸序列,与本文得到的3个PBP基因一起构建系统发育树。利用MEGA 7.0软件进行系统发育分析,系统发育树的构建采用邻接法并重复1 000次。
1.7 PBP基因组织表达谱分析分别采用RT-PCR和RT-qPCR进行表达谱分析。RT-PCR反应体系为25 μL,在灭菌的PCR管中配制如下反应体系:ddH2O 9.5 μL,2×Phanta Max Master Mix 12.5 μL,上、下游引物各1 μL,cDNA模板1 μL(50 ng)。反应程序为:95 ℃ 3 min;95 ℃ 15 s,60 ℃ 15 s,72 ℃ 30 s,25~35个循环;72 ℃ 5 min,4 ℃保持。以双委夜蛾GAPDH作为内参基因[20]。试验进行3次生物学重复。PCR产物通过12 g · L-1的琼脂糖凝胶电泳检测,使用GelX 1650凝胶成像分析系统对电泳条带进行可视性数字化分析。
RT-qPCR采用SYBR Green Ⅱ,在QuantStudioTM 6 Flex System(Thermo Fisher)应用程序下使用96孔板进行。使用试剂盒SYBR® Premix Ex TaqTM GC(Perfect Real Time)在冰上配制反应体系,总反应体系为20 μL:ddH2O 6.8 μL,SYBR® Premix Ex TaqTM GC(2×)10 μL,上、下游引物各0.4 μL,Rox Reference DyeⅡ0.4 μL,cDNA模板2 μL(100 ng)。反应程序为:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 34 s,40个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s。用QuantStudioTM Real-time PCR Software软件记录数据和绘制熔解曲线,采用内参基因计算相对表达量,进行3次生物学重复和3次技术重复。目的基因相对表达量采用2-ΔΔCT值法计算。
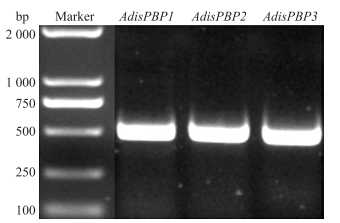
2 结果与分析 2.1 PBP基因的克隆验证及序列分析通过对触角转录组数据分析,获得了双委夜蛾的3个PBP基因(AdisPBP1、AdisPBP2、AdisPBP3)的cDNA全长序列。为验证序列的准确性,以双委夜蛾雌、雄成虫各1头为模板,提取总RNA,然后合成cDNA进行PCR验证。将PCR扩增产物凝胶电泳图(图 1)中500 bp处的目标条带切胶纯化、连接转化后送公司测序,测序结果与转录组所得序列100%匹配。氨基酸序列(图 2)分析表明:AdisPBP1、AdisPBP2、AdisPBP3 基因的编码框(ORF)长度分别为501、510和495 bp,分别编码166、169和164个氨基酸,且均具有6个保守的半胱氨酸位点;此外,3个基因的N端均具有1个信号肽序列,长度分别为23、23和22个氨基酸。
|
图 1 双委夜蛾3个PBP基因的PCR扩增产物 Figure 1 PCR products of three PBP genes in Athetis dissimilis |

|
图 2 双委夜蛾3个PBP基因和其他已知昆虫PBP基因的氨基酸序列比对 Figure 2 Sequence alignment of three PBP genes in A.dissimilis with homologous proteins genes from other insect species 6个保守的半胱氨酸位点用方框标出。The six conserved cysteines are labeled by panes.信息素结合蛋白的来源与GenBank登录号见表 2。The origin of the PBP and their GenBank accession numbers are shown in Table 2. |
| 编号 No. |
基因名称 Gene name |
登录号 Accession number |
物种 Species |
| 1 | AdisPBP1 | ALJ93808 | 双委夜蛾Athetis dissimilis |
| 2 | AdisPBP2 | ALJ93809 | 双委夜蛾Athetis dissimilis |
| 3 | AdisPBP3 | — | 双委夜蛾Athetis dissimilis |
| 4 | AlepPBP1 | — | 二点委夜蛾Athetis lepigone |
| 5 | AlepPBP2 | — | 二点委夜蛾Athetis lepigone |
| 6 | AlepPBP3 | — | 二点委夜蛾Athetis lepigone |
| 7 | SlitPBP1 | ABK41047 | 斜纹夜蛾Spodoptera litura |
| 8 | SlitPBP2 | AKI87958 | 斜纹夜蛾Spodoptera litura |
| 9 | SlitPBP3 | ACY78414 | 斜纹夜蛾Spodoptera litura |
| 10 | AipsPBP1 | AFM36756 | 小地老虎Agrotis ipsilon |
| 11 | AipsPBP2 | AFM36757 | 小地老虎Agrotis ipsilon |
| 12 | AipsPBP3 | AFM36758 | 小地老虎Agrotis ipsilon |
| 13 | SexiPBP1 | ABK41046 | 甜菜夜蛾Spodoptera exigua |
| 14 | SexiPBP2 | ABK41049 | 甜菜夜蛾Spodoptera exigua |
| 15 | SexiPBP3 | ACY78413 | 甜菜夜蛾Spodoptera exigua |
| 16 | HarmPBP1 | HQ436362 | 棉铃虫Helicoverpa armigera |
| 17 | HarmPBP2 | ACD01993 | 棉铃虫Helicoverpa armigera |
| 18 | HarmPBP3 | AAO16091 | 棉铃虫Helicoverpa armigera |
| 19 | HassPBP1 | AY864775 | 烟青虫Helicoverpa assulta |
| 20 | HassPBP2 | ADP76647 | 烟青虫Helicoverpa assulta |
| 21 | HassPBP3 | ABB91374 | 烟青虫Helicoverpa assulta |
| 22 | MbraPBP1 | AAC05702 | 甘蓝夜蛾Mamestra brassicae |
| 23 | MbraPBP2 | AAC05701 | 甘蓝夜蛾Mamestra brassicae |
| 24 | SnonPBP1 | AAS49922 | 蛀茎夜蛾Sesamia nonagrioides |
| 25 | SnonPBP2 | AAS49923 | 蛀茎夜蛾Sesamia nonagrioides |
| 26 | SinfPBP1 | AEQ30019 | 大螟Sesamia inferens |
| 27 | SinfPBP2 | AEX58642 | 大螟Sesamia inferens |
| 28 | SinfPBP3 | AEQ30020 | 大螟Sesamia inferens |
| 29 | DplePBP2 | OWR47910 | 君主斑蝶Danaus plexippus |
| 30 | LdisPBP1 | AAC47913 | 舞毒蛾Lymantria dispar |
| 31 | ObruPBP3 | KOB67876 | 冬尺蠖Operophtera brumata |
| 32 | EobiPBP2 | AQU15093 | 茶尺蠖Ectropis oblique |
| 33 | AselPBP2 | BAF64703 | 大造桥虫Ascotis selenaria |
| 34 | CsupPBP1 | ADK66921 | 二化螟Chilo suppressalis |
| 35 | CsupPBP2 | ACJ07123 | 二化螟Chilo suppressalis |
| 36 | CsupPBP3 | ADL09140 | 二化螟Chilo suppressalis |
| 37 | OfurPBP1 | ADT78500 | 亚洲玉米螟Ostrinia furnacalis |
| 38 | OfurPBP2 | ADT78501 | 亚洲玉米螟Ostrinia furnacalis |
| 39 | OfurPBP3 | ADT78502 | 亚洲玉米螟Ostrinia furnacalis |
| 40 | OnubPBP1 | ADT78491 | 欧洲玉米螟Ostrinia nubilalis |
| 41 | OnubPBP2 | ADT78496 | 欧洲玉米螟Ostrinia nubilalis |
| 42 | OnubPBP3 | ADT78497 | 欧洲玉米螟Ostrinia nubilalis |
| 43 | PxylPBP1 | ACI28451 | 小菜蛾Plutella xylostella |
| 44 | PxylPBP2 | AGH13203 | 小菜蛾Plutella xylostella |
| 45 | PxylPBP3 | BAG71422 | 小菜蛾Plutella xylostella |
| 46 | DtabPBP1 | AGJ71278 | 油松毛虫Dendrolimus tabulaeformis |
| 47 | DsupPBP1 | AGJ83347 | 落叶松毛虫Dendrolimus superans |
| 48 | DkikPBP1 | AGJ83349 | 思茅松毛虫Dendrolimus kikuchii |
| 49 | DpunPBP1 | AGJ83348 | 马尾松毛虫Dendrolimus punctatus |
| 50 | DhouPBP1 | AGJ83350 | 云南松毛虫Dendrolimus houi |
| 51 | MsexPBP3 | AAF16702 | 烟草天蛾Manduca sexta |
| 52 | BmorPBP1 | KC879865 | 家蚕Bombyx mori |
| 53 | BmorPBP2 | AM403100 | 家蚕Bombyx mori |
| 54 | BmorPBP3 | AM403101 | 家蚕Bombyx mori |
| 55 | ApolPBP2 | CAB86718 | 多音天蚕Antheraea polyphemus |
| 56 | ApolPBP3 | CAB86719 | 多音天蚕Antheraea polyphemus |
| 57 | AperPBP1 | CAA65576 | 柞蚕Antheraea pernyi |
| 58 | AperPBP2 | CAA65603 | 柞蚕Antheraea pernyi |
| 59 | AperPBP3 | CAB86717 | 柞蚕Antheraea pernyi |
| 60 | LglyPBP2 | AEO91540 | 大豆食心虫Leguminivora glycinivorella |
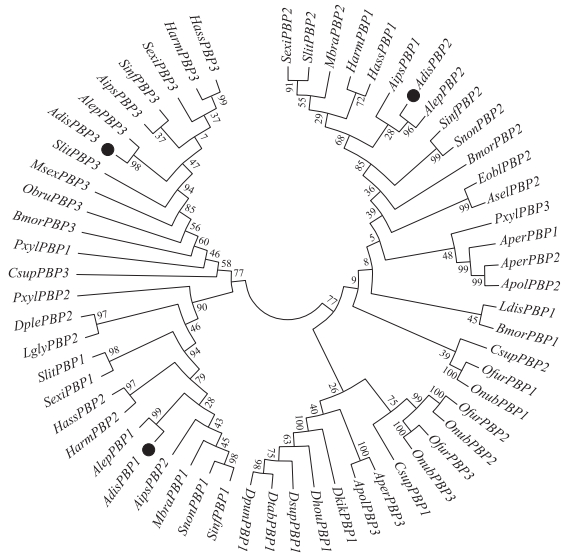
由图 2可以看出:AdisPBP1、AdisPBP2、AdisPBP3与同属的二点委夜蛾的3个PBP基因(AlepPBP1、AlepPBP2、AlepPBP3)的同源性最高,氨基酸序列一致性分别为89%、90%、94%;与小地老虎3个PBP基因(AipsPBP2、AipsPBP1、AipsPBP3)的氨基酸序列一致性也较高,分别为70%、83%、86%。将双委夜蛾和其他29种鳞翅目昆虫(其中含10种夜蛾科昆虫)的60个PBP基因(表 2)一起进行聚类分析(图 3),结果显示:所有PBP基因形成了4个主要分支,而3个双委夜蛾PBP基因AdisPBP1、AdisPBP2、AdisPBP3分别与其他夜蛾科昆虫的相应PBP基因聚到一起。
|
图 3 双委夜蛾PBP基因及其他代表性鳞翅目昆虫PBP基因的系统进化树 Figure 3 Phylogenetic tree of PBP genes and other lepidopteran PBP genes |
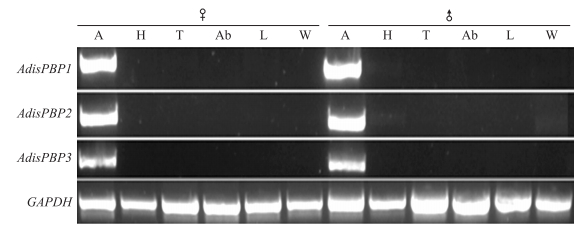
RT-PCR分析结果表明:3个PBP基因均在雌、雄蛾触角中高表达,而在头、胸、腹、足、翅等组织中不表达(图 4)。进一步的RT-qPCR分析(图 5)也证实了这一结果。就雌、雄比较而言,AdsiPBP1为雄蛾显著高表达,在雄蛾触角的表达量是雌蛾的1.84倍;AdsiPBP2和AdsiPBP3则在雌、雄蛾触角中的表达量相似,在雄蛾触角的表达量分别是雌蛾的1.14和0.95倍,但差异不显著。
|
图 4 双委夜蛾3个PBP基因组织表达谱的RT-PCR分析 Figure 4 Tissue expression patterns of three PBP genes of A.dissimilis by RT-PCR A.触角Antenna;H.头部Head;T.胸部Thorax;Ab.腹部Abdomen;L.足Leg;W.翅Wing.下同。The same as follows. |

|
图 5 双委夜蛾3个PBP基因在雌、雄虫各组织表达量的RT-qPCR分析 Figure 5 RT-qPCR analysis of three PBP genes of A.dissimilis in different tissues 图中数据为x±SE(n=3);柱上不同字母代表差异显著(P < 0.05)。 Values are mean±SE of three biological replicates. Different letters above bars indicate significant difference(P < 0.05). |
昆虫OBP是一类水溶性的酸性小分子蛋白(120~150个氨基酸),具有6个保守的半胱氨酸,且未成熟蛋白N-端具有1条长约20个氨基酸的信号肽[22-23]。在鳞翅目昆虫中,根据序列相似性和结合的气味分子种类,OBP被分为PBP、GOBP(general odorant binding protein)和触角结合蛋白(antennal binding protein,ABP)等[24]。其中,PBP一般认为在性信息素的感受中起作用。鉴于昆虫性信息素在两性求偶交配中的重要性,以及蛾类昆虫性信息素通讯的高度敏感性和种特异性,研究PBP等性信息素感受相关基因的功能及进化,具有重要的科学意义和潜在应用价值。本研究利用触角转录组数据和RT-PCR的方法,针对近年在玉米等作物上严重危害的双委夜蛾,从成虫触角中克隆了3个PBP基因的全长cDNA序列,并测定了它们的组织表达谱及在雌、雄触角中的表达差异,为进一步的功能研究及鳞翅目PBP基因的进化分析奠定了基础。
采用邻接法对29种鳞翅目昆虫的60个PBP基因进行聚类分析显示,所有基因明显聚为4个组,其中AdisPBP1和AdisPBP3所在的2个组相互靠近,而AdisPBP2所在的组较远;同时,双委夜蛾的3个PBP基因分别与其他夜蛾科昆虫的3个不同PBP基因聚到1个组,符合夜蛾科PBP的总体进化特征[4-5, 25]。在所分析的鳞翅目昆虫PBP中,双委夜蛾PBP与同属的二点委夜蛾的PBP紧密聚集在一起,说明其PBP的氨基酸相似性与亲缘关系相一致。二点委夜蛾的性信息素为2个乙酸酯组分即顺7-十二碳烯乙酸酯(Z7-12:OAc)和顺9-十四碳烯乙酸酯(Z9-14:OAc)[26];而双委夜蛾中,只有一种醇类组分即顺9-十四碳烯醇(Z9-14:OH)得到鉴定(未发表数据)。由此,推测双委夜蛾和二点委夜蛾的PBP可能分别对醇类和乙酸酯类组分偏好性结合,2种害虫PBP结构与配体结合特性的关系值得进一步研究。此外,Gu等[8]利用配体结合试验研究小地老虎3个PBP基因的功能时发现,AipsPBP1主要与性信息素主要组分Z7-12:Ac和Z9-14:Ac结合;AipsPBP2不仅结合主要组分,还和次要组分Z11-16:Ac有着较强的结合能力;而AipsPBP3则主要结合次要组分。双委夜蛾的性信息素是否存在次要组分以及3个PBP基因能否选择性识别不同的性信息素组分,还需要深入研究。
早期发现昆虫的PBP基因特异高表达于触角中,如亚洲玉米螟(Ostrinia furnacalis)的OfurPBP 3 [27]、小菜蛾(Plutella xylostella)的PxylPBP1 [28]、水稻二化螟(Chilo suppressalis)的CsupGOBP2 [29]。后来研究表明,有些PBP基因不仅在触角中表达,在昆虫的头、足、喙、口器、生殖系统等组织部位也有表达。如:小地老虎的3个PBP基因在味觉器官喙和下唇须中也有少量表达[8],斜纹夜蛾SlitPBP4在雄蛾生殖系统高表达[10]。本文明确了双委夜蛾3个PBP基因仅在触角中高表达,而在头、胸、腹、足、翅等组织不表达或极低表达,表明3个PBP基因主要参与嗅觉感受。进一步的雌、雄差异分析发现,双委夜蛾的AdisPBP1基因在雄虫触角中的表达量显著高于雌虫,而AdisPBP2和AdisPBP3基因在雌、雄间的表达量相当,与二点委夜蛾[30]和斜纹夜蛾[11]等昆虫中的情况相似,进一步暗示3个PBP基因在性信息素感受中的不同重要性。
从现有报道看,鳞翅目昆虫中的PBP基因数量不同。螟蛾科是目前发现PBP基因数量最多的科,如欧洲玉米螟(Ostrinia nubilalis)和亚洲玉米螟各有5个PBP基因[27]。在夜蛾科昆虫中,从触角中已鉴定到3个PBP基因的有多种昆虫,如斜纹夜蛾[5-6]、棉铃虫[9]、小地老虎[8]、二点委夜蛾[30]等;基于进化分析及在越来越多的夜蛾科昆虫中发现有3个PBP基因,Jin等[25]推测所有夜蛾科昆虫的成虫触角均表达3个不同的PBP基因。最近,孙佳斌等[10]从斜纹夜蛾中又鉴定到第4个PBP基因,为首次报道的夜蛾科PBP4基因,但组织表达谱暗示其主要功能并非嗅觉。双委夜蛾中是否存在PBP4 基因?如果存在其功能如何?有待进一步研究确定。
山东省农业科学院植物保护研究所门兴元研究员和河北省农林科学院谷子研究所马继芳老师提供本研究所需虫源,谨致谢意。
| [1] |
Venthur H, Mutis A, Zhou J J, et al. Ligand binding and homology modelling of insect odorant-binding proteins[J]. Physiological Entomology, 2014, 39: 183-198. DOI:10.1111/phen.12066 |
| [2] |
Li F, Prestwich G D. Expression and characterization of a lepidopteran general odorant binding protein[J]. Insect Biochemistry and Molecular Biology, 1997, 27: 405-412. DOI:10.1016/S0965-1748(97)00012-X |
| [3] |
Vogt R G, Riddiford L M. Pheromone binding and inactivation by moth antennae[J]. Nature, 1981, 293: 161-163. DOI:10.1038/293161a0 |
| [4] |
Xiu W M, Dong S L. Molecular characterization of two pheromone binding proteins and quantitative analysis of their expression in the beet armyworm, Spodoptera exigua Hübner[J]. Journal of Chemical Ecology, 2007, 33: 947-961. DOI:10.1007/s10886-007-9277-2 |
| [5] |
Xiu W M, Zhou Y Z, Dong S L. Molecular characterization and expression pattern of two pheromone-binding proteins from Spodoptera litura (Fabricius)[J]. Journal of Chemical Ecology, 2008, 34(4): 487-498. DOI:10.1007/s10886-008-9452-0 |
| [6] |
杨芳, 贺鹏, 董双林. 斜纹夜蛾信息素结合蛋白3基因的分子鉴定及进化分析[J]. 南京农业大学学报, 2010, 33(5): 65-70. Yang F, He P, Dong S L. Melecular identification and evolutionary analysis of pheromone binding protein 3 gene in the common cutworm, Spodoptera litura (Fabricius)[J]. Journal of Nanjing Agricultural University, 2010, 33(5): 65-70 (in Chinese with English abstract). DOI:10.7685/j.issn.1000-2030.2010.05.012 |
| [7] |
Abraham D, Löfstedt C, Picimbon J F. Molecular characterization and evolution of pheromone binding protein genes in Agrotis moths[J]. Insect Biochemistry and Molecular Biology, 2005, 35: 1100-1111. DOI:10.1016/j.ibmb.2005.05.002 |
| [8] |
Gu S H, Zhou J J, Wang G R, et al. Sex pheromone recognition and immunolocalization of three pheromone binding proteins in the black cutworm moth Agrotis ipsilon[J]. Insect Biochemistry and Molecular Biology, 2013, 43(3): 237-251. DOI:10.1016/j.ibmb.2012.12.009 |
| [9] |
Zhang T T, Gu S H, Wu K M, et al. Construction and analysis of cDNA libraries from the antennae of male and female cotton bollworms Helicoverpa armigera (Hübner) and expression analysis of putative odorant-binding protein genes[J]. Biochemical and Biophysical Research Communications, 2011, 407(2): 393-399. DOI:10.1016/j.bbrc.2011.03.032 |
| [10] |
孙佳斌, 刘乃勇, 李双美, 等. 斜纹夜蛾信息素结合蛋白SlitPBP4的分子克隆、组织表达谱及结合特性分析[J]. 昆虫学报, 2018, 61(6): 657-667. Sun J B, Liu N Y, Li S M, et al. Molecular cloning, tissue expression profiling and bingding characterization of the pheromone binding protein SlitPBP4 from Spodoptera litura (Lepidoptera:Noctuidae)[J]. Acta Entomologica Sinica, 2018, 61(6): 657-667 (in Chinese with English abstract). |
| [11] |
Liu N Y, Liu C C, Dong S L. Functional differentiation of pheromone-binding proteins in the common cutworm Spodoptera litura[J]. Comparative Biochemistry and Physiology:Part A, 2013, 165: 254-262. DOI:10.1016/j.cbpa.2013.03.016 |
| [12] |
Zhu G H, Xu J, Cui Z, et al. Functional characterization of SlitPBP3 in Spodoptera litura by CRISPR/Cas9 mediated genome editing[J]. Insect Biochemistry and Molecular Biology, 2016, 75: 1-9. DOI:10.1016/j.ibmb.2016.05.006 |
| [13] |
Liu N Y, Yang K, Liu Y, et al. Two general-odorant binding proteins in Spodoptera litura are differentially tuned to sex pheromones and plant odorants[J]. Comparative Biochemistry and Physiology:Part A, 2015, 180: 23-31. DOI:10.1016/j.cbpa.2014.11.005 |
| [14] |
Chang H T, Liu Y, Yang T, et al. Pheromone binding proteins enhance the sensitivity of olfactory receptors to sex pheromones in Chilo suppressalis[J]. Scientific Reports, 2015, 5: 13093. DOI:10.1038/srep13093 |
| [15] |
宋月芹, 李文亮, 刘顺通, 等. 双委夜蛾非典型嗅觉受体Orco的克隆、分子特征及表达[J]. 植物保护学报, 2015, 42(6): 997-1003. Song Y Q, Li W L, Liu S T, et al. Cloning, molecular characteristics and expression pattern of the olfactory receptor co-receptor gene of Athetis dissimilis[J]. Journal of Plant Protection, 2015, 42(6): 997-1003 (in Chinese with English abstract). |
| [16] |
李静雯, 于毅, 张安盛, 等. 山东省发现二点委夜蛾近似种——双委夜蛾[J]. 植物保护, 2014, 40(6): 193-195. Li J W, Yu Y, Zhang A S, et al. Morphologically alike species of Athesis legion (Möschler):Athesis dissimilis (Hampson)found in Shandong Province of China[J]. Plant Protection, 2014, 40(6): 193-195 (in Chinese with English abstract). DOI:10.3969/j.issn.0529-1542.2014.06.038 |
| [17] |
郭婷婷, 于志浩, 门兴元, 等. 双委夜蛾不同虫态耐寒性及体内生化物质含量变化[J]. 昆虫学报, 2016, 59(12): 1291-1297. Guo T T, Yu Z H, Men X Y, et al. Cold tolerance and changes in the contents of biochemical substances in different developmental stages of Athetis dissimilis (Lepidoptera:Noctuidae)[J]. Acta Entomologica Sinica, 2016, 59(12): 1291-1297 (in Chinese with English abstract). |
| [18] |
丁金凤, 徐春梅, 张正群, 等. 溴氰虫酰胺对双委夜蛾生长发育、繁殖和营养利用的影响[J]. 中国农业科学, 2017, 50(22): 4307-4315. Ding J F, Xu C M, Zhang Z Q, et al. Effects of cyantraniliprole on development, fecundity and nutritional utilization of Athetis dissimilis[J]. Scientia Agricultura Sinica, 2017, 50(22): 4307-4315 (in Chinese with English abstract). DOI:10.3864/j.issn.0578-1752.2017.22.007 |
| [19] |
Dong J F, Song Y Q, Li W L, et al. Identification of putative chemosensory receptor genes from the Athetis dissimilis antennal transcriptome[J]. PLoS One, 2016, 11(1): e0147768. DOI:10.1371/journal.pone.0147768 |
| [20] |
Sun H Z, Song Y Q, Du J, et al. Identification and tissue distribution of chemosensory protein and odorant binding protein genes in Athetis dissimilis (Lepidoptera:Noctuidae)[J]. Applied Entomology and Zoology, 2016, 51: 409-420. DOI:10.1007/s13355-016-0413-8 |
| [21] |
朱丽梅, 倪钰萍, 曹晓宇, 等. 斜纹夜蛾的人工饲养技术[J]. 昆虫知识, 2001, 38(3): 227-228. Zhu L M, Ni Y P, Cao X Y, et al. A method for artificially rearing to the cotton leafworm Prodenia litura Fabricius[J]. Entomological Knowledge, 2001, 38(3): 227-228 (in Chinese with English abstract). DOI:10.3969/j.issn.0452-8255.2001.03.021 |
| [22] |
Leal W S, Nikonova L, Peng G H. Disulfide structure of the pheromone binding protein from the silkworm moth, Bombyx mori[J]. FEBS Letters, 1999, 464: 85-90. DOI:10.1016/S0014-5793(99)01683-X |
| [23] |
Briand L, Swasdipan N, Nespoulous C, et al. Characterization of a chemosensory protein (ASP3c) from honeybee (Apis mellifera L.)as a brood pheromone carrier[J]. European Journal of Biochemistry, 2002, 269: 4586-4596. DOI:10.1046/j.1432-1033.2002.03156.x |
| [24] |
Pelosi P, Zhou J J, Ban L P, et al. Soluble proteins in insect chemical communication[J]. Cellular and Molecular Life Sciences, 2006, 63: 1658-1676. DOI:10.1007/s00018-005-5607-0 |
| [25] |
Jin J Y, Li Z Q, Zhang Y N, et al. Different roles suggested by sex-biased expression and pheromone binding affinity among three pheromone binding proteins in the pink rice borer, Sesamia inferens (Walker) (Lepidoptera:Noctuidae)[J]. Journal of Insect Physiology, 2014, 66: 71-79. DOI:10.1016/j.jinsphys.2014.05.013 |
| [26] |
Yan Q, Zheng M Y, Xu J W, et al. Female sex pheromone of Athetis lepigone (Lepidoptera:Noctuidae):identification and field evaluation[J]. Journal of Applied Entomology, 2018, 142: 125-130. DOI:10.1111/jen.2018.142.issue-1pt2 |
| [27] |
Allen J E, Wanner K W. Asian corn borer pheromone binding protein 3, a candidate for evolving specificity to the 12-tetradecenyl acetate sex pheromone[J]. Insect Biochemistry and Molecular Biology, 2011, 41(3): 141-149. DOI:10.1016/j.ibmb.2010.10.005 |
| [28] |
Zhang Z C, Wang M Q, Zhang G. Molecular cloning and expression of pheromone-binding protein1 from the diamondback moth, Plutella xylostella[J]. Entomologia Experimentalis et Applicata, 2009, 133(2): 136-145. DOI:10.1111/eea.2009.133.issue-2 |
| [29] |
Gong D P, Zhang H J, Zhao P, et al. The odorant binding protein gene family from the genome of silkworm, Bombyx mori[J]. BMC Genomics, 2009, 10: 332. DOI:10.1186/1471-2164-10-332 |
| [30] |
Zhang Y N, Zhu X Y, Ma J F, et al. Molecular identification and expression patterns of odorant binding protein and chemosensory protein genes in Athetis lepigone (Lepidoptera:Noctuidae)[J]. PeerJ, 2017, 5: e3157. DOI:10.7717/peerj.3157 |




