文章信息
- 翁金洋, 薛松, 倪照君, 阎依超, 沈志军, 高志红
- WENG Jinyang, XUE Song, NI Zhaojun, YAN Yichao, SHEN Zhijun, GAO Zhihong
- 梅和杏果实有机酸代谢差异研究
- The differences of organic acid metabolism in fruits of Prunus mume and Prunus armeniaca
- 南京农业大学学报, 2018, 41(6): 1009-1017
- Journal of Nanjing Agricultural University, 2018, 41(6): 1009-1017.
- http://dx.doi.org/10.7685/jnau.201804015
-
文章历史
- 收稿日期: 2018-04-08
2. 江苏省农业科学院果树研究所, 江苏 南京 210014
2. Institute of Pomology, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China
梅(Prunus mume Sieb.et Zucc.)起源于中国,果实含有丰富的对人体有益的天然有机酸,一般以柠檬酸为主[1]。因梅果实酸含量较高,即便成熟时也会让人感觉比较酸,一般用于加工蜜饯或制作青梅酒[2]。杏(Prunus armeniaca)在果实成熟时,含酸量低,果实风味较甜,主要以鲜食为主[3-4]。近年来国内外学者在研究果实有机酸方面取得了较大进展,但梅果实有机酸积累的机制还未涉及。
果实有机酸的积累和代谢是一个复杂的过程,有一系列酶、蛋白以及相关的代谢产物参与,主要代谢路径有乙酰辅酶A和γ-氨基丁酸(GABA)2种途径[5-6]。研究发现,有机酸代谢关键酶主要有柠檬酸合成酶(CS)、磷酸烯醇式丙酮酸羧化酶(PEPC)、乌头酸酶(ACO)、异柠檬酸脱氢酶(IDH)和苹果酸脱氢酶(MDH)[7-8]。陈美霞等[9]认为CS、MDH和ACO是杏果实有机酸积累的关键酶。王鹏飞等[10]研究发现CS活性变化是引起不同品种欧李果实柠檬酸积累差异的主要原因。张秀梅等[11]发现CS和PEPC是菠萝柠檬酸积累的关键酶,其他学者还发现ACO也参与了菠萝有机酸的代谢[12]。Tang等[13]对甜瓜研究时发现ACO和ME活性变化是导致甜瓜2个品种柠檬酸含量不同的原因。文涛等[14]也认为在脐橙中有机酸合成与CS和PEPC相关,通过抑制CS活性有利于减少果实柠檬酸含量。在梨[15-16]、甜橙[17]、枣[18]、荔枝[19]等的研究中也有类似的报道,说明这些酶对果实有机酸的合成和代谢起调控作用。在分子水平上,杨滢滢等[20]研究发现在纽荷尔脐橙中顺乌头酸酶基因(CitAco)、异柠檬酸脱氢酶基因(CitIDH1、CitIDH3)与谷氨酸脱羧酶基因(CitGAD4)的上调可能是导致成熟脐橙果实柠檬酸含量下降的原因。Zhang等[21]对椪柑的研究发现CitAco1、CitGAD4下调和柠檬酸合成酶基因(CitCS1、CitCS2)上调可能与柠檬酸积累有关。以上研究说明不同物种中柠檬酸调控基因不同。因此,本研究以梅和杏果实为材料,通过测定不同发育期果实有机酸含量及相关代谢酶活性,进一步分析梅和杏果实有机酸积累和代谢的关键基因,旨在为揭示梅果实有机酸积累和代谢规律提供理论依据。
1 材料与方法 1.1 试验材料以梅品种‘养老’和‘丰后’以及杏品种‘金太阳’作为试验材料,其中‘养老’和‘丰后’果实采自国家果梅杨梅种质资源圃,‘金太阳’果实采自江苏省农业科学院桃资源圃。分别于2016年果实幼果期、硬核前期、硬核期、硬核后期、退绿期和生理成熟期取样。取样日期:‘养老’为4月8、19、29日和5月6、13、20日,‘丰后’为4月19、29日,5月10、20、30日和6月8日,‘金太阳’为4月13、21、30日和5月7、15、22日。
1.2 有机酸的提取和测定有机酸的提取方法采用姚改芳[22]和Jia等[23]的方法,并加以改进。称取适量样品放入研钵中,加入液氮充分研磨。研磨好的样品取2 g,加入提取液(体积分数为80%乙醇)5 mL,37 ℃水浴30 min,超声波提取20 min,4 ℃、12 000 g离心15 min。取上清液,重复3次,定容至25 mL。再取1.6 mL置于离心管中,用浓缩仪蒸干,超纯水定容至0.8 mL,用0.22 μm滤膜过滤后,进行HPLC分析。有机酸含量测定的色谱条件:色谱柱为ACQUITY UPLC HSS T3 C18柱(2.1 mm×100 mm,1.8 μm),流动相为2%甲醇和98% 20 mmol · L-1磷酸氢二钠缓冲液(用磷酸调配pH2.6),流速为0.5 mL · min-1,柱温30 ℃,紫外检测器,检测波长为210 nm,进样量2 μL,根据峰面积和标准曲线计算有机酸含量,总酸含量采用酸碱滴定法测定[24]。
1.3 酶液的制备和酶活性测定参照Hirai等[25]和罗安才等[26]方法并稍有改动。取2 g果肉加2 mL研磨缓冲液[0.2 mol · L-1 Tris-HCl(pH8.2),0.6 mol · L-1蔗糖,10 mmol · L-1异抗坏血酸]研磨,4 ℃、4 000 g离心20 min,取上清液并用提取缓冲液[0.2 mol · L-1 Tris-HCl(pH8.2),10 mmol · L-1异抗坏血酸,0.1%曲拉通X-100]定容至4 mL,即得细胞质乌头酸酶液。沉淀用提取缓冲液定容至2 mL,即得线粒体乌头酸酶液和NAD-IDH酶液。另外3 mL加等体积提取缓冲液,可用于测定苹果酸脱氢酶,取其中4 mL分为2份,在大量透析液(即提取缓冲液)中4 ℃透析过夜,用新鲜透析液定容即得磷酸烯醇式丙酮酸羧化酶和柠檬酸合成酶。
参照罗安才等[26]方法,稍有改动。反应体系为0.5 mL,加入反应底物后立即用UV-2450型紫外分光光度计测定吸光值。以每分钟吸光值变化0.01为1个酶活性单位,单位为U · g-1 · min-1。
1.4 RNA提取及实时荧光定量PCR采用改良CTAB法提取梅和杏果实总RNA[27],10 g · L-1琼脂糖凝胶电泳检测其完整性。取适量总RNA,利用反转录试剂盒(TaKaRa)进行纯化并反转录为cDNA。利用SYBR GreenⅠ试剂盒(TaKaRa)以及ABI 7300实时荧光定量PCR仪进行PCR扩增。反应体系(20 μL):10 μL SYBR® Premix Ex TaqTM(TaKaRa),1 μL稀释的cDNA,上、下游引物各0.3 μL,ddH2O补至20 μL。反应程序如下:94 ℃ 3 min;94 ℃ 30 s,60 ℃ 20 s,72 ℃ 40 s,40个循环。对所有样品的熔解曲线进行分析,确定每个引物均为特异性扩增。每个样品进行3次重复,以果梅的Actin为内参基因。采用2-ΔΔCT方法计算基因的相对表达量。
根据已经报道的有机酸合成和代谢途径相关基因,选用同一引物对梅和杏果实进行荧光定量PCR分析,在NCBI中搜索相关基因序列并设计引物,引物由上海捷瑞生物工程有限公司合成。引物序列见表 1。
| 基因Genes | 引物序列(5′→3′) Primer sequence | 基因描述Gene description |
| Actin | TGAACTTCGTGTTGCTCCTG/AGCCACGCTCAGTCAAGATT | 内参基因Reference gene |
| CS | TCAGAGATTCCGTCAGATG/CCACCAAGAACCATATCAAC | 柠檬酸合成酶Citrate synthase |
| IDH | TACAGTTACTCGGCATTACA/CCAGATTCCACAGTTCCA | 异柠檬酸脱氢酶Isocitrate dehydrogenase |
| ACO | CCATACTCCATCAGAATCCT/TCATAGCATCACGCATACA | 乌头酸酶Aconitase |
| PEPC | GTTCTCGTCAGTTGTTAGC/AATATCAAGCCTCACCAATG | 磷酸烯醇式丙酮酸羧化酶Phosphoenolpyruvate carboxylase |
| MDH | AAGATGGAGGAACGGAAG/TTCAGTAACGCTTGATTGC | 苹果酸脱氢酶Malate dehydrogenase |
| ME | TTACTTGCGTGGTCTTCT/CTTCACCGACAGTAGGAG | 苹果酸酶Malic enzyme |
采用Excel 2010进行数据整理与绘图,采用SPSS 20.0进行数据处理分析和差异显著性分析。
2 结果与分析 2.1 梅和杏果实中有机酸积累动态和含量分析通过HPLC测定不同发育时期梅和杏果实中有机酸含量(图 1),可知3个品种的主要有机酸为柠檬酸和苹果酸。在果实生长发育前期,3个品种果实有机酸都以苹果酸为主,而在生长发育后期以柠檬酸为主,其他为少量有机酸组分。在梅和杏果实中,柠檬酸含量随着生长发育进程均不断增加,但在果实成熟期略有下降。其中,从硬核期到退绿期,柠檬酸含量增加最快。在整个果实生长期,3个品种柠檬酸含量的积累速率由大到小依次为‘养老’‘丰后’‘金太阳’,表明梅和杏属于柠檬酸型积累果实,这种差异主要是柠檬酸积累速率不同引起的。在梅和杏果实中,苹果酸从幼果期到硬核期不断快速积累,到硬核期含量达到最大值,然后随着果实的发育而减少,到成熟期含量下降到最低。在梅和杏果实成熟期,‘养老’果实中总酸含量最高,‘丰后’次之,‘金太阳’最少,3个品种果实总酸变化趋势与苹果酸和柠檬酸含量变化一致,表明总酸含量是由柠檬酸和苹果酸的总含量决定。而其他有机酸组分含量在整个生长周期中变化范围较小,为微量有机酸组分。
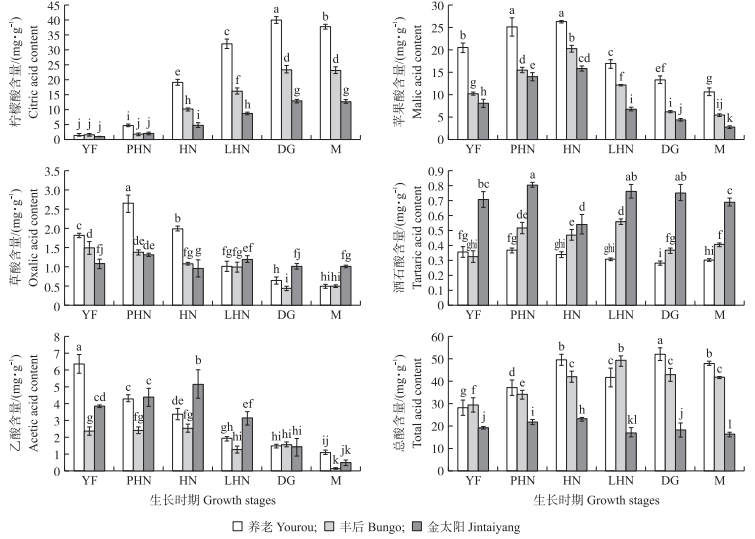
|
图 1 梅和杏果实发育中有机酸含量的变化
Figure 1 Changes of organic acid during development in fruits of Prunus mume and Prunus armeniaca
1)YF:幼果期Young fruit stage;PHN:硬核前期Prophase of hard nucleus;HN:硬核期Hard nucleus stage;LHN:硬核后期Late stage of hard nucleus;DG:退绿期Degreening stage;M:成熟期Mature stage. 2)不同字母表示在0.05水平显著差异。下同。Different letters indicate significant difference at 0.05 level. The same as follows. |
由图 2可知:梅和杏果实在生长发育过程中柠檬酸合成酶(CS)活性变化趋势总体是一致的,‘金太阳’果实在整个发育过程中CS活性显著低于‘丰后’和‘养老’。在果实发育前期,‘丰后’和‘养老’果实中CS活性差异比较小,到了果实发育后期,两者CS活性差异开始变大,到了成熟期表现出显著的差异,‘养老’果实中CS活性最高,‘丰后’次之,‘金太阳’最低。‘丰后’和‘金太阳’果实在发育前期NAD-异柠檬酸脱氢酶(IDH)活性均呈下降趋势,而‘养老’的变化幅度较大;在果实发育后期,‘丰后’和‘养老’果实的NAD-IDH活性呈快速下降趋势。在果实生理成熟期,‘金太阳’果实中NAD-IDH活性最高,‘养老’次之,‘丰后’最低。在‘养老’果实生长发育过程中,细胞质乌头酸酶(Cyt-ACO)活性变化呈下降—升高—下降—升高的趋势。‘丰后’果实Cyt-ACO活性变化在发育前期呈快速下降趋势,在硬核期到硬核后期呈上升趋势,到成熟期快速下降,整体变化趋势为下降—升高—下降。在果实发育过程中,Cyt-ACO活性变化没有明显的规律性。在成熟期,‘养老’果实中Cyt-ACO活性最高,‘丰后’次之,‘金太阳’最低。
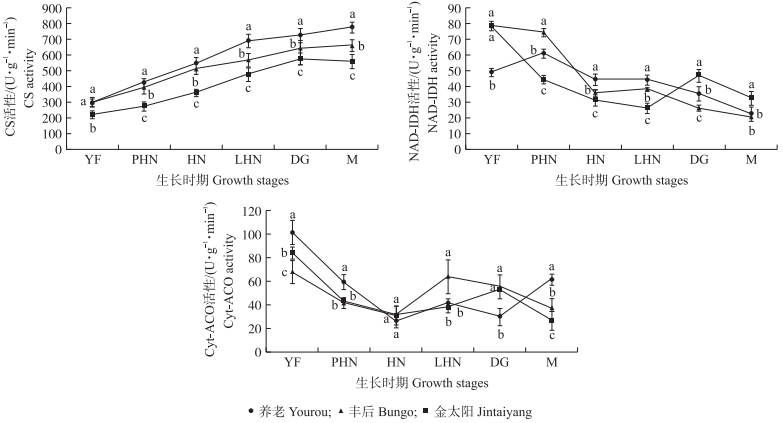
|
图 2 梅和杏果实发育过程中柠檬酸合成酶(CS)、NAD-异柠檬酸脱氢酶(NAD-IDH)和细胞质乌头酸酶(Cyt-ACO)活性的变化 Figure 2 Changes of citrate synthase(CS), NAD-isocitrate dehydrogenase(NAD-IDH) and cytoplasm aconitase(Cyt-ACO) activities during development in fruits of P. mume and P. armeniaca |
如表 2所示:在3个品种果实中,CS活性与柠檬酸含量均呈极显著正相关性,由此可以推断CS是梅和杏果实柠檬酸合成的关键酶。在‘养老’果实中,NAD-IDH和Cyt-ACO活性与柠檬酸含量呈极显著负相关性,说明NAD-IDH和Cyt-ACO是‘养老’生长发育过程中的降解酶。而‘丰后’果实中,只有NAD-IDH活性与柠檬酸含量呈极显著负相关性,说明NAD-IDH对柠檬酸的降解起作用,是柠檬酸的主要降解酶。在‘金太阳’果实中,NAD-IDH和Cyt-ACO活性与柠檬酸含量相关性呈显著负相关,表明在柠檬酸形成过程中,这2种酶对柠檬酸的积累起阻碍作用,因此NAD-IDH和Cyt-ACO是‘金太阳’果实柠檬酸降解的关键酶。综上所述,在3个品种果实中CS活性与柠檬酸含量相关系数最大,同时也是柠檬酸合成过程中共同的关键酶,因此CS是柠檬酸合成的关键酶。
| 品种 Varieties |
柠檬酸含量与其代谢酶相关系数 Coefficient of the content of citric acid and its metabolizing enzyme |
苹果酸含量与其代谢酶相关系数Coefficient of the content of malic acid and its metabolizing enzyme | |||||
| CS | NAD-IDH | Cyt-ACO | PEPC | NAD-MDH | NADP-ME | ||
| 养老Yourou | 0.974** | -0.813** | -0.613** | 0.896** | 0.343 | -0.481* | |
| 丰后Bungo | 0.956** | -0.926** | 0.081 | 0.952** | 0.460 | -0.827** | |
| 金太阳Jintaiyang | 0.989** | -0.533* | -0.491* | 0.938** | 0.254 | -0.553* | |
| Note:*P < 0.05,* *P < 0.01. The same as follows. | |||||||
由图 3可见:在梅和杏果实发育前期,磷酸烯醇式丙酮酸羧化酶(PEPC)活性变化趋势一致,且从硬核期开始,PEPC活性均快速下降。在生理成熟期,‘养老’果实的PEPC活性最高,‘丰后’其次,‘金太阳’最低。梅和杏果实的NAD-苹果酸脱氢酶(NAD-MDH)活性在生长过程中整体呈下降趋势,在果实发育后期,3个品种果实中NAD-MDH活性的变化不同。‘金太阳’果实在退绿期时,NAD-MDH活性呈先上升再下降趋势;‘养老’果实中NAD-MDH活性在生理成熟期略上升,而‘丰后’果实中NAD-MDH活性一直下降。在生理成熟期时,‘养老’果实中NAD-MDH活性最高,‘丰后’其次,‘金太阳’最低。在果实发育过程中,3个品种NADP-苹果酸酶(ME)活性均呈“V”型变化趋势。在生理成熟期,‘金太阳’果实中NADP-ME活性最高,‘养老’和‘丰后’果实中NADP-ME活性较低。
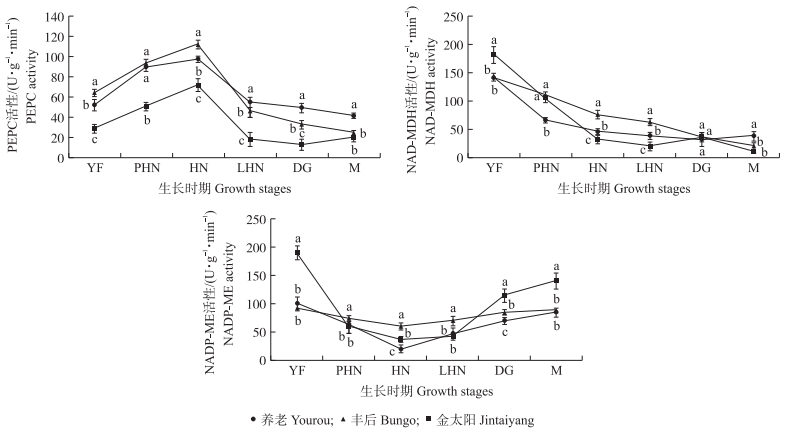
|
图 3 梅和杏果实发育过程中磷酸烯醇式丙酮酸羧化酶(PEPC)、NAD-苹果酸脱氢酶(NAD-MDH)和NADP-苹果酸酶(NADP-ME)活性的变化 Figure 3 Changes of phosphoenolpyruvate carboxylase(PEPC), NAD-malate dehydrogenase(NAD-MDH), NADP-malic enzyme(NADP-ME)during development in fruits of P. mume and P. armeniaca |
通过相关性分析(表 2),‘养老’‘丰后’和‘金太阳’果实中PEPC与苹果酸含量呈极显著正相关,表明PEPC为苹果酸合成关键酶。3个品种NADP-ME活性与苹果酸含量均呈显著负相关,说明NADP-ME是梅和杏果实苹果酸代谢的关键酶。3个品种在发育过程中,果实中苹果酸含量呈先升后降的趋势,说明PEPC可能对果实发育前期的苹果酸合成起关键作用,而NADP-ME对果实发育后期苹果酸的降解起关键作用。
2.4 梅和杏果实柠檬酸含量与其代谢酶基因表达分析由图 4可见:在‘养老’和‘丰后’果实发育过程中,CS基因的相对表达量与柠檬酸含量变化趋势一致,且相关性分析(表 3)表明,CS基因与柠檬酸含量均呈极显著正相关,因此可以推断CS基因是‘养老’和‘丰后’果实中柠檬酸合成的关键基因。在梅果实发育中,2个品种果实中IDH和ACO基因与柠檬酸含量呈正相关。在‘金太阳’果实生长发育过程中,CS基因与柠檬酸含量的变化趋势不一致,呈极显著负相关,而IDH和ACO基因与柠檬酸含量呈显著正相关。综上所述,CS基因是梅果实中柠檬酸合成的关键基因,而‘金太阳’果实中柠檬酸关键基因还需要进一步探究。
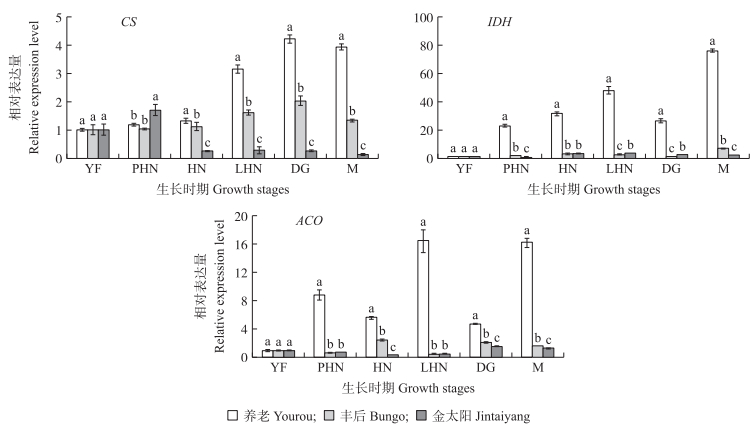
|
图 4 梅和杏果实发育过程中柠檬酸代谢酶基因的相对表达量 Figure 4 The relative expression level of metabolizing enzymes genes in citric acid during development in fruits of P. mume and P. armeniaca |
| 品种 Varieties |
柠檬酸含量与其代谢酶基因相关系数 Coefficient of the content of citric acid and its metabolizing enzyme genes |
苹果酸含量与其代谢酶基因相关系数 Coefficient of the content of malic acid and its metabolizing enzyme genes |
|||||
| CS | IDH | ACO | PEPC | MDH | ME | ||
| 养老Yourou | 0.947** | 0.729** | 0.545* | 0.538* | 0.357 | -0.906** | |
| 丰后Bungo | 0.759** | 0.372 | 0.410 | -0.446 | -0.215 | -0.809** | |
| 金太阳Jintaiyang | -0.747** | 0.543* | 0.554* | -0.652** | -0.666** | -0.812** | |
由图 5和表 3可见:在‘养老’果实生长发育过程中,PEPC基因与苹果酸含量的总体变化规律一致,相关分析表明,PEPC基因与苹果酸含量呈显著正相关,表明PEPC基因是促进苹果酸积累的关键基因。而在‘丰后’和‘金太阳’中,PEPC基因与苹果酸含量变化趋势相反。在梅和杏果实中,MDH基因没有明显的变化规律。在梅和杏果实发育过程中,ME基因的变化趋势总体一致,均与苹果酸含量的变化趋势相反,相关系数分别为-0.906、-0.809和-0.812,表明ME基因是调控梅和杏果实苹果酸代谢的关键基因。综上所述,PEPC和ME基因是‘养老’果实苹果酸合成和降解的关键基因,ME基因是‘丰后’和‘金太阳’果实中促进果实苹果酸降解的关键基因。
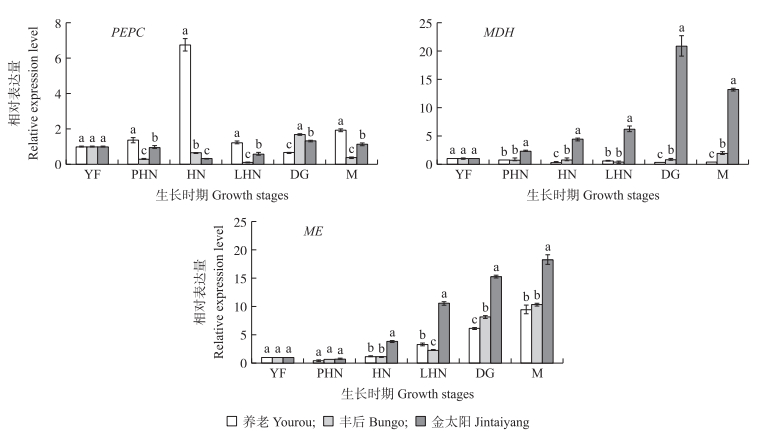
|
图 5 梅和杏果实发育过程中苹果酸代谢酶基因的相对表达量 Figure 5 The relative expression level of metabolizing enzymes genes in malic acid during development of P. mume and P. armeniaca |
果实中有机酸含量是决定果实品质好坏的重要指标之一。本研究表明,梅和杏果实主要有机酸为柠檬酸和苹果酸,在果实发育前期苹果酸快速积累,而在果实发育后期,苹果酸含量快速下降,果实以柠檬酸积累为主。通过相关性分析得知:在‘养老’和‘金太阳’果实中,CS、NAD-IDH和Cyt-ACO是果实柠檬酸代谢的关键酶。在‘丰后’果实中,CS和NAD-IDH是柠檬酸代谢的关键酶。PEPC和NADP-ME是梅和杏果实中起关键作用的苹果酸代谢酶。在本试验中发现ACO不是‘金太阳’果实积累的关键酶,表明不同品种中有机酸代谢的关键酶不同。赵永红等[28]对设施油桃研究发现,CS活性与柠檬酸含量没有明显相关性,而NADP-ME活性在后期逐渐升高,促进了苹果酸降解。在本研究中也发现NADP-ME对苹果酸的降解起关键作用。在果实发育后期,随着ME活性的增加,苹果酸含量不断下降,表明不同物种有机酸代谢存在相似的规律。王鹏飞等[10]认为欧李中存在柠檬酸和苹果酸2种主要有机酸,因为不同品种欧李中CS活性变化导致柠檬酸含量差异,苹果酸的积累差异主要由NAD-MDH活性和NADP-ME活性协同变化引起,在本研究结果中也发现类似的结论。在刘雅兰等[29]对果梅发育中有机酸研究时发现,柠檬酸主要受CS活性变化影响,苹果酸主要受NAD-MDH、PFPC和NADP-ME共同协同调控,其中CS活性是柠檬酸含量形成差异的主要原因,这与本研究结论一致,表明不同树种的果梅柠檬酸含量的调控酶具有相似性。梅和杏果实柠檬酸含量差异主要是由于CS活性不同而引起的,苹果酸含量的关键酶主要是PEPC和NADP-ME,可以通过在果实生长发育前期调控苹果酸合成关键酶降低苹果酸的合成,在果实生长发育后期降低CS活性来减少成熟期时果实中有机酸含量,提高果实品质。
本研究通过对有机酸代谢酶基因进行实时荧光定量PCR测定,发现CS、ME基因是梅果实有机酸代谢的关键基因,ME基因是杏果实有机酸代谢的关键基因。目前关于有机酸的研究,大多集中在果实中有机酸的组分及果实生长发育过程中有机酸的变化,有机酸代谢酶、液泡膜质子泵的跨膜运输与果实中有机酸含量的关系,以及环境因素与栽培措施对果实有机酸的影响与调控等方面[30-31]。本文通过研究不同发育时期的梅和杏果实中有机酸含量和相关酶活性及有机酸代谢酶基因表达量的相关性,为其他果实有机酸的研究提供了理论依据,同时对应用基因工程改良梅果实酸度和选育新品种具有重要意义。
| [1] |
林耀盛, 刘学铭, 钟炜雄, 等. 青梅有机酸谱特性分析及其应用研究[J]. 现代食品科技, 2014, 30(9): 280-285. Lin Y S, Liu X M, Zhong W X, et al. Chromatographic characterization of organic acid in Prunus mume and its application[J]. Modern Food Science and Technology, 2014, 30(9): 280-285 (in Chinese with English abstract). |
| [2] |
黄伟素, 潘秋月, 高一勇. 青梅果产品的开发现状和发展趋势[J]. 食品工业科技, 2011, 32(11): 519-521. Huang W S, Pan Q Y, Gao Y Y. Recent development and trends of the products made from plum fruit[J]. Science and Technology of Food Industry, 2011, 32(11): 519-521 (in Chinese with English abstract). |
| [3] |
张艳敏, 何天明, 冯建荣, 等. 杏种质资源评价、创新与利用研究新进展[J]. 园艺学报, 2009, 36(5): 755-762. Zhang Y M, He T M, Feng J R, et al. New advances of the apricot resources evaluation germplasm enhancement and ultilization[J]. Acta Horticulturae Sinica, 2009, 36(5): 755-762 (in Chinese with English abstract). DOI:10.3321/j.issn:0513-353X.2009.05.020 |
| [4] |
赵海娟, 刘威生, 刘宁, 等. 普通杏(Armeniaca vulgaris)种质资源果实主要数量性状变异及概率分级[J]. 果树学报, 2013, 30(1): 37-42. Zhao H J, Liu W S, Liu N, et al. Variation and probability grading of main quantitative traits of apricot (Armeniaca vulgaris)germplasm[J]. Journal of Fruit Science, 2013, 30(1): 37-42 (in Chinese with English abstract). |
| [5] |
Chen M, Jiang Q, Yin X R, et al. Effect of hot air treatment on organic acid-and sugar-metabolism in Ponkan (Citrus reticulata)fruit[J]. Scientia Horticulturae, 2012, 147: 118-125. DOI:10.1016/j.scienta.2012.09.011 |
| [6] |
Lin Q, Wang C, Dong W, et al. Transcriptome and metabolome analyses of sugar and organic acid metabolism in Ponkan (Citrus reticulata)fruit during fruit maturation[J]. Gene, 2015, 554(1): 64. DOI:10.1016/j.gene.2014.10.025 |
| [7] |
Sadka A, Artzi B, Cohen L, et al. Arsenite reduces acid content in Citrus fruit, inhibits activity of citrate synthase but induces its gene expression[J]. Journal of the American Society for Horticultural Science, 2000, 125(3): 288-293. |
| [8] |
Shangguan L F, Sun X, Zhang C, et al. Genome identification and analysis of genes encoding the key enzymes involved in organic acid biosynthesis pathway in apple, grape, and sweet orange[J]. Scientia Horticulturae, 2015, 185: 22-28. DOI:10.1016/j.scienta.2015.01.012 |
| [9] |
陈美霞, 赵从凯, 陈学森, 等. 杏果实发育过程中有机酸积累与相关代谢酶的关系[J]. 果树学报, 2009, 26(4): 471-474. Chen M X, Zhao C K, Chen X S, et al. Relationship between accumulation of organic acid and organic acid-metabolizing enzymes during apricot fruit development[J]. Journal of Fruit Science, 2009, 26(4): 471-474 (in Chinese with English abstract). |
| [10] |
王鹏飞, 薛晓芳, 穆晓鹏, 等. 不同酸度欧李果实有机酸积累特性与相关代谢酶活性分析[J]. 中国农业科学, 2013, 46(19): 4101-4109. Wang P F, Xue X F, Mu X P, et al. Analysis of organic acid accumulation characteristics and organic acid-metabolizing enzyme activities of Chinese dwarf cherry (Cerasus humilis Bunge)fruit[J]. Scientia Agricultura Sinica, 2013, 46(19): 4101-4109 (in Chinese with English abstract). DOI:10.3864/j.issn.0578-1752.2013.19.016 |
| [11] |
张秀梅, 杜丽清, 孙光明, 等. 菠萝果实发育过程中有机酸含量及相关代谢酶活性的变化[J]. 果树学报, 2007, 24(3): 381-384. Zhang X M, Du L Q, Sun G M, et al. Changes in organic acid concentrations and the relative enzyme activities during the development of Cayenne pineapple fruit[J]. Journal of Fruit Science, 2007, 24(3): 381-384 (in Chinese with English abstract). |
| [12] |
Saradhuldhat P, Paull R E. Pineapple organic acid metabolism and accumulation during fruit development[J]. Scientia Horticulturae, 2007, 112(3): 297-303. DOI:10.1016/j.scienta.2006.12.031 |
| [13] |
Tang M, Bie Z L, Wu M Z, et al. Changes in organic acids and acid metabolism enzymes in melon fruit during development[J]. Scientia Horticulturae, 2010, 123(3): 360-365. DOI:10.1016/j.scienta.2009.11.001 |
| [14] |
文涛, 熊庆娥, 曾伟光, 等. 脐橙果实发育过程中有机酸合成代谢酶活性的变化[J]. 园艺学报, 2001, 28(2): 161-163. Wen T, Xiong Q E, Zeng W G, et al. Changes of organic acid synthetase activity during fruit development of navel orange (Citrus sinesis Osbeck)[J]. Scientia Agricultura Sinica, 2001, 28(2): 161-163 (in Chinese with English abstract). DOI:10.3321/j.issn:0513-353X.2001.02.015 |
| [15] |
郭润姿, 郭文岚, 李兴元, 等. 黄冠梨果实发育过程中有机酸含量及相关代谢酶活性的变化[J]. 江苏农业学报, 2013, 29(1): 157-161. Guo R Z, Guo W L, Li X Y, et al. Changes of organic acid contents and relative enzyme activities during the development of Huangguan pear fruit[J]. Jiangsu Journal of Agricultural Sciences, 2013, 29(1): 157-161 (in Chinese with English abstract). DOI:10.3969/j.issn.1000-4440.2013.01.027 |
| [16] |
蒋爽, 岳晓燕, 滕元文, 等. 不同砂梨果实中糖酸含量及代谢相关基因表达分析[J]. 果树学报, 2016, 33(增刊): 65-70. Jiang S, Yue X Y, Teng Y W, et al. The contents of sugars and acids, and the expression analysis of metabolism-associated genes in fruit of Pyrus pyrifolia[J]. Journal of Fruit Science, 2016, 33(Suppl): 65-70 (in Chinese with English abstract). |
| [17] |
孙琦.江津三个特异甜橙品种果实的品质特征及其有机酸代谢分子机制研究[D].重庆: 西南大学, 2015. Sun Q. Analysis of fruit quality and acid metabolism of three orange cultivars from Jiangjin district, Chongqing[D]. Chongqing: Southwest University, 2015 (in Chinese with English abstract). |
| [18] |
马倩倩, 蒲小秋, 王德, 等. 枣果实发育过程中有机酸质量分数及相关代谢酶活性的变化[J]. 西北农业学报, 2017, 26(12): 1821-1827. Ma Q Q, Pu X Q, Wang D, et al. Changes of organic acid content and related metabolic enzyme activities during fruit development of jujube fruit[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2017, 26(12): 1821-1827 (in Chinese with English abstract). DOI:10.7606/j.issn.1004-1389.2017.12.011 |
| [19] |
Liu K, Liu J, Li H, et al. Influence of postharvest citric acid and chitosan coating treatment on ripening attributes and expression of cell wall related genes in cherimoya (Annona cherimola Mill.)fruit[J]. Scientia Horticulturae, 2016, 198(10): 1-11. |
| [20] |
杨滢滢, 高阳, 向妙莲, 等. '纽荷尔'脐橙果实发育过程中几种柠檬酸代谢相关基因的表达特征分析[J]. 果树学报, 2016, 33(4): 400-408. Yang Y Y, Gao Y, Xiang M L, et al. Expression profile analysis of several citric acid metabolism related genes in the 'Newhall' navel orange during fruit development[J]. Journal of Fruit Science, 2016, 33(4): 400-408 (in Chinese with English abstract). |
| [21] |
Zhang G F, Xie S X. Influence of water stress on the citric acid metabolism related gene expression in the ponkan fruits[J]. Agricultural Sciences, 2014, 5(14): 1513-1521. DOI:10.4236/as.2014.514162 |
| [22] |
姚改芳.不同栽培种梨果实糖酸含量特征及形成规律研究[D].南京: 南京农业大学, 2011. Yao G F. Conformation and characteristics of sugar and acid in pear fruits of cultivated species[D]. Nanjing: Nanjing Agricultural University, 2011 (in Chinese with English abstract). |
| [23] |
Jia H, Hirano K, Okamoto G. Effects of fertilizer levels on tree growth and fruit quality of 'Hakuho' peaches (Prunus persica)[J]. J Japan Soc Hort Sci, 1999, 68(3): 487-493. DOI:10.2503/jjshs.68.487 |
| [24] |
蔡庆生. 植物生理学实验[M]. 北京: 中国农业大学出版社, 2013. Cai Q S. Plant Physiology Experiment[M]. Beijing: China Agricultural University Press, 2013 (in Chinese). |
| [25] |
Hirai M, Ueno I. Development of citrus fruits:fruit development and enzymatic changes in juice vesicle tissue[J]. Plant & Cell Physiology, 1977, 18(4): 791-799. |
| [26] |
罗安才, 杨晓红, 邓英毅, 等. 柑橘果实发育过程中有机酸含量及相关代谢酶活性的变化[J]. 中国农业科学, 2003, 36(8): 941-944. Luo A C, Yang X H, Deng Y Y, et al. Organic acid concentrations and the relative enzymatic changes during the development of citrus fruits[J]. Scientia Agricultura Sinica, 2003, 36(8): 941-944 (in Chinese with English abstract). DOI:10.3321/j.issn:0578-1752.2003.08.014 |
| [27] |
蔡斌华, 张计育, 高志红, 等. 一种改良的提取草莓属叶片总RNA的方法[J]. 江苏农业学报, 2008, 24(6): 875-877. Cai B H, Zhang J Y, Gao Z H, et al. An improved method forisolation of total RNA from the leaves of Fragaria spp.[J]. Jiangsu Journal of Agricultural Sciences, 2008, 24(6): 875-877 (in Chinese with English abstract). DOI:10.3969/j.issn.1000-4440.2008.06.029 |
| [28] |
赵永红, 李宪利, 姜泽盛, 等. 设施油桃果实发育过程中有机酸代谢的研究[J]. 中国生态农业学报, 2007, 15(5): 87-89. Zhao Y H, Li X L, Jiang Z S, et al. Organic acid metabolism in nectarine fruit development under protected cultivation[J]. Chinese Journal of Eco-Agriculture, 2007, 15(5): 87-89 (in Chinese with English abstract). |
| [29] |
刘雅兰, 靳志飞, 陈红. 果梅果实发育过程中有机酸含量及相关代谢酶活性的变化特征[J]. 西北植物学报, 2017, 37(1): 130-137. Liu Y L, Jin Z F, Chen H. Changes of the organic acid concentrations and the relative metabolic enzyme activities during the development of Prunus mume fruit[J]. Acta Botanica Boreali-Occidentalia Sinica, 2017, 37(1): 130-137 (in Chinese with English abstract). |
| [30] |
赵淼, 吴延军, 蒋桂华, 等. 柑橘果实有机酸代谢研究进展[J]. 果树学报, 2008, 25(2): 225-230. Zhao M, Wu Y J, Jiang G H, et al. Advances in research on the metabolism of organic acids in citrus fruits[J]. Journal of Fruit Science, 2008, 25(2): 225-230 (in Chinese with English abstract). |
| [31] |
陈发兴, 刘星辉, 陈立松. 果实有机酸代谢研究进展[J]. 果树学报, 2005, 22(5): 526-531. Chen F X, Liu X H, Chen L S. Advances in research on organic acid metabolism in fruits[J]. Journal of Fruit Science, 2005, 22(5): 526-531 (in Chinese with English abstract). |




