文章信息
- 唐倩莹, 吕凤, 王启明, 王倩, 尤世民, 柏文婷, 郑海, 王沛然, 赵志刚, 万建民
- TANG Qianying, LÜ Feng, WANG Qiming, WANG Qian, YOU Shimin, BAI Wenting, ZHENG Hai, WANG Peiran, ZHAO Zhigang, WAN Jianmin
- 影响水稻雌雄配子发育的基因图位克隆
- Map-based cloning of a female and male sterile mutant in rice
- 南京农业大学学报, 2018, 41(6): 983-993
- Journal of Nanjing Agricultural University, 2018, 41(6): 983-993.
- http://dx.doi.org/10.7685/jnau.201803012
-
文章历史
- 收稿日期: 2018-03-08
2. 中国农业科学院作物科学研究所, 北京 100081
2. Institute of Crop Science, Chinese Academy of Agricultural Sciences, Beijing 100081, China
水稻是世界上最重要的粮食作物之一,也是单子叶植物研究的模式作物[1]。水稻育性对产量有关键性的影响。水稻的不育主要分为雄性和雌性不育,雄性不育的控制基因和相关分子机制研究已取得了一些进展[2],而雌性不育往往导致完全不育且不能结实,因而突变体材料少,研究进展较慢。相比之下,关于雌、雄同时不育的基因研究报道则更少。
植物的雄性不育是指由于生理上或遗传上的原因造成植物花粉败育而雌蕊正常的特性。由生理因素引起的雄性不育性一般不会遗传给后代,但由遗传因子决定的雄性不育性,则会世代遗传下去。根据基因是否位于染色体上以及显隐性关系可以将雄性不育分为显性核不育、隐性核不育和核质互作雄性不育。根据基因功能和调控时期的差异,水稻细胞核雄性不育基因可以大致分为6类[3]:1)减数分裂异常导致的雄性不育,如OsMSP1 [4]、OsPAIR1 [5]和OsPAIR2 [6],基因作用时期包括减数分裂的启动,同源染色体的联会、配对、分离及胞质分裂等;2)胼胝质代谢异常导致的雄性不育,如Osg1 [7],它编码1个β-1,3-葡聚糖酶,作用于四分体解离过程中胼胝质的降解;3)绒毡层发育异常导致的雄性不育,如OsTDR[8]和OsUDT1 [9],绒毡层对花粉的发育至关重要,它主要作用是为花粉母细胞提供营养物质和分泌胼胝质酶来降解胼胝质释放小孢子,绒毡层发育过程中任一过程受阻都会导致雄性不育[10];4)花粉壁发育异常导致的雄性不育,如OsCYP 704B2[11]、OsDPW[12]和OsNP1 [13],影响花粉壁的结构和外壁分泌物的沉积;5)花药开裂异常导致的雄性不育,如OsAID1 [14]和OsDAO[15];6)其他类型的雄性不育,如OsCSA[16]和OsGAMYB[17]。而水稻雌性不育基因根据分子机制主要分为4类:1)杂种不育相关基因,如S5 [18]和S7 [19];2)胚珠发育相关基因,如OsOSH1 [20]、OsMADS13 [21]、OsMEL1 [22]及一些胚珠转录组分析相关基因[23];3)细胞分裂相关基因,如OsPAIR1 [5]、OsMSH4 [24]和OsDMC1 [25];4)花器官发育异常相关基因,如OsJAG[26]和OsDL[27]。
随着越来越多的水稻不育基因被发现,对其分子机制的研究极大地丰富了育性调控的分子网络。其中很多基因存在一因多效,特别是与早期孢母细胞发育及减数分裂相关的基因突变可能造成雌、雄配子的同时败育,这对育性和产量均有重要影响。本文发现了1个不育突变体,对其雌、雄配子的发育进行细胞学鉴定,确定其为雌雄配子发育同时受到影响。通过图位克隆锁定了功能基因,初步揭示了其作用机制,也为水稻育种研究提供了资源。
1 材料与方法 1.1 材料水稻育性突变体fms是从‘宁粳4号’经甲磺酸乙酯(EMS)诱变突变体库中筛选获得的。该突变体花药退化,呈白色,花药用I2-KI镜检没有花粉粒,表现为全不育。在南京市南京农业大学土桥试验基地和海南陵水南繁基地多代回交,突变体全不育表型已经稳定遗传。因为是隐性核不育材料,纯合突变体表型为全不育,所以该材料以杂合子(FMS/fms)形式保存。
1.2 遗传分析和基因定位2015年夏季在南京试验基地以FMS杂合子植株为母本,与‘N22’配组,得到的F1代种子在2016年春季于海南陵水繁殖,得到自交种子。2016年夏季于南京试验基地种植F2群体,出现表型分离。在群体抽穗开花时期挑选花药呈白色的单株作为极端个体,并统计败育花药个体和正常花药植株的分离株数。
根据实验室已有的‘宁粳4号’和‘N22’之间有多态性的SSR和InDel分子标记,从中选出均匀间隔分布于12条染色体且多态性好的分子标记。随机挑选20个白色花药表型的极端个体进行初连锁,然后用全部271个极端个体进行精细定位。在精细定位没有开发标记的区域用RiceVarMap(http://ricevarmap.ncpgr.cn/v2/)和Primer Premier 5.0软件设计新标记(表 1)。
| 引物名称 Primer name |
正向引物序列(5′→3′) Forward primer sequence |
反向引物序列(5′→3′) Reverse primer sequence |
物理位置/bp Physical location |
| RM7102 | CGGCTTGAGAGCGTTTTTAG | TACTTGGTTACTCGGGTCGG | 12:13211315 |
| Ta-1 | ACACATACTACCTATTCCCCGG | GCGATCAACGATTCGGTTGA | 12:15776370 |
| Ta-4 | GCTAGGAACGGAGTCGAGAA | TGCGTCAATAGTTCCCTCGA | 12:16568274 |
| Ta-5 | GCATTGAAGCATGTGAACGC | GCACCATTCTAGTACTGCCAC | 12:16986181 |
| Ta-7 | CCCCGCGCATTATCAAAAGA | GGCTCTCGCAACATGTTCAA | 12:17386720 |
| Ta-2 | GACGGTAGTGGTATCCCGAA | ATCTCGGTAGCACCCTTGTC | 12:17894894 |
| RM277 | CGGTCAAATCATCACCTGAC | CAAGGCTTGCAAGGGAAG | 12:18290458 |
| MSP1 | TGTGGCTGAGAAACCGAGCA | CGACTTCATGTCCCGGTGGA | 1:40022948 |
| PAIR1 | CACCAGTCAGCATAATCATC | CTCTCCTCCTCCTCTTCC | 3:370913 |
| PAIR2 | ACAAGCGATTCAGGAAGG | CGGAACTAGGAATAGGATGG | 9:19628242 |
| MSH4 | TGCCAGGAATAAGTCTGCTG | TAATACTTCGGCAAGCAACG | 7:17876213 |
| TDL1A | ACGACGACTGCCTCCTCAAC | GAGGCGTAGCAAATGGTGAG | 12:16990566 |
| DMC1A | TGCTTCGAGTCCATCGACAAGC | CCCTTGATTCCTGTCAGGCTCTTC | 12:2157988 |
| Ubiquitin | GCTCCGTGGCGGTATCAT | CGGCAGTTGACAGCCCTAG | 3:7104294 |
取开花前1~2 d具有成熟花药的小花3~5朵,立即放入卡诺固定液(乙醇、冰醋酸体积比为3 : 1)中,4 ℃保存。用镊子夹取1枚花药于滴有I2-KI染液的载玻片上,夹碎花药,去掉残余花药壁,盖上盖玻片,在显微镜下观察。通过花粉细胞形态和染色情况判断是否有成熟可育花粉粒。可育花粉粒呈圆形黑色,败育花粉粒染色不完全或不能染上颜色,形状表现为不规则或者圆形。每个小花观察3个视野,视野中花粉粒不低于200粒。花粉育性=可育花粉粒数/总花粉粒×100%,取3个视野计算平均值和标准差。
1.4 醋酸洋红染色取突变体和野生型孕穗到开花各时期穗置于卡诺固定液中,4 ℃保存。夹取颖花中的花药置于滴有1%(体积分数)醋酸洋红染液的干净载玻片上,将花药在染液中夹碎,用盖玻片压片,置于光学显微镜下观察。根据醋酸洋红染色观察花粉细胞的染色体状况和细胞形态,判断花药发育的时期。
1.5 半薄切片根据颖花的长度选取不同发育时期的花药,置于卡诺固定液中,4 ℃保存。制备样品时,先真空抽气,然后用0.1 mol · L-1磷酸钠缓冲液冲洗2次,乙醇系列脱水,树脂渗透后,将样品包埋在Technovit 7100 resin (Hereaus Kulzer)中,45 ℃聚合。切成厚度1 μm的切片,烘干后,用0.5%甲苯胺蓝溶液染色,观察并且拍照。
1.6 胚囊整体染色和透明技术取胚囊发育不同时期的颖花置于卡诺固定液中保存。染色前,先在解剖镜下将颖花中的子房剥离出来,根据胚囊发育的时期分开保存在卡诺固定液中。染色方法如下:1)分别用70%、50%、30%(体积分数)乙醇和蒸馏水对剥离出来的子房进行复水,每一梯度浸泡30 min;2)用20 g · L-1硫酸铝钾溶液浸泡30 min,再用10 mg · L-1曙红溶液避光染色12 h,重新用20 g · L-1硫酸铝钾溶液浸泡30 min,用蒸馏水洗2次;3)分别用30%、50%、70%、80%、90%乙醇和无水乙醇对样品进行脱水,每一梯度浸泡30 min,其中无水乙醇处理重复3次。将样品置于用无水乙醇和水杨酸甲酯按1 : 1体积配制的溶液中处理2 h,最后用水杨酸甲酯透明12 h。曙红染色之后的样品尽量避光处理。观察方法:先在凹玻片上滴1滴水杨酸甲酯,然后用移液枪(枪头需要提前剪短,以防堵塞)小心吸取子房,转移到凹玻片上。用镊子小心拨正子房,使子房尽量平铺于凹玻片上,再盖上盖玻片。将制好的玻片置于LeicaSP8激光共聚焦显微镜下,用543 nm波长的光进行激发处理并拍照保存。
1.7 实时荧光定量RT-PCR分析取野生型不同组织提取总RNA,取突变体和野生型不同发育时期的胚囊和花药提取RNA[28],试剂盒为RNA Pre Pure Plant Kit(天根生化有限公司)。反转录过程参照TaKaRa公司的反转录方法,仪器为Applied Biosystems 7500 Real-time PCR System。反应体系为cDNA模板100 ng,10 μL 2×SYBR Premix Ex Taq Ⅱ,1.5 μL 10 μmol · L-1 PCR正向引物,1.5 μL 10 μmol · L-1 PCR反向引物,50×ROX Reference Dye Ⅱ 0.4 μL,ddH2O补至20 μL。反应程序:95 ℃起始变性30 s,95 ℃变性5 s,60 ℃退火34 s,40个循环。熔解曲线反应:95 ℃变性15 s,60 ℃退火1 min,95 ℃变性15 s,60 ℃15 s。用2-ΔΔCT法对结果进行分析,以水稻基因OsUbiquitin(Ubq)作为内参,与一些和水稻雌雄配子发育相关基因进行表达分析,定量引物如表 1。
2 结果与分析 2.1 水稻雌雄不育突变体fms表型突变体fms与野生型‘宁粳4号’的株型、穗型、胚囊均没有明显差异(图 1-A—C)。但花药差异明显,突变体花药为白色,而且比野生型小,药室朝内皱缩(图 1-D)。对野生型和突变体成熟小穗进行育性观察,发现突变体不结实。

|
图 1 野生型和突变体fms的表型比较 Figure 1 Phenotypic comparison of wild type(WT) and mutant fms 野生型和fms的植株形态,比例尺为15 cm;B.野生型和fms的穗型和育性,比例尺为2 cm;C.野生型和fms胚囊形态,比例尺为300 μm;D.野生型和fms花药形态,比例尺为600 μm。 A. Cross morphology of WT and fms at florescence, Bar=15 cm; B. Panicle type and setting rate of WT and fms, Bar=2 cm; C. Observation on embryo sac of WT and fms, Bar=300 μm; D. Anther of WT and fms, Bar=600 μm. |
突变体fms的花药表现为瘦小、纯白色,推测很有可能是花粉败育引起的;突变体fms花药中几乎没有花粉粒,只有极少数典型败育花粉粒(图 2)。用突变体fms的花粉对母本‘宁粳4号’授粉,不能获得成熟的种子,花粉育性表现为完全不育;而用野生型‘宁粳4号’的花粉对突变体fms授粉,发现结实率极低(表 2),说明突变体fms雌配子发育也受到了严重的影响。

|
图 2 野生型和突变体fms花粉育性相关表型 Figure 2 Observation of pollen fertility in WT and mutant fms A、C.野生型花粉I2-KI染色;B、D.突变体fms花粉I2-KI染色; A、B的比例尺为500 μm;C、D的比例尺为50 μm。 A, C. Pollen of WT stained with I2-KI; B, D. Pollen of mutant fms stained with I2-KI; Bar=500 μm in A and B; Bar=50 μm in C and D. |
| 组合 Combination |
每穗授粉小花数 Number of flowers pollinated each panicle |
每穗成熟种子数 Number of mature seeds each panicle |
WT WT WT |
177.67 | 151.29 |
| fms×WT | 101.33 | 3.00 |
| WT×fms | 124.00 | 0.00 |
F1 F1 F1 |
201.00 | 140.13 |
为了进一步确定花粉发生败育的时期,我们对突变体fms的花药进行了醋酸洋红染色。根据花粉发育过程中花药壁和小孢子的形态判断突变体fms哪个时期发生了变化。与野生型相比(图 3-A—E),突变体fms在花粉母细胞时期不能进行减数分裂产生二分体、四分体(图 3-F、G),但从单核期开始能观察到萌发孔(图 3-H—J)。

|
图 3 野生型和突变体fms花粉的发育过程(醋酸洋红染色) Figure 3 The process of microspore development in WT and mutant fms(Acetic acid carmine staining) A—E. 野生型;F—J.突变体;A、F.小孢子母细胞;B、G.二分体和四分体;C、H.单核期的花粉;D、I.单核靠边期的花粉;E、J.二核晚期的花粉。比例尺为10 μm。 A-E. Wild type; F-J. Mutant; A, F. Pollen mother cell; B, G. Dyads and tetrads; C, H. Microspore; D, I. Bicellular pollen; E, J. Mature pollen. Bar=10 μm. |
通过半薄切片来观察花药壁细胞的发育情况,特别是花药的绒毡层,验证花粉败育是否是由花药壁细胞的不正常发育引起的。正常的水稻花药壁由4层细胞构成,从外到内分别是表皮、内层、中间层和绒毡层(图 4-A—D)。切片结果显示突变体fms花药在早期花药壁分层时就存在缺陷,只有2层,缺少绒毡层和中间层(图 4-E—G),而且在花粉发育到花粉母细胞时就停滞,后期花粉母细胞也被降解(图 4-H)。
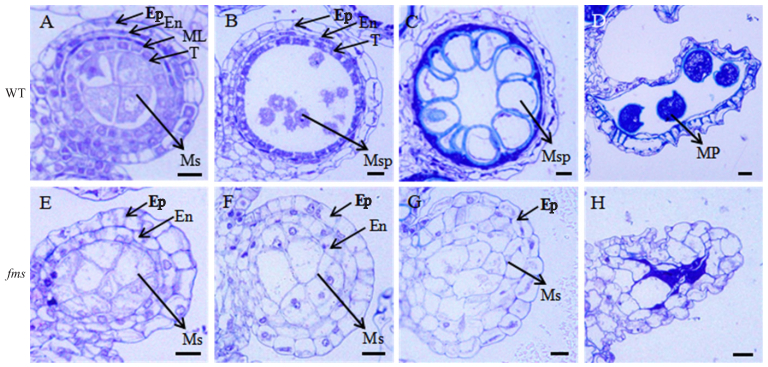
|
图 4 野生型和突变体fms花药半薄切片的比较
Figure 4 The transverse section of anthers comparison between WT and mutant fms
A—D.野生型花药;E—H.突变体花药;A、E. 花粉母细胞时期花粉;B、F.小孢子早期花粉;C、G.小孢子后期花粉;D、H.成熟花粉。 Ep:表皮层;En:药室内壁;ML:中间层;T:绒毡层;Ms:小孢子母细胞;Msp:小孢子;MP:成熟花粉粒。比例尺为10 μm。 A-D. Anthers of wild type; E-H. Anthers of mutant; A, E. Microspore mother cell stage; B, F. Early microspore stage; C, G. Late microspore stage; D, H. Mature pollen stage. Ep:Epidermis; En:Endothecium; ML:Middle layer; T:Tapetum; Ms:Microsporocyte; Msp:Microspore; MP:Mature pollen. Bar=10 μm. |
水稻胚囊是进行双受精的场所,胚囊若不能正常发育也会影响水稻的育性。为了判断突变体不育是否与胚囊有关,我们用胚囊的整体染色和透明技术分别对突变体fms和野生型不同发育时期的胚囊进行观察。与野生型相比(图 5-A—D,I—L),突变体fms胚囊中大孢子母细胞的数量明显增多(图 5-E—H),不止1个大孢子母细胞参与减数分裂,最后部分突变体fms成熟的胚囊被完全降解(图 5-P),有的突变体fms胚囊中则不规则地分布着远多于正常7细胞8核胚囊的细胞核,并且还出现隔膜将胚囊整体分隔开(图 5-M—T)。以突变体fms为母本与‘宁粳4号’杂交,结果发现只能获得极少量的成熟种子(表 2)。上述结果表明:突变体fms中雌配子的发育也受到了很大的影响,导致雌配子几乎不育。

|
图 5 野生型和突变体fms胚囊发育过程 Figure 5 The process of embryo sac development in the WT and mutant fms A、E. 孢原细胞时期;B、F.大孢子母细胞形成期;C、G.大孢子母细胞减数分裂时期;D、H.功能大孢子形成期;I、M.单核胚囊形成期;J、N.胚囊有丝分裂期;K、O.八核胚囊发育期;L、P—T.胚囊成熟期。箭头指细胞核,三角形指隔膜。 A, E. Archesporial cell formation stage; B, F. Megasporocyte formation stage; C, G. Megasporacyte meiosis stage; D, H. Functional megaspore formation stage; I, M. Mono-nucleate embryo sac formation stage; J, N. Embryo sac mitosis stage; K, O. 8-nucleate embryo sac developing-stage; L, P-T. Embryo sac matured stage. The arrows indicate nucleate, triangles indicate cell walls. |
用杂合子(FMS/fms)为母本与‘N22’杂交,得到F1,F1表型正常。将F1自交获得的种子分单株收种,获得F2群体种子,F2群体按家系播种,部分家系中出现了表型分离。从F2群体中随机取10个出现分离的家系进行统计,发现表型正常的植株数为152,突变体fms表型的植株数为51,卡方测验结果显示符合3 : 1的孟德尔分离比,卡方值χ2=0.001 6,小于χ0.05,12=3.84,突变体fms的性状由1个隐性核基因控制。
2.7 水稻雌雄不育突变体fms基因精细定位和图位克隆2015年正季,利用杂合子和‘N22’获得的F1代自交得到的F2代分离群体(共1 313株)进行连锁定位。用本实验室已有的一套均匀分布于水稻12条染色体上的SSR和Indel标记(共500对)来筛选‘宁粳4号’和‘N22’之间的多态性标记。在开花期,从F2群体中随机挑选10个具有花药变白且瘦小表型的突变体植株和10个正常表型植株,用SDS法提取叶片DNA,结合筛选出来的亲本间有多态的标记,利用聚丙烯酰胺凝胶电泳进行连锁定位。初步定位在水稻第12号染色体长臂的SSR标记RM27877和RM28404之间。然后从F2群体剩余的突变体中再随机挑选约250株提取叶片DNA进行精细定位。在初定位区间内设计合成并筛选新的多态性好的引物,进一步缩小定位区间。并同时从F2中随机取300株正常表型的植株对定位区间进行验证。最后连锁图谱在标记Ta-5出现了共分离,所以我们将该基因定位在标记Ta-4和Ta-7之间,中间距离为818 kb(图 6)。

|
图 6 突变体fms的物理图谱和突变位点 Figure 6 Physical mapping and mutation site of mutant fms |
采用RiceXPro(http://ricexpro.dna.affrc.go.jp)和国家水稻数据中心的数据(http://www.ricedata.cn)对Ta-4和Ta-7区间进行基因预测,发现该区间存在13个基因。根据这些基因的基本信息和表达量分析(表 3),只有Os12g0472500 基因在花药中表达量特异,而且在拟南芥中的同源基因TPD1 [29]也影响小孢子的发育。
| 基因编号Gene code | RAP位置RAP locus | 基因注释Gene description |
| ORF1 | Os12g0467200 | 未知功能蛋白DUF1677,水稻家族蛋白 Protein of unknown function DUF1677,Oryza sativa family protein |
| ORF2 | Os12g0467300 | 抗病蛋白家族蛋白 Disease resistance protein family protein |
| ORF3 | Os12g0467500 | 植物MuDR转座子结构域蛋白 Plant MuDR transposase domain containing protein |
| ORF4 | Os12g0467700 | AAA ATP酶结构域蛋白 AAA ATPase domain containing protein |
| ORF5 | Os12g0468300 | NB-ARC结构域蛋白 NB-ARC domain containing protein |
| ORF6 | Os12g0468500 | 类似核环苷酸门控通道C Similar to cyclic nucleotide-gated channel C |
| ORF7 | Os12g0468600 | 金属依赖性水解酶,含有复合结构域的蛋白质 Metallo-dependent hydrolase,composite domain containing protein |
| ORF8 | Os12g0470700 | AAA ATP酶结构域蛋白 AAA ATPase domain containing protein |
| ORF9 | Os12g0471100 | 类似ATP酶2 Similar to ATPase 2 |
| ORF10 | Os12g0472500 | 谷蛋白家族蛋白(TDL1A/MIL2) Glutelin family protein(TDL1A/MIL2) |
| ORF11 | Os12g0472800 | 含有胶原蛋白结合表面蛋白的B重复单元 B repeat unit of collagen binding surface protein(cna)containing protein |
| ORF12 | Os12g0476200 | MtN3和唾液相关的跨膜蛋白家族蛋白 MtN3 and saliva related transmembrane protein family protein |
| ORF13 | Os12g0477100 | 抗病蛋白家族蛋白 Disease resistance protein family protein |
对Os12g0472500基因进行测序,发现突变体fms相较于野生型在该基因第1个外显子的第60个碱基处(全基因序列第611个碱基)有1个单碱基的突变,导致第20个密码子TGG变成终止密码子TGA,可能造成翻译提前终止(图 6和图 7)。Os12g0472500是绒毡层决定基因OsTDL1A/OsMIL2 [30-31],它编码谷蛋白家族蛋白,是拟南芥基因TPD1 [29]在水稻中的同源基因。突变体mil2突变发生在第3个外显子,有1个碱基替换导致翻译提前终止,而本文的突变体fms则是在第1个外显子处发生单碱基替换,可能导致翻译提前终止,仅编码19个氨基酸,因此推测突变体fms基因蛋白功能完全丧失(图 7)。

|
图 7 野生型和突变体fms的氨基酸序列差异 Figure 7 Amino acid sequence divergence between WT and mutant fms |
从图 8可见:FMS基因在花药中高表达,其次是穗和胚囊(图 8-A)。野生型的FMS基因在花药和胚囊中都是减数分裂前期表达量较高(图 8-B、C)。在突变体fms的花药中,OsDMC1、OsPAIR1和OsPAIR2的表达量均明显降低;在突变体fms胚囊中OsDMC1的表达量明显降低,而OsPAIR1和OsPAIR2的表达量在前期孢原细胞中变化不大,在大孢子母细胞减数分裂时期又出现明显的降低。OsMSH4和OsMSP1的表达量在花药和胚囊中变化基本一致,在减数分裂前明显上升。因此我们推测FMS的缺失可能对减数分裂相关基因的表达产生影响,从而影响雌雄配子的发育,导致配子不育。

|
图 8 野生型和突变体fms中相关基因的表达分析
Figure 8 Expression analysis of related genes in WT and mutant fms
A.野生型不同组织中FMS的表达;B.野生型和突变体fms不同时期胚囊中OsTDL1A和相关基因(OsDMC1、OsMSH4、OsPAIR1、OsPAIR2、OsMSP1)的表达;C.野生型和fms不同时期花药中OsTDL1A和相关基因(OsDMC1、OsMSH4、OsPAIR1、OsPAIR2、OsMSP1)的表达。 P1、P2.胚囊孢原细胞时期;P3.大孢子母细胞形成期;P4.大孢子母细胞减数分裂产生二分体时期;P5.四分体时期;P6.功能大孢子形成期;S5.初生周缘层和次生周缘层分化为药室内壁、中间层和绒毡层时期;S6.造孢细胞分化为花粉母细胞时期;S7.花粉母细胞开始进行减数分裂时期;S8a.二分体时期;S8b.四分体时期;S9.小孢子单核早期。 A. RT-PCR analysis of the expression of FMS in different tissues of wild type; B. RT-PCR analysis of the expression of OsTDL1A and other ralated genes(OsDMC1, OsMSH4, OsPAIR1, OsPAIR2, OsMSP1 )in embryo sac at different stages in wild type and fms; C. RT-PCR analysis of the expression of OsTDL1A and other ralated genes(OsDMC1, OsMSH4, OsPAIR1, OsPAIR2, OsMSP1 )in pollen at different stages in wild type and fms. P1, P2. Archesporial cell formation stage; P3. Megasporocyte formation stage; P4. Dyad of megasporacyte meiosis stage; P5. Tetrad; P6. Functional megaspore formation stage; S5. The primary parietal layer and the secondary primary stratified into the endothecium, middle layer and tapetum stage; S6. The sporegenous cells differentiate into pollen mother cells stage; S7. Pollen mother cells become meiotic cells stage; S8a. Dyad stage; S8b. Tetrad stage; S9. Early microspore stage. |
目前已发现的雄性不育基因大致按花药发育时期可以分为两大类:减数分裂前控制花药壁分化和小孢子母细胞分化的基因;减数分裂后期绒毡层程序性死亡调控基因。前者已克隆的基因较少,如OsMSP1 [4]和OsTDL1A[30]。本研究中的突变体fms被证明是OsTDL1A的等位突变体。根据前人研究的分子机制,TDL1A蛋白可与MSP1蛋白的LRR domain结合,形成复合体抑制孢母细胞的数量以及花药壁的分化,从而促进花药正常发育。而且OsMSP1和OsTDL1A的单基因突变,或者OsMSP1和OsTDL1A双基因的突变,突变体的表型都一致。因此判断这2个基因需要同时存在才能使花药发育正常。研究发现OsTDL1A突变后,花药壁只有2层细胞,而野生型在S3时期以后,初生壁层会进行平周分裂形成药室内壁和次生细胞壁层,到S5时期,内层的次生细胞壁层会进一步分化为中间层和绒毡层,形成完整的4层花药壁细胞[32]。所以推测OsTDL1A与OsMSP1结合后,应该是作用于初生壁层平周分裂形成药室内壁和次生细胞壁层时期,因为突变后没有形成次生细胞壁层及之后的中间层和绒毡层。OsMSP1和OsTDL1A这条信号途径会影响到许多基因,主要可分为与花药壁细胞发育相关的一些转录因子基因,如bHLH、bZIP和MADS等基因家族相关基因;氧化还原反应调节基因,如OsMIL1 [32]和细胞分化速率相关基因[33],但具体的作用机制还有待进一步研究。关于OsTDL1A在孢母细胞及胚囊方面的相关研究较少,本文通过Real-time PCR定量分析发现在突变体花药和胚囊中OsDMC1 [25]、OsPAIR1 [5]和OsPAIR2 [6]的表达量在减数分裂时期都明显下降,说明FMS的突变会影响这些减数分裂相关基因的正常表达,因此我们推测突变体的减数分裂受到了影响。OsPAIR1和OsPAIR2影响大孢子母细胞和小孢子母细胞中同源染色体的配对,而OsDMC1则影响联会和交换,因此推测OsTDL1A对孢母细胞的影响可能与减数分裂染色体配对及联会、交换有关,甚至在水稻雌雄配子发育过程中,OsDMC1、OsPAIR1和OsPAIR2可能作用于FMS的下游。
本研究通过EMS诱变在水稻中筛选了1个隐性核不育基因FMS,通过测序发现它是1个新的OsTDL1A的等位基因。通过细胞学观察确定了它的表型,又通过分子生物学试验对该基因作用的分子机制进行了研究,为该基因在孢母细胞发育方面的调节作用研究提供了一定的思路和方向。
| [1] |
Khush G S. What it will take to feed 5.0 billion rice consumers in 2030[J]. Plant Molecular Biology, 2005, 59(1): 1-6. DOI:10.1007/s11103-005-2159-5 |
| [2] |
官文祥, 邓赟, 李小旭, 等. 水稻雌性不育分子机理研究进展[J]. 分子植物育种, 2017, 15(2): 672-684. Guan W X, Deng Y, Li X X, et al. Advances in research on molecular mechanism of female sterility in rice (Oryza sativa L.)[J]. Molecular Plant Breeding, 2017, 15(2): 672-684 (in Chinese with English abstract). |
| [3] |
杨莉芳, 刁现民. 植物细胞核雄性不育基因研究进展[J]. 植物遗传资源学报, 2013, 14(6): 1108-1117. Yang L F, Diao X M. Progress in identification of plant male sterility related nuclear genes[J]. Journal of Plant Genetic Resources, 2013, 14(6): 1108-1117 (in Chinese with English abstract). |
| [4] |
Nonomura K, Miyoshi K, Eiguchi M, et al. The MSP1 gene is necessary to restrict the number of cells entering into male and female sporogenesis and to initiate anther wall formation in rice[J]. The Plant Cell, 2003, 15(8): 1728-1739. DOI:10.1105/tpc.012401 |
| [5] |
Nonomura K, Nakano M, Fukuda T, et al. The novel gene HOMOLOGOUS PAIRING ABERRATIONN RICE MEIOSIS1 of rice encodes a putative coiled-coil protein required for homologous chromosome pairing in meiosis[J]. The Plant Cell, 2004, 16(4): 1008-1020. DOI:10.1105/tpc.020701 |
| [6] |
Nonomura K, Nakano M, Eiguchi M, et al. PAIR2 is essential for homologous chromosome synapsis in rice meiosis Ⅰ[J]. Journal of Cell Science, 2006, 119(2): 217-225. DOI:10.1242/jcs.02736 |
| [7] |
Wan L L, Zha W J, Cheng X Y, et al. A rice β-1, 3-glucanase gene Osg1 is required for callose degradation in pollen development[J]. Planta, 2011, 233(2): 309-323. DOI:10.1007/s00425-010-1301-z |
| [8] |
Li N, Zhang D S, Liu H S, et al. The rice Tapetum Degeneration Retardation gene is required for tapetum degradation and anther development[J]. The Plant Cell, 2006, 18(11): 2999-3014. DOI:10.1105/tpc.106.044107 |
| [9] |
Jung K H, Han M J, Lee Y S, et al. An rice Undeveloped Tapetum1 is a major regulator of early tapetum development[J]. The Plant Cell, 2005, 17(10): 2705-2722. DOI:10.1105/tpc.105.034090 |
| [10] |
Pacini E. Tapetum character states:analytical keys for tapetum types and activities[J]. Canadian Journal of Botany, 1997, 75(9): 1448-1459. DOI:10.1139/b97-859 |
| [11] |
Li H, Pinot F, Sauveplane V, et al. Cytochrome P450 family member CYP704B2 catalyzes the ω-hydroxylation of fatty acids and is required for anther cutin biosynthesis and pollen exine formation in rice[J]. The Plant Cell, 2010, 22(1): 173-190. DOI:10.1105/tpc.109.070326 |
| [12] |
Shi J, Tan H X, Yu X H, et al. Defective Pollen Wall is required for anther and microspore development in rice and encodes a fatty acyl carrier protein reductase[J]. The Plant Cell, 2011, 23(6): 2225-2246. DOI:10.1105/tpc.111.087528 |
| [13] |
Liu Z, Lin S, Shi J X, et al. Rice No Pollen1 (NP1) is required for anther cuticle formation and pollen exine patterning[J]. The Plant Journal, 2017, 91(2): 263-277. DOI:10.1111/tpj.2017.91.issue-2 |
| [14] |
Zhu Q H, Ramm K, Shivakkumar R, et al. The ANTHER INDEHISCENCE1 gene encoding a single MYB domain protein is involved in anther development in rice[J]. Plant Physiology, 2004, 135(3): 1514-1525. DOI:10.1104/pp.104.041459 |
| [15] |
Zhao Z G, Zhang Y H, Liu X, et al. A role for a dioxygenase in auxin metabolism and reproductive development in rice[J]. Developmental Cell, 2013, 27(1): 113-122. DOI:10.1016/j.devcel.2013.09.005 |
| [16] |
Zhang H, Liang W Q, Yang X J, et al. Carbon starved anther encodes a MYB domain protein that regulates sugar partitioning required for rice pollen development[J]. The Plant Cell, 2010, 22(3): 672-689. DOI:10.1105/tpc.109.073668 |
| [17] |
Kaneko M, Inukai Y, Ueguchi-Tanaka M, et al. Loss-of-function mutations of the rice GAMYB gene impair α-amylase expression in aleurone and flower development[J]. The Plant Cell, 2004, 16(1): 33-44. DOI:10.1105/tpc.017327 |
| [18] |
Yang J Y, Zhao X B, Cheng K, et al. A killer-protector system regulates both hybrid sterility and segregation distortion in rice[J]. Science, 2012, 337(6100): 1336-1340. DOI:10.1126/science.1223702 |
| [19] |
Yu Y, Zhao Z, Shi Y, et al. Hybrid sterility in rice (Oryza sativa L.) involves the tetratricopeptide repeat domain containing protein[J]. Genetics, 2016, 203(3): 1439-1451. DOI:10.1534/genetics.115.183848 |
| [20] |
Sato Y, Hong S K, Tagiri A, et al. A rice homeobox gene, OSH1, is expressed before organ differentiation in a specific region during early embryogenesis[J]. Proc Natl Acad Sci USA, 1996, 93(15): 8117-8122. DOI:10.1073/pnas.93.15.8117 |
| [21] |
Dreni L, Jacchia S, Fornara F, et al. The D-lineage MADS-box gene OsMADS13 controls ovule identity in rice[J]. The Plant Journal, 2007, 52(4): 690-699. DOI:10.1111/j.1365-313X.2007.03272.x |
| [22] |
Nonomura K I, Morohoshi A, Nakano M, et al. A germ cell-specific gene of the ARGONAUTE family is essential for the progression of premeiotic mitosis and meiosis during sporogenesis in rice[J]. The Plant Cell, 2007, 19(8): 2583-2594. DOI:10.1105/tpc.107.053199 |
| [23] |
Yang L Y, Wu Y, Yu M L, et al. Genome-wide transcriptome analysis of female-sterile rice ovule shed light on its abortive mechanism[J]. Planta, 2016, 244(5): 1011-1028. DOI:10.1007/s00425-016-2563-x |
| [24] |
Wang C L, Wang Y, Cheng Z J, et al. The role of OsMSH4 in male and female gamete development in rice meiosis[J]. Journal of Experimental Botany, 2016, 67(5): 1447-1459. DOI:10.1093/jxb/erv540 |
| [25] |
Wang H J, Hu Q, Tang D, et al. OsDMC1 is not required for homologous pairing in rice meiosis[J]. Plant Physiology, 2016, 171(1): 230-241. DOI:10.1104/pp.16.00167 |
| [26] |
Duan Y L, Diao Z J, Liu H Q, et al. Molecular cloning and functional characterization of OsJAG gene based on a complete-deletion mutant in rice (Oryza sativa L.)[J]. Plant Molecular Biology, 2010, 74(6): 605-615. DOI:10.1007/s11103-010-9703-7 |
| [27] |
Nagasawa N, Miyoshi M, Sano Y, et al. SUPERWOMAN1 and DROOPING LEAF genes control floral organ identity in rice[J]. Development, 2003, 130(4): 705-718. DOI:10.1242/dev.00294 |
| [28] |
Zhang D B, Luo X, Zhu L. Cytological analysis and genetic control of rice and anther development[J]. Journal of Genetics and Genomics, 2011, 33: 379-390. |
| [29] |
Yang S L, Xie L F, Mao H Z, et al. Tapetum determinant1 is required for cell specialization in the Arabidopsis anther[J]. The Plant Cell, 2003, 15(12): 2792-2804. DOI:10.1105/tpc.016618 |
| [30] |
Zhao X N, de Palma D J, Oane R, et al. OsTDL1A binds to the LRR domain of rice receptor kinase MSP1, and is required to limit sporocyte numbers[J]. The Plant Journal, 2008, 54(3): 375-387. DOI:10.1111/j.1365-313X.2008.03426.x |
| [31] |
Hong L L, Tang D, Shen Y, et al. MIL2 (MICROSPORELESS2) regulates early cell differentiation in the rice anther[J]. New Phytologist, 2012, 196(2): 402-413. DOI:10.1111/j.1469-8137.2012.04270.x |
| [32] |
Hong L, Tang D, Zhu K, et al. Somatic and reproductive cell development in rice anther is regulated by a putative glutaredoxin[J]. The Plant Cell, 2012, 24(2): 577-588. DOI:10.1105/tpc.111.093740 |
| [33] |
Yang L, Qian X, Chen M, et al. Regulatory role of a receptor-like kinase in specifying anther cell identity[J]. Plant Physiology, 2016, 171(3): 2085-2100. DOI:10.1104/pp.16.00016 |




