文章信息
- 高夕全, 阮辛森, 马亮, 孙亚利
- GAO Xiquan, RUAN Xinsen, MA Liang, SUN Yali
- 植物先天性免疫反应中的细胞死亡及其调控
- Regulation of programmed cell death responses in plant innate immunity
- 南京农业大学学报, 2018, 41(6): 971-982
- Journal of Nanjing Agricultural University, 2018, 41(6): 971-982.
- http://dx.doi.org/10.7685/jnau.201803061
-
文章历史
- 收稿日期: 2018-03-30
生物体在其生存环境中,会持续与外界生物和非生物因素相互作用。与动物不同,植物通常情况下难以主动避开对其自身不利的生物或非生物胁迫。细胞壁等结构在植物抵抗病原菌侵害过程中发挥着物理防御作用,但一些病原菌可以通过进化产生的特殊机制来突破植物的物理防御屏障,进而对植物体进行成功侵染。因此,除物理屏障外,植物体还往往拥有一套内在的抵抗病原菌侵染的先天性免疫系统(plant innate immunity);在植物通过免疫系统抵抗病原菌侵染的过程中,常常诱发植物细胞死亡(cell death)。在大量的植物突变体研究中发现[1-2],植物细胞死亡在先天性免疫反应中发挥双向作用:细胞死亡既是限制病原菌生长和侵染的防御手段,也是大多数病原菌对植物成功侵染的外在表现。然而,对植物先天性免疫反应中细胞死亡的发生与调控机制尚缺乏系统深入的研究。因此,拓展该方面的工作将有助于对细胞死亡在植物免疫反应中功能的理解,同时,对植物抗病育种具有一定的意义和价值。
1 植物先天性免疫系统植物先天性免疫是植物与微生物长期共进化过程中发展起来的、应对大多数病原菌的一种策略,其主要包含2个层面:1)植物细胞通过对多种保守的病原菌(微生物)相关分子特征(pathogen-associated molecular patterns或microbe-associated molecular patterns,PAMPs或MAMPs)进行识别,从而激活相应的免疫反应,被称为病原菌模式分子引发的免疫反应(PAMP-triggered immunity,PTI)[3];PAMPs的识别主要通过细胞膜上的模式识别受体(pattern recognition receptors,PRRs)来实现,常见的PRRs有FLS2(flagellin-sensing 2)、CERKs(chitin elicitor receptor kinases)等,FLS2可与BAK1(BRASSINOSTEROID INSENSITIVE 1-associated receptor kinase 1)形成受体复合物,来识别病原菌产生的PAMPs,如flg22等[4-6]。2)效应子引发的免疫反应(effector-triggered immunity,ETI),ETI的激活主要来源于植物对效应子的监控或识别[7],病原菌通过其分泌系统向植物细胞内注射一种效应子,亦被称为无毒蛋白(avirulence effectors,Avrs);效应子一方面可以抑制PTI[8],另一方面还可以被植物细胞内的抗性蛋白NB-LRR(nucleotide-binding leucine-rich repeats,NLR)识别,从而激活ETI反应。与PTI相比,ETI反应更强烈,导致细胞产生ROS、激活免疫相关基因转录表达,引起程序性细胞死亡(programmed cell death,PCD)等,PCD亦被称为超敏反应(hypersensitive response,HR)[9]。
2 植物细胞死亡的种类细胞死亡是多细胞生物生命活动中的重要过程之一,既可在受调控的生长发育过程中有序发生,亦在应对外界的胁迫及免疫反应过程中发生[10]。有关细胞死亡的调控研究最早在动物中开始,按照细胞死亡发生的条件、特征及结果,动物中的细胞死亡可分为凋亡(apoptosis)、自噬(autophagy)以及坏死(necrosis)3种类型。
凋亡作为正常的细胞死亡途径,其主要特征是:1)细胞有序地产生染色体固缩;2)细胞膜内陷形成凋亡小体;3)DNA片段化;4)细胞的最终解体[11]。自噬主要是指细胞在高胁迫环境的应激反应下,通过形成双层膜自噬小体,包裹胞质内容物与溶酶体结合进行消化,从而为自身提供营养[12]。坏死则是指细胞质膜崩解、结构自溶并引发急性炎症反应的现象[13]。
有关动物细胞死亡的研究,大多集中于PCD的功能,以及有关细胞发生PCD过程中受基因调控启动的有序死亡的方式和机制方面[14]。有研究提出,事实上并不能明确地以PCD对凋亡、自噬和坏死进行分类,从三者的特征来看,凋亡和自噬更符合PCD的定义,而一部分坏死的发生仍受基因的有序调控[15]。
由于生理结构的差异,植物细胞死亡与动物存在较多差异。尽管如此,凋亡、自噬和坏死3种概念仍被用在植物细胞死亡的讨论中。其中,坏死与凋亡或自噬不同,溶酶体在坏死过程中未发挥作用[16]。目前,有关植物细胞坏死的生理功能、机制和调控过程的深入研究还较少。
按照生理功能的差异,植物的PCD可分为dPCD(development-related PCD)、aPCD(abiotic stress-related PCD)和bPCD(biotic stress-related PCD)[17]。dPCD在植物的生长发育过程中发挥调控作用,主要包括:植物雌雄配子和胚的发育、植株的木质部导管形成等营养生长以及衰老过程[18]。如花药发育过程中,需要花药绒毡层细胞进行PCD,如果绒毡层细胞不能进行正常的PCD,会造成花粉败育,导致植物雄性不育[19]。aPCD在植物的非生物逆境胁迫反应中起重要作用,其主要通过ROS积累、蛋白水解酶等途径调控胁迫反应[20-21]。bPCD主要是在植物与细菌、真菌及昆虫等的互作中发生,典型的bPCD常常以HR的方式发挥作用。
2.1 凋亡型细胞死亡由于植物细胞具有细胞壁,但无巨噬细胞,完整意义上的凋亡在植物中并不存在。目前,植物中表现出凋亡特征的细胞死亡通常被称为凋亡型细胞死亡(apoptosis-like PCD,AL-PCD),其主要在植物细胞发育、衰老、逆境胁迫以及免疫反应过程中发生[22]。
植物细胞AL-PCD的调控机制尚不清楚。尽管与动物的细胞凋亡有某些类似特征,但植物细胞凋亡的调控机制与动物存在一定的差异。由于液泡、叶绿体以及植物激素的作用,植物具有一套特有的AL-PCD调控网络[23]。在AL-PCD中发挥重要调控作用的因子,包括caspase(cysteinyl aspartate specific proteinase)-like蛋白酶[20]、ROS[24]、线粒体[25]以及水杨酸(salicylic acid,SA)、茉莉酸(jasmonic acid,JA)和乙烯(ethylene,ET)等植物激素[26]。ROS可以通过钙离子介导的MAPKs(mitogen-activated protein kinases)/CDPKs(calcium-dependent protein kinases)级联反应来产生[21],或通过线粒体产生的细胞色素c积累来促使其产生[27],积累的ROS则通过激活蛋白水解酶来诱导AL-PCD的发生[28](图 1)。此外,根据动物细胞中凋亡的调控因子的功能,有研究发现,植物中的同源调控因子亦可能在AL-PCD中发挥作用,例如,拟南芥中,BI-1(Bax inhibitor-1)在病原菌Pseudomonas syringae pv. tomato DC3000处理后上调表达,并能抑制AL-PCD,其调控过程可能与线粒体的Bcl-2(B-cell lymphoma-2)蛋白家族相互作用有关[2];拟南芥BAG(Bcl-2-associated athanogene)蛋白家族可抑制AL-PCD发生[29]。植物中是否存在保守的AL-PCD调控机制将是今后相关研究的重点。
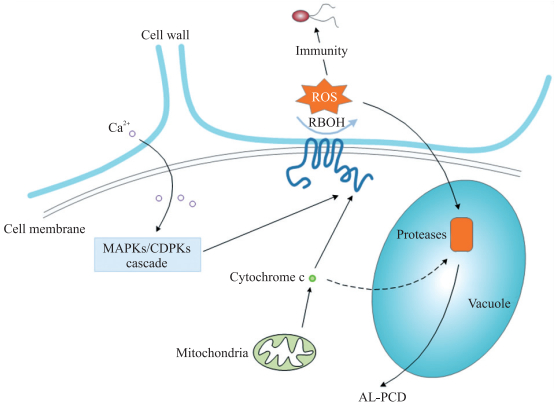
|
图 1 植物细胞中凋亡型细胞死亡的调控 Figure 1 The regulation of AL-PCD(apoptosis-like PCD)in plant cells MAPKs:Mitogen-activated protein kinases; CDPKs:Calcium-dependent protein kinases; RBOH:Respiratory burst oxidase homolog; ROS:Reactive oxygen species; AL-PCD:Apoptosis-like programmed cell death. |
植物中自噬(autophagy)的发生主要依赖细胞中具有双层膜结构的自噬体(autophagosomes),一系列被称为Autophagy-Related Genes(ATGs)的基因在自噬过程中发挥着重要的调控作用[30]。按照调控功能的不同,ATGs可被分为几个大类,其中Atg1 complex包括Atg1、Atg13等组分,其通过TORC1(target of rapamycin complex 1)介导的营养信号调控PI3K(phosphoinositide 3-kinase)complex,PI3K complex包括Vps34、Vps15和Atg6等[31]。拟南芥Atg9在ER形成自噬体过程中发挥着关键作用[32];Atg12共轭复合物和Atg8共轭复合物均参与调控自噬体的形成,其中Atg8在自噬体形成过程中与膜表面磷脂酰乙醇胺(phosphatidyl ethanolamine,PE)共轭结合,因此,通常被用作自噬发生的检测标记物[33]。还有研究发现,Atg6和Atg3等通过特异的信号通路调控自噬,如拟南芥TRAF(tumor necrosis factor receptor-associated factor)蛋白家族中的TRAF1a和TRAF1b,在营养缺乏的条件下通过E3泛素化连接酶SINAT1/2泛素化降解Atg6蛋白[34];烟草中GAPCs(glyceraldehyde-3-phosphate dehydrogenases)与Atg3相互作用抑制细胞自噬,但在ROS刺激下,GAPCs与Atg3的相互作用被抑制,从而促进细胞自噬的发生[35](图 2)。
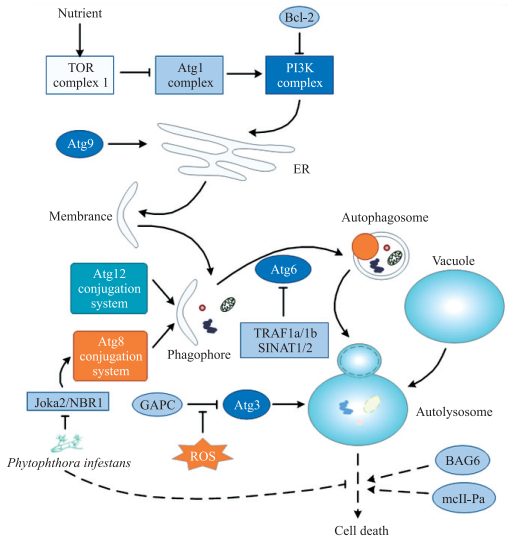
|
图 2 植物细胞中自噬的调控 Figure 2 The regulation of autophagy in plant cells TOR:Target of rapamycin; Atg:Autophagy-related gene; Bcl-2:B-cell lymphoma-2;PI3K:Phosphoinositide 3-kinase; TRAF:Tumor necrosis factor receptor-associated factor; GAPCs:Glyceraldehyde-3-phosphate dehydrogenases; BAG:Bcl-2-associated athanogene; NBR1:Neighbor of Brca1. |
自噬在植物细胞系统的稳态维持、发育、逆境胁迫以及免疫反应过程中具有重要作用[36]。根据细胞的特定条件,自噬在PCD的调控过程中可发挥激活或抑制的功能[37]。在植物细胞自噬命运决定的调控中,目前研究较深入的是NBR1(neighbor of Brca1),其可在系统性自噬或异源自噬反应中被激活[38-39],并通过Joka2/NBR1拮抗作用调控自噬后续的PCD[40]。拟南芥和烟草的BAG蛋白家族成员BAG6在天冬氨酸蛋白酶剪切作用下引起自噬的发生,并影响后续的细胞死亡[1];mcII-Pa亦被报道通过ATG5/6在自噬的细胞死亡中发挥调控作用[41];在逆境胁迫下TOR复合物可通过磷酸化Atg1复合体来负调控自噬反应[42];马铃薯中病原菌Phytophthora infestans通过分泌的效应子PexRD54抑制Joka2与Atg8复合物组分Atg8CL相互作用,负调控相对应的自噬反应,并促进病原菌的侵染[40](图 2)。
3 植物免疫反应中的细胞死亡植物免疫反应过程中发生的细胞死亡,主要是通过HR来体现的,其中,ROS、蛋白水解酶以及线粒体的功能变化等是引发细胞死亡的主要因素[9]。在此过程中,细胞表现出一系列凋亡特征,包括线粒体膨胀、DNA片段化以及生物膜系统的破坏等[43]。免疫反应过程中的细胞死亡可以影响植物对病原菌的抗性。如在番茄中表达p35可抑制细胞死亡,并增强对多种病原菌的抗性[44];死体营养型(necrotroph)病原菌Botrytis cinerea可通过激活SA信号通路,促进番茄中病原菌的侵染及引起细胞死亡,从而增强侵染效果[45]。研究发现,自噬在植物免疫反应中也发挥着重要作用[46]。例如:在拟南芥中,自噬可通过BAG6来调控细胞后续的AL-PCD,从而增强拟南芥对Botrytis cinerea的抗性[1]。
3.1 PTI信号分子参与的细胞死亡PTI反应中,FLS2是被研究得最为深入的PRRs之一。FLS2可识别细菌鞭毛蛋白中一段高度保守的22个氨基酸多肽flg22[5],并激活BAK1。BAK1属于体细胞胚发生相关激酶(somatic embryogenesis-related kinases,SERKs)基因家族,是一类定位于细胞膜上的RLKs,在识别胞外配基、体外环境刺激信号向胞内的转导、调控与发育相关的dPCD以及与免疫相关的bPCD过程中具有重要作用[47]。例如:拟南芥bak1突变体接种坏死型病原菌Botrytis cinerea和Alternaria brassicicola后,突变体表现更加感病,且出现从接种部位向四周扩展的坏死,而野生型中的PCD仅仅局限于接种部位[48]。利用病毒诱导的基因沉默(virus-induced gene silencing,VIGS)干扰棉花的GhBAK1基因,可引起叶片内ROS的大量积累,同时诱发明显的细胞死亡[49]。
MAPKs级联反应的激活是PTI途径的重要特征之一。有研究表明,MAPKs途径可能作为重要的信号节点参与PCD的调控。如:在烟草HR反应中,MAPKs级联反应被激活后,通过关闭叶绿体中的碳固定和产生H2O2来激活PCD[50]。另外,MPK6能被PCD的激发子FB1(fumonisin B1)和鞘脂类分子的前体长链基团(long chain bases,LCBs)激活,而mpk6突变体则丧失了FB1诱导的PCD表型[51]。
另外,有研究表明,泛素化参与了PTI过程中的细胞死亡。水稻的ebr1 (enhanced blight and blast resistance 1)突变体对细菌和真菌具有广谱抗性,同时表现出持续自发的PCD;EBR1基因编码的E3泛素化连接酶可与OsBAG4互作,直接介导OsBAG4的降解,而OsBAG4则促进PRs(pathogenesis-related)基因的表达,因而,可用,其水平与水稻的PCD及病原菌抗性显著关联[52]。
以上研究提示,一些PTI途径的关键信号分子,如BAK1和MAPKs等可能会作为保守的信号节点同时在dPCD和PTI的细胞死亡中发挥作用。然而,有关dPCD与PTI中的细胞死亡是如何交叉互作的,还需要深入研究。
3.2 ETI调控的细胞死亡相比于PTI,由ETI介导的细胞死亡更为普遍[9]。植物R基因(resistance genes)表达的NLR蛋白,在识别病原菌分泌的特异效应子后,会迅速引发强烈的免疫反应[53],包括ROS爆发积累、SA含量增加、PRs基因上调表达以及HR等[54]。对拟南芥的研究发现,R基因表达的RPM1(resistance to Pseudomonas syringae pv. maculicola 1)和RPS2(resistance to Pseudomonas syringae 2)蛋白,分别识别效应子AvrRpm1(avirulence protein 1 from Pseudomonas syringae pv. maculicola)和AvrRpt2(avirulence protein 2 from Pseudomonas syringae pv. tomato),往往伴随着强烈的PCD发生。RIN4(RPM1-interacting protein 4)在相关的信号传导中发挥重要作用,效应子AvrRpm1和AvrRpt2可与RIN4互作并磷酸化RIN4,磷酸化的RIN4则被RPM1或RPS2识别,从而激活RPM1或RPS2介导的PCD反应[55-57]。
在AvrRpm1-RPM1和AvrRpt2-RPS2介导的ETI激活过程中,CDPKs信号途径可能参与调节PCD的发生,一组特异的CDPKs家族成员cpk1/2/5/6突变体接种Pseudomonas syringae pv. tomato DC3000/avrRpm 1和Pseudomonassyringae pv. tomato DC3000/avrRpt2后,表现出显著降低的PCD水平[58]。此外,在拟南芥和烟草中的研究发现,自噬在ETI过程中对细胞死亡的调控发挥重要作用, 在ATG6低表达情况下,Pseudomonas syringae pv. tomato DC3000侵染产生的细胞死亡会向未感染组织扩散[59]。
在拟南芥bak 1-4 bkk1-1背景中,ETI途径的关键组分EDS1(enhanced disease susceptibility 1)和PAD4(phytoalexin-deficient 4)被突变后,bak1-4 bkk1-1的细胞死亡表型被显著抑制,因此,SA通路可以通过ETI关键组分来调控bak 1-3 bkk1-1中的细胞死亡[60]。
SPL(SQUAMOSA promoter-binding protein like)蛋白家族是ETI过程中细胞死亡的另一个重要调控因子。烟草的NbSPL6在烟草花叶病毒Tobacco mosaic virus效应子p50-U1诱导的ETI抗性中是必需的,拟南芥的AtSPL6在病原菌Pseudomonas syringae效应子激活RPS4(resistance to Pseudomonas syringae 4)诱导的ETI抗性中,可以正调控免疫相关基因的表达,并激活后续的HR反应[61]。
另外,在玉米的研究中发现1个具有自激活活性的R基因编码的抗病蛋白(resistance proteins)RP1-D21可持续诱导玉米HR反应[62-63]。利用全基因组关联分析(genome-wide association study,GWAS)方法,在玉米中鉴定到多个与RP1-D21诱导的HR反应相关的候选基因。其中,木质素合成相关蛋白HCT(hydroxycinnamoyl transferase)可与RP1-D21互作,可能是作为RP1-D21的卫兵蛋白,通过与后者的CC domain互作来抑制HR反应及免疫活性[64]。
3.3 植物激素调控的细胞死亡植物激素信号途径在dPCD中的作用已有相关报道;在免疫反应中,JA、ET和SA三者存在相互作用,这些相互作用与植物对于活体营养型及死体营养型病原菌的免疫反应以及细胞死亡调控的差异有关。SA在植物对活体营养型病原菌的免疫反应中发挥作用,活体营养型病原菌侵染过程的发展依赖于宿主细胞,免疫过程中发生的细胞死亡可以有效阻止该类病原菌的进一步生长、侵染和扩展;而JA/ET途径主要在死体营养型病原菌的免疫反应中起作用,免疫过程中的细胞死亡对死体营养型病原菌的侵染控制效果甚微[65](图 3)。
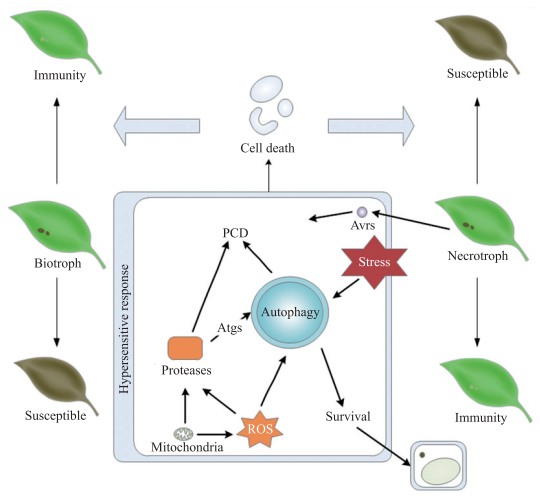
|
图 3 细胞死亡调控在植物免疫反应中的作用 Figure 3 The roles of cell death in the regulation of plant innate immunity ROS:Reactive oxygen species; Atgs:Autophagy-related genes; PCD:Programmed cell death. |
SA-JA在大多数情况主要表现为拮抗作用,其中,最为关键的组分是NPR1(non-expressor of pathogenesis related genes 1)[26]。拟南芥bak 1-4 bkk1-1突变体在光照条件下表现出明显的细胞死亡表型,但对Pseudomonas syringae pv. tomato DC3000更加抗病,而黑暗则抑制这种表型;在bak 1-4 bkk1-1中检测到高表达的SA合成基因SID2(salicylic acid induction-deficient 2)和EDS5,而sid2或eds5突变体与bak1-3 bkk1-1杂交,可显著抑制后者的细胞死亡表型[60]。SA和JA在ETI途径中起协同作用:外源喷施茉莉酸甲酯(MeJA)可以加速拟南芥接种Pseudomonas syringae pv. maculicola ES4326/avrRpt2后PCD的发生,但对rps2突变体的PCD表型却未见明显的影响。因此,JA途径可以通过参与调节PCD的发生来正调控ETI。有趣的是,伴随着ETI途径的激活,在接种部位内源SA水平显著增加,而高水平的SA则促进NPR3介导的NPR1和JAZ(jasmonate ZIM-domain)蛋白的降解,从而解除了NPR1对ETI过程中PCD的抑制,表明SA和JA可以通过协同作用,利用对PCD的调控来增强植物对活体营养型病原菌的免疫反应,且寄主不会对死体营养型病原菌更加感病[66]。
JA-ET主要表现为协同作用,调控其相互作用的最重要因子是AP2/ERF(Apetala2/Ethylene response factor)家族的ERF1和ORA59(octadecanoid-responsive Arabidopsis 59)。ERF1和ORA59均可被JA或ET激活,从而激活JA/ET信号通路下游的PDF 1.2(Plant defensin 1.2)基因[67]。ET-SA的相互作用主要表现在ET通路中EIN2(ethylene-insensitive protein 2)对SA通路的强化作用[68]。在番茄和拟南芥中,病原菌Pseudomonas syringae分泌的一种JA类似物冠毒素(coronatine,COR)能激活植物JA信号通路,对SA信号通路起拮抗作用等,从而抑制免疫反应中PRs基因的表达,并促进病原菌的侵染及植物细胞死亡[69]。总之,植物可通过SA-JA/ET复杂的网络,来精密调控在病原菌侵染时的免疫反应和细胞死亡。
3.4 ROS调控的细胞死亡ROS是包括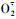
目前,对植物免疫反应中ROS产生机制的了解并不透彻,主要集中在植物RBOH(respiratory burst oxidase homolog)家族的NADPH氧化酶(RBOHD)的调控上,后者可通过Ca2+依赖或非依赖的途径激活,从而促进ROS的产生[58, 71]。CDPKs在PTI和ETI途径中均可以通过激活RBOH来介导ROS的产生[72]。此外,部分植物PRRs受体同时具有蛋白受体和蛋白激酶功能,在植物PTI反应过程中,EFR/FLS2-BAK1可在识别PAMPs后直接磷酸化激活BIK1(botrytis-induced kinase 1),磷酸化的BIK1可以磷酸化激活RBOHD,从而调控ROS的产生[73]。
ROS诱导植物细胞死亡的具体机制尚不完全清楚。其中,一氧化氮(nitric oxide,NO)可能是一个关键因子。NO属于ROS类物质,NO需与其他ROS产物共同作用诱发植物细胞的HR反应;NO还可通过其介导的蛋白S-亚硝基化作用来调控ROS产生[74]。在病原菌Pseudomonas syringae pv. tomato DC3000侵染过程中,拟南芥组织内的NO和ROS含量增加,伴随SA的积累,促进HR的发生;升高的NO可S-亚硝基化拟南芥RBOHD中保守的890位半胱氨酸,从而抑制RBOHD合成ROS的活性,负调控HR反应[75]。
植物细胞叶绿体和线粒体亦可以通过ROS参与调控HR反应。在烟草和拟南芥中的研究表明,病原菌释放的效应子可通过激活MAPKs通路促进叶绿体中ROS的产生,并造成细胞发生AL-PCD[50]。线粒体对于ROS的调控主要通过细胞色素c的释放[76],病原菌Erwinia amylovora释放的harpin NEa通过刺激烟草线粒体ROS的产生来激活免疫反应和细胞死亡[77]。
植物免疫反应过程中,病原菌产生的毒素亦能刺激ROS的产生。在小麦和拟南芥中的研究发现,由禾谷镰孢菌Fusarium graminearum分泌的一种毒素脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON),通过刺激ROS积累及抑制线粒体功能等方式,促进植物细胞AL-PCD的发生,进而促进镰孢菌死体营养型阶段的侵染和发展。DON在植物对镰孢菌的免疫反应中发挥依赖于剂量的双向作用:高浓度的DON有利于镰孢菌的侵染;较低浓度的DON则可以激活免疫相关基因表达,从而抑制病原菌的侵染[78]。
3.5 Caspase-like蛋白酶调控的细胞死亡在动物细胞中,caspase是介导PCD的关键因素。caspase前体被诱导PCD的因子剪切激活,激活的caspase进而激活一系列的PCD进程[79]。然而,植物并不表达caspase[80]。对植物中caspase-like蛋白酶与AL-PCD相互作用的研究发现,caspase底物及抑制剂均对caspase-like蛋白酶产生反应,但敲除这些caspase-like蛋白酶基因并不能阻断植物细胞AL-PCD的发生,仅能偶尔减缓AL-PCD的进程。因此,这些敲除植株在发育上未见明显的表型变化[28, 76]。植物中与PCD相关的caspase-like蛋白酶分为3类[81]:1)Vacuolar processing enzymes(VPEs);2)Metacaspases(MCs);3)Papain-like cysteine proteases(PLCPs),植物免疫反应PCD中研究较多的是VPEs及MCs。
VPEs是一类位于液泡膜上的C12家族蛋白酶,具有半胱氨酸蛋白酶活性,与液泡中的蛋白成熟有关[82]。拟南芥中,病原菌Fusarium moniliforme通过毒素FB1激活γVPE,从而引发PCD;突变VPE以及利用caspase-1或VPEs抑制剂处理,均可阻断FB1引起的细胞死亡[83]。烟草的NbVPEs在病毒侵染过程中被激活,造成液泡膜崩解和液泡中贮存的水解酶释放,进而诱导细胞死亡发生[84];NbVPE1a和NbVPE1b是PTI反应中诱导的细胞死亡所必需的,但在病原菌Magnaporthe grisea效应子Nep1(ethylene-inducing peptide 1)诱导的免疫反应中,VPEs则不会参与调控相关的PCD过程[82]。
MCs是不存在于动物的一类C14家族蛋白酶,具有半胱氨酸蛋白酶活性。拟南芥的MCs分为MC-Ⅰ(AtMC1-AtMC3)和MC-Ⅱ(AtMC4-AtMC9)2个大类,AtMC1、AtMC2以及AtMCP2d在病原菌Pseudomonas syringae pv. tomato激发的免疫反应中调控AL-PCD的发生,其中,AtMC1和AtMCP2d正调控AL-PCD发生,AtMC2则抑制AL-PCD;此外,AtMCP2d在FB1激活的细胞死亡中亦发挥正调控作用[85]。但是,atmcI敲除突变体中,AL-PCD并未能被完全阻断,表明上述免疫反应过程中,AL-PCD的发生还存在不依赖于AtMC-Ⅰ的调控途径[86]。
PLCPs属于C1A家族蛋白酶,具有半胱氨酸蛋白酶活性。PLCPs主要与植物衰老组织的蛋白降解有关[87],在自噬和免疫反应等过程中亦发挥作用[88]。如,拟南芥atg5突变体中一类PLCPs在自噬过程中被上调表达,从而促进蛋白水解及细胞死亡的发生[89];马铃薯的PLCP C14能增强对病原菌Phytophthora infestans的抗性,后者分泌的Avrblb2(avirulence protein 2 from Phytophthora infestans pv. bulbocastanum)则抑制PLCP C14向外质体的转移,进而有利于病原菌的侵染[90]。
植物中的其他蛋白酶在免疫反应的细胞死亡调控中的作用亦有报道。例如,番茄的枯草杆菌酶P69B属于PR蛋白,在对Phytophthora infestans和Pseudomonas syringae的免疫反应中,可经由SA通路激活表达,而过量表达P69B可诱导番茄胚轴表皮细胞发生PCD[91-92];病原菌Cochliobolus victoriae产生的毒素victorin能刺激燕麦发生细胞死亡,此过程中丝氨酸蛋白酶被激活表达并转移至外质体[93]。
4 总结和展望先天性免疫反应是植物应对大多数病原微生物的主要策略,其中,细胞死亡的调控是植物先天性免疫反应的重要特征。对于活体营养型病原菌,其生长和侵染的发展依赖于宿主植物细胞,植物受侵染部分通过免疫反应发生的细胞死亡,有助于抑制活体营养型病原菌的生长和扩展;而免疫反应中的细胞死亡对于抵抗死体营养型病原菌的侵染则效果有限,一些病原菌可能通过分泌效应子诱导植物细胞死亡,为自身生长提供更多营养。如燕麦中,R基因Pc2可通过诱导HR反应及后续的细胞死亡,对活体营养型病原菌Puccinia coronata产生抗性,而病原菌Cochliobolus victoriae产生的毒素victorin则通过与Pc2基因连锁的Vb基因,诱导HR反应及细胞死亡,最终促进病原菌Cochliobolus victoriae的侵染[94]。细胞死亡的调控是植物对病原菌产生抗性的重要手段之一。多种因素参与该调控过程,在PTI和ETI过程中产生的ROS在其中发挥重要作用:PTI过程通常经由PRRs的激活,快速产生ROS;ETI过程则通过NLR蛋白产生慢速而强力的ROS。细胞产生的ROS既能抑制侵染部位的病原菌增殖,也会刺激侵染部位附近植物组织发生细胞死亡;同时,植物中还存在对ROS的负调控机制,从而防止细胞死亡向未感染部位扩展。蛋白水解酶是另一个复杂的调控因子,一些特异的蛋白水解酶会在特定病原菌的免疫反应中被激活,促进细胞死亡的发生;蛋白水解酶还在细胞自噬的命运决定中起调控作用。另外,SA、JA、ET等植物激素通过协同作用或拮抗作用调控细胞死亡过程,使得植物应对不同类型病原菌侵染时,发生合适的免疫反应。病原菌亦能通过分泌效应子干扰上述免疫过程,与此同时,植物对效应子的识别则会进一步引起强烈的免疫反应。因此,利用调控细胞死亡来增强植物的抗病能力,可为作物的抗病育种提供了更多的策略和手段。
已有的研究表明,植物先天性免疫不同层面的作用因子在抗病育种中具有潜在的应用价值。将烟草NbFLS2在柑橘中过表达,可提高柑橘对病原菌Xanthomonas citri的抗性[95];水稻的OsSWEET14(SUGARS WILL EVENTUALLY BE EXPORTED TRANSPORTER14)基因是病原菌Xanthomonas oryzae效应子AvrXa17的靶基因,利用基因编辑技术突变OsSWEET14启动子区域的AvrXa17作用位点,可显著增强水稻对Xanthomonas oryzae的抗性[96];在油菜中过表达拟南芥AtRRS1(resistance to Ralstonia solanacearum 1)和AtRPS4,提高了油菜对病原菌Ralstonia solanacearum的抗性[97]。虽然目前已鉴定出大量参与植物与病原菌互作的基因,但大多基因尚未能在抗病育种中应用。其原因之一是这些基因的调控较为复杂且功能多样,如:MLO(mildew resistance locus O)是大麦、番茄等植物中对Erysiphales spp.的易感基因,在番茄中将MLO基因失活,可提高番茄对多种霉菌的抗性[98]。在大麦中失活MLO基因后,虽然可以增强大麦对霉菌的抗性,但同时会使大麦对病原菌Ramularia collocygni产生环境相关的易感[99]。相对而言,目前有关调控PCD的途径或基因在育种实践中的成功应用还很少。例如,杆状病毒中分离的p35基因和IAP基因的表达产物可抑制细胞凋亡,在棉花中转入p35和IAP,可抑制死体营养型病原菌Verticillium dahliae分泌的VD毒素引起的PCD,并增强棉花对此病原菌的抗性[100]。
在动物免疫反应中,免疫相关受体蛋白的结构生物学基础,对抗原识别以及信号传导的调控具有重要意义[101]。植物先天性免疫中亦有类似报道。例如:通过结构解析发现BIR1蛋白质胞外富含亮氨酸(leucine-rich repeats,LRR)结构域(BIR1LRR)和BAK1LRR在体外可以形成稳定的复合物,进而对BAK1参与的植物免疫反应进行负调控[102]。虽然PCD在PTI和ETI途径中均可发生,但目前仅有为数不多的参与调控PCD的组分被研究报道。这2个免疫分支途径是否通过共同的信号节点?BAK1和R基因介导的PCD是否通过交叉对话(cross-talk)来调控PCD?另外,一些细胞死亡的保守信号分子和途径,如Atg、caspases和AL-PCD等在植物细胞死亡调控过程中的上、下游关系是怎样的?由这些途径调控的PCD和细胞坏死之间是否有联系?不同的细胞死亡途径与植物免疫反应是否具有特异性的遗传关联?这些问题在将来的研究中均需加以关注。
总之,植物免疫反应中的细胞死亡调控是一个复杂的网络系统,涉及植物与病原菌相互作用的诸多方面,如对病原菌的识别、信号的传递、ROS的调控和免疫基因功能的激活等。这种复杂的网络有助于植物在病原菌侵染过程中维持侵染部位或植株整体的“稳态”:“稳态”的维持包括对病原菌生长的抑制,以及通过可控的细胞死亡限制病原菌的增殖;而病原菌的爆发增长或大量发生的植物细胞坏死则象征着“稳态”被破坏。植物与病原菌之间的共进化,提供了研究植物细胞死亡复杂调控网络的基础。对于植物免疫反应中的细胞死亡调控的理解和阐明,有助于筛选植物抗病相关因子。然而,如何有效利用和调控免疫反应中的细胞死亡,将是未来植物抗病分子育种实践中的一个重要研究课题。
| [1] |
Li Y, Kabbage M, Liu W, et al. Aspartyl protease-mediated cleavage of BAG6 is necessary for autophagy and fungal resistance in plants[J]. The Plant Cell, 2016, 28(1): 233-247. |
| [2] |
Sanchez P, Zabala M D T, Grant M. AtBI-1, a plant homologue of Bax inhibitor-1, suppresses Bax-induced cell death in yeast and is rapidly upregulated during wounding and pathogen challenge[J]. Plant Journal, 2000, 21(4): 393-399. DOI:10.1046/j.1365-313x.2000.00690.x |
| [3] |
Boller T, He S Y. Innate immunity in plants:an arms race between pattern recognition receptors in plants and effectors in microbial pathogens[J]. Science, 2009, 324(5928): 742-744. DOI:10.1126/science.1171647 |
| [4] |
Chinchilla D, Zipfel C, Robatzek S, et al. A flagellin-induced complex of the receptor FLS2 and BAK1 initiates plant defence[J]. Nature, 2007, 448(7152): 497-500. DOI:10.1038/nature05999 |
| [5] |
Gómez-Gómez L, Boller T. FLS2:An LRR receptor-like kinase involved in the perception of the bacterial elicitor flagellin in Arabidopsis[J]. Molecular Cell, 2000, 5(6): 1003-1011. DOI:10.1016/S1097-2765(00)80265-8 |
| [6] |
Liu T, Liu Z, Song C, et al. Chitin-induced dimerization activates a plant immune receptor[J]. Science, 2012, 336(6085): 1160-1164. DOI:10.1126/science.1218867 |
| [7] |
Jones J D G, Dangl J L. The plant immune system[J]. Nature, 2006, 444(7117): 323-329. DOI:10.1038/nature05286 |
| [8] |
Alfano J R, Collmer A. Type Ⅲ secretion system effector proteins:double agents in bacterial disease and plant defense[J]. Annual Review of Phytopathology, 2004, 42: 385-414. DOI:10.1146/annurev.phyto.42.040103.110731 |
| [9] |
Greenberg J T, Yao N. The role and regulation of programmed cell death in plant-pathogen interactions[J]. Cellular Microbiology, 2004, 6(3): 201-211. DOI:10.1111/cmi.2004.6.issue-3 |
| [10] |
Huysmans M, Lema A S, Coll N S, et al. Dying two deaths-programmed cell death regulation in development and disease[J]. Current Opinion in Plant Biology, 2017, 35: 37-44. DOI:10.1016/j.pbi.2016.11.005 |
| [11] |
Kerr J F R, Wyllie A H, Currie A R. Apoptosis:a basic biological phenomenon with wideranging implications in tissue kinetics[J]. British Journal of Cancer, 1972, 26(4): 239-257. DOI:10.1038/bjc.1972.33 |
| [12] |
He C, Klionsky D J. Regulation mechanisms and signaling pathways of autophagy[J]. Annual Review of Genetics, 2009, 43: 67-93. DOI:10.1146/annurev-genet-102808-114910 |
| [13] |
Majno G, Joris I. Apoptosis, oncosis, and necrosis:an overview of cell death[J]. The American Journal of Pathology, 1995, 146(1): 3-15. |
| [14] |
Ellis H M, Horvitz H R. Genetic control of programmed cell death in the nematode Caenorhabditis elegans[J]. Cell, 1986, 44(6): 817-829. DOI:10.1016/0092-8674(86)90004-8 |
| [15] |
Proskuryakov S Y, Konoplyannikov A G, Gabai V L. Necrosis:a specific form of programmed cell death?[J]. Experimental Cell Research, 2003, 283(1): 1-16. DOI:10.1016/S0014-4827(02)00027-7 |
| [16] |
van Doorn W G, Woltering E J. Many ways to exit?Cell death categories in plants[J]. Trends in Plant Science, 2005, 10(3): 117-122. DOI:10.1016/j.tplants.2005.01.006 |
| [17] |
Kabbage M, Kessens R, Bartholomay L C, et al. The life and death of a plant cell[J]. Annual Review of Plant Biology, 2017, 68: 375-404. DOI:10.1146/annurev-arplant-043015-111655 |
| [18] |
van Hautegem T, Waters A J, Goodrich J, et al. Only in dying, life:programmed cell death during plant development[J]. Trends in Plant Science, 2015, 20(2): 102-113. DOI:10.1016/j.tplants.2014.10.003 |
| [19] |
刘子涵, 石晓艺, 闫鹏娇, 等. D2型细胞质雄性不育小麦绒毡层细胞程序化死亡与活性氧代谢[J]. 中国农业科学, 2017, 50(21): 4071-4086. DOI:10.3864/j.issn.0578-1752.2017.21.002 |
| [20] |
Fagundes D, Bohn B, Cabreira C, et al. Caspases in plants:metacaspase gene family in plant stress responses[J]. Functional & Integrative Genomics, 2015, 15(6): 639-649. |
| [21] |
Liu Y, He C. A review of redox signaling and the control of MAP kinase pathway in plants[J]. Redox Biology, 2017, 11: 192-204. DOI:10.1016/j.redox.2016.12.009 |
| [22] |
Dickman M, Williams B, Li Y, et al. Reassessing apoptosis in plants[J]. Nature Plants, 2017, 3(10): 773-779. DOI:10.1038/s41477-017-0020-x |
| [23] |
Hoeberichts F A, Woltering E J. Multiple mediators of plant programmed cell death:interplay of conserved cell death mechanisms and plant-specific regulators[J]. BioEssays, 2003, 25(1): 47-57. DOI:10.1002/(ISSN)1521-1878 |
| [24] |
Vranová E, Inzé D, van Breusegem F. Signal transduction during oxidative stress[J]. Journal of Experimental Botany, 2002, 53(372): 1227-1236. DOI:10.1093/jexbot/53.372.1227 |
| [25] |
Zhao Y, Luo L, Xu J, et al. Malate transported from chloroplast to mitochondrion triggers production of ROS and PCD in Arabidopsis thaliana[J]. Cell Research, 2018, 28(4): 448-461. DOI:10.1038/s41422-018-0024-8 |
| [26] |
Pieterse C M J, Leon-Reyes A, van der Ent S, et al. Networking by small-molecule hormones in plant immunity[J]. Nature Chemical Biology, 2009, 5(5): 308-316. DOI:10.1038/nchembio.164 |
| [27] |
van Aken O, van Breusegem F. Licensed to kill:mitochondria, chloroplasts, and cell death[J]. Trends in Plant Science, 2015, 20(11): 754-766. DOI:10.1016/j.tplants.2015.08.002 |
| [28] |
Sueldo D J, van der Hoorn R A L. Plant life needs cell death, but does plant cell death need Cys proteases?[J]. The FEBS Journal, 2017, 284(10): 1577-1585. DOI:10.1111/febs.14034 |
| [29] |
Doukhanina E V, Chen S, van der Zalm E, et al. Identification and functional characterization of the BAG protein family in Arabidopsis thaliana[J]. The Journal of Biological Chemistry, 2006, 281(27): 18793-18801. DOI:10.1074/jbc.M511794200 |
| [30] |
Mizushima N, Yoshimori T, Ohsumi Y. The role of Atg proteins in autophagosome formation[J]. Annual Review of Cell and Developmental Biology, 2011, 27: 107-132. DOI:10.1146/annurev-cellbio-092910-154005 |
| [31] |
Itakura E, Kishi C, Inoue K, et al. Beclin 1 forms two distinct phosphatidylinositol 3-kinase complexes with mammalian Atg14 and UVRAG[J]. Molecular Biology of the Cell, 2008, 19(12): 5360-5372. DOI:10.1091/mbc.e08-01-0080 |
| [32] |
Zhuang X, Chung K P, Cui Y, et al. ATG9 regulates autophagosome progression from the endoplasmic reticulum in Arabidopsis[J]. Proc Natl Acad Sci USA, 2017, 114(3): E426-E435. DOI:10.1073/pnas.1616299114 |
| [33] |
Mizushima N, Yoshimori T, Levine B. Methods in mammalian autophagy research[J]. Cell, 2010, 140(3): 313-326. DOI:10.1016/j.cell.2010.01.028 |
| [34] |
Qi H, Xia F N, Xie L J, et al. TRAF family proteins regulate autophagy dynamics by modulating AUTOPHAGY PROTEIN6 stability in Arabidopsis[J]. The Plant Cell, 2017, 29(4): 890-911. DOI:10.1105/tpc.17.00056 |
| [35] |
Han S, Wang Y, Zheng X, et al. Cytoplastic glyceraldehyde-3-phosphate dehydrogenases interact with ATG3 to negatively regulate autophagy and immunity in Nicotiana benthamiana[J]. The Plant Cell, 2015, 27(4): 1316-1331. DOI:10.1105/tpc.114.134692 |
| [36] |
Yang X, Bassham D C. New insight into the mechanism and function of autophagy in plant cells[J]. International Review of Cell and Molecular Biology, 2015, 320: 1-40. DOI:10.1016/bs.ircmb.2015.07.005 |
| [37] |
Anding A L, Baehrecke E H. Autophagy in cell life and cell death[J]. Current Topics in Developmental Biology, 2015, 114: 67-91. DOI:10.1016/bs.ctdb.2015.07.012 |
| [38] |
Hafrén A, Macia J L, Love A J, et al. Selective autophagy limits cauliflower mosaic virus infection by NBR1-mediated targeting of viral capsid protein and particles[J]. Proc Natl Acad Sci USA, 2017, 114(10): E2026-E2035. DOI:10.1073/pnas.1610687114 |
| [39] |
Zhou J, Wang J, Cheng Y, et al. NBR1-mediated selective autophagy targets insoluble ubiquitinated protein aggregates in plant stress responses[J]. PLoS Genetics, 2013, 9(1): e1003196. DOI:10.1371/journal.pgen.1003196 |
| [40] |
Dagdas Y F, Belhaj K, Maqbool A, et al. An effector of the Irish potato famine pathogen antagonizes a host autophagy cargo receptor[J]. eLife, 2016, 5: e10856. DOI:10.7554/eLife.10856 |
| [41] |
Minina E A, Filonova L H, Fukada K, et al. Autophagy and metacaspase determine the mode of cell death in plants[J]. The Journal of Cell Biology, 2013, 203(6): 917-927. DOI:10.1083/jcb.201307082 |
| [42] |
Robaglia C, Thomas M, Meyer C. Sensing nutrient and energy status by SnRK1 and TOR kinases[J]. Current Opinion in Plant Biology, 2012, 15(3): 301-307. DOI:10.1016/j.pbi.2012.01.012 |
| [43] |
Heath M C. Hypersensitive response-related death[J]. Plant Molecular Biology, 2000, 44(3): 321-334. DOI:10.1023/A:1026592509060 |
| [44] |
Lincoln J E, Richael C, Overduin B, et al. Expression of the antiapoptotic baculovirus p35 gene in tomato blocks programmed cell death and provides broad-spectrum resistance to disease[J]. Proc Natl Acad Sci USA, 2002, 99(23): 15217-15221. DOI:10.1073/pnas.232579799 |
| [45] |
El Oirdi M, El-Rahman T A, Rigano L, et al. Botrytis cinerea manipulates the antagonistic effects between immune pathways to promote disease development in tomato[J]. The Plant Cell, 2011, 23(6): 2405-2421. DOI:10.1105/tpc.111.083394 |
| [46] |
Hofius D, Li L, Hafrén A, et al. Autophagy as an emerging arena for plant-pathogen interactions[J]. Current Opinion in Plant Biology, 2017, 38: 117-123. |
| [47] |
Li J. Multi-tasking of somatic embryogenesis receptor-like protein kinases[J]. Current Opinion in Plant Biology, 2010, 13(5): 509-514. DOI:10.1016/j.pbi.2010.09.004 |
| [48] |
Kemmerling B, Schwedt A, Rodriguez P, et al. The BRI1-associated kinase 1, BAK1, has a brassinolide-independent role in plant cell-death control[J]. Current Biology, 2007, 17(13): 1116-1122. DOI:10.1016/j.cub.2007.05.046 |
| [49] |
Gao X, Li F, Li M, et al. Cotton GhBAK1 mediates Verticillium wilt resistance and cell death[J]. Journal of Integrative Plant Biology, 2013, 55(7): 586-596. DOI:10.1111/jipb.12064 |
| [50] |
Liu Y, Ren D, Pike S, et al. Chloroplast-generated reactive oxygen species are involved in hypersensitive response-like cell death mediated by a mitogen-activated protein kinase cascade[J]. The Plant Journal, 2007, 51(6): 941-954. DOI:10.1111/j.1365-313X.2007.03191.x |
| [51] |
Saucedo-García M, Guevara-García A, González-Solís A, et al. MPK6, sphinganine and the LCB2a gene from serine palmitoyltransferase are required in the signaling pathway that mediates cell death induced by long chain bases in Arabidopsis[J]. The New Phytologist, 2011, 191(4): 943-957. DOI:10.1111/nph.2011.191.issue-4 |
| [52] |
You Q, Zhai K, Yang D, et al. An E3 ubiquitin ligase-BAG protein module controls plant innate immunity and broad-spectrum disease resistance[J]. Cell Host & Microbe, 2016, 20(6): 758-769. |
| [53] |
Caplan J, Padmanabhan M, Dinesh-Kumar S P. Plant NB-LRR immune receptors:from recognition to transcriptional reprogramming[J]. Cell Host & Microbe, 2008, 3(3): 126-135. |
| [54] |
Wu L, Chen H, Curtis C, et al. Go in for the kill:how plants deploy effector-triggered immunity to combat pathogens[J]. Virulence, 2014, 5(7): 710-721. DOI:10.4161/viru.29755 |
| [55] |
Mackey D, Holt B F, Wiig A, et al. RIN4 interacts with Pseudomonas syringae type Ⅲ effector molecules and is required for RPM1-mediated resistance in Arabidopsis[J]. Cell, 2002, 108(6): 743-754. DOI:10.1016/S0092-8674(02)00661-X |
| [56] |
Mackey D, Belkhadir Y, Alonso J M, et al. Arabidopsis RIN4 is a target of the type Ⅲ virulence effector AvrRpt2 and modulates RPS2-mediated resistance[J]. Cell, 2003, 112(3): 379-389. DOI:10.1016/S0092-8674(03)00040-0 |
| [57] |
Chisholm S T, Dahlbeck D, Krishnamurthy N, et al. Molecular characterization of proteolytic cleavage sites of the Pseudomonas syringae effector AvrRpt2[J]. Proc Natl Acad Sci USA, 2005, 102(6): 2087-2092. DOI:10.1073/pnas.0409468102 |
| [58] |
Gao X, Chen X, Lin W, et al. Bifurcation of Arabidopsis NLR immune signaling via Ca2+-dependent protein kinases[J]. Plos Pathogens, 2013, 9(1): e1003127. DOI:10.1371/journal.ppat.1003127 |
| [59] |
Patel S, Dinesh-Kumar S P. Arabidopsis ATG6 is required to limit the pathogen-associated cell death response[J]. Autophagy, 2008, 4(1): 20-27. DOI:10.4161/auto.5056 |
| [60] |
Gao Y, Wu Y, Du J, et al. Both light-induced SA accumulation and ETI mediators contribute to the cell death regulated by BAK1 and BKK1[J]. Frontiers in Plant Science, 2017, 8: 622. DOI:10.3389/fpls.2017.00622 |
| [61] |
Padmanabhan M S, Ma S, Burch-Smith T M, et al. Novel positive regulatory role for the SPL6 transcription factor in the N TIR-NB-LRR receptor-mediated plant innate immunity[J]. PLoS Pathogens, 2013, 9(3): e1003235. DOI:10.1371/journal.ppat.1003235 |
| [62] |
Collins N, Drake J, Ayliffe M, et al. Molecular characterization of the maize Rp1-D rust resistance haplotype and its mutants[J]. The Plant Cell, 1999, 11(7): 1365-1376. DOI:10.1105/tpc.11.7.1365 |
| [63] |
Wang G F, Ji J, El-Kasmi F, et al. Molecular and functional analyses of a maize autoactive NB-LRR protein identify precise structural requirements for activity[J]. PLoS Pathogens, 2015, 11(2): e1004674. DOI:10.1371/journal.ppat.1004674 |
| [64] |
Wang G F, Balint-Kurti P J. Maize Homologs of CCoAOMT and HCT, two key enzymes in lignin biosynthesis, form complexes with the NLR Rp1 protein to modulate the defense response[J]. Plant Physiology, 2016, 171(3): 2166-2177. DOI:10.1104/pp.16.00224 |
| [65] |
Glazebrook J. Contrasting mechanisms of defense against biotrophic and necrotrophic pathogens[J]. Annual Review of Phytopathology, 2005, 43: 205-227. DOI:10.1146/annurev.phyto.43.040204.135923 |
| [66] |
Liu L, Sonbol F M, Huot B, et al. Salicylic acid receptors activate jasmonic acid signalling through a non-canonical pathway to promote effector-triggered immunity[J]. Nature Communications, 2016, 7: 13099. DOI:10.1038/ncomms13099 |
| [67] |
Penninckx I A, Thomma B P, Buchala A, et al. Concomitant activation of jasmonate and ethylene response pathways is required for induction of a plant defensin gene in Arabidopsis[J]. The Plant Cell, 1998, 10(12): 2103-2113. DOI:10.1105/tpc.10.12.2103 |
| [68] |
de Vos M, van Zaanen W, Koornneef A, et al. Herbivore-induced resistance against microbial pathogens in Arabidopsis[J]. Plant Physiology, 2006, 142(1): 352-363. DOI:10.1104/pp.106.083907 |
| [69] |
Thatcher L F, Manners J M, Kazan K. Fusarium oxysporum hijacks COI1-mediated jasmonate signaling to promote disease development in Arabidopsis[J]. The Plant Journal, 2009, 58(6): 927-939. DOI:10.1111/tpj.2009.58.issue-6 |
| [70] |
Torres M A. ROS in biotic interactions[J]. Physiologia Plantarum, 2010, 138(4): 414-429. DOI:10.1111/ppl.2010.138.issue-4 |
| [71] |
Dubiella U, Seybold H, Durian G, et al. Calcium-dependent protein kinase/NADPH oxidase activation circuit is required for rapid defense signal propagation[J]. Proc Natl Acad Sci USA, 2013, 110(21): 8744-8749. DOI:10.1073/pnas.1221294110 |
| [72] |
Kadota Y, Shirasu K, Zipfel C. Regulation of the NADPH oxidase RBOHD during plant immunity[J]. Plant & Cell Physiology, 2015, 56(8): 1472-1480. |
| [73] |
Kadota Y, Sklenar J, Derbyshire P, et al. Direct regulation of the NADPH oxidase RBOHD by the PRR-associated kinase BIK1 during plant immunity[J]. Molecular Cell, 2014, 54(1): 43-55. DOI:10.1016/j.molcel.2014.02.021 |
| [74] |
Scheler C, Durner J, Astier J. Nitric oxide and reactive oxygen species in plant biotic interactions[J]. Current Opinion in Plant Biology, 2013, 16(4): 534-539. DOI:10.1016/j.pbi.2013.06.020 |
| [75] |
Yun B W, Feechan A, Yin M, et al. S-nitrosylation of NADPH oxidase regulates cell death in plant immunity[J]. Nature, 2011, 478(7368): 264-268. DOI:10.1038/nature10427 |
| [76] |
Reape T J, McCabe P F. Apoptotic-like programmed cell death in plants[J]. The New Phytologist, 2008, 180(1): 13-26. DOI:10.1111/nph.2008.180.issue-1 |
| [77] |
Vidal G, Ribas-Carbo M, Garmier M, et al. Lack of respiratory chain complexⅠimpairs alternative oxidase engagement and modulates redox signaling during elicitor-induced cell death in tobacco[J]. The Plant Cell, 2007, 19(2): 640-655. DOI:10.1105/tpc.106.044461 |
| [78] |
Desmond O J, Manners J M, Stephens A E, et al. The Fusarium mycotoxin deoxynivalenol elicits hydrogen peroxide production, programmed cell death and defence responses in wheat[J]. Molecular Plant Pathology, 2008, 9(4): 435-445. DOI:10.1111/mpp.2008.9.issue-4 |
| [79] |
Shalini S, Dorstyn L, Dawar S, et al. Old, new and emerging functions of caspases[J]. Cell Death and Differentiation, 2015, 22(4): 526-539. DOI:10.1038/cdd.2014.216 |
| [80] |
Lord C E N, Gunawardena A H L A N. Programmed cell death in C. elegans, mammals and plant[J]. European Journal of Cell Biology, 2012, 91(8): 603-613. DOI:10.1016/j.ejcb.2012.02.002 |
| [81] |
Balakireva A V, Zamyatnin A A. Indispensable role of proteases in plant innate immunity[J]. International Journal of Molecular Sciences, 2018, 19(2): E629. DOI:10.3390/ijms19020629 |
| [82] |
Zhang H, Dong S, Wang M, et al. The role of vacuolar processing enzyme (VPE) from Nicotiana benthamiana in the elicitor-triggered hypersensitive response and stomatal closure[J]. Journal of Experimental Botany, 2010, 61(13): 3799-3812. DOI:10.1093/jxb/erq189 |
| [83] |
Kuroyanagi M, Yamada K, Hatsugai N, et al. Vacuolar processing enzyme is essential for mycotoxin-induced cell death in Arabidopsis thaliana[J]. The Journal of Biological Chemistry, 2005, 280(38): 32914-32920. DOI:10.1074/jbc.M504476200 |
| [84] |
Hatsugai N, Kuroyanagi M, Yamada K, et al. A plant vacuolar protease, VPE, mediates virus-induced hypersensitive cell death[J]. Science, 2004, 305(5685): 855-858. DOI:10.1126/science.1099859 |
| [85] |
Watanabe N, Lam E. Arabidopsis metacaspase 2d is a positive mediator of cell death induced during biotic and abiotic stresses[J]. The Plant Journal, 2011, 66(6): 969-982. DOI:10.1111/tpj.2011.66.issue-6 |
| [86] |
Coll N S, Vercammen D, Smidler A, et al. Arabidopsis typeⅠmetacaspases control cell death[J]. Science, 2010, 330(6009): 1393-1397. DOI:10.1126/science.1194980 |
| [87] |
Parrott D L, Martin J M, Fischer A M. Analysis of barley (Hordeum vulgare)leaf senescence and protease gene expression:a family C1A cysteine protease is specifically induced under conditions characterized by high carbohydrate, but low to moderate nitrogen levels[J]. The New Phytologist, 2010, 187(2): 313-331. DOI:10.1111/j.1469-8137.2010.03278.x |
| [88] |
van der Hoorn R A L. Plant proteases:from phenotypes to molecular mechanisms[J]. Annual Review of Plant Biology, 2008, 59: 191-223. DOI:10.1146/annurev.arplant.59.032607.092835 |
| [89] |
Havé M, Balliau T, Cottyn-Boitte B, et al. Increases in activity of proteasome and papain-like cysteine protease in Arabidopsis autophagy mutants:back-up compensatory effect or cell-death promoting effect?[J]. Journal of Experimental Botany, 2018, 69(6): 1369-1385. DOI:10.1093/jxb/erx482 |
| [90] |
Bozkurt T O, Schornack S, Win J, et al. Phytophthora infestans effector AVRblb2 prevents secretion of a plant immune protease at the haustorial interface[J]. Proc Natl Acad Sci USA, 2011, 108(51): 20832-20837. DOI:10.1073/pnas.1112708109 |
| [91] |
Jordá L, Vera P. Local and systemic induction of two defense-related subtilisin-like protease promoters in transgenic Arabidopsis plants:luciferin induction of PR gene expression[J]. Plant Physiology, 2000, 124(3): 1049-1058. DOI:10.1104/pp.124.3.1049 |
| [92] |
Zimmermann D, Gomez-Barrera J A, Pasule C, et al. Cell death control by matrix metalloproteinases[J]. Plant Physiology, 2016, 171(2): 1456-1469. |
| [93] |
Coffeen W C, Wolpert T J. Purification and characterization of serine proteases that exhibit caspase-like activity and are associated with programmed cell death in Avena sativa[J]. The Plant Cell, 2004, 16(4): 857-873. DOI:10.1105/tpc.017947 |
| [94] |
Gilbert B M, Wolpert T J. Characterization of the LOV1-mediated, victorin-induced, cell-death response with virus-induced gene silencing[J]. Molecular Plant-Microbe Interactions, 2013, 26(8): 903-917. DOI:10.1094/MPMI-01-13-0014-R |
| [95] |
Hao G, Pitino M, Duan Y, et al. Reduced susceptibility to Xanthomonas citri in transgenic citrus expressing the FLS2 receptor from Nicotiana benthamiana[J]. Molecular Plant-Microbe Interactions, 2016, 29(2): 132-142. DOI:10.1094/MPMI-09-15-0211-R |
| [96] |
Boch J, Scholze H, Schornack S, et al. Breaking the code of DNA binding specificity of TAL-type Ⅲ effectors[J]. Science, 2009, 326(5959): 1509-1512. DOI:10.1126/science.1178811 |
| [97] |
Narusaka M, Hatakeyama K, Shirasu K, et al. Arabidopsis dual resistance proteins, both RPS4 and RRS1, are required for resistance to bacterial wilt in transgenic Brassica crops[J]. Plant Signaling & Behavior, 2014, 9(7): e29130. |
| [98] |
Bai Y, Pavan S, Zheng Z, et al. Naturally occurring broad-spectrum powdery mildew resistance in a Central American tomato accession is caused by loss of Mlo function[J]. Molecular Plant-Microbe Interactions, 2008, 21(1): 30-39. DOI:10.1094/MPMI-21-1-0030 |
| [99] |
McGrann G R D, Stavrinides A, Russell J, et al. A trade off between mlo resistance to powdery mildew and increased susceptibility of barley to a newly important disease, Ramularia leaf spot[J]. Journal of Experimental Botany, 2014, 65(4): 1025-1037. DOI:10.1093/jxb/ert452 |
| [100] |
Tian J, Zhang X, Liang B, et al. Expression of baculovirus anti-apoptotic genes p35 and op-iap in cotton (Gossypium hirsutum L.)enhances tolerance to Verticillium wilt[J]. PLoS One, 2010, 5(12): e14218. DOI:10.1371/journal.pone.0014218 |
| [101] |
Yin Q, Fu T M, Li J, et al. Structural biology of innate immunity[J]. Annual Review of Immunology, 2015, 33: 393-416. DOI:10.1146/annurev-immunol-032414-112258 |
| [102] |
Ma C, Liu Y, Bai B, et al. Structural basis for BIR1-mediated negative regulation of plant immunity[J]. Cell Research, 2017, 27(12): 1521-1524. DOI:10.1038/cr.2017.123 |




