文章信息
- 乔颖, 马锐, 陈志刚
- QIAO Ying, MA Rui, CHEN Zhigang
- 天然低共熔溶剂对冷冻干燥期间嗜热链球菌活力的影响
- Effects of natural deep eutectic solvents on the viability of Streptococcus thermophilus during freeze-drying period
- 南京农业大学学报, 2018, 41(5): 931-938
- Journal of Nanjing Agricultural University, 2018, 41(5): 931-938.
- http://dx.doi.org/10.7685/jnau.201711005
-
文章历史
- 收稿日期: 2017-11-03
天然低共熔溶剂(NADES)是指一定化学计量比的2或3种天然产物(氢键供体和氢键受体)混合后通过加热的方式,使分子间氢键相互缔合而形成的均匀液体[1]。NADES具有合成方便、成本低、原料易获得、毒性低且性质可调节等优点。自2003年Abbott等[2]首次合成氯化胆碱和尿素组成的胆碱类低共熔溶剂以来,低共熔溶剂作为一种可以替代传统溶剂和离子液体的新型绿色溶剂得到了广泛应用。
冷冻干燥是乳酸菌商业生产的常用方法,因其在生产中方便快捷而被广泛应用[3]。为了提高乳酸菌冻藏及冻干后的存活率,最常用且有效的方法是添加一定比例的保护剂。常用的冷冻保护剂包括糖类、醇类、氨基酸类、维生素类和蛋白质等,如乳酸菌冻藏保护剂常用甘油、丝胶肽,冻干保护剂常用海藻糖和脱脂乳粉[4]。目前并没有一个完全能适用于所有菌株的通用基础理论,来解释乳酸菌在冷冻干燥过程中的损伤机制[5-7],只有对于某一个具体菌株的损伤机制研究[8]。
天然低共熔溶剂可以由传统的冷冻保护剂制备而成。已有研究报道了天然低共熔溶剂的酶催化作用[9]。也有研究表明通过冷冻干燥的方法将大肠杆菌(Escherichia coli)TG1/pPBG11细胞保存在天然低共熔溶剂中后细胞仍然具有较好的完整性[10]。因此,本研究筛选出5种由不同天然成分制备的低共熔溶剂,作为保护剂用于嗜热链球菌的冷冻干燥保藏加工中,以提高嗜热链球菌在冷冻干燥后的存活率。同时,探究冷冻干燥对嗜热链球菌的生理损伤,为冷冻干燥乳酸菌工业化生产提供理论和技术支持。
1 材料与方法 1.1 试验材料嗜热链球菌(Streptoccus thermphilus)CICC20364由中国工业微生物菌种保藏管理中心提供。
天然低共熔溶剂组分包括:木糖醇(≥98.0%)、氯化胆碱(≥98.0%)、乙二醇(≥98.0%)、L-脯氨酸(≥98.0%)、葡萄糖(≥98.0%)、甘油(≥98.0%)、山梨糖醇(≥98.0%)、2,2′-联喹啉-4,4′-二甲酸二钠(BCA)(≥98.0%)、β-NADH(≥98.0%)、丙酮酸钠(≥99.0%)、p-甲基-β-D-吡喃半乳糖苷(PNPG)(≥99.0%)和溶菌酶(盐纯化,≥8 000 U · mg-1),均为分析纯,购自上海阿拉丁生化科技股份有限公司。
PQ001低场核磁共振分析仪购自中国上海纽曼有限公司;CM100透射电子显微镜购自新西兰埃因霍温飞利浦电子光学有限公司;UV Bluestar A紫外分光光度计购自北京莱伯泰科仪器有限公司;SHZ-82A气浴恒温振荡器购自江苏金坛市科析仪器有限公司;J30I落地式高速冷冻离心机购自贝克曼库尔特商贸(中国)有限公司。
1.2 天然低共熔溶剂(NADES)的制备制备5种NADES[11]:1)ChX,氯化胆碱/木糖醇/水,摩尔比为1 : 2 : 3;2)EtP,乙二醇/L-脯氨酸,摩尔比为3 : 1;3)ChG,氯化胆碱/葡萄糖/水,摩尔比为2 : 5 : 5;4)GlyP,甘油/L-脯氨酸,摩尔比为3 : 1;5)ChS,氯化胆碱/山梨糖醇/水,摩尔比为2 : 5 : 5。将5种天然低共熔溶剂在85 ℃条件下混合均匀并不断搅拌,待形成均匀透明液体后,于121 ℃灭菌20 min,密封保存于干燥的环境中。
1.3 透射电镜观察细胞结构先将菌体沉淀重悬于无菌磷酸盐缓冲液(PBS,pH6.5)中,-20 ℃冷冻3个月,然后于4 ℃、10 000 g离心10 min,收集菌体沉淀,最后根据文献[12]的方法,用戊二醛固定细胞,制备切片,切片厚度50~70 nm,在电镜下观察不同放大倍数下的细胞形态。
1.4 菌种活力的测定将供试菌株嗜热链球菌活化后,按3%(100 mL培养基接种3 mL菌液)接种量接种于MRS肉汤培养基中,在42 ℃下培养至对数期;收集菌体重悬于无菌PBS溶液中。预冻保藏试验中NADES与菌液的体积比为1 : 1(50% NADES)和4 : 1(80% NADES),混匀后取1 mL保藏于3 mL西林瓶中,测定菌落总数。-70 ℃预冻24 h后的菌液于-10 ℃条件下冷冻干燥36 h。采用MRS倒平板法[4]测定菌落总数,重复3次。
存活率=V2/V1×100%。其中:V1为冷冻干燥前缓冲液中的活菌数(CFU · mL-1);V2为冷冻干燥后的活菌数(CFU · mL-1)。
1.5 细胞裂解条件优化乳酸菌因具有较厚的肽聚糖而难以裂解[13],常见的超声裂解细胞方法[14]经验证不适合嗜热链球菌细胞的裂解。为了使裂解条件更能够稳定细胞内酶的活性,使用控制变量法优化裂解条件。
1.5.1 嗜热链球菌菌体的收集取保藏好的菌种管活化1代后接种至300 mL MRS培养基中,培养15 h,4 ℃、10 000 g离心10 min,用30 mL的PBS悬浮,分装1.6 mL在2 mL离心管中。
1.5.2 离心时间离心时间分别设为2.5、5、10、15、20 min,4 ℃、10 000 g离心后,将菌体沉淀溶于1 mL裂解液[50 mmol · L-1 Tris-HCl、150 mmol · L-1 NaCl、0.5%(体积分数)TritonX-100、pH7.8]中,加入100 μL溶菌酶,37 ℃水浴30 min;4 ℃、10 000 g离心2 min后取上清液,测定酶活性和蛋白含量。
1.5.3 溶菌酶用量配制10 mg · mL-1溶菌酶溶液。取1 mL菌液,4 ℃、10 000 g离心5 min,重悬在裂解液中,分别加入0、50、100、150、200、300和400 μL溶菌酶和1.60、1.55、1.50、1.45、1.40、1.30和1.20 mL裂解液。于37 ℃水浴30 min,4 ℃、10 000 g离心2 min,取上清液,测定酶活性和蛋白含量。
1.5.4 保温时间取1 mL菌液,4 ℃、10 000 g离心5 min,用裂解液1.4 mL悬浮菌体,同时加入200 μL溶菌酶,37 ℃分别保温0 min、15 min、30 min、1 h、2 h。4 ℃、10 000 g离心2 min,取上清液,测定酶活性和蛋白含量。
1.5.5 水浴温度取1 mL菌液,4 ℃、10 000 g离心5 min,用裂解液1. 4 mL悬浮菌体,加入200 μL溶菌酶,4、25、37、45和55 ℃保温30 min。4 ℃、10 000 g离心2 min,取上清液,测定酶活性和蛋白含量。
1.5.6 TritonX-100含量取1 mL菌液,4 ℃、10 000 g离心5 min,用裂解液(去掉TritonX-100)1.4 mL悬浮菌体,加入200 μL溶菌酶,37 ℃保温30 min。TritonX-100的含量分别是0、0.1%、0.5%、1%(体积分数)。4 ℃、10 000 g离心2 min,取上清液,测定酶活性和蛋白含量。
1.6 蛋白含量及胞内β-半乳糖苷酶和乳酸脱氢酶活性测定 1.6.1 蛋白含量取0.1 mL样品液,加入2 mL BCA工作试剂,涡旋混匀后置于60 ℃水浴加热15 min,冷却至室温,562 nm处测吸光值。
1.6.2 β-半乳糖苷酶活性利用Qiao等[15]的方法测定,实际酶活性为扣除对硝基苯基β-D-葡萄糖苷非酶水解后的活性。酶活性单位(U)定义为:45 ℃、pH7.0的条件下,每分钟每单位蛋白催化对硝基苯基β-D-葡萄糖苷水解释放出1 μmol对硝基苯酚所需的酶量。
1.6.3 乳酸脱氢酶(LDH)活性采用Li等[8]的方法并略有改进,其中底物浓度为0.06 mol · L-1丙酮酸钠,0.01 mol · L-1 NADH,反应菌液量为100 μL菌液(稀释10倍)。酶活性单位(U)定义为:25 ℃、pH7.0条件下,每分钟每单位蛋白催化NADH降解所需的酶量。
1.7 水分子在NADES中的活度测定溶剂中的NADES含量分别设定为100%、80%和50%(体积分数),即含水量分别为0%、20%、50%;ChS含量分别设定为100%、80%、60%、50%、40%和30%(体积分数)。借助核磁共振成像得到NADES中水分子氢质子密度图谱可直观反映NADES的水分活度及空间分布情况。用纯NADES溶剂矫正参数,质子共振频率22.4 MHz,将准备好的NADES约7 mL放置于15 mm的NMR管中,将管放入NMR探针中,T2弛豫时间在32 ℃下使用Carr-Purcell-Meiboom-Gill序列测量。所用参数为:τ -值(90°脉冲和180°脉冲之间的时间)为150 μs。重复扫描16次,重复间隔时间为5 s得到5 000个回波,得到的图为指数衰减图形,3次重复。用MultiExp Inv Analysis软件进行反演,得到T2值[16]。
1.8 数据处理方法所有数据采用Microsoft Excel 2010计算并用Origin 8.5绘图。采用IBM SPSS Statistics 22进行单因素方差分析和差异显著性检验。使用Adobe Illustrator CS5和Adobe Photoshop CS3创建插图。
2 结果与分析 2.1 冰晶对嗜热链球菌的影响由图 1可见:嗜热链球菌的细胞结构在冷冻后发生一定程度的变化。嗜热链球菌的细胞由3~5个单细胞像链子一样连接在一起(图 1-D),而图中各细胞连接处出现了断裂现象(图 1-A和图 1-C),表明嗜热链球菌在冷冻期间会逐渐由链状结构变成单细胞结构(图 1-B)。在大多数冷冻后的细胞中,与对照菌株相比,细胞膜均被破坏,细胞质发生一定程度的聚集,而嗜热链球菌细胞表面蛋白基本保持完整。
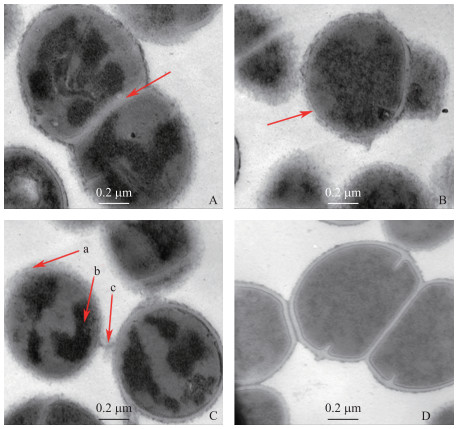
|
图 1 冷冻对嗜热链球菌结构的影响 Figure 1 Effects of freezing on the cell structure of Streptococcus thermophilus A.细胞连接处(箭头);B.细胞膜(箭头);C.细胞裂解(a.细胞表面;b.细胞质;c.细胞连接处);D.对照菌株。 A. Cell link(arrowhead); B. Cell membrane(arrowhead); C. Cell lysis(a. Cell surface; b. Cytoplasm; c. Cell link); D. Control strains. |
利用皮尔斯相关系数分析不同条件下的LDH和β-半乳糖苷酶活性(图 2),r=0.978,P=0.01,说明具有极显著相关性,即在裂解过程中,2种酶的活性能够保持一致。溶出蛋白含量(Y)与溶菌酶含量(X1)、裂解时间(X2)、裂解温度(X3)和TritonX-100含量(X4)的回归方程为:Y=0.345X1+0.01X2+0.15X3-0.03X4-0.567。裂解温度、溶菌酶含量和裂解时间与溶出蛋白呈正相关关系,TritonX-100含量与溶出蛋白呈负相关关系。裂解温度和溶菌酶的含量显著影响溶出蛋白。
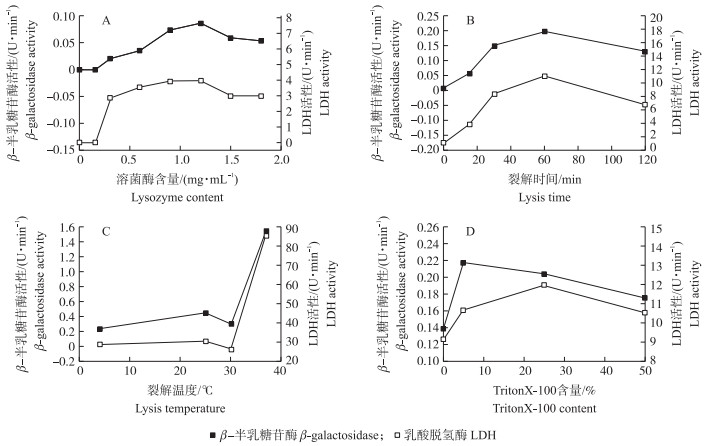
|
图 2 溶菌酶含量(A)、裂解时间(B)、裂解温度(C)和TritonX-100含量(D)对嗜热链球菌细胞裂解的影响 Figure 2 Effects of lysozyme content(A), lysis time(B), lysis temperature(C)and TritonX-100 content(D) on the cell lysis of S.thermophilus |
综上分析,在1.2 mg · mL-1溶菌酶和0.5% TritonX-100的溶液中37 ℃裂解30 min时,LDH和β-半乳糖苷酶活性最高。
2.3 NADES对嗜热链球菌的保护作用冷冻干燥分为预冻和冷冻干燥2个过程。由图 3可见:在预冻期间50% NADES对嗜热链球菌的保护作用较为明显。因此在预冻期间选择50% NADES作为冷冻保护剂。由图 4可知:冻干后ChS的保藏效果极显著(P < 0.001),ChG与GlyP也能极显著提高嗜热链球菌的存活率(P < 0.001)。由图 5和图 6可见:预冻期间和冻干过程中NADES对酶的保护作用不明显。NADES中ChX、ChG和ChS均能有效提高嗜热链球菌180 d后的存活率,适合冷冻干燥后嗜热链球菌的长久保藏。

|
图 3 预冻期间80% NADES(A)和50% NADES(B)对嗜热链球菌存活率的影响 Figure 3 Effects of 80% NADES(A)and 50% NADES(B)on S.thermophilus survival rate during pre-freezing period ChX:氯化胆碱/木糖醇/水,摩尔比1 : 2 : 3;EtP:乙二醇/L-脯氨酸,摩尔比3 : 1;ChG:氯化胆碱/葡萄糖/水,摩尔比2 : 5 : 5;GlyP:甘油/L-脯氨酸,摩尔比3 : 1;ChS:氯化胆碱/山梨糖醇/水,摩尔比2 : 5 : 5;PBS:磷酸盐缓冲液。下同。 ChX:Choline chloride/xylitol/water, mole ratio is 1 : 2 : 3;EtP:Ethylene glycol/L-proline, mole ratio is 3 : 1;ChG:Choline chloride/glucose/water, mole ratio is 2 : 5 : 5;GlyP:Glyceroll/L-proline, mole ratio is 3 : 1;ChS:Choline chloride/D-sorbitol/water, mole ratio is 2 : 5 : 5; PBS:Phosphatic buffer solution. The same as follows. |

|
图 4 NADES在冷冻干燥后0 d(A)和180 d(B)对嗜热链球菌存活率的影响 Figure 4 Effects of NADES on S.thermophilus survival rate in 0 d(A) and 180 d(B)after freeze-drying *P < 0.05, * * *P < 0.001. |
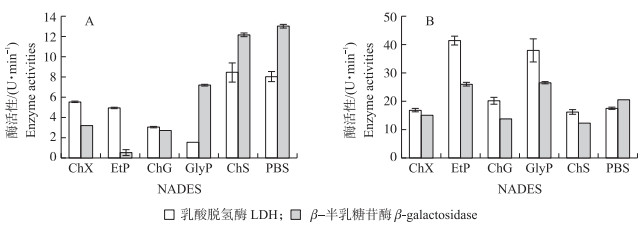
|
图 5 预冻期间80% NADES(A)和50% NADES(B)对嗜热链球菌酶活性的影响 Figure 5 Effects of 80% NADES(A)and 50% NADES(B)on S.thermophilus enzyme activities during pre-freezing period |
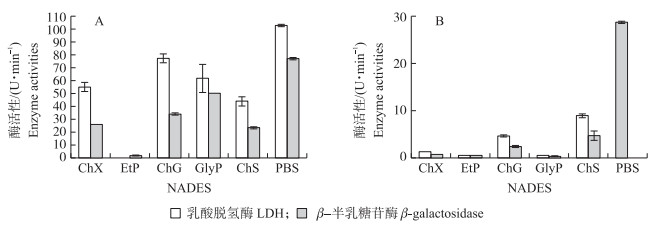
|
图 6 NADES在冷冻干燥后0 d(A)和180 d(B)对嗜热链球菌酶活性的影响 Figure 6 Effects of NADES on S.thermophilus enzyme activities in 0 d(A) and 180 d(B)after freeze-drying |
由表 1可知:水分含量相同时,不同NADES具有不同水分活度。当含水量由20%(80% NADES)增加到50%时,部分NADES弛豫时间增加了约1 000 ms,说明50%的含水量可能导致有些NADES之间的氢键被水分子取代。而20%的含水量对于大部分NADES来说,弛豫时间均小于300 ms,主要以结合水和不易流动水为主,容易造成细胞失水[17]。
| 含水量Water content | NADES | T21/ms | M21/% | T22/ms | M22/% |
| ChX | 236.45±2.45 | 1.45±0.09 | 1 204.50±96.85 | 98.51±1.01 | |
| EtP | 739.07±9.87 | 100.00±1.22 | |||
| 50%(50% NADES) | ChG | 46.42±3.78 | 6.40±0.23 | 236.45±12.17 | 93.60±3.53 |
| GlyP | 453.49±20.19 | 100.00±1.90 | |||
| ChS | 170.74±10.62 | 2.54±0.22 | 869.75±10.15 | 97.46±0.55 | |
| ChX | 89.02±7.22 | 3.58±0.09 | 278.26±12.32 | 96.42±1.00 | |
| EtP | 278.26±10.57 | 99.73±1.90 | 1 668.10±125.46 | 0.27±0.08 | |
| 20%(80% NADES) | ChG | 46.42±2.73 | 6.40±0.01 | 236.45±7.49 | 93.60±0.27 |
| GlyP | 17.48±0.23 | 4.57±0.22 | 104.76±7.63 | 95.43±0.17 | |
| ChS | 54.62±0.45 | 3.93±0.01 | 278.27±31.48 | 96.07±1.52 | |
| ChX | 64.28±2.52 | 99.45±0.01 | 200.92±34.70 | 0.55±0.44 | |
| EtP | 75.65±0.65 | 97.46±0.98 | 278.26±8.51 | 2.54±1.32 | |
| 0%(100% NADES) | ChG | 5.59±0.60 | 7.18±0.06 | 28.48±0.49 | 92.82±0.08 |
| GlyP | 44.76±2.54 | 95.43±0.84 | |||
| ChS | 54.62±3.89 | 100.00±7.85 | |||
由图 7可以看出:当ChS含量高于50%时弛豫时间在1 000 ms之内,而ChS含量小于50%时弛豫时间大于1 000 ms,且弛豫时间变化范围很小,说明50%ChS含量可能是ChS分子之间稳定氢键的最小含量。
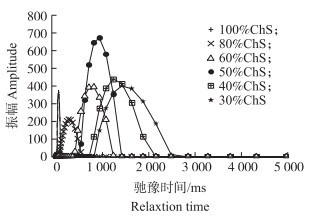
|
图 7 不同含量ChS的溶剂低场核磁共振结果 Figure 7 Low-field NMR results of solvents with different ChS concentrations |
一般认为乳酸菌细胞表面由脂磷壁酸、完整肽聚糖、多糖和表层单蛋白组成[18],冷冻后冰晶对细胞造成的机械损伤是细胞冷冻后主要的损伤机制[19],并且冷冻干燥加工之前要先进行预冻步骤,因此冷冻对乳酸菌的保藏至关重要[20]。本试验探索了冷冻期间无NADES保护时形成的冰晶对嗜热链球菌的破坏作用。冷冻后嗜热链球菌细胞表面蛋白保持完整,细胞膜部分消失,细胞质聚集,这些都说明细胞内冰晶造成的细胞损伤是冷冻后细胞主要的生理损伤。对冷冻后细胞的结构分析表明,在细胞保藏过程中,细胞膜的完整性和细胞质的保护作用非常重要。
本研究结果表明,50%NADES在预冻期间对嗜热链球菌的保护效果最好,而在所有的NADES中只有ChS在冷冻干燥后显著提高了嗜热链球菌的存活率,说明ChS不仅在预冻期间能够阻止冰晶的生成,在冷冻干燥期间也有很好的保护效果。研究表明NADES对蛋白的二级结构没有破坏作用[21],且很多酶的催化作用能够在NADES中顺利进行[22-23]。而嗜热链球菌细胞质的保护效果则可以通过细胞内酶活性来判断。ChS在嗜热链球菌冷冻干燥期间对胞内酶活性没有明显保护作用。
同时,水分活度的变化对NADES中水的状态影响巨大[24],对细胞的存活状态和冰晶的形成都有很大影响[9]。NADES溶液中自由水过多会导致NADES与NADES间的氢键断裂,而自由水过少会使NADES与H2O间的氢键过强,造成细胞失水等不利影响[25]。因此,NADES中自由水、不易流动水和结合水的组成和分布对NADES中氢键构成和微生物来说都具有重要意义。本试验分析了在NADES中添加不同比例的水后,溶剂的氢键活跃度变化。弛豫时间在400~800 ms时NADES对嗜热链球菌保护效果最好,而冷冻干燥后自由水的减少则有利于嗜热链球菌的长期保藏。
有研究表明季铵盐化合物对乳酸菌具有重要的渗透调节功能,其中具有渗透保护作用的相容性溶质有:甘氨酸甜菜碱、肉毒碱、脯氨酸、二甲基巯基丁二酸和胆碱等[26]。因此,氯化胆碱类的NADES对乳酸菌的保护作用具有非常乐观的前景。如果NADES能够显著提高在嗜热链球菌中的渗透能力,那么也就能显著提高嗜热链球菌在冷冻干燥时的活力。同时,本研究结果也为不同细胞的保藏提供了新策略,具有一定的参考价值。
| [1] | Smith E L, Abbott A P, Ryder K S. Deep eutectic solvents(DESs)and their applications[J]. Chemistry Review, 2014, 114(21): 11060-11082. DOI: 10.1021/cr300162p |
| [2] | Abbott A P, Harris R C, Ryder K S, et al. Glycerol eutectics as sustainable solvent systems[J]. Green Chemistry, 2011, 13(1): 82-90. DOI: 10.1039/C0GC00395F |
| [3] | Dimitrellou D, Kandylis P, Kourkoutas Y. Effect of cooling rate, freeze-drying, and storage on survival of free and immobilized Lactobacillus casei ATCC 393[J]. LWT-Food Science and Technology, 2016, 69: 468-473. DOI: 10.1016/j.lwt.2016.01.063 |
| [4] |
李宝坤.乳酸杆菌冷冻干燥生理损伤机制及保护策略的研究[D].无锡: 江南大学, 2011.
Li B K. Study on physiological damage mechanism and protection strategy of Lactobacillus freeze-drying[D]. Wuxi: Jiangnan University, 2011(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10295-1012278984.htm |
| [5] | Romano N, Schebor C, Mobili P, et al. Role of mono- and oligosaccharides from FOS as stabilizing agents during freeze-drying and storage of Lactobacillus delbrueckii subsp. bulgaricus[J]. Food Research International, 2016, 90: 251-258. DOI: 10.1016/j.foodres.2016.11.003 |
| [6] | Santivarangkna C, Wenning M, Foerst P, et al. Damage of cell envelope of Lactobacillus helveticus during vacuum drying[J]. Journal of Applied Microbiology, 2007, 102(3): 748-756. DOI: 10.1111/jam.2007.102.issue-3 |
| [7] | Halim M, Anizawanie N, Mustafa M, et al. Effect of encapsulant and cryoprotectant on the viability of probiotic Pediococcus acidilactici ATCC 8042 during freeze-drying and exposure to high acidity, bile salts and heat[J]. LWT-Food Science and Technology, 2017, 81: 210-216. DOI: 10.1016/j.lwt.2017.04.009 |
| [8] | Li B K, Tian F, Liu X, et al. Effects of cryoprotectants on viability of Lactobacillus reuteri CICC6226[J]. Applied Microbiology Biotechnology, 2011, 92(3): 609-616. DOI: 10.1007/s00253-011-3269-4 |
| [9] | Durand E, Lecomte J, Bar A B, et al. Evaluation of deep eutectic solvent-water binary mixtures for lipase-catalyzed lipophilization of phenolic acids[J]. Green Chemistry, 2013, 15(8): 2275-2282. DOI: 10.1039/c3gc40899j |
| [10] | Gutiérrez M C, Ferrer M L, Yuste L, et al. Bacteria incorporation in deep-eutectic solvents through freeze-drying[J]. Angewandte Chemie International Edition, 2010, 49(12): 2158-2162. DOI: 10.1002/anie.v49:12 |
| [11] | Huang Y, Feng F, Jiang J, et al. Green and efficient extraction of rutin from tartary buckwheat hull by using natural deep eutectic solvents[J]. Food Chemistry, 2017, 221: 1400-1405. DOI: 10.1016/j.foodchem.2016.11.013 |
| [12] | Hajmeer M, Ceylane E, Marsden J L, et al. Impact of sodium chloride on Escherichia coli O157:H7 and Staphylococcus aureus analysed using transmission electron microscopy[J]. Food Microbiology, 2006, 23(5): 446-452. DOI: 10.1016/j.fm.2005.06.005 |
| [13] | Malanovic N, Lohner K. Gram-positive bacterial cell envelopes:the impact on the activity of antimicrobial peptides[J]. Biochimica et Biophysica Acta(BBA):Biomembranes, 2016, 1858(5): 936-946. DOI: 10.1016/j.bbamem.2015.11.004 |
| [14] | Babu V, Choudhury B. Methods of cell lysis and effect of detergents for the recovery of nitrile metabolizing enzyme from Amycolatopsis sp. ⅡTR215[J]. Journal of Genetic Engineering and Biotechnology, 2013, 11(2): 117-122. DOI: 10.1016/j.jgeb.2013.05.002 |
| [15] | Qiao Y, Huang Y, Feng F, et al. Efficient enzymatic synthesis and antibacterial activity of andrographolide glycoside[J]. Process Biochemistry, 2016, 51(5): 675-680. DOI: 10.1016/j.procbio.2016.02.008 |
| [16] | Li T, Rui X, Wang K, et al. Study of the dynamic states of water and effects of high-pressure homogenization on water distribution in tofu by using low-field nuclear magnetic resonance[J]. Innovative Food Science & Emerging Technologies, 2015, 30: 61-68. |
| [17] | King V E, Su J. Dehydration of Lactobacillus acidophilus[J]. Process Biochemistry, 1993, 28(1): 47-52. |
| [18] | Meng J, Zhu X, Gao S M, et al. Characterization of surface layer proteins and its role in probiotic properties of three Lactobacillus strains[J]. Int J Biol Macromol, 2014, 65: 110-114. DOI: 10.1016/j.ijbiomac.2014.01.024 |
| [19] | Han B, Bischof J C. Direct cell injury associated with eutectic crystallization during freezing[J]. Cryobiology, 2004, 48(1): 8-21. DOI: 10.1016/j.cryobiol.2003.11.002 |
| [20] | Hub L Z. Protectants used in the cryopreservation of microorganisms[J]. Cryobiology, 2003, 46(3): 205-229. DOI: 10.1016/S0011-2240(03)00046-4 |
| [21] | Sanchezfernandez A, Edler K J, Arnold T, et al. Protein conformation in pure and hydrated deep eutectic solvents[J]. Physical Chemistry Chemical Physics, 2017, 19(13): 8667-8670. DOI: 10.1039/C7CP00459A |
| [22] | Zeng Q, Wang Y, Huang Y, et al. Deep eutectic solvents as novel extraction media for protein partitioning[J]. Analyst, 2014, 139(10): 2565-2573. DOI: 10.1039/c3an02235h |
| [23] | Tang B, Row K H. Recent developments in deep eutectic solvents in chemical sciences[J]. Monatshefte für Chemie-Chemical Monthly, 2013, 144(10): 1427-1454. DOI: 10.1007/s00706-013-1050-3 |
| [24] | Xiao Q, Lim L T, Zhou Y, et al. Drying process of pullulan edible films forming solutions studied by low-field NMR[J]. Food Chemistry, 2017, 230: 611-617. DOI: 10.1016/j.foodchem.2017.03.097 |
| [25] | Zhang L, Qu M, Yao J, et al. Effect of high hydrostatic pressure on the viability of Streptococcus thermophilus bacteriophages isolated from cheese[J]. Innovative Food Science & Emerging Technologies, 2015, 29: 113-118. |
| [26] |
高薇, 韩雪, 张兰威. 乳酸菌渗透胁迫相关相容性溶质及其转运机制研究进展[J].
微生物学通报, 2013, 40(11): 2097-2106.
Gao W, Han X, Zhang L W. Advances in research on compatibility solute and its transport mechanism of lactic acid bacterial osmotic stress[J]. Microbiology Bulletin, 2013, 40(11): 2097-2106. (in Chinese with English abstract) |




