文章信息
- 白雪瑞, 王权, 陈永军, 万莹, 凌娇, 王亚磊, 蒋蔚
- BAI Xuerui, WANG Quan, CHEN Yongjun, WAN Ying, LING Jiao, WANG Yalei, JIANG Wei
- 副溶血弧菌ompA基因缺失株的生物学特性及致病性分析
- Biological characteristics and pathogenicity of an ompA mutant of Vibrio parahaemolyticus
- 南京农业大学学报, 2018, 41(5): 902-910
- Journal of Nanjing Agricultural University, 2018, 41(5): 902-910.
- http://dx.doi.org/10.7685/jnau.201712031
-
文章历史
- 收稿日期: 2017-12-22
2. 上海市农业学校动物科学技术系, 上海 201600
2. Department of Animal Science and Technology, Shanghai Agriculture School, Shanghai 201600, China
副溶血弧菌(Vibrio parahaemolyticus)是普遍存在于海洋和河口环境中的一种具嗜盐性的革兰氏阴性菌,主要通过食物引起人类急性胃肠炎,也可通过开放性伤口感染,引起败血症等[1-2]。此外,副溶血性弧菌可导致对虾等水生动物的急性坏死性肝胰腺炎,困扰虾养殖业[3]。副溶血弧菌之所以能够在全球范围内流行,与其众多的致病因子有关,其中主要包括耐热直接溶血毒素(thermostable direct hemolysin,TDH)、TDH相关溶血毒素,Ⅲ型和Ⅳ型分泌系统等[4-5]。此外,有研究指出,黏附素与副溶血弧菌的致病作用有关[6]。
外膜(outer membrane,OM)作为细胞壁外侧特有的结构,主要由磷脂双分子膜、脂多糖和膜蛋白组成,是革兰氏阴性菌抵御外界环境的重要屏障。在大肠杆菌等革兰氏阴性致病菌中,外膜在宿主感染和致病性中起重要作用[7]。外膜蛋白(outer membrane proteins,OMP)是外膜的重要成分,占外膜的50%,主要分为外膜A蛋白(outer membrane protein A,OmpA)、微孔蛋白(porins)、脂蛋白(lipoprotein,Lpp)和微量蛋白。由于定位在细胞的最外层区域,OMP在革兰氏阴性菌的物质运输、维持膜完整性、抗原性及多重耐药性等方面发挥重要作用。此外,OMP在适应外界环境变化过程中起关键作用。最近研究表明,副溶血弧菌和溶藻弧菌OMP的主要成分和分布随外界环境的变化而改变,例如饥饿、渗透压改变和短波紫外光辐射[8-12]。
OmpA为革兰氏阴性菌主要的外膜蛋白,是一种嵌入外膜的β桶状蛋白(β-Barrel),结构高度保守,在细菌OM结构完整性和病原菌致病性方面发挥重要作用,可介导疾病的产生,也可激活机体的免疫反应对抗细菌的感染[13-14]。研究表明,大肠杆菌OmpA参与细菌的细胞黏附入侵和免疫逃避的过程,因此,在影响该菌毒力方面具有至关重要的作用[15-16]。OmpA因参与细菌与宿主之间的多种作用,被认为是多效蛋白,在不同细菌病原体的致病机制中有不同的作用[15]。
副溶血弧菌具有4个OmpA(VPA0248、VP0764、VP0636与VPA1186),其中VP0764和VPA1186均具有良好的免疫原性和疫苗开发潜力[17-18]。然而,关于OmpA在副溶血弧菌感染致病过程中是否发挥作用的研究未见报道。本试验选用ompA(VPA1186)基因作为研究对象,通过构建副溶血弧菌SH112株ompA基因缺失株和互补株,深入探究ompA基因在副溶血弧菌生物学特性及致病性中的作用,为进一步研究外膜蛋白对革兰氏阴性菌的致病机制提供试验依据。
1 材料与方法 1.1 菌种、质粒、试剂和实验动物副溶血弧菌临床分离株SH112(tdh+,血清型O3 : K6)、同源重组质粒菌(pYAK1)、互补质粒菌(pMMB207)、大肠杆菌HB101(pRK2013)均由中国农业科学院上海兽医研究所细菌研究室保存。细菌基因组和质粒提取试剂盒购自上海天根生化公司。限制性内切酶、DNA Taq聚合酶及T4连接酶购自大连TaKaRa公司。CytoTox 96®非放射性细胞毒性检测试剂盒购自Promega公司,DMEM细胞培养基和胎牛血清均购自Gibco公司,硫代硫酸盐柠檬酸盐胆盐蔗糖琼脂培养基(TCBS)购自广东环凯微生物公司,其他生化试剂均为进口或国产分析纯。紫外分光光度计购自Thermo公司,细胞计数仪购自Bio-Rad公司,普通PCR仪和高速低温离心机购自Eppendorf公司。ICR(Institute of Cancer Research)小鼠购自上海杰思捷实验动物有限公司。
1.2 引物设计根据GenBank中副溶血弧菌RIMD2210633标准株的ompA(VPA1186)基因序列,用Primer Premier 5.0软件设计引物(表 1)。其中引物sacB-F/R检测位于质粒pYAK1的多克隆酶切位点外侧的sacB基因,根据目的基因的有无,可以判断同源重组后质粒在细菌中凋亡情况。
| 引物Primer | 引物对序列Primer pairs sequence(5′→3′) | 限制性内切酶Restriction enzyme |
| ompA-A/B | CTAGGATCCTATCTCGCACATCGTAA/AATGTTTCCTTGTATTGATTGCATAT | BamHⅠ |
| ompA-C/D | ATACAAGGAAACATTTCTGAATGTTCACAC/AATGCATGCGCAGGGTTGATCGACAGG | SphⅠ |
| ompA-E/F | CGAAGACCGTCATTTAGC/GAATCGTCATTATGGGTTA | |
| ompA-pMMB-F/R | CTCGAATTCATGAACAAAGTAGCAA/TTTGGATCCTTATGGTTGAACCAT | EcoRⅠ/BamHⅠ |
| sacB-F/R | ACGGCACTGTCGCAAACTAT/TTCCGTCACCGTCAAAGAT | |
| 注:下划线的序列为酶切位点。Restriction enzyme sites are underlined. | ||
以副溶血弧菌SH112株为野生株(WT),待细菌长至生长对数期,利用基因提取试剂盒提取其DNA。以野生株DNA为模板,用2对引物ompA-A/B、ompA-C/D分别扩增ompA基因的上、下游同源臂片段AB和CD,产物经回收试剂盒回收。以ompA-A/D为引物,利用融合PCR扩增片段AB和CD,获得ompA基因缺失片段ompA-AD片段。
1.3.2 ompA基因同源重组质粒构建将ompA-AD片段与pYAK-CC118质粒同时进行双酶切,经T4连接酶连接后转入到CC118λpir感受态细胞,于含10 μg · mL-1氯霉素的LB平板上培养,挑取单菌落进行液体培养,并提取其DNA进行PCR鉴定,扩增产物送至上海英骏生物技术公司测序,命名阳性重组质粒为pYAK1-ompA。
1.3.3 ompA基因缺失株的筛选与鉴定以含有同源重组质粒的CC118λpir为供体菌,副溶血弧菌SH112株为受体菌,HB101为辅助菌进行接合转移。经含10 μg · mL-1氯霉素的TCBS平板和含200 g · L-1蔗糖的LB平板进行传代筛选。挑取疑似单菌落培养,用ompA-E/F和sacB-F/R引物进行PCR鉴定。将扩增产物送至上海英骏生物技术公司测序,命名阳性基因缺失株为ΔompA。
1.4 ompA基因互补株的构建以野生株DNA为模板,用引物ompA-pMMB-F/R扩增获得ompA整个ORF片段,与pMMB207质粒同时进行双酶切,经连接后转入CC118λpir感受态细胞,于含10 μg · mL-1氯霉素的LB平板上培养,挑取单菌落进行PCR鉴定,将扩增产物测序,命名阳性互补质粒为pMMB-ompA。以含互补质粒pMMB-ompA的CC118λpir为供体菌,ΔompA缺失株为受体菌,HB101为辅助菌进行结合转移试验,利用引物ompA-pMMB-F/R进行PCR鉴定,其阳性株命名为互补株CΔompA。
1.5 各菌株的生长曲线测定分别挑取WT、ΔompA及CΔompA的单菌落接种至含30 g · L-1 NaCl的LB(NaCl-LB,pH7.2)液体培养基中,37 ℃、180 r · min-1培养至对数生长期,将100 μL菌液接种于5 mL新鲜培养基中混悬,取100 μL于96孔的酶标板孔中,重复10个孔,空白孔为液体培养基。将酶标板放置37 ℃温箱温育,每隔1 h测其D600值,连续监测12 h,绘制各菌株的生长曲线。
1.6 各菌株的生物被膜测定同1.5节方法,将各菌液稀释于NaCl-LB液体培养基中,使其D600值为0.2。取200 μL菌液加至酶标板中作为试验孔,重复10个孔,空白孔加培养基,放置37 ℃温箱内静置培养48 h。弃菌液上清,用PBS(pH7.4)洗3次,加200 μL纯甲醇固定10 min,再用200 μL的10 g · L-1结晶紫染色15 min,用PBS洗涤3次后室内晾干。最后,加200 μL无水乙醇作用10 min,用酶标仪测量光密度值(D595)。
1.7 各菌株的运动性测定先配制含3 g · L-1琼脂的LB平板培养基(运动培养基),室温风干,过夜待用。同1.5节方法,将各菌株培养至D600=0.2,取1.5 μL菌液轻轻垂直点于运动培养基表面,放置37 ℃温箱内培养,每小时观察1次。在4 h时,将运动培养基中细菌的运动情况进行拍照,并测量细菌圆形运动轨迹的直径。
1.8 各菌株的细胞黏附试验用20%(体积分数)胎牛血清-高糖DNEM培养基培养人结肠癌(Caco-2)细胞于24孔板内,待单层细胞布满孔底部90%(每孔约1×105细胞)时,用DMEM洗涤2次后,待用。将培养至对数生长期的野生株、缺失株和互补株菌,调其菌含量一致,再用DMEM培养基洗2次并重悬,均以感染率(multiplicity of infection,MOI)为100 : 1(菌数:细胞数)感染Caco-2细胞,每孔加200 μL,重复3个孔,置于37 ℃、5% CO2细胞培养箱中孵育1 h。用PBS洗1次,每孔加100 μL预冷的0.5%(体积分数)TritonX-100裂解细胞,作用1 h。最后用无菌的NaCl-LB培养基105~107倍比稀释裂解液,并涂布于NaCl-LB琼脂平板,37 ℃培养过夜,记录单菌落数,计算各细菌株的相对黏附率。
1.9 各菌株的细胞毒性检测将Caco-2细胞培养于96孔细胞板,待单层细胞长至满孔底部90%(每孔约5×104细胞)时,用无菌PBS洗2次备用。将野生株、缺失株和互补株培养至对数生长期,调节细菌含量均为D600=0.2,用无酚红DMEM洗1次并重悬,按MOI=100 : 1感染细胞,每细胞孔加入100 μL的菌液作为试验孔,重复6个孔;加入100 μL无酚红DMEM作为细胞对照孔;加入90 μL的DMEM为最大释放孔;无细胞孔加入90 μL DMEM和10 μL裂解液作为空白对照孔,将细胞板于37 ℃、5% CO2的细胞培养箱中分别孵育1 h和2 h。利用CytoTox 96®试剂盒检测细胞上清液中乳酸脱氢酶(LDH)的释放,在收集细胞上清液前45 min,在最大释放孔加入10 μL裂解液。收集上清液时,每孔取出50 μL转移至96孔酶标板中,避光加入50 μL底物混合液,用锡箔纸盖住平板,室温孵育30 min,然后快速向每孔加入50 μL终止液,参照说明书计算各细菌感染Caco-2细胞后的LDH释放百分比。
1.10 各菌株的血清杀菌试验按Wang等[19]的试验方法,从5只6周龄的ICR小鼠眼球采血,血液经室温静置3 h后离心,取血清,过0.22 μm滤膜除菌。用无菌PBS(pH7.2)稀释至100%、75%、50%、25%作为试验组,高温灭活的鼠血清作为阴性血清,分别取90 μL加至96孔板中备用。将处于对数生长期的各菌株浓度均调致D600=0.2,用无菌生理盐水洗3次后重悬,每个菌株分别取10 μL(1×104 CFU)至不同浓度的鼠血清中混匀,重复3个孔,置于37 ℃、5% CO2的培养箱中静置培养30 min。将每孔细菌血清混合液(100 μL)用无菌PBS倍比稀释,取102~104倍的稀释液涂于NaCl-LB琼脂平板上,37 ℃培养过夜后记录菌落数。以野生株在鼠血清的存活率为标准,计算ΔompA、CΔompA的相对存活率,并绘图。
1.11 各菌株的小鼠致死率将3周龄的ICR小鼠(体质量为11~13 g)随机分成4组,即WT组、ΔompA组、CΔompA组和空白组,每组10只。参照Hiyoshi等[20]的方法,将各细菌培养至生长对数期(D600=0.2),用无菌生理盐水洗3次,调节其浓度至1×105 CFU · μL-1。酒精棉球擦拭小鼠腹部,将100 μL菌液注射到相应试验组的小鼠腹腔内,空白组注射相同剂量的无菌生理盐水。每小时观察1次,记录每组ICR小鼠的存活率,连续观察7 d,以时间作为横坐标,以各组小鼠存活率为纵坐标绘制各菌株感染ICR小鼠的存活率图。
1.12 细菌组织载量测定将3周龄的ICR小鼠随机分成4组(WT、ΔompA、CΔompA和空白组),每组10只,以每只5×106CFU的细菌剂量攻毒,测定各菌株在小鼠血液、肝组织的细菌载量。主要步骤:对各组小鼠腹腔注射生长对数期的细菌(5×104 CFU · μL-1,共100 μL)和无菌生理盐水,细菌处理方法同1.11。感染后10 h,从每组随机选取存活的5只小鼠,摘除眼球采血致死,血液加入抗凝剂(柠檬酸钠),小鼠浸润于75%乙醇中待用。对小鼠腹腔无菌解剖,观察各菌株感染小鼠后内脏的病理变化,并取其肝组织(0.2 g)进行研磨。用无菌PBS倍比稀释肝组织匀浆液和血液样本(100 μL)至104倍,涂布于TCBS琼脂平板,次日对小于500菌落的平板进行单菌落计数,计算各菌株对ICR小鼠血液、肝组织的细菌载量。
1.13 数据分析所有试验均重复3次。数据采用Graph Pad Prism软件进行单因素方差分析(one-way ANOVA),用平均数±标准差(x±SD)表示。
2 结果与分析 2.1 ompA基因缺失株和互补株的构建以SH112株为受体菌,含同源重组质粒pYAK1-ompA的CC118λpir为供体菌,进行接合转移,通过多次传代筛选,挑取在氯霉素抗性平板不生长,而在含200 g · L-1蔗糖LB平板生长的单菌落进行液体培养,提取其DNA并进行PCR鉴定,结果见图 1-A。用引物ompA-E/F扩增野生株基因获得2 369 bp完整片段(图 1-A泳道1),而扩增缺失株基因获得1 379 bp的缺失片段(图 1-A泳道2)。此外,用重组质粒引物sacB-F/R扩增缺失株基因(图 1-A泳道3),无任何条带,表明ΔompA缺失株构建成功。

|
图 1 副溶血弧菌ompA基因缺失株(A)和互补株(B)的PCR鉴定 Figure 1 PCR identification of ompA gene mutant strain(A)and complement strain(B)of Vibrio parahaemolyticus M. 2 000 bp DNA标准品2000 bp DNA standard;1.野生株ompA基因扩增Amplification of ompA genes of WT strain;2.缺失株ompA基因扩增Amplification of ompA genes of ΔompA strain;3.缺失株sacB基因扩增Amplification of sacB genes of ΔompA strain;4.缺失株pMMB-ompA基因扩增Amplification of pMMB-ompA gene of ΔompA strain. |
用引物ompA-pMMB-F/R对CΔompA互补株基因进行鉴定,结果如图 1-B所示。缺失株转入互补质粒pMMB-ompA后能扩增出大小为1 008 bp的ompA基因片段(图 1-B泳道4),表明对缺失株ΔompA的互补株CΔompA构建成功。
缺失株和互补株经连续培养20代后,通过以上PCR方法同样可扩增出相应片段,证明构建成功的缺失株和互补株具有较好的遗传稳定性。
2.2 ompA缺失对细菌生长能力的影响从图 2可见:副溶血弧菌WT、ΔompA和CΔompA株的生长特性基本一致(P>0.05)。表明,ompA基因缺失对副溶血弧菌的生长能力无显著影响。

|
图 2 副溶血弧菌野生株(WT)、缺失株(ΔompA)及互补株(CΔompA)的生长曲线 Figure 2 The growth curve of the wild-type(WT), mutant strain(ΔompA)and complement strain(CΔompA) |
各菌株在运动培养基上的运动结果显示:在4 h时各菌株均表现出明显的运动性,呈半透明圆形运动轨迹(图 3-A)。圆形运动半径测量统计结果显示(图 3-B),ΔompA的运动能力较WT无显著差异(P>0.05)。以上结果表明,ompA基因缺失对副溶血弧菌的运动性无明显影响。

|
图 3 各菌株4 h的运动轨迹(A)和运动半径(B) Figure 3 The swimming pattern(A)and motility zone diameter(B)of the strains at 4 h |
经48 h静置温育,用结晶法检测各菌株生物被膜形成能力。结果显示(图 4):WT、ΔompA和CΔompA的生物被膜形成能力均无显著差异(P>0.05)。表明,ompA基因缺失对副溶血弧菌的生物被膜形成能力无显著影响。

|
图 4 各菌株培育48 h后结晶紫染色情况(A)及生物被膜形成能力(B) Figure 4 Biofilm formation of the strains by crystal violet staining with visual signs(A)and measured data(B)at 48 h |
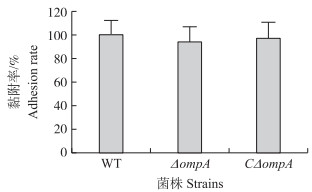
以MOI=100 : 1感染Caco-2细胞,各菌株的细胞黏附结果(图 5)显示:ΔompA和CΔompA株的黏附率较WT无显著差异(P>0.05),表明ompA基因不影响副溶血弧菌SH112株对Caco-2细胞的黏附作用。
|
图 5 各菌株对Caco-2细胞的黏附作用 Figure 5 Adhesion to Caco-2 cell monolayers of the strains |
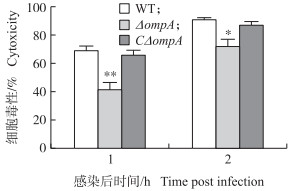
各菌株以MOI=100 : 1感染Caco-2细胞1 h和2 h,结果(图 6)显示:ΔompA株的细胞毒性较WT株显著或极显著降低(P < 0.05或P < 0.01),为野生株的60%和79%。表明,ompA基因对副溶血弧菌在细胞毒性方面有显著影响。
|
图 6 各菌株细胞毒性的比较 Figure 6 Comparison of cytotoxic effects of the strains |
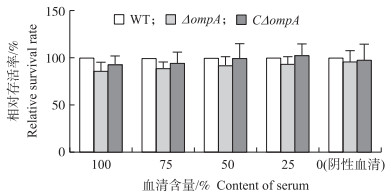
将各菌株以终浓度1.0×105 CFU · mL-1的量分别加入100%、75%、50%、25%的鼠血清中,反应0.5 h,结果(图 7)显示:以WT株在鼠血清的存活率为标准,ΔompA株和CΔompA株在血清中的相对存活率较野生株均无显著差异(P>0.05)。表明ompA基因缺失不影响副溶血弧菌抗血清杀菌能力。
|
图 7 各菌株抗鼠血清杀菌能力的比较 Figure 7 Comparison of bacterial resistances to mice serum diluted to 25%, 50%, 75% and 100% in PBS |
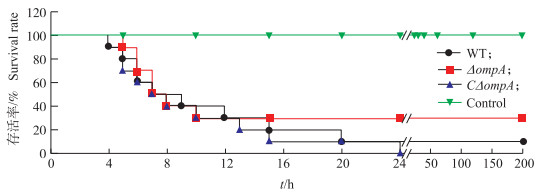
将WT、ΔompA和CΔompA组各10只3周龄ICR小鼠腹腔注射1.0×107CFU的活菌数,连续观察7 d,结果显示:副溶血弧菌感染小鼠的死亡时间主要集中在10~24 h以内。WT组和CΔompA组小鼠感染2 h出现精神委顿、立毛颤抖、不愿走动;ΔompA组小鼠上述临床症状轻微。感染4~5 h,WT组和CΔompA组小鼠共济失调,体质量减轻,粪便黏稠,甚至血尿等临床症状,并开始死亡;ΔompA组小鼠表现较轻的上述症状,无血尿,死亡时间较野生株组延后。感染24 h后,存活小鼠均逐渐恢复至正常状态。ICR小鼠存活率统计结果(图 8)显示,感染缺失株ΔompA小鼠存活率为30%,而感染野生株小鼠存活率为10%,感染互补株组小鼠存活率为0。表明,ompA基因缺失使副溶血弧菌对小鼠的毒力有所降低,而互补株恢复了细菌毒力,提示ompA基因与副溶血弧菌对宿主的致病性相关。
|
图 8 细菌毒力试验 Figure 8 Determination of bacterial virulence |
将WT、ΔompA和CΔompA菌株以每只5.0×106 CFU的剂量腹腔感染ICR小鼠10 h时,细菌载量结果(图 9)显示:ΔompA缺失株在血液、肝组织的细菌定殖数量显著低于野生株(P < 0.05),互补株的细菌定殖均恢复到野生株水平(P>0.05),表明ompA基因在副溶血弧菌的定殖过程中发挥显著作用。

|
图 9 各菌株在小鼠血液(A)和肝组织(B)的细菌载量 Figure 9 Bacterial loads in blood(A)and liver(B)of infected mice |
目前关于OmpA在细菌致病过程中的研究主要集中于大肠杆菌等肠道杆菌。在大肠杆菌等肠道阴性菌中OmpA是一种多功能蛋白,且表达水平较高[14, 21]。作为外膜的主要跨膜蛋白,OmpA具有稳定细菌细胞形态,有助于摄取营养物质,利于细菌生长繁殖的功能[22-23]。此外,OmpA作为主要的免疫原性蛋白和免疫逃避因子,具有一定的免疫保护作用;作为大肠菌素、黏附素和侵袭素,参与细菌感染致病过程[15-16, 23]。霍乱弧菌ompA缺失导致外膜囊泡(outer membrane vesicles,OMV)的释放增强,且细菌存活时间显著延长[24]。另有研究表明ompA缺失引起大肠杆菌对环境中高渗透压和酸、去污剂、胆酸盐的耐受性显著降低[25]。然而,关于OmpA在副溶血弧菌生物学特性和致病性中的作用研究甚少。为此,本文选用副溶血弧菌SH112株的ompA(VPA1186)基因作为研究对象,成功构建了ompA基因缺失株和互补株,并展开了对缺失株生物学特性和致病性的研究。
本研究中,ompA基因缺失不影响副溶血弧菌的生长特性。细菌的运动性和生物被膜的形成能力与其在环境中的生存能力相关[26],细菌的OmpA可能与其在环境中生存相关,如参与大肠杆菌生物被膜的形成过程[22-23]。本研究发现ompA基因缺失不影响副溶血弧菌的运动性及生物被膜形成能力,提示其与该菌的环境适应性可能无关。对于副溶血弧菌ompA基因是否与其他外界环境耐受因子(如酸碱度、去污剂等)相关,仍需进一步研究。
细菌感染宿主的第一步为黏附与入侵,有研究表明OmpA参与大肠杆菌对HeLa上皮细胞和Caco-2结肠上皮细胞的黏附作用[27]。本研究结果表明,ompA基因不参与副溶血弧菌对Caco-2细胞黏附作用,但能显著减弱副溶血弧菌对Caco-2细胞的毒性作用。类似报道也表明,嗜麦芽窄食单胞菌含量最高的外膜蛋白MopB经基因缺失后,也表现为对细胞毒性的减弱[28]。细菌对细胞产生毒性有利于其在宿主体内定殖和侵袭,进而产生致病作用。目前,已有报道表明,外膜蛋白在沙门氏菌、大肠杆菌等革兰氏阴性菌的定殖和侵袭等致病作用中扮演重要角色[29-30]。其中,研究显示费希尔氏弧菌ompU基因缺失株与野生株共生于宿主组织器官中,缺失株的定殖率为野生株的60%,证明外膜蛋白OmpU在弧菌定殖过程中发挥作用[31]。通过ICR小鼠存活率试验,我们发现感染ompA基因缺失株小鼠表现的症状比野生株轻,且死亡率(70%)低于野生株(90%)。进一步利用ICR小鼠模型检测细菌载量结果表明,ompA基因缺失导致细菌组织定殖能力显著降低,证实外膜蛋白OmpA在副溶血弧菌定殖动物组织过程中发挥作用,从而影响细菌毒力。此外,细菌能在宿主血清中存活以及逃避细胞介导的免疫,与细菌表面蛋白密切相关。研究表明,外膜蛋白OmpA能影响大肠杆菌的抗血清杀菌活性,进一步参与细胞介导的逃避免疫过程[32]。本试验证实,ompA基因缺失不影响副溶血弧菌的抗鼠血清杀菌能力,推测外膜蛋白OmpA与副溶血弧菌在宿主血清中的存活以及免疫逃避能力相关性不显著,主要通过影响细菌的组织定殖能力,从而有助于细菌毒力。有类似研究表明,沙门氏菌ompA基因缺失株在无菌鸡血清存活试验、细胞内存活试验等与野生株无显著差异,但体内竞争试验表明缺失株在肝、心、脾、肺、肾的定殖能力较野生株显著降低,从而减弱系统感染[31]。因此,在副溶血弧菌感染致病过程中,外膜蛋白OmpA可能主要通过影响细菌细胞毒性和组织定殖能力两个方面发挥其毒力作用。
本研究通过对ompA基因缺失株进行生物学特性和致病性分析,表明ompA缺失对副溶血弧菌的基本生物学特性无显著影响,但参与细菌对细胞毒性和组织定殖等致病过程,从而影响细菌对小鼠的毒力作用,在副溶血弧菌的致病过程中发挥一定作用。因此,亟需进一步深入研究OmpA蛋白对致病性革兰氏阴性菌的致病机制。
| [1] | Kosek M, Bern C, Guerrant R L. The global burden of diarrhoeal disease, as estimated from studies published between 1992 and 2000[J]. Bulletin of the World Health Organization, 2003, 81(3): 197-204. |
| [2] | Su Y C, Liu C. Vibrio parahaemolyticus:a concern of seafood safety[J]. Food Microbiology, 2007, 24(6): 549-558. DOI: 10.1016/j.fm.2007.01.005 |
| [3] | Tran L, Nunan L, Redman R M, et al. Determination of the infectious nature of the agent of acute hepatopancreatic necrosis syndrome affecting penaeid shrimp[J]. Diseases of Aquatic Organisms, 2013, 105(1): 45-55. DOI: 10.3354/dao02621 |
| [4] | Park K S, Ono T, Rokuda M, et al. Functional characterization of two type Ⅲ secretion systems of Vibrio parahaemolyticus[J]. Infection and Immunity, 2004, 72(11): 6659-6665. DOI: 10.1128/IAI.72.11.6659-6665.2004 |
| [5] | Bingle L E, Bailey C E, Pallen M J. Type Ⅳ secretion:a beginner ' s guide[J]. Current Opinion in Microbiology, 2008, 11(1): 3-8. DOI: 10.1016/j.mib.2008.01.006 |
| [6] | Krachler A M, Ham H, Orth K. Turnabout is fair play:use of the bacterial multivalent adhesion molecule 7 as an antimicrobial agent[J]. Virulence, 2012, 3(1): 68-71. DOI: 10.4161/viru.3.1.18172 |
| [7] | Tsolis R M. Comparative genome analysis of the alpha-proteobacteria:relationships between plant and animal pathogens and host specificity[J]. Proceedings of National Academy of Sciences of the United States of America, 2002, 99(20): 12503-12505. DOI: 10.1073/pnas.212508599 |
| [8] | Xu C, Ren H, Wang S, et al. Proteomic analysis of salt-sensitive outer membrane proteins of Vibrio parahaemolyticus[J]. Research in Microbiology, 2004, 155(10): 835-842. DOI: 10.1016/j.resmic.2004.07.001 |
| [9] | Xu C, Wang S, Ren H, et al. Proteomic analysis on the expression of outer membrane proteins of Vibrio alginolyticus at different sodium concentrations[J]. Proteomics, 2005, 5(12): 3142-3152. DOI: 10.1002/(ISSN)1615-9861 |
| [10] | Wibbenmeyer J A, Provenzano D, Landry C F, et al. Vibrio cholerae OmpU and OmpT porins are differentially affected by bile[J]. Infection and Immunity, 2002, 70(1): 121-126. DOI: 10.1128/IAI.70.1.121-126.2002 |
| [11] | Abdallah F B, Lagha R, Ellafi A, et al. Identification of outer membrane proteins altered in response to UVC-radiation in Vibrio parahaemolyticus and Vibrio alginolyticus[J]. Indian Journal of Microbiology, 2012, 52(4): 660-665. DOI: 10.1007/s12088-012-0299-2 |
| [12] | Abdallah F B, Kallel H, Bakhrouf A. Enzymatic, outer membrane proteins and plasmid alterations of starved Vibrio parahaemolyticus and Vibrio alginolyticus cells in seawater[J]. Archives of Microbiology, 2009, 191(6): 493-500. DOI: 10.1007/s00203-009-0477-8 |
| [13] | Smith S G, Mahon V, Lambert M A, et al. A molecular Swiss army knife:OmpA structure, function and expression[J]. FEMS Microbiology Letters, 2007, 273(1): 1-11. DOI: 10.1111/fml.2007.273.issue-1 |
| [14] | Confer A W, Ayalew S. The OmpA family of proteins:roles in bacterial pathogenesis and immunity[J]. Vet Microbiol, 2013, 163(3): 207-222. |
| [15] | Krishnan S, Prasadarao N V. Outer membrane protein A and OprF:versatile roles in Gram-negative bacterial infections[J]. The FEBS Journal, 2012, 279(6): 919-931. DOI: 10.1111/j.1742-4658.2012.08482.x |
| [16] | Weiser J N, Gotschlich E C. Outer membrane protein A(OmpA)contributes to serum resistance and pathogenicity of Escherichia coli K-1[J]. Infection and Immunity, 1991, 59(7): 2252-2258. |
| [17] | Li H, Chu X, Li D, et al. Construction and immune protection evaluation of recombinant polyvalent OmpAs derived from genetically divergent OmpA by DNA shuffling[J]. Fish & Shellfish Immunology, 2016, 49: 230-236. |
| [18] | Li H, Ye M Z, Peng B, et al. Immunoproteomic identification of polyvalent vaccine candidates from Vibrio parahaemolyticus outer membrane proteins[J]. Journal of Proteome Research, 2010, 9(5): 2573-2583. DOI: 10.1021/pr1000219 |
| [19] | Wang S, Liu X, Xu X, et al. Escherichia coli type Ⅲ secretionsystem 2 ATPase EivC is involved inthe motility and virulence of avian pathogenic Escherichia coli[J]. Frontiers in Microbiology, 2016, 7: 1387. |
| [20] | Hiyoshi H, Kodama T, Iida T, et al. Contribution of Vibrio parahaemolyticus virulence factors to cytotoxicity, enterotoxicity, and lethality in mice[J]. Infection and Immunity, 2010, 78(4): 1772-1780. DOI: 10.1128/IAI.01051-09 |
| [21] | Reusch R N. Insights into the structure and assembly of Escherichia coli outer membrane protein A[J]. The FEBS Journal, 2012, 279(6): 894-909. DOI: 10.1111/j.1742-4658.2012.08484.x |
| [22] | Saito R, Matsuoka S, Fujinami Y, et al. Role of Moraxella catarrhalis outer membrane protein CD in bacterial cell morphology and autoaggregation[J]. Research in Microbiology, 2013, 164(3): 236-243. DOI: 10.1016/j.resmic.2012.12.005 |
| [23] | Prasadarao N V, Blom A M, Villoutreix B O, et al. A novel interaction of outer membrane protein A with C4b binding protein mediates serum resistance of Escherichia coli K1[J]. The Journal of Immunology, 2002, 169(11): 6352-6360. DOI: 10.4049/jimmunol.169.11.6352 |
| [24] | Valeru S P, Shanan S, Alossimi H, et al. Lack of outer membrane protein a enhances the release of outer membrane vesicles and survival of Vibrio cholerae and suppresses viability of Acanthamoeba castellanii[J]. International Journal of Microbiology, 2014, 2014: 610190. |
| [25] | Wang Y. The function of OmpA in Escherichia coli[J]. Biochemical and Biophysical Research Communications, 2002, 292(2): 396-401. DOI: 10.1006/bbrc.2002.6657 |
| [26] |
白雪瑞, 王权, 凌娇, 等. T3SS1和T3SS2影响副溶血弧菌生物学特性及细胞致病性的比较[J].
微生物学报, 2018, 58(3): 455-466.
Bai X R, Wang Q, Ling J, et al. Comparison of biological characteristics and cytopathogenicities between T3SS1 and T3SS2 in Vibrio parahaemolyticus[J]. Acta Microbiologica Sinica, 2018, 58(3): 455-466. (in Chinese with English abstract) |
| [27] | Torres A G, Kaper J B. Multiple elements controlling adherence of enterohemorrhagic Escherichia coli O157:H7 to HeLa cells[J]. Infection and Immunity, 2003, 71(9): 4985-4995. DOI: 10.1128/IAI.71.9.4985-4995.2003 |
| [28] | Chen Y Y, Wu H C, Lin J W, et al. Functional properties of the major outer membrane protein in Stenotrophomonas maltophilia[J]. Journal of Bacteriology, 2015, 53(8): 535-543. |
| [29] | Zhou Y, Zhou J, Wang D, et al. Evaluation of ompA and pgtE genes in determining pathogenicity in Salmonella enterica serovar Enteritidis[J]. The Veterinary Journal, 2016, 218(2): 19-26. |
| [30] | Hejair H M A, Zhu Y, Ma J, et al. Functional role of ompF and ompC porins in pathogenesis of avian pathogenic Escherichia coli[J]. Microbial Pathogenesis, 2017, 107(14): 29-37. |
| [31] | Aeckersberg F, Lupp C, Feliciano B, et al. Vibrio fischeri outer membrane protein OmpU plays a role in normal symbiotic colonization[J]. Journal of Bacteriology, 2001, 183(22): 6590-6597. DOI: 10.1128/JB.183.22.6590-6597.2001 |
| [32] | Mittal R, Krishnan S, Gonzalez-Gomez I, et al. Deciphering the roles of outer membrane protein A extracellular loops in the pathogenesis of Escherichia coli K1 meningitis[J]. Journal of Biological Chemistry, 2011, 286(3): 2183-2193. DOI: 10.1074/jbc.M110.178236 |




