文章信息
- 郭晓, 汪远, 范红结, 马喆
- GUO Xiao, WANG Yuan, FAN Hongjie, MA Zhe
- 鼠伤寒沙门菌PagC蛋白单克隆抗体的制备及其特性分析
- Development and epitope mapping of monoclonal antibodies against Salmonella PagC protein
- 南京农业大学学报, 2018, 41(5): 896-901
- Journal of Nanjing Agricultural University, 2018, 41(5): 896-901.
- http://dx.doi.org/10.7685/jnau.201801033
-
文章历史
- 收稿日期: 2018-01-22
2. 重要动物传染病与人畜共患病预防和控制中心江苏协同创新中心, 江苏 扬州 225009
2. Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, China
沙门菌(Salmonella)是寄生于人和动物肠道内的革兰氏阴性杆菌,主要引起人类的伤寒、副伤寒、急性胃肠炎和败血症等疾病,感染动物可导致败血症、胃肠炎及其他组织局部炎症,严重危害公共卫生及畜禽养殖安全[1-3]。现在临床上广泛使用的沙门菌检测方法主要是玻片凝集试验,该方法操作方便快捷且成本低,但是检测通量低且对于抗体滴度较低的血清样本敏感性不足,易出现假阴性结果判定主观性较强且存在与其他肠杆菌科细菌的交叉反应问题,容易出现假阳性结果。酶联免疫吸附检测法(ELISA)作为一种通量高、灵敏性强的血清学检测方法,可以有效提高沙门菌的临床检测效率和准确性[4-5]。由于肠杆菌科细菌交叉反应严重,在建立ELISA方法过程中首先需要克服这一难题。现有沙门菌抗体ELISA检测方法选用的检测抗原主要是O抗原和H抗原,但是O和H抗原表位复杂,用于ELISA抗体检测仍然存在着交叉反应[6-7]。
单克隆抗体是建立沙门菌抗体阻断ELISA检测方法的核心,需要筛选出针对沙门菌属保守抗原特异性强且与其余肠杆菌科细菌均无交叉反应的单克隆抗体。本实验室通过生物信息学比对发现,外膜蛋白PagC的保守性最好,在属内的同源性达到95%以上,与其他属间细菌的同源性在68%以下[8]。PagC蛋白是细菌的跨膜蛋白,全长185个氨基酸,呈β-桶装结构。pagC基因由pHoP调控,与沙门菌在巨噬细胞内的存活有关[9]。已有报道PagC具有良好的免疫原性和免疫反应性[8],因此,外膜蛋白PagC可以作为免疫原制备单克隆抗体。本试验首先原核表达并纯化了沙门菌PagC蛋白,免疫BALB/c小鼠,按照常规的杂交瘤细胞制备技术[10],得到了6株PagC蛋白单克隆抗体。其次,通过NCBI比对PagC蛋白质序列,合成存在于PagC蛋白中的属内保守、属间特异的氨基酸序列P1和P2,偶联上匙孔血蓝蛋白KLH,将偶联肽KLH-P1和KLH-P2作为筛选抗原进行Dot-blot试验。最终得到1株杂交瘤细胞,其分泌的抗体识别的抗原表位在多肽P1中。
1 材料与方法 1.1 材料小鼠骨髓瘤细胞SP2/0-Ag14和试验使用菌种(鸡百痢沙门菌、鼠伤寒沙门菌、大肠杆菌O1、变形杆菌、宋内志贺菌)均由本实验室保存;多肽序列P1和P2由南京金斯瑞生物公司合成;钥孔血蓝蛋白(KLH)、牛血清白蛋白(BSA)、琥珀酰亚胺-4-(N-马来酰亚胺)环已烷-1-碳酸酯(SMCC)、HAT和HT培养基购自Sigma公司;SPF级6~8周龄雌性BALB/c鼠购自扬州大学实验动物比较中心;胎牛血清购自PAN;羊抗鼠HRP酶标二抗购自Abcam公司;ECL发光液购自Thermo Pierce,DAB显色液购自索莱宝。
1.2 抗原的制备 1.2.1 PagC蛋白的表达与纯化将含有pET-28a-PagC质粒的表达菌BL21[8]用LB培养基(含终浓度为50 ng · mL-1的卡那霉素)培养至对数生长期,加入终浓度为1 mmol · L-1的IPEG(异丙基硫代半乳糖苷,isopropyl β-D-thiogalactoside)诱导剂,37 ℃振荡培养3 h;诱导后的菌体用灭菌的PBS洗3次,最终用PBS重悬后进行超声破碎菌体(功率200 W,工作5 s,间歇8 s);1 h后4 ℃离心30 min,分别取上清液和沉淀进行SDS-PAGE。确定重组蛋白PagC是以包涵体的形式表达后进行诱导表达。使用2 mol · L-1尿素洗涤3次包涵体蛋白,最终使用包涵体结合缓冲液于4 ℃过夜溶解沉淀。次日,使用His Ni2+柱对重组蛋白进行亲和层析纯化,纯化后的蛋白使用梯度透析的方法进行蛋白质的复性[11-12]。
1.2.2 多肽的合成与偶联通过生物信息学分析合成PagC特异性氨基酸序列P1和P2,使用SMCC交联剂偶联到载体KLH上,通过Ellman试剂盒测定偶联后体系巯基的D412值,判断偶联是否成功。同时用Dot-blot验证偶联肽KLH-P1、KLH-P2与PagC免疫鼠阳性血清的反应性。试验流程:在0.45 μm的硝酸纤维素膜(nitrocellulose filter membrane,NC)上分别滴加KLH-P1、KLH-P2、KLH、PagC各3 μg,4 ℃过夜(12 h)或37 ℃ 1 h;用5%PBST配制的脱脂乳室温封闭2 h;PBST洗涤3次,每次5 min;加入1 : 1 000稀释的PagC免疫小鼠阳性血清,室温孵育1 h;PBST洗涤3次后加入1 : 5 000稀释的羊抗鼠HRP酶标IgG,室温孵育1 h;PBST洗涤3次,加ECL发光液避光室温孵育2 min,曝光保存。
1.3 动物免疫选取SPF级6~8周龄雌性BALB/c小鼠,初免使用乳化后的纯化PagC蛋白进行背部皮下分点注射,每只50 μg(0.3 mL);21 d后抗原乳化后进行皮下和腹腔注射,每只50 μg(0.5 mL);二免后10 d采血分离血清,用建立的间接ELISA测定小鼠效价。选取效价最高且大于104的小鼠,再次每只腹腔注射50 μg(0.5 mL)抗原;3 d后取脾细胞用于融合。
1.4 间接ELISA筛选方法的建立通过反应条件的优化,建立间接ELISA抗体检测方法:将纯化的PagC蛋白用碳酸盐缓冲液(pH9.6)稀释至2 μg · mL-1,每孔100 μL加入96孔酶标板中,4 ℃作用过夜;次日用PBST洗涤3次后,加入用PBST配制的50 g · L-1脱脂乳,每孔200 μL,37 ℃封闭2 h;PBST洗涤3次后,加入50~100 μL的杂交瘤细胞培养上清液,37 ℃孵育1 h,并设置对照孔和阳性孔(对照孔加入SP2/0-Ag14细胞培养上清液,阳性孔加入PagC免疫小鼠阳性血清);PBST洗涤5次后,加入1 : 100 000稀释的羊抗鼠酶标HRP IgG,每孔100 μL,37 ℃孵育1 h;PBST洗涤5次后,加入TMB显色液,每孔100 μL,37 ℃避光显色10 min;加入2 mol · L-1硫酸,每孔50 μL终止显色,在酶标仪上读取D450值并保存。
1.5 单克隆抗体的制备在融合试验的前1 d,抽取ICR品系(费城癌症研究所繁育)小鼠腹腔巨噬细胞并铺于96孔细胞板中待用;取免疫良好的BALB/c小鼠,无菌取其脾脏,用200目铜网过滤组织悬液得到单一的脾细胞。将新鲜提取的脾细胞与培养至对数生长期的SP2/0-Ag14细胞进行计数;分别取(2.0~5.0)×107个SP2/0-Ag14与1.0×108个脾细胞混匀后,1 000 r · min-1离心10 min,弃上清液,轻击融合管使细胞松散,在45 s缓慢滴加预热至40 ℃的1 mL体积分数为50%的PEG4000,并轻轻晃动融合管促进细胞融合,随后由慢到快加入预热至37 ℃的1640培养基终止融合反应,轻晃融合管后静止10 min;1 000 r · min-1离心10 min,用80~100 mL的HAT培养基重悬融合细胞,加入培养有饲养细胞的96孔板中,每孔100 μL;37 ℃、5% CO2培养4~6 d后用HAT培养基进行半换液;第8~10天每天进行全换液,并观察杂交瘤细胞,待长至孔底面积1/5以上时取上清液,用建立的间接ELISA方法检测。阳性杂交瘤细胞孔采用有限稀释法进行连续2次亚克隆处理,最终得到稳定分泌抗体的细胞株冻存[13]。
1.6 Western blot鉴定PagC单克隆抗体的特异性纯化的pET-28a-PagC重组蛋白经SDS-PAGE电泳后转印至PVDF膜上,以间接ELISA检测为阳性的杂交瘤细胞培养上清(1 : 100稀释)为一抗,羊抗鼠酶标HRP IgG为二抗进行单克隆抗体的Western blot鉴定。
1.7 Dot-blot初步鉴定沙门菌PagC蛋白单克隆抗体的B细胞表位在NC膜上分别滴加KLH-P1、KLH-P2、KLH各3 μg,4 ℃过夜;加入50 g · L-1脱脂乳室温封闭2 h;PBST洗涤3次后,加入阳性杂交瘤细胞上清液,室温孵育1 h;PBST洗涤3次后,加入1 : 5 000稀释的羊抗鼠HRP酶标二抗,室温孵育1 h;PBST洗涤3次后,避光加DAB显色5~10 min,将NC膜放入蒸馏水漂洗终止显色,取出晾干。
1.8 Western blot鉴定单克隆抗体交叉反应性将培养至对数生长期的鸡白痢沙门菌、鼠伤寒沙门菌、大肠杆菌O1、变形杆菌、宋内志贺菌的菌液,离心后使用PBS重悬,同时设置重组蛋白PagC的阳性对照,加入4倍体积的蛋白上样缓冲液,煮沸10 min,进行120 g · L-1 SDS-PAGE电泳,转印至聚偏氟乙烯(PVDF)膜上,用制备的单克隆抗体J的细胞培养上清液作为一抗进行常规Western blot检测,加ECL发光液曝光并保存图片。
2 结果与分析 2.1 PagC蛋白的表达与纯化含重组质粒的表达菌BL21经IPTG诱导后,SDS-PAGE检测结果显示,在相对分子质量大约23×103处有一明显的目的蛋白条带,而空载对照组没有该条带,说明目的蛋白成功表达(图 1-A)。诱导表达的菌液超声破碎后,取上清液和包涵体进行SDS-PAGE检测,确定重组PagC是以包涵体蛋白的形式表达(图 1-B)。使用Ni2+亲和层析柱对重组蛋白进行纯化,纯化后的蛋白经SDS-PAGE检测,有且仅有1条大小为23×103左右的条带,说明目的蛋白纯度较高(图 1-C)。
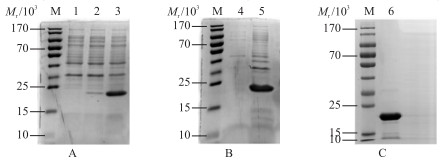
|
图 1 重组蛋白PagC的表达与纯化
Figure 1 Expression and purification of the recombinant PagC(rPagC)protein
A.重组蛋白PagC的SDS-PAGE分析;B.超声破碎重组蛋白的SDS-PAGE分析;C.纯化后的重组蛋白PagC。 A. SDS-PAGE analysis of the recombinant PagC protein;B. SDS-PAGE analysis of the recombinant protein after ultrasonication;C. The purified recombinant protein. M.蛋白标准品;1. pET-28a空载体诱导对照;2. pET-28a-PagC未诱导;3. pET-28a-PagC经IPTG诱导;4. pET-28a-PagC诱导后超声破碎上清液;5. pET-28a-PagC诱导超声破碎包涵体;6.纯化后重组蛋白PagC。 M. Protein maker;1. Add IPTG to induce expression of the pET-28a as blank control;2. Uninduced rPagC;3. Add IPTG to induce expression of the rPagC;4. Soluble protein of the induced rPagC;5. Inclusion body protein of the induced rPagC;6. Puried rPagC protein. |
图 2显示:偶联肽KLH-P1和KLH-P2均与PagC免疫鼠血清有反应,而与空载KLH无反应,说明合成肽偶联成功且PagC蛋白序列中的P1和P2氨基酸序列存在免疫反应性良好的线性表位。

|
图 2 合成肽偶联的Dot-blot验证 Figure 2 Dot-blot diagram for verifing the coupling of synthetic peptide |
采集PagC免疫小鼠的血清进行ELISA检测,结果显示2次免疫后血清ELISA效价均大于104,可以采集脾脏进行B细胞分离。
2.3.2 阳性杂交瘤细胞培养上清液的间接ELISA结果按照有限稀释的方法对融合后检测为阳性孔的细胞进行2次亚克隆,最终得到6株能稳定分泌抗体的杂交瘤细胞株,分别命名为A、B、C、D、I、J(表 1)。
| 细胞株 Cells |
初次检测 First detection |
第1次亚克隆 First subclone |
第2次亚克隆 Second subclone |
空白对照 Blank control |
阳性对照 Positive control |
| A | 3.60 | 3.2~3.6 | 3.0~3.6 | 0.05~0.08 | 0.8~1.2 |
| B | 2.00 | 2.6~2.8 | 2.6~2.8 | 0.05~0.08 | 1.0~1.2 |
| C | 0.80 | 2.2~2.6 | 2.8~3.0 | 0.05~0.08 | 1.0~1.2 |
| D | 1.20 | 0.7~0.9 | 1.4~1.6 | 0.04~0.05 | 0.8~1.3 |
| I | 0.32 | 2.3~2.4 | 3.2~3.6 | 0.07~0.09 | 1.0~1.2 |
| J | 0.87 | 3.0~3.2 | 2.7~3.2 | 0.04~0.06 | 1.0~1.2 |
纯化的PagC蛋白与阳性的杂交瘤细胞培养上清液孵育,结果(图 3)显示:单克隆抗体细胞株均能与PagC蛋白反应,说明单克隆抗体细胞株能特异性地识别PagC蛋白,而且这6株抗体识别的抗原表位都是PagC蛋白上的线性表位。
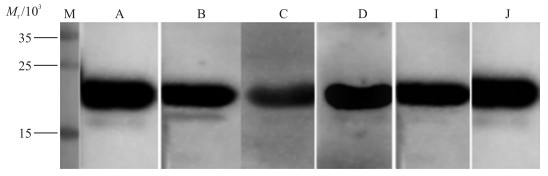
|
图 3 6株单克隆抗体与PagC的反应特性鉴定 Figure 3 Reaction of 6 monoclonal antibodies(mAb)with PagC by Western blot M.蛋白标准品;A、B、C、D、I、J为ELISA检测为阳性的杂交瘤细胞株培养上清液。下同。 M. Protein maker; A, B, C, D, I, J are positive supernatant of hyhridoma cells detected by ELISA. The same as below. |
Dot-blot筛选结果(图 4)显示:J细胞株与KLH-P1有明显反应,而与KLH和KLH-P2均无反应,说明J细胞株分泌抗体识别的抗原表位在P1序列上。其他细胞株与PagC有反应,而与KLH、KLH-P1和KLH-P2无反应,说明识别的抗原表位不是线性的P1和P2氨基酸序列。
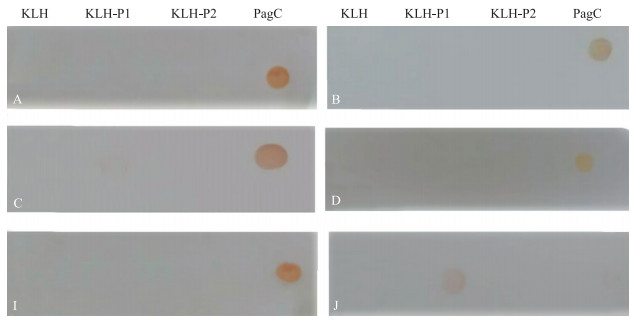
|
图 4 Dot-blot筛选能识别P1或P2抗原表位的单克隆抗体 Figure 4 Screen out mAbs recognizing P1 or P2 by Dot-blot |
由图 5可知:单克隆抗体作为一抗与纯化的PagC蛋白、野生型鸡白痢沙门菌和鼠伤寒沙门菌的PagC蛋白均有反应,与大肠杆菌O1、宋内志贺菌和变形杆菌的PagC蛋白无反应。说明野生型的鸡白痢沙门菌和鼠伤寒沙门菌的PagC蛋白上有单克隆抗体所识别的抗原表位序列,而变形杆菌、宋内志贺菌和大肠杆菌O1的PagC蛋白上无该抗原表位,进一步证明了沙门菌PagC蛋白中P1氨基酸序列的特异性。

|
图 5 单克隆抗体J细胞培养上清液的交叉反应性试验 Figure 5 Cross reaction test of mAb J 1~5分别为鸡白痢沙门菌、鼠伤寒沙门菌、变形杆菌、宋内志贺菌、大肠杆菌O1;6是纯化的PagC蛋白。 1-5. Respectively are Salmonella pullorum, Salmonella typhimurium, Proteus species, Shigella sonnei, Escherichia coli O1; 6. Puried PagC protein. |
沙门菌血清型众多,且与其他肠杆菌科细菌存在交叉,因此建立特异性强的沙门菌血清学检测方法具有较大困难。食源性沙门菌的国标检测方法(GB 4789.4—2010)是通过对细菌的分离鉴定完成,操作繁琐,周期4~7 d,不能实现及时有效的监测。目前我国鸡白痢沙门菌的临床血清学检测方法主要是玻板凝集试验,其操作方便,成本低,结果判定简单易懂,但实际使用中存在假阳性或假阴性的问题,不能满足精准检测的要求。ELISA检测方法较传统的玻板凝集试验灵敏度高[14-15],但是需要找到特异性的检测靶标。Strid等[7]使用等质量的肠炎沙门菌和鼠伤寒沙门菌的脂多糖(LPS)作为抗原建立的ELISA方法,检测患者血清中的抗体,发现大肠杆菌、小肠结肠炎耶尔森菌、空肠弯曲菌等与沙门菌之间存在3%~21%的交叉反应。Dalby等[6]使用沙门菌鞭毛蛋白作为抗原建立的间接ELISA方法测定沙门菌感染者血清抗体水平的试验,发现耶尔森菌、大肠杆菌、空肠弯曲菌、变形杆菌及幽门螺旋杆菌等与沙门菌之间存在25%~95%的交叉反应。以上基于沙门菌LPS建立的方法,因LPS组成相对简单,易出现交叉抗原表位。为了克服这一难题,本实验室通过生物信息学技术分析沙门菌属的保守抗原PagC,发现该蛋白与其他肠杆菌科细菌蛋白同源性低,在此基础上成功建立了基于PagC的沙门菌抗体检测的ELISA方法[8]。
阻断ELISA检测方法的特异性更胜于间接ELISA检测法,并已有多种针对其他病原的高特异性阻断ELISA检测方法。例如:猪圆环病毒2型、猪伪狂犬病毒、口蹄疫病毒和马动脉炎病毒[16-19]。为了进一步提升ELISA检测方法的特异性,我们希望利用PagC的保守性区段建立基于阻断法的ELISA检测试剂盒。因此,本试验制备了抗PagC蛋白的单克隆抗体,间接ELISA和Western blot试验都表明,这6株单克隆抗体均能与纯化的PagC蛋白有反应;使用特异性合成肽分析抗原表位,发现单克隆抗体J与KLH-P1有反应,与空载KLH无反应,说明J单克隆抗体识别的抗原表位在线性的P1序列上。Western blot结果中,该单克隆抗体J能够与纯化PagC蛋白、野生型鼠伤寒沙门菌和鸡白痢沙门菌PagC反应,但是与大肠杆菌、变形杆菌、宋内志贺肠杆菌无反应,进一步说明多肽P1序列是沙门菌PagC所特有。因此,使用本试验制备的单克隆抗体建立沙门菌阻断ELISA方法,可以有效避免肠杆菌科细菌抗原之间的交叉反应,提高沙门菌检测方法的特异性。
| [1] |
林忠兰, 吴兴美, 吴光渠. 一起肠炎沙门菌食物中毒事件调查[J].
海峡预防医学杂志, 2017, 23(2): 89-91.
Lin Z L, Wu X M, Wu G Q. Investigation of a case of Salmonella enteritis with food poisoning[J]. Strait Journal of Preventive Medicine, 2017, 23(2): 89-91. (in Chinese with English abstract) |
| [2] | Dailey N, Niemeier D, Elkhoraibi C, et al. Descriptive survey and Salmonella surveillance of pastured poultry layer farms in California[J]. Poultry Science, 2017, 96(4): 957-965. |
| [3] | Wales A D, Davies R H. A critical review of Salmonella typhimurium infection in laying hens[J]. Avian Pathol, 2011, 40(5): 429-436. DOI: 10.1080/03079457.2011.606799 |
| [4] | Charles S D, Sreevatsan S, Bey R F, et al. A dot immunobinding assay(dot-ELISA)for the rapid serodiagnosis of Salmonella enteritidis infection in chickens[J]. Journal of Veterinary Diagnostic Investigation, 1996, 8(3): 310-314. DOI: 10.1177/104063879600800306 |
| [5] | Minga U M, Wray C, Gwakisa P S. Serum, disk and egg ELISA for the serodiagnosis of Salmonella gallinarum and Salmonella enteritidis infections in chickens[J]. Scandinavian Journal of Immunology, 1992, 36: 157-159. DOI: 10.1111/sji.1992.36.issue-s1 |
| [6] | Dalby T, Strid M A, Beyer N H, et al. Rapid decay of Salmonella flagella antibodies during human gastroenteritis:a follow up study[J]. Journal of Microbiol Methods, 2005, 62(2): 233-43. DOI: 10.1016/j.mimet.2005.02.006 |
| [7] | Strid M A, Dalby T, Krogfelt K A, et al. Kinetics of the human antibody response against Salmonella enterica serovars enteritidis and typhimurium determined by lipopolysaccharide enzyme-linked immunosorbent assay[J]. Clinical and Vaccine Immunology, 2007, 14(6): 192-197. |
| [8] | Ma Z, Yang X Y, Fang Y Z, et al. Detection of Salmonella infection in chickens by an indirect enzyme-linked immunosorbent assay based on presence of PagC antibodies in sera[J]. Foodborne Pathogens and Disease, 2018, 15(2): 109-113. DOI: 10.1089/fpd.2017.2322 |
| [9] | Heffernan E J, Harwood J, Fierer J, et al. The Salmonella typhimurium virulence plasmid complement resistance gene rck is homologous to a family of virulence-related outer membrane protein genes, including pagC and ail[J]. Journal of Bacteriology, 1992, 174(1): 84-91. DOI: 10.1128/jb.174.1.84-91.1992 |
| [10] | Chen J S, Ye H M, Yi Y, et al. Preparation of chloramphenicol artificial immunogen and monoclonal antibodies[J]. Biotechnology & Biotechnological Equipment, 2011, 25(1): 2284-2289. |
| [11] |
付明娟, 林接玉, 谢捷明. 包涵体蛋白复性的研究进展[J].
医学综述, 2015, 21(20): 3657-3659.
Fu M J, Lin J Y, Xie J M. Progress in the study of inclusion body protein refolding[J]. Medical Recapitulate, 2015, 21(20): 3657-3659. DOI: 10.3969/j.issn.1006-2084.2015.20.004 (in Chinese with English abstract) |
| [12] |
包义风, 应莲芳, 蒋琳. 包涵体蛋白复性技术研究进展[J].
微生物学免疫学进展, 2012, 40(2): 84-88.
Bao Y F, Ying L F, Jiang L. Research progress in renaturation of inclusion body protein[J]. Progress in Microbiology and Immunology, 2012, 40(2): 84-88. DOI: 10.3969/j.issn.1005-5673.2012.02.017 (in Chinese with English abstract) |
| [13] | Kohler G, Milstein C. Continuous cultures of fused cells secreting antibody of predefined specificity[J]. Journal of Immunology, 2005, 174(5): 2453-2455. |
| [14] |
钱珊珊.沙门菌SpiC蛋白单克隆抗体的研制与初步应用[D].扬州: 扬州大学, 2015.
Qian S S. Development and primary application of monoclonal antibodies against Salmonella SpiC protien[D]. Yangzhou: Yangzhou University, 2015(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-11117-1015662054.htm |
| [15] |
康孟佼, 朱春红, 蒋颖, 等. 肠炎沙门菌间接ELISA检测方法的建立[J].
中国家禽, 2010, 32(15): 22-25.
Kang M J, Zhu C H H, Jiang Y, et al. Dvelopment of an indirect enzyme-linked immunosorbent assay for detection of Salmonella enteritidis[J]. China Poultry, 2010, 32(15): 22-25. (in Chinese with English abstract) |
| [16] |
孙海凤.猪伪狂犬病病毒gB蛋白B细胞表位解析及其阻断ELISA抗体检测方法的建立[D].南京: 南京农业大学, 2015.
Sun H F. Evaluation of B-cell epitopes of gB protein and development of blocking ELISA with monoclonal antibody for detection of antibody to PRV[D]. Nanjing: Nanjing Agricultural University, 2015(in Chinese with English abstract). http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y3184570 |
| [17] |
杨香林.猪圆环病毒2型单克隆抗体阻断ELISA方法的建立与核酸疫苗重组体的构建及免疫特性研究[D].南京: 南京农业大学, 2012.
Yang X L. Development of blocking ELISA with monoclonal antibody for detection of antibody to PCV2 and immunogenicity of DNA vaccine based on the modififd ORF2 gene[D]. Nanjing: Nanjing Agricultural University, 2012(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10307-1014122442.htm |
| [18] | Cho H J, Entz S C, Deregt D, et al. Detection of antibodies to equine arteritis virus by a monoclonal antibody-based blocking ELISA[J]. Canadian Journal of Veterinary Research, 2000, 64(1): 38-43. |
| [19] | Fu Y F, Li P H, Cao Y M, et al. Development of a blocking ELISA using a monoclonal antibody to a dominant epitope in non-structural protein 3A of foot-and-mouth disease virus, as a matching test for a negative-marker vaccine[J]. PLoS One, 2017, 12(1): 550-559. |




