文章信息
- 李祎, 杨顺瑛, 郝东利, 苏彦华
- LI Yi, YANG Shunying, HAO Dongli, SU Yanhua
- 光氮互作对拟南芥col-0和CS3721512突变体碳、氮代谢的影响
- Effects of light and nitrogen interaction on carbon-nitrogen metabolism of Arabidopsis thaliana col-0 and mutant CS3721512
- 南京农业大学学报, 2018, 41(5): 873-880
- Journal of Nanjing Agricultural University, 2018, 41(5): 873-880.
- http://dx.doi.org/10.7685/jnau.201801049
-
文章历史
- 收稿日期: 2018-01-29
碳代谢和氮代谢是植物体内最重要的2个代谢过程[1]。氮代谢中植物吸收氮的主要形式为NH4+,但大多数植物对NH4+都较为敏感。高浓度NH4+甚至抑制植物的生长,减少植物的产量[2-3]。Togoro等[4]的试验结果表明,供应NH4+的植株体内非常容易积累大量的游离铵,这可能是植株生长受抑制的原因之一。在高等植物中,谷氨酰胺合成酶(glutamine synthetase,GS)是氮代谢途径中关键酶之一,在植株体内游离NH4+同化过程中起着至关重要的作用,可以直接影响植物的生长发育和产量[5]。GS1的表达受氮素影响较为明显[6]。Lematre等[7]发现,在氮素极度缺乏的情况下,拟南芥叶片中GS1表达量明显的增加,可能是由于蛋白质异化作用产生的NH4+被GS用于氮的同化作用,以此来保证植株正常生长。
光照是通过光合作用对植株的生长发育产生影响。朱祝军等[8]的研究结果表明,只有在强光下,NH4+才会对植物的生长产生抑制作用,而在弱光下,氮素形态对于植物生长状况的影响没有显著差异。在一定的光照强度范围内,植物的光合速率随光照的增强而增加,对养分的需要量随之增加,吸收能力增强[9]。光照不足时,植物通过自身调节来增加地上部的生物量分配比例,增加植株叶片中氮浓度和比叶面积(SLA),从而达到增强光能捕捉和利用的效果[10-11]。在植物生长过程中,只有当氮素和光照处在一个平衡、协调的供应水平时,植株才可能处于最佳生长状态。
对GS基因高效表达报道很多,但是对GS基因缺乏的报道却较少。目前已有的研究多是在光照强度或者氮素水平单一因素上对拟南芥的生长和碳、氮代谢的影响,结合两者的研究较少。本试验以谷氨酰胺合成相关基因的T-DNA插入缺陷突变体和野生型为材料,研究不同光、氮处理对拟南芥植株体内碳、氮代谢的影响。
1 材料与方法 1.1 材料植物材料为col-0野生型拟南芥(Arabidopsis thaliana Columbia),为本实验室保存。T-DNA插入突变体CS3721512 (GS1;1 T-DNA插入缺陷突变体)购于ABRC(https://abrc.osu.edu)。
2Mix rTaq、RNAiso Plus和PrimeScriptTM Ⅱ RT试剂盒以及Ex Taq购自宝生物工程(大连)有限公司。引物由生工生物工程(上海)有限公司合成。其他生化试剂均为国产分析纯试剂。
1.2 材料培养水培方法参照文献[12],光照培养箱的温度为(23±1) ℃,光周期为光照16 h、黑暗8 h,光照强度为100 μmol · m-2 · s-1。水培营养液成分根据Yuan等[13]的方法修改为:2 mmol · L-1 NH4NO3,1 mmol · L-1KH2PO4,1 mmol · L-1 MgSO4,250 μmol · L-1K2SO4,250 μmol · L-1CaCl2,100 μmol · L-1 Na-Fe-EDTA,50 μmol · L-1 KCl,50 μmol · L-1 H3BO3,5 μmol · L-1MnSO4,1 μmol · L-1 ZnSO4,1 μmol · L-1CuSO4,1 μmol · L-1 NaMoO4,1 mmol · L-1 MES-KOH(2-码啉已磺酸),pH5.7。种子用100 g · L-1次氯酸钠和1 g · L-1SDS消毒5 min,然后用灭菌水清洗(5次),置4 ℃低温避光保存48 h,然后播种培养。
1.3 试验设计水培培养14 d之后,挑选长势一致的拟南芥幼苗进行处理,将1.2节中水培培养液NH4NO3更换为NH4Cl,其余成分不变。处理设置2个光照水平:正常光照(L1)和50%遮阳网遮光处理(L2);每个光照处理下设置2个氮浓度:2 mmol · L-1 NH4Cl(N1)和20 mmol · L-1 NH4Cl(N2)。每个处理组有3株植株幼苗,每个处理重复3次。隔1 d更换培养液,培养4周后采样,测定相关生理指标。
1.4 试验方法 1.4.1 CS3721512纯合体鉴定采用蔗糖法[14]提取拟南芥基因组DNA,随后进行PCR反应,反应体系:模板DNA 1 μL,正向引物(10 μmol · L-1)0.4 μL,反向引物(10 μmol · L-1)0.4 μL,2×Mix rTaq 10 μL,双蒸水8.2 μL,总体积20 μL,混匀后进行PCR反应。PCR反应条件为:94 ℃ 3 min;94 ℃ 30 s,60 ℃ 45 s,72 ℃ 90 s,30个循环;72 ℃ 10 min。引物为LBb1(5′-ATAATAACGCTGCGGACATCTACATTTT-3′),CS3721515-LP(5′-TATCACGTCCTACTCGGATCG-3′),CS3721515-RP(5′-CAAGGATCCTTTCCGTAGAGG-3′)。
利用TaKaRa的RNAiso Plus试剂提取拟南芥野生型与待检测T-DNA插入株系叶片的RNA。用NanoDrop 2000超微量分光光度计测定RNA的浓度。利用Prime-ScriptTM Ⅱ RT试剂盒对2 μg RNA合成cDNA。然后,利用At5g37600基因的特异引物At5g37600-F(5′-CATCAACCTTAACCTCTCAGACTCCA-3′)和At5g37600-R(5′-GGTTTGGCCCATCAGAATCG-3′)进行RT-PCR检测At5g37600 的表达。ACTIN 1基因作为内参,引物为ACTIN1-F(5′-ACACCAGACATAGTAGCAGAAATCAAG-3′);ACTIN1-R(5′-GAGCCTTACAACGCTACTCTGTCTGTC-3′)。扩增条件:94 ℃ 3 min;94 ℃ 3 min,58 ℃ 30 s,72 ℃ 1 min,25个循环;72 ℃ 5 min。扩增产物用10 g · L-1琼脂糖凝胶电泳进行分析。
1.4.2 植株生理生化指标的测定培养4周后,测定不同处理拟南芥植株的鲜质量。采用丙酮萃取法,测定叶绿素含量,计算叶绿素a、b、a/b和叶绿素总含量;采用蒽酮比色法测定可溶性糖含量;采用考马斯亮蓝G-250染色法测定可溶性蛋白含量;采用靛酚蓝比色法测定游离铵含量;采用凯氏定氮法测定全氮含量[15-16]。每个处理重复3次,计算平均值。
1.4.3 拟南芥谷氨酰胺合成酶(GS)和谷氨酸脱氢酶(GDH)活性的测定称取0.2 g鲜样叶片,放入预冷的研钵中,加入1.5 mL预冷的提取缓冲液,添加少量石英砂在冰上研磨,匀浆收集至1个2.0 mL离心管中,4 ℃、16 000 g离心20 min,然后将上清液转移到新的离心管中用于测定相关酶活性。提取缓冲液组成:50 mmol · L-1 Tris-HCl(pH7.5),10 mmol · L-1 MgCl2,1 mmol · L-1 EDTA,1 mmol · L-1 EGTA,1 mmol · L-1苯甲脒,1 mmol · L-1ε-氨基乙酸和10 μmol · L-1亮抑酶肽。采用Magalhaes等[17]方法测定谷氨酰胺合成酶(GS)和谷氨酸脱氢酶(GDH)活性。
1.5 数据分析采用Excel 2010软件和SPSS 13.0软件进行试验数据的统计和相关性分析,采用Duncan ’ s检验法进行差异显著性分析。
2 结果与分析 2.1 CS3721512纯合体鉴定从图 1-b可知:CS3721512突变体中插入特异性扩增条带,产物大约为700 bp。对该株系DNA样品利用T-DNA插入两端的LP和RP引物进行了PCR扩增,野生型样品有预测的特异的1 142 bp PCR产物(图 1-c),而CS3721512株系样品并没有扩增条带,说明CS3721512为纯合的T-DNA插入。对CS3721512株系进行定量PCR,几乎检测不到At5g37600 ,表明CS3721512株系在T-DNA插入的作用下,At5g37600 基因完全被敲除(图 1-d)。

|
图 1 CS3721512纯合体鉴定和RT-PCR结果 Figure 1 Homozygote detection and RT-PCR of CS3721512 a. T-DNA突变体插入片段PCR鉴定模式图;b. col-0和CS3721512的LBb1和LP引物扩增结果;c. col-0和CS3721512的RP和LP引物扩增结果(M. DNA Marker;1. col-0;2. CS3721512);d. At5g37600 在col-0和CS3721512株系中的表达结果。 a. PCR identification pattern of T-DNA; b. Result of LBb1 and LP in col-0 and CS3721512; c. Result of RP and LP in col-0 and CS3721512 (M. DNA Marker; 1. col-0;2. CS3721512); d. Expression of At5g37600 in col-0 and CS3721512. |
从表 1可以看出:L1处理下,N2处理col-0和CS3721512植株鲜质量均低于N1处理(P < 0.05),分别比N1处理降低了8.8%和22.7%。这表明正常光照下高NH4+胁迫下植株的生长受到抑制,其中CS3721512对高NH4+的影响更为敏感。L2处理下,与L1处理相比,N1处理col-0和CS3721512鲜质量分别降低了64.22%和67.4%,表明弱光对植株生长有抑制作用;N2处理col-0和CS372151植株鲜质量均大于N1,其鲜质量分别增加30.5%和75.2%。这说明弱光处理下,拟南芥的生长受到抑制,但增加NH4+含量可以在一定程度上缓解弱光对植物生长的抑制作用。
| g | |||
| 光照强度Light intensity | 氮素Nitrogen level | col-0 | CS3721512 |
| L1 | N1 | 1.364±0.12a | 1.349±0.01a |
| N2 | 1.243±0.09b | 1.042±0.06b | |
| L2 | N1 | 0.486±0.03d | 0.493±0.02d |
| N2 | 0.634±0.04c | 0.864±0.02c | |
| 注:1)L1:不遮光;L2:50%遮光。N1:2 mmol · L-1 NH4Cl; N2:20 mmol · L-1 NH4Cl。 2)同一列数字后不同小写字母表示同一材料不同处理差异达0.05显著水平。 Note:1)L1:No shading;L2:50% shading. N1:2 mmol · L-1 NH4Cl;N2:20 mmol · L-1 NH4Cl. 2) Values within a column followed by different letters are significantly different at 0.05 probability level between different treatments at the same material. | |||
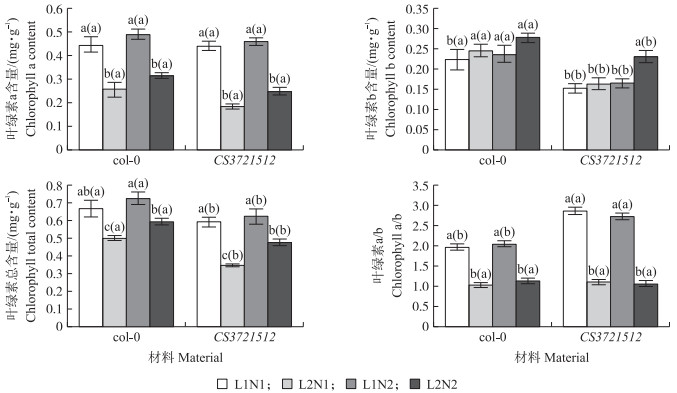
从图 2可知:2种光照处理下,N2处理col-0和CS3721512叶片叶绿素a含量均大于N1处理(P>0.05);相同NH4+浓度下,L1处理col-0和CS3721512叶片叶绿素a含量均大于L2处理(P < 0.05)。这表明高NH4+在一定程度上增加植株叶片叶绿素a含量,弱光则在一定程度上减少叶绿素a含量。不同处理下,col-0的叶绿素a含量略高于CS3721512 (P>0.05)。
|
图 2 光氮互作对拟南芥叶片光合色素的影响 Figure 2 Effects of light intensity and nitrogen interaction on leaf photosynthetic pigments of A. thaliana leaves 柱形的上面括号外不同字母表示同一材料不同处理间在0.05水平差异显著;括号内不同字母表示相同处理不同材料间在0.05水平差异显著。下同。 Values by the different small letters out of bracket on the column are significantly different at 0.05 level between different treatments at the same material; values by the different small letters in bracket on the column are significantly different at 0.05 level between different materials at the same treatment. The same as follows. |
2种光照处理下,N2处理col-0和CS3721512的叶片叶绿素b含量均大于N1处理;相同NH4+浓度下,L1处理col-0和CS3721512的叶片叶绿素b含量均小于L2处理;不同处理下,col-0的叶绿素b含量高于CS3721512 (P < 0.05)。这表明高NH4+和弱光胁迫在一定程度上增加了植株叶片叶绿素b含量,两者互作对植株叶片中叶绿素b含量的增幅最为明显。
2种光照处理下,N2处理col-0和CS3721512的叶绿素总含量均大于N1处理,相同NH4+处理下,L1处理col-0和CS3721512的叶绿素总含量均大于L2处理。这说明高NH4+在一定程度上可以增加叶片叶绿素含量,而弱光则减少叶片叶绿素含量。不同处理下,col-0的叶绿素总含量高于CS3721512 (P < 0.05)。
2种光照处理下,N1处理col-0的叶绿素a/b均小于N2处理,而N1处理CS3721512的叶绿素a/b值大于N2处理;相同NH4+水平下,L1处理col-0和CS3721512的叶片叶绿素a/b值均大于L2处理。弱光胁迫下,col-0和CS3721512叶片中叶绿素a/b值都降低;随着NH4+的增加,col-0的叶绿素a/b值增加,而CS3721512的叶绿素a/b值则降低。
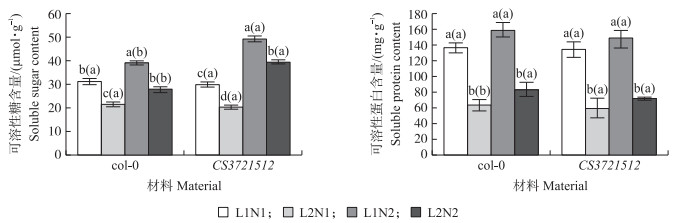
2.4 不同光氮处理对拟南芥可溶性糖和可溶性蛋白含量的影响由图 3可知:相同NH4+水平下,L1处理叶片可溶性糖含量均大于L2处理;2种光照强度下,N2处理叶片的可溶性糖含量均大于N1处理;正常NH4+浓度下,CS3721512叶片可溶性糖含量略低于col-0(P>0.05);而高NH4+胁迫下,CS3721512叶片可溶性糖含量高于col-0(P < 0.05)。
|
图 3 光氮互作下拟南芥叶片可溶性糖和可溶性蛋白含量 Figure 3 Interaction effects of light intensity and nitrogen supply on soluble sugar content and soluble protein content of A. thaliana |
相同NH4+处水平下,L1处理叶片的可溶性蛋白含量大于L2处理,相同光照条件下,N1处理叶片的可溶性蛋白含量小于N2处理;相同处理下,col-0叶片的可溶性蛋白含量略高于CS3721512 (P>0.05)。弱光胁迫下,可溶性糖和可溶性蛋白含量降低,增加NH4+浓度,可以在一定程度上增加叶片的可溶性糖含量,维持细胞内渗透压的平衡,提高植物的抗逆性,为氮代谢提供碳源,维持碳、氮代谢。
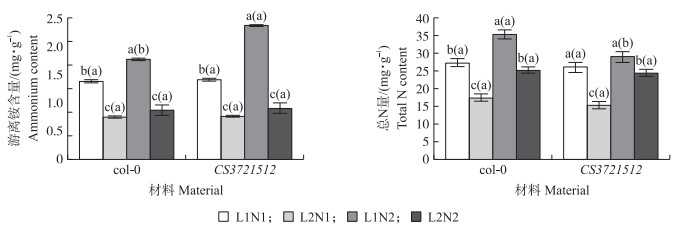
2.5 不同光氮处理对拟南芥游离铵和全N量的影响从图 4可以看出:L1处理下,N2处理2种植株的游离铵含量都大于N1处理,与N1处理相比较,N2处理col-0和CS3721512植株的游离铵含量分别增加了35.0%和70.8%;L2处理下,与L1处理相比,N1处理col-0和CS3721512的游离铵含量分别降低了41.1%和34.56%,表明弱光对植物体内游离铵含量有影响;在L2处理下,N2处理植株游离铵含量大于N1处理,col-0和CS3721512的游离铵含量分别增加了27.3%和34.2%。这说明弱光处理下,增加NH4+含量可以在一定程度上增加植株体内游离铵含量,且CS3721512所受的影响更大。
|
图 4 光氮互作对拟南芥植株游离铵和总N量的影响 Figure 4 Effects of light intensity and nitrogen interaction on ammonium content and total N content of A. thaliana |
L1处理下,N2处理2种植株的总N量均大于N1处理,与N1处理相比较,N2处理下col-0和CS3721512植株中总N量分别增加了25.0%和21.4%;L2处理下,与L1处理相比,N1处理col-0和CS3721512的总N量分别降低了41.1%和34.56%,表明弱光对植物的总N含量有影响;在L2处理下,N2处理植株总N量大于N1处理,col-0和CS3721512的总N量分别增加61.4%和62.7%。这说明弱光处理下,拟南芥的铵同化作用受到抑制,但增加NH4+含量可以在一定程度上缓解弱光对植物铵同化作用的抑制。
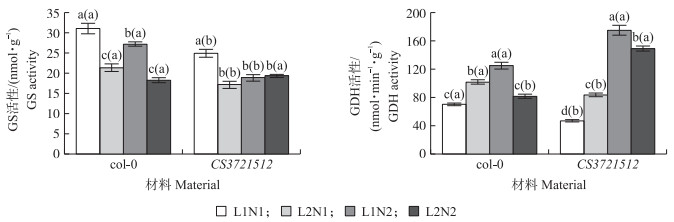
2.6 不同光氮处理对GS与GDH活性的影响从图 5可知:相同光照处理下,N1处理植株叶片GS活性小于N2处理,相同NH4+水平下,L1处理植株叶片GS活性大于L2处理,CS3721512的GS活性低于相同处理下的col-0(P < 0.05)。弱光抑制植株叶片GS活性,增加NH4+浓度,可以在一定程度上增加叶片GS活性,促进无机氮转化成有机氮。
|
图 5 光氮互作下拟南芥叶片的GS与GDH活性 Figure 5 Interaction effects of light intensity and nitrogen supply on glutamine synthetase(GS) and glutamate dehydrogenase(GDH)activities of A. thaliana leaves |
相同光照处理下,N1处理叶片的GDH活性小于N2处理;相同NH4+水平下,L1处理植株叶片GDH活性大于L2处理。在正常NH4+浓度下,CS3721512的GDH活性低于相同处理下的col-0,但高NH4+浓度下,CS3721512的GDH活性高于col-0(P < 0.05)。弱光抑制植株叶片GDH活性,但增加NH4+浓度,可以增加叶片GDH活性,且CS3721512的增加幅度远高于col-0。
3 讨论氮素和光照是植物生长发育最重要的2个限定因素[1]。植物的鲜质量可直观反映植株生长状况[18]。Zebarth等[19]发现,NH4+不仅抑制植株生长,较高浓度的NH4+还会产生毒害作用。Togoro等[4]的试验结果表明,供应NH4+的植株体内非常容易积累大量的游离铵,这可能是植株生长受到抑制的原因之一。在高等植物中,一般认为叶绿体GS随光照强度增加而增强,而胞质GS活性不随光照强度改变而变化[17]。刘晓明等[20]证实了光照能增强番茄叶中GS活性。本试验中,CS3271512与col-0相比较,更容易受到高NH4+毒害。可能是因为CS3721512缺乏GS1.1 基因,植株的GS活性低,体内游离铵积累,生长受到抑制。弱光处理下GS活性降低可能就是因为叶片中GS活性减少,使植株总GS活性降低。GDH在植物体内有双重性[21],既起到NH4+的同化作用,也起到氧化脱氮的作用,尤其在解除氨毒过程中起主要作用。本试验中,CS3721512的GDH活性较高可能是为了解除CS3721512高NH4+毒害作用。
叶绿素含量是叶片衰老的重要标志之一,不仅表征植物生长状况,还与植物光合作用效率、营养状态等相关[22-24]。李冬梅[25]研究发现连续的弱光胁迫会导致玉米叶绿素b和总叶绿素含量上升,叶绿素a/b值降低。宋航等[26]研究表明弱光处理下随施氮量增加,玉米叶片叶绿素a、叶绿素b和叶绿素总含量均提高。光合色素中叶绿素a更偏向吸收长波长方面,叶绿素b吸收短波蓝紫光的能力较强[27],在阴天的光谱中蓝光等短波长比例增加[28]。弱光处理下,叶绿素b含量的增加有利于植物对蓝紫光的吸收,可以充分利用光能,是植物一种弱光胁迫的自我调节。因此,在弱光下通过增加NH4+增加叶绿素含量,可充分利用叶绿素的光能。可溶性糖和可溶性蛋白是植物体内的主要渗透调节物质,也是植物抗逆性的重要指标[29]。本研究结果表明植物体内可溶性糖含量随NH4+的升高而逐渐减小。姜丹等[30]研究表明,不同光强下早熟禾的可溶性糖含量随氮水平的升高呈先降低后升高的趋势,这与本试验结果相似。
在弱光胁迫条件下,适量增施NH4+可以改善拟南芥的光合特性,增强拟南芥的碳氮代谢相关酶活性,一定程度上缓解弱光胁迫对拟南芥生理生化造成的影响,为缓解弱光胁迫提供新的思路。
| [1] |
宋建民, 田纪春, 赵世杰. 植物光合碳代谢和氮代谢之间的关系及其调节[J].
植物生理学通讯, 1998, 6(3): 230-238.
Song J M, Tian H C, Zhao S J. Relationship between photosynthetic carbon and nitrogen metabolism in plants and its regulation[J]. Plant Physiology Communications, 1998, 6(3): 230-238. (in Chinese with English abstract) |
| [2] | Britto D T, Kronzucker H J. NH4+ toxicity in higher plants:a critical review[J]. Plant Physiol, 2002, 159: 567-584. DOI: 10.1078/0176-1617-0774 |
| [3] | Gerendas J, Zhu Z, Bendixen R, et al. Physiological and biochemical processes related to ammonium toxicity in higher plants[J]. Journal of Plant Nutrition and Soil Science, 1997, 160: 239-251. |
| [4] | Togoro H, Hiroshi T, Yoshio Y. Effect of nitrogen source on the chemical components in young plants[J]. Soil Science Plant Nutrition, 1968, 14: 47-55. DOI: 10.1080/00380768.1968.10432008 |
| [5] | Kusano M, Tabuchi M, Fukushima A, et al. Metabolomics data reveal a crucial role of cytosolic glutamine synthetase 1;1 in coordinating metabolic balance in rice[J]. Plant J, 2011, 66(3): 456-466. DOI: 10.1111/j.1365-313X.2011.04506.x |
| [6] |
于瑶, 张汉尧, 杜建伟. 高等植物谷氨酰胺合成酶基因的研究进展[J].
山东农业科学, 2012, 44(4): 15-19.
Yu Y, Zhang H Y, Du J W. Research progress of glutamine synthetase gene in higher plants[J]. Shandong Agricultural Sciences, 2012, 44(4): 15-19. DOI: 10.3969/j.issn.1001-4942.2012.04.004 (in Chinese with English abstract) |
| [7] | Lematre T, Gaufichon L, Boutet-Mercey S, et al. Enzymatic and metabolic diagnostic of nitrogen deficiency in Arabidopsis thaliana Wassileskija accession[J]. Plant and Cell Physiology, 2008, 49(7): 1056-1065. DOI: 10.1093/pcp/pcn081 |
| [8] |
朱祝军, 喻景权, JoskaGerendas, 等. 氮素形态和光照强度对烟草生长和H2O2清除酶活性的影响[J].
植物营养与肥料学报, 1998, 4(4): 379-385.
Zhu Z J, Yu J Q, Joska Gerendas, et al. Effect of light intensity and nitrogen form on growth and activities of H2O2-scavenging enzymes in tobacco[J]. Plant Nutrition and Fertilizer, 1998, 4(4): 379-385. DOI: 10.3321/j.issn:1008-505X.1998.04.009 (in Chinese with English abstract) |
| [9] |
曾希柏, 青长乐, 谢德体, 等. 作物生长中光照和氮肥施用量的相互关系研究[J].
土壤学报, 2000, 37(3): 380-386.
Zeng X B, Qing C L, Xie D T, et al. Interrelationship of light and nitrogen fertilizer application in crop growth[J]. Acta Pedologica Sinica, 2000, 37(3): 380-386. DOI: 10.3321/j.issn:0564-3929.2000.03.012 (in Chinese with English abstract) |
| [10] | Fownes J H, Harrington R A. Seedling response to gaps:separating effects of light and nitrogen[J]. Forest Ecology and Management, 2004, 203: 297-310. DOI: 10.1016/j.foreco.2004.07.044 |
| [11] | Grechi I, Vivin P, Hilbert G, et al. Effect of light and nitrogen supply on internal C:N balance and control of root-to-shoot biomass allocation in grapevine[J]. Environmental and Experimental Botany, 2007, 59: 139-149. DOI: 10.1016/j.envexpbot.2005.11.002 |
| [12] |
刘峰, 施卫明. 拟南芥室内水培方法的改进[J].
土壤, 2006, 38(1): 102-105.
Liu F, Shi W M. An improved method for indoor hydroponic culture of Arabidopsis thaliana[J]. Soils, 2006, 38(1): 102-105. DOI: 10.3321/j.issn:0253-9829.2006.01.018 (in Chinese with English abstract) |
| [13] | Yuan L X, Loque D, Ye F H, et al. Nitrogen-dependent posttranscriptional regulation of the ammonium transporter AtAMT1;1[J]. Plant Physiology, 2007, 143(2): 732-744. |
| [14] | Takakura K, Noshio T. Safer DNA extraction from plant tissues using sucrose buffer and glass fiber filter[J]. Journal of Plant Research, 2012, 125(6): 805-807. DOI: 10.1007/s10265-012-0502-x |
| [15] |
李合生.
植物生理生化实验原理与技术[M]. 北京: 高等教育出版社, 1999.
Li H S. Principles and Techniques of Plant Physiological and Biochemical Experiment[M]. Beijing: Higher Education Press, 1999. (in Chinese with English abstract) |
| [16] |
鲁如坤.
土壤农业化学分析方法[M]. 北京: 中国农业科学技术出版社, 2000.
Lu R K. Methods of Soil Agricultural Chemical Analysis[M]. Beijing: China Agricultural Science and Technology Press, 2000. (in Chinese with English abstract) |
| [17] | Magalhaes J R, Huber D M. Response of ammonium assimilation enzymes to nitrogen form treatment in different plant species[J]. Journal of Plant Nutrition, 1991, 14: 175-185. DOI: 10.1080/01904169109364193 |
| [18] | Ni L Y. Growth of Potamageton maackianus under low-light stress in eutrophic water[J]. Journal of Freshwater Ecology, 2001, 16: 249-256. DOI: 10.1080/02705060.2001.9663809 |
| [19] | Zebarth B J, Tai H, Luo S, et al. Effect of nitrogen form on gene expression in leaf tissue of greenhouse grown potatoes during three stages of growth[J]. American Journal of Potato Research, 2012, 89: 315-324. DOI: 10.1007/s12230-012-9255-2 |
| [20] |
刘晓明, 杨延杰, 李天来. 光强对番茄氮素代谢及相关酶活性的影响[J].
北方园艺, 2008(5): 1-5.
Liu X M, Yang Y J, Li T L. Effects of low light intensity on nitrogen metabolism and relative enzymes activity in tomato[J]. Northern Horticulture, 2008(5): 1-5. (in Chinese with English abstract) |
| [21] | Melo-Oliveira R, Oliveira I C, Coruzzi G M. Arabidopsis mutant analysis and gene regulation define anonredundant role for glutamate dehydrogenase in nitrogen assimilation[J]. Proc Natl Acad Sci USA, 1996, 93: 4718-4723. DOI: 10.1073/pnas.93.10.4718 |
| [22] | Zhang M, Cao T, Ni L Y, et al. Carbon, nitrogen and antioxidant enzyme responses of Potamogeton crispus to both low-light and high-nutrient stresses[J]. Environmental and Experimental Botany, 2010, 68(1): 44-50. DOI: 10.1016/j.envexpbot.2009.09.003 |
| [23] |
黎慧娟, 倪乐意, 曹特, 等. 弱光照和富营养对苦草生长的影响[J].
水生生物学报, 2008, 32(2): 225-230.
Li H J, Ni L Y, Cao T, et al. Responses of Vallisneria natans to reduced light availability and nutrient enrichment[J]. Acta Hydrobiologica Sinica, 2008, 32(2): 225-230. DOI: 10.3321/j.issn:1000-3207.2008.02.014 (in Chinese with English abstract) |
| [24] |
杨振超, 何蔚, 牟孙涛, 等. 不同光周期和红蓝光质配比对辣椒幼苗生长发育的影响[J].
农业工程学报, 2017, 33(17): 173-180.
Yang Z C, He W, Mou S T, et al. Plant growth and development of pepper seedlings under different photo periods and photon flux ratios of red and blue LEDs[J]. Transactions of the Chinese Society of Agricultural Engineering, 2017, 33(17): 173-180. DOI: 10.11975/j.issn.1002-6819.2017.17.023 (in Chinese with English abstract) |
| [25] |
李冬梅, 赵奎华, 王延波, 等. 不同耐密性玉米品种光合特性对弱光响应的差异[J].
玉米科学, 2013, 21(5): 52-56.
Li D M, Zhao K H, Wang Y B, et al. Responses of photosynthesis characters to low-light stress for maize hybrids with different density tolerances[J]. Journal of Maize Sciences, 2013, 21(5): 52-56. DOI: 10.3969/j.issn.1005-0906.2013.05.010 (in Chinese with English abstract) |
| [26] |
宋航, 杨艳, 周卫霞, 等. 光、氮及其互作对玉米光合特性与物质生产的影响[J].
玉米科学, 2017, 25(1): 121-126.
Song H, Yang Y, Zhou W X, et al. Effects of light, nitrogen and their interaction on photosynthetic traits and matter accumulation of maize[J]. Journal of Maize Sciences, 2017, 25(1): 121-126. (in Chinese with English abstract) |
| [27] |
李合生.
现代植物生理学[M]. 北京: 高等教育出版社, 2006: 148.
Li H S. Modern Plant Physiology[M]. Beijing: Higher Education Press, 2006: 148. (in Chinese with English abstract) |
| [28] |
刘贤德, 马为民, 沈允钢. 植物光合机构的状态转换[J].
植物生理与分子生物学学报, 2006, 32(2): 127-132.
Liu X D, Ma W M, Shen Y G. State transition of the photosynthetic apparatus in plant[J]. Journal of Plant Physiology and Molecular Biology, 2006, 32(2): 127-132. (in Chinese with English abstract) |
| [29] |
颜昌宙, 曾阿妍, 金相灿, 等. 不同浓度铵氮对轮叶黑藻的生理影响[J].
生态学报, 2007, 27(3): 1050-1055.
Yan C Z, Zeng A Y, Jin X C, et al. Physiological effects of ammonia-nitrogen concentrations on Hydrilla verticillata[J]. Acta Ecologica Sinica, 2007, 27(3): 1050-1055. DOI: 10.3321/j.issn:1000-0933.2007.03.027 (in Chinese with English abstract) |
| [30] |
姜丹, 陈雅君, 刘丹, 等. 光氮互作对草地早熟禾碳氮代谢的影响[J].
中国草地, 2005, 27(6): 49-53.
Jiang D, Chen Y J, Liu D, et al. Effects of light condition and nitrogen supply on carbon-nitrogen metabolism of Poa pratensis L.[J]. Grassland of China, 2005, 27(6): 49-53. (in Chinese with English abstract) |




