文章信息
- 郑赛, 古芸, 曲峰龙, 陈雅玲, 余光辉, 冉炜, 沈其荣
- ZHENG Sai, GU Yun, QU Fenglong, CHEN Yaling, YU Guanghui, RAN Wei, SHEN Qirong
- 大豆粉和稻壳固液混合发酵产物的抗氧化特征
- Antioxidant activities of products from solid-liquid mixed fermentation of soybean meal and rice husk
- 南京农业大学学报, 2018, 41(5): 867-872
- Journal of Nanjing Agricultural University, 2018, 41(5): 867-872.
- http://dx.doi.org/10.7685/jnau.201801018
-
文章历史
- 收稿日期: 2018-01-15
脂肪类、油类和含脂食品在加热和长期贮存过程中会因氧化作用及被氧化过程中产生的过氧化物产物分解而发生变质,导致食品的营养价值和风味降低。因此,抑制食品氧化过程对食品生产和消费十分重要[1-3]。在食品中添加具有抗氧化功能的物质或抗氧化剂是当前食品、保健和饲料工业的重要研究课题[4]。与化学合成的抗氧化剂相比,天然抗氧化剂具有无毒、无污染、安全等优点,尤其受到生产者和消费者的青睐[5-7]。
一些芽胞杆菌属细菌如解淀粉芽胞杆菌(Bacillus amyloliquefaciens)的代谢产物以脂肽类表面活性剂为特征,应用前景十分广阔[8-9]。我们的前期研究表明,以农业副产物大豆粉和秸秆粉为基质时解淀粉芽胞杆菌XZ-173的固体发酵产物含有比较丰富的脂肽类表面活性剂成分,具有良好的油脂乳化和表面活性,能够抑制植物病原菌生长[10]。然而,当用不同提取方法提取时,这些发酵产物的性质变化尚不清楚。有研究表明,以大豆为原料的微生物发酵产物具有良好的抗氧化活性[11-13]。为拓宽发酵产物的应用潜力,本研究探索了2种提取方法获得的发酵产物在抗氧化性能方面的表现,为天然活性物质在食品、保健和饲料中的应用提供理论依据。
1 材料与方法 1.1 供试菌株发酵菌株解淀粉芽胞杆菌(Bacillus amyloliquefaciens)XZ-173和植物病原菌菌株茄科雷尔氏菌(Ralstonia solanacearum)QL-Rs1115由本实验室保存。
1.2 发酵产物的制备 1.2.1 发酵和发酵物预处理在固液混合体系中菌株XZ-173以大豆粉和稻壳为主的底物发酵而获得发酵产物。取1 L三角瓶,加入40 g大豆粉和20 g稻壳混合,添加500 mL去离子水、10 mL无机盐溶液、1.2 g酵母提取物和1.2 g葡萄糖,调节pH值至7.0,30 ℃、170 r·min-1发酵60 h,纱布过滤去除豆粉、稻壳等大颗粒物质,4 ℃、10 000 r·min-1条件下离心15 min,去除菌体,收集上清液。
1.2.2 发酵液粗提物(fermentation crude extract, FCE)取适量发酵液上清液,抽滤过0.22 μm滤膜,收集过滤液,调节pH值至7.0左右保存,冷冻干燥得FCE,备用。表面活性和抗菌性分析表明[10, 14],FCE为2.0 mg·mL-1时表面张力系数为6.23×10-2 N·m-1(测量室温26.3 ℃,水的表面张力系数为7.025×10-2 N·m-1),乳化活性达到7.2%左右,对病原菌QL-Rs1115的抑菌圈直径为16.3 mm。
1.2.3 表面活性剂粗品(surfactant crude product, SCP)取适量发酵上清液加入6 mol·L-1 HCl,调节pH至2.0左右,上清液产生白色絮状沉淀,4 ℃过夜保存,4 ℃、10 000 r·min-1离心20 min,收集沉淀,用pH2.0 HCl溶液洗涤3次,将沉淀溶于无菌水中,用1 mol·L-1 NaOH调节溶液pH至7.0,冷冻干燥得SCP,备用。表面活性和抗菌性分析表明,2.0 mg·mL-1 SCP溶液表面张力系数为4.29×10-2 N·m-1,乳化活性达到19%左右,对病原菌QL-Rs1115的抑菌圈直径为22.9 mm。
1.3 测定方法将FCE和SCP样品在25 ℃下用去离子水制备成不同质量浓度的样品溶液(0.2、0.4、0.6、0.8、1.0、1.5和2.0 mg·mL-1)进行以下试验。
1.3.1 1,1-二苯基-2-苦肼基(DPPH)自由基清除率取上述各质量浓度的2种样品溶液加入到0.2 mmol·L-1DPPH(溶于无水乙醇)溶液中,以无水乙醇为空白对照和调零,2,6-二叔丁基-4-甲基苯酚(BHT)溶液为对照,具体测定方法参照文献[15-16],每组样品重复3次。
1.3.2 2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS+)自由基清除能力ABTS+自由基离子的制备方法参照文献[17]。取上述各质量浓度的2种样品溶液100 μL,加入到3 mL制备好的ABTS+自由基溶液中,混合后充分振荡,室温反应6 min,734 nm波长下测定溶液吸光值,以去离子水代替样品作为空白对照并调零,每组样品重复3次。
1.3.3 还原能力根据将Fe3+络合物还原成Fe2+络合物的原理,还原能力的检测方法参照文献[18]。700 nm波长下分别测定FCE和SCP上述各质量浓度溶液的吸光值,以还原性谷胱甘肽作为对照,每组样品重复3次。
1.3.4 超氧阴离子自由基清除率使用还原辅酶Ⅰ-吩嗪硫酸甲脂-氮蓝四唑(NADH-PMS-NBT)体系测定超氧阴离子自由基清除率,方法参照文献[19]。取上述各质量浓度的2种样品溶液1.2 mL,依次加入300 μmol·L-1 NBT溶液0.9 mL、1 mmol·L-1 NADH溶液0.9 mL、120 μmol·L-1PMS溶液0.9 mL,用多功能酶标仪进行测定,每组样品重复3次。
1.3.5 羟基自由基清除率取5 mmol·L-1邻菲罗啉300 μL于试管中,依次加入磷酸盐缓冲液(PBS)(0.2 mol·L-1,pH7.4)200 μL和5 mmol·L-1硫酸亚铁300 μL,混合均匀后,加入上述各质量浓度的2种样品溶液1 mL和0.1% H2O2溶液200 μL,用多功能酶标仪测定羟基自由基清除率,每组样品重复3次[20]。
1.3.6 总抗氧化能力采用T-AOC试剂盒(南京建成生物工程研究所)测定总抗氧化能力,其原理为在酸性条件下抗氧化物质可以还原Fe3+-TPTZ(三吡啶基三嗪)产生蓝色的Fe2+-TPTZ,在593 nm处测定吸光值,计算出样品中的总抗氧化能力。
1.4 数据分析采用SPSS 22.0和Origin 8.5软件分析数据,Excel 2003软件进行t检验、方差分析和线性回归分析。
2 结果与分析 2.1 SCP和FCE的DPPH自由基清除能力由图 1可知:SCP和FCE均表现出良好的DPPH自由基清除能力。FCE和SCP对DPPH自由基的清除率随浓度的增加呈增加趋势。在FCE和SCP为2.0 mg·mL-1时,2种产物的清除率均达到了0.2 mg·mL-1 BHT标准物质的清除效果(43.44%),表明其均具有良好的DPPH自由基清除能力。FCE的清除效果呈良好的线性关系(R2=0.996 5,P < 0.001),而SCP在0.4~1.0 mg·mL-1的低质量浓度范围清除效果较好,而当质量浓度大于1.5 mg·mL-1时,SCP的清除效果较差,但亦呈线性关系(R2=0.951 8,P < 0.001)。

|
图 1 不同质量浓度SCP和FCE对DPPH自由基清除能力的影响 Figure 1 Effects of different concentrations of SCP and FCE on DPPH radical scavenging |
图 2表明:随浓度增加FCE的ABTS+自由基清除能力从4.48%上升到33.88%,具有比较良好的清除能力;SCP的清除能力由1.14%增加到10.29%,清除效果显著低于FCE。在相同质量浓度下FCE的清除能力显著高于SCP,2.0 mg·mL-1时FCE的清除能力约是SCP的3倍。FCE(R2=0.980 3,P < 0.001)和SCP(R2=0.977 1,P < 0.001)的清除效果均呈显著的线性关系,但FCE的斜率(b=16.649)远大于SCP的斜率(b=5.287),表明发酵物中属多肽类的SCP不是清除ABTS+自由基的主要成分。

|
图 2 不同质量浓度SCP和FCE对ABTS+自由基清除能力的影响 Figure 2 Effects of different concentrations of SCP and FCE on scavenging ability of ABTS+ cation radicals |
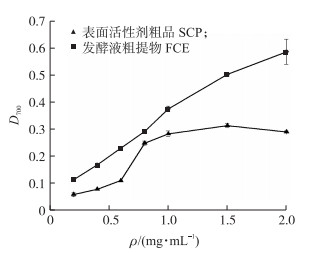
由图 3可见:FCE的还原能力显著高于SCP。随着SCP质量浓度的增加,D700明显上升,但在1.0~2.0 mg·mL-1时,D700呈平缓趋势,表明在1.0 mg·mL-1左右SCP的还原能力达到最大。FCE在0.2~2.0 mg·mL-1时,D700从0.11增加到0.58,与FCE质量浓度呈极显著的线性关系(R2=0.985 3,P < 0.001)。SCP的还原效果只在低质量浓度有所表现,在高质量浓度变化平缓,但仍然存在显著线性关系(R2=0.726 3,P < 0.05)。
|
图 3 不同质量浓度SCP和FCE的还原能力 Figure 3 Reducing power of different concentrations of SCP and FCE |
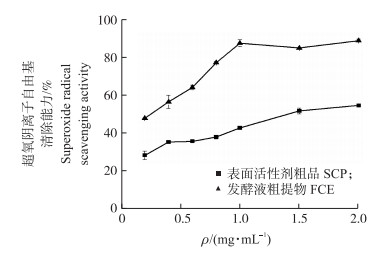
由图 4可见:SCP和FCE均具有良好的超氧阴离子自由基清除能力,其中FCE的清除能力较为显著。SCP随质量浓度的增加清除自由基的能力从28.1%升高到54.3%,清除能力提升了48%左右。FCE在0.2~1.0 mg·mL-1时清除能力从47.6%升高到87.1%,清除能力提高了45%左右,之后其清除能力没有较大的变化,在2.0 mg·mL-1时达到88.5%。1.0 mg·mL-1时SCP的清除能力达到42.49%,比FCE清除能力降低约1倍左右。FCE(R2=0.761 2,P=0.010 < 0.05)和SCP(R2=0.962 5,P < 0.001)的清除效果均呈显著的线性关系,但FCE的斜率(b=22.40)大于SCP的斜率(b=14.55),表明FCE含有更高效清除超氧阴离子自由基的功能团。
|
图 4 不同质量浓度SCP和FCE对超氧阴离子自由基清除的影响 Figure 4 Effects of different concentrations of SCP and FCE on superoxide radicals scavenging activity |
从图 5可以看出:当质量浓度为2.0 mg·mL-1时,SCP和FCE的羟基自由基清除能力分别达到25.79%和29.19%,均具有清除羟基自由基的能力。随着质量浓度的升高,清除能力均呈线性升高(FCE R2=0.938 3,P < 0.001;SCP R2=0.985 1,P < 0.001)。在相同质量浓度时,FCE清除能力显著强于SCP。

|
图 5 不同质量浓度SCP和FCE对羟自由基清除能力的影响 Figure 5 Effects of different concentrations of SCP and FCE on hydroxyl radical scavenging activity |
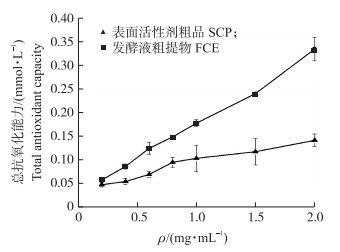
从图 6可知:FCE和SCP的总抗氧化能力(T-AOC)均随质量浓度升高而呈线性增强(FCE R2=0.995 3,P < 0.001;SCP R2=0.951 2,P < 0.001),但FCE的T-AOC显著强于SCP。0.2~2.0 mg·mL-1时SCP的总抗氧化能力从0.048升高到0.141 mmol·L-1;FCE的总抗氧化能力从0.058升高到0.333 mmol·L-1。在2.0 mg·mL-1时,FCE的T-AOC约为SCP的2.36倍。随着质量浓度的增加,FCE的抗氧化能力逐渐高于SCP的,并且差值在不断增大。
|
图 6 不同质量浓度SCP和FCE的总抗氧化能力(T-AOC) Figure 6 T-AOC at different concentrations of SCP and FCE |
本研究中,大豆粉和稻壳经过菌株XZ-173发酵后,产物FCE和SCP均不同程度表现出生物表面活性剂和多种自由基清除剂的功能,有潜力用作食物或饲料的添加剂。FCE具备非常良好的抗氧化能力,其清除超氧阴离子自由基及还原能力方面较显著。SCP在生防和吸附重金属方面具备比较良好的应用前景[10, 21]。
本研究发现,2种发酵产物都表现出了良好的DPPH自由基清除能力,在2.0 mg·mL-1时,分别达到41.94%和40.07%。刘文颖等[22]报道了玉米低聚肽质量浓度在1.9 mg·mL-1时对DPPH自由基的清除率达到50%左右,但李丹等[23]研究结果表明,玉米低聚肽质量浓度达到29.48 mg·mL-1时才有相同的DPPH自由基消除率。根据发酵产物具有臭味,猜测可能原因是大豆蛋白在经过混合发酵过程中产生了较多的还原性巯基,它是一种很重要的自由基清除剂[24]。质量浓度在2.0 mg·mL-1时,FCE的ABTS+自由基清除能力比SCP高约3倍,达到33.88%。Zhang等[25]利用花生发酵得到的抗氧化肽具有非常良好的清除ABTS+自由基的能力,在1.0 mg·mL-1时清除效果可以达到70.67%。另外,芽胞杆菌发酵过程中产生的含5~7个氨基酸的脂肽类物质,可能使SCP具有抗氧化活性[25],而大豆粉中含有的异黄酮如大豆黄酮和染料木黄酮等物质,可能是FCE比SCP具有更强自由基清除能力的原因[12]。研究表明,多肽在经过酶解后的抗氧化能力会明显增强,还原能力D700可以达到0.898[26]。本研究的发酵产物FCE和SCP均具有还原能力,但FCE显著优于SCP,可能是大豆粉在发酵过程中产生的还原酮增加了FCE的供氢能力。林为艺等[19]从铁皮石斛中提取到非多糖和多糖两类抗氧化产物,对超氧阴离子自由基有良好的清除效果,Yang等[12]研究发现大豆发酵原液也具有优异的超氧阴离子自由基清除效果。本研究中,低质量浓度FCE就具有非常高的超氧阴离子自由基的清除率(87.1%),优于已报道的相关物质[16, 19]。2种产物表现出良好的羟基自由基清除能力,并与质量浓度呈显著线性关系。刘文颖等[27]研究发现大豆低聚肽清除羟基自由基的能力在5.8 mg·mL-1时清除率达到50%左右,玉米低聚肽[22]则在5.4 mg·mL-1时达到此效果,在2.0 mg·mL-1时清除能力均不足20%。本研究没有测定质量浓度高于2.0 mg·mL-1时2种提取物的羟基自由基清除率,但质量浓度在2.0 mg·mL-1时清除率均高于上述已报道的大豆和玉米低聚肽。
本研究发现FCE的抗氧化能力要优于SCP。SCP还原能力较弱可能与构成脂肽的氨基酸残基种类少(主要为亮氨酸、谷氨酸和天冬氨酸等)有关[21, 28],而未经沉淀过程的FCE组成则可能更为复杂和含有更丰富的还原性物质,要弄清具体功能物质的结构和组成今后还需要进一步的分离、纯化及分析。
| [1] | Kumar Y, Yadav D N, Ahmad T, et al. Recent trends in the use of natural antioxidants for meat and meat products[J]. Comprehensive Reviews in Food Science and Food Safety, 2015, 14(6): 796-812. DOI: 10.1111/crf3.2015.14.issue-6 |
| [2] | Raikos V. Natural antioxidants for food applications:challenges and recent developments[J]. EC Nutrition, 2017, 8(2): 33-34. |
| [3] | Rashid F, Dhanapal K, Sravani K, et al. Potato and ginger peels:a potential new source of natural antioxidants[J]. Moj Food Process Technol, 2017, 4(5): 00103. |
| [4] | Byun H G, Lee J K, Park H G, et al. Antioxidant peptides isolated from the marine rotifer, Brachionus rotundiformis[J]. Process Biochemistry, 2009, 44(8): 842-846. DOI: 10.1016/j.procbio.2009.04.003 |
| [5] | Taghvaei M, Jafari S M. Application and stability of natural antioxidants in edible oils in order to substitute synthetic additives[J]. Journal of Food Science and Technology, 2015, 52(3): 1272-1282. DOI: 10.1007/s13197-013-1080-1 |
| [6] | Kapadiya D B, Bhumika K. Spices and herbs as a source of natural antioxidants for food[J]. International Journal of Current Microbiology and Applied Sciences, 2016, 5(7): 280-288. DOI: 10.20546/ijcmas |
| [7] | Imaida K, Fukushima S, Shirai T, et al. Promoting activities of butylated hydroxyanisole and butylated hydroxytoluene on 2-stage urinary bladder carcinogenesis and, inhibition of γ-glutamyl transpeptidase-positive foci development in the liver of rats[J]. Carcinogenesis, 1983, 4(7): 895-899. DOI: 10.1093/carcin/4.7.895 |
| [8] |
曹娟, 刘怡辰, 张振华, 等. 脂肽类生物表面活性剂产生菌的分离及特性研究[J].
环境科学学报, 2009, 29(10): 2056-2062.
Cao J, Liu Y C, Zhang Z H, et al. Isolation and characterization of lipopeptide biosurfactant producing microorganism Y8A[J]. Acta Scientiae Circumstantiae, 2009, 29(10): 2056-2062. DOI: 10.3321/j.issn:0253-2468.2009.10.006 (in Chinese with English abstract) |
| [9] | Raza W, Wang J, Wu Y, et al. Effects of volatile organic compounds produced by Bacillus amyloliquefaciens on the growth and virulence traits of tomato bacterial wilt pathogen Ralstonia solanacearum[J]. Appl Microbiol Biotechnol, 2016, 100(17): 7639-7650. DOI: 10.1007/s00253-016-7584-7 |
| [10] |
朱震, 余光辉, 冉炜, 等. 脂肽类生物表面活性剂液体发酵条件的响应面优化[J].
环境工程学报, 2012, 6(10): 3787-3794.
Zhu Z, Yu G H, Ran W, et al. Optimization of lipopeptide biosurfactant production from liquid-state fermentation using response surface methodology[J]. Chinese Journal of Environmental Engineering, 2012, 6(10): 3787-3794. (in Chinese with English abstract) |
| [11] | Xiao Y, Wang L, Rui X, et al. Enhancement of the antioxidant capacity of soy whey by fermentation with Lactobacillus plantarum B1-6[J]. Journal of Functional Foods, 2015, 12: 33-44. DOI: 10.1016/j.jff.2014.10.033 |
| [12] | Yang J H, Mau J L, Ko P T, et al. Antioxidant properties of fermented soybean broth[J]. Food Chemistry, 2000, 71(2): 249-254. DOI: 10.1016/S0308-8146(00)00165-5 |
| [13] | Zamindar N, Bashash M, Khorshidi F, et al. Antioxidant efficacy of soybean cake extracts in soy oil protection[J]. J Food Sci Technol, 2017, 54(7): 2077-2084. DOI: 10.1007/s13197-017-2646-0 |
| [14] |
殷代印, 姜婷婷. 低渗透油藏阴离子/非离子表面活性剂复配机理研究[J].
化学工程师, 2017, 31(6): 6-9.
Yin D Y, Jiang T T. Research on the mechanism of anionic/nonionic surfactants applied in low permeability reservoirs[J]. Chemical Engineer, 2017, 31(6): 6-9. (in Chinese with English abstract) |
| [15] | Turkoglu A, Duru M E, Mercan N, et al. Antioxidant and antimicrobial activities of Laetiporus sulphureus(Bull.)Murrill[J]. Food Chemistry, 2007, 101(1): 267-273. DOI: 10.1016/j.foodchem.2006.01.025 |
| [16] |
赵晓蕾, 田甜, 胡远亮, 等. 大米抗氧化肽的分离纯化及结构鉴定[J].
华中农业大学学报, 2017, 36(2): 102-107.
Zhao X L, Tian T, Hu Y L, et al. Isolation purification and characterization of antioxidant peptides from rice dreg[J]. Journal of Huazhong Agricultural University, 2017, 36(2): 102-107. (in Chinese with English abstract) |
| [17] | Thana P, Machmudah S, Goto M, et al. Response surface methodology to supercritical carbon dioxide extraction of astaxanthin from Haematococcus pluvialis[J]. Bioresource Technology, 2008, 99(8): 3110-3115. DOI: 10.1016/j.biortech.2007.05.062 |
| [18] | Kerasioti E, Stagos D, Priftis A, et al. Antioxidant effects of whey protein on muscle C2C12 cells[J]. Food Chemistry, 2014, 155(2): 271-278. |
| [19] |
林为艺, 颜美秋, 吕圭源, 等. 铁皮石斛茎非多糖与粗多糖体内外抗氧化活性的比较[J].
中药药理与临床, 2016(2): 138-141.
Lin W Y, Yan M Q, Lü G Y, et al. Antioxidant activity comparison between non-polysaccharides and crude polysaccharides from dendrobium officinale stems in vitro and in vivo[J]. Pharmacology and Clinics of Chinese Materia Medica, 2016(2): 138-141. (in Chinese with English abstract) |
| [20] |
章银良, 蔡亚玲, 李鑫. L-赖氨酸-D-阿拉伯糖美拉德反应产物自由基清除活性及其反应条件的优化[J].
轻工学报, 2017, 32(5): 1-7.
Zhang Y L, Cai Y L, Li X. Free radical scavenging activity and reaction conditions optimization of maillard reaction products derived from L-lysine-D-arabinose[J]. Journal of Light Industry, 2017, 32(5): 1-7. DOI: 10.3969/j.issn.2096-1553.2017.5.001 (in Chinese with English abstract) |
| [21] |
朱震, 张国漪, 冉炜, 等. 产脂肽菌株发酵生物有机肥的生物防治与促生作用研究[J].
土壤学报, 2012, 49(1): 104-110.
Zhu Z, Zhang G Q, Ran W, et al. Bio-control and growth-promoting effects of biomanure fermented by lipopeptide-producing bacteria[J]. Acta Pedolgica Sinica, 2012, 49(1): 104-110. (in Chinese with English abstract) |
| [22] |
刘文颖, 林峰, 金振涛, 等. 玉米低聚肽的体外抗氧化作用[J].
食品科学, 2011, 32(5): 22-26.
Liu W Y, Lin F, Jin Z T, et al. Antioxidant effect of corn oligopeptides in vitro[J]. Food Science, 2011, 32(5): 22-26. (in Chinese with English abstract) |
| [23] |
李丹, 李晓磊, 李荣和. 玉米和大豆短肽的自由基清除活性与还原力的对比研究[J].
食品工业科技, 2008, 29(8): 71-73.
Li D, Li X L, Li R H. Comparison study on free radical scavenging and reducing power of oligopeptides from soybean and corn[J]. Science and Technology of Food Industry, 2008, 29(8): 71-73. (in Chinese with English abstract) |
| [24] |
陈湘宁, 张艳艳, 范俊峰, 等. 大豆多肽的凝胶性及抗氧化性研究[J].
食品科学, 2005, 26(5): 71-75.
Chen X N, Zhang Y Y, Fan J F, et al. Gel-forming ability of pepsin-treated soy protein isolates[J]. Food Science, 2005, 26(5): 71-75. DOI: 10.3321/j.issn:1002-6630.2005.05.011 (in Chinese with English abstract) |
| [25] | Zhang Y W, Jie L, Xia L, et al. Isolation and identification of an antioxidant peptide prepared from fermented peanut meal using Bacillus subtilis fermentation[J]. International Journal of Food Properties, 2014, 17(6): 1237-1253. DOI: 10.1080/10942912.2012.675605 |
| [26] |
周婷婷, 李燕, 宋斐. 抗氧化大豆多肽制备的研究[J].
食品工业科技, 2010, 31(3): 281-284.
Zhou T T, Li Y, Song F. Study on preparation of soybean peptide swith antioxidant activity[J]. Science and Technology of Food Industry, 2010, 31(3): 281-284. DOI: 10.3969/j.issn.1673-9078.2010.03.017 (in Chinese with English abstract) |
| [27] |
刘文颖, 谷瑞增, 鲁军, 等. 大豆低聚肽的成分分析及体外抗氧化作用[J].
食品工业, 2015, 36(4): 200-203.
Liu W Y, Gu R Z, Lu J, et al. Composition analysis and antioxidant effects in vitro of aoy oligopeptides[J]. Food Industry, 2015, 36(4): 200-203. (in Chinese with English abstract) |
| [28] | Zou T B, He T P, Li H B, et al. The structure-activity relationship of the antioxidant peptides from natural proteins[J]. Molecules, 2016, 21(1): 72. DOI: 10.3390/molecules21010072 |




