文章信息
- 房加鹏, 张琳, 李茹, 陈国奇, 董立尧
- FANG Jiapeng, ZHANG Lin, LI Ru, CHEN Guoqi, DONG Liyao
- 稗HYYJ-1种群对五氟磺草胺的抗药性及其与细胞色素P450代谢的关系
- P450-mediated metabolism, related to the penoxsulam resistance in barnyard grass(Echinochloa crusgalli)
- 南京农业大学学报, 2018, 41(5): 854-859
- Journal of Nanjing Agricultural University, 2018, 41(5): 854-859.
- http://dx.doi.org/10.7685/jnau.201711036
-
文章历史
- 收稿日期: 2017-11-26
2. 上海青浦区农业技术推广服务中心, 上海 201700;
3. 徐淮地区淮阴农业科学研究院, 江苏 淮安 223001
2. Shanghai Qingpu District Agricultural Technology Extension Service Center, Shanghai 201700, China;
3. Xuhuai District Huaiyin Academy of Agricultural Sciences, Huai'an 223001, China
稗是我国水稻田危害最严重的恶性杂草,给水稻生产造成巨大损失。化学防除仍是防治稗的最重要手段,但稗易对化学除草剂产生抗药性。目前已经报道稗对乙酰乳酸合成酶(acetolactate synthase,ALS)抑制剂类的除草剂甲咪唑烟酸和甲氧咪草烟以及五氟磺草胺等产生了抗药性[1]。特别是五氟磺草胺,作为水稻田最重要的除草剂,稗对其抗性的报道越来越多,本实验室也报道了稗对五氟磺草胺产生了抗药性[2]。为更好防治抗五氟磺草胺稗,明确其抗性机制必不可少。
ALS抑制剂类的抗性机制分成2类:靶标抗性(target-site resistance,TSR)和非靶标抗性(non-target-site resistance,NTSR)[3]。目前关于杂草对ALS抑制剂的靶标抗性研究较多,抗性机制主要分为3方面:靶标酶基因突变、靶标酶活性改变以及靶标酶基因表达量上调。最为常见的是杂草ALS基因突变使除草剂与之结合时契合度下降,ALS与药剂的亲和力下降,ALS对除草剂变得不敏感。离体酶表现出更高的活性,杂草对除草剂表现出抗性,而ALS基因过量表达导致的抗性报道较少。
非靶标抗性主要涉及3种机制:减少除草剂的渗透和转运、提高除草剂的代谢以及增强抗氧化保护机制[4]。除草剂的渗透、转运减少是指抗性植株通过一系列反应减少除草剂到达作用靶标从而规避除草剂的伤害,但由于现在商用除草剂很注重药剂的渗透,使用促进润湿、展布、渗透作用的助剂,再加上同种杂草间茎叶表面理化性质差异不大,因此该种机制很难形成较高的抗性;增强抗氧化保护机制主要是指杂草通过提高过氧化物的表达使细胞减少除草剂带来的氧化破坏,为杂草代谢除草剂提供时间[4],这两种机制研究难度较大,报道较少。各种代谢酶导致的代谢抗性研究最深入,在增强除草剂抗性代谢方面发挥重要作用的3种酶类分别为芳香基酰基酰胺酶(aryl acylamidases)、谷胱甘肽硫转移酶(glutathione S-transferases,GST)和细胞色素P450酶系(cytochrome P450 monooxygenases,Cyt P450s)[5]。对ALS抑制剂除草剂来说,Cyt P450s参与的抗性报道较多。参与除草剂氧化代谢的是微粒体P450酶,通过氧化和羟基化增加除草剂的极性,减少除草剂在作用靶标的积累,导致对除草剂的抗性[6],例如野芥菜(Sinapis arvensis)对胺苯磺隆(ethametsulfuron-methyl)的抗性,日本看麦娘(Alopecurus japonicus)对啶磺草胺(pyroxsulam)的抗性等[7-8]。在稗属杂草中类似机制也有报道,水稗(Echinochloa phyllopogon)对双草醚等多种除草剂抗性是由P450家族某些基因发生突变或者基因表达量上调导致[9-10]。
1-氨基苯并三唑(1-aminobenzotriazole,ABT)、胡椒基丁醚(piperonyl butoxide,PBO)和马拉硫磷是3种常见细胞色素P450抑制剂,能够强烈抑制微粒体P450酶的活性,例如ABT能够抑制西玛津在黑麦草(Lolium rigidum)体内的代谢[11]以及绿麦隆和异丙隆在小麦植株体内代谢[12]。因此常用这3种抑制剂来检验细胞色素P450介导的代谢抗性的存在。
本文通过对ALS基因序列、ALS离体酶的活性、ALS基因的表达量等研究,旨在明确稗对五氟磺草胺抗性的靶标酶机制;再通过P450抑制剂参与下稗对五氟磺草胺的敏感性研究,确定细胞色素P450代谢与五氟磺草胺的抗药性是否有关。
1 材料与方法 1.1 供试材料植物材料:抗性种群HYYJ-1于2012年采自湖南省益阳市沅江市阳罗镇阳罗村,当年使用五氟磺草胺防治稗,效果不佳;敏感种群JLGY-3于2012年采自江苏省连云港市赣榆县青口镇盐场,该地未使用过除草剂。种子采集后于阴凉处自然风干,置于4 ℃冰箱待用,每年繁种以保持种子活力。
主要试剂:焦磷酸硫胺素(TPP,上海瑞永生物科技有限公司),黄素腺嘌呤二核苷酸钠盐(FAD,上海瑞永生物科技有限公司),乙偶姻(上海阿拉丁试剂有限公司),胡椒基丁醚(PBO,西亚试剂),1-氨基苯并三唑(ABT,日本Tokyo Chemical Industry),马拉硫磷原药(美国AccuStandard),RNA simple总RNA提取试剂盒(北京天根生化科技有限公司),Prime ScriptTM RT reagent Kit with gDNA Eraser for Perfect Real Time和SYBR® Premix Ex TaqTM Ⅱ(大连宝生物科技有限公司)。
1.2 P450抑制剂处理下稗HYYJ-1种群对五氟磺草胺敏感性的测定采用整株生物测定的方法[13]测定3种抑制剂参与下稗HYYJ-1种群对五氟磺草胺的敏感性。在9 cm×9 cm×10 cm的长方体塑料盆钵中装满营养土(有机肥与土的质量比为1 : 1),均匀播种20粒稗种子,置于温室中,白天约30 ℃,夜晚约22 ℃。待稗出苗整齐时,定苗至每盆12株。稗生长至3~4叶期时,根据预试验的结果,对2个种群进行药剂处理。P450抑制剂ABT、PBO和马拉硫磷处理剂量分别为70 μmol·L-1、4 200 g·hm-2和1 000 g·hm-2。1 h后喷施五氟磺草胺,抗性种群剂量分别为60、30、15、7.5、3.75、0 g·hm-2,敏感种群剂量分别为15、7.5、3.75、1.88、0.94、0 g·hm-2,同时以无抑制剂处理组为对照。处理后14 d,测定植株地上部鲜质量,计算各种群对五氟磺草胺的ED50值。试验重复2次,每处理4次重复。
1.3 HYYJ-1种群基因克隆及序列分析将稗按照1.2节方法培养至3~4叶期,抗性种群用30 g·hm-2五氟磺草胺进行药剂处理,敏感种群不处理。14 d后取抗性种群存活单株幼嫩组织,采用植物基因组DNA提取试剂盒提取稗基因组DNA。根据NCBI登录的水稗ALS基因序列(登录号AB636580.1),利用Primer Premier 5.0设计用于扩增稗ALS基因全长的引物(上游引物:3′-CAACAAAATGGGCAGGCCCA-5′,下游引物:3′-GCATAGCAGCGCTTATTACC-5′)。PCR体系包括:2.5 ng模板DNA,上、下游引物(10 μmol·L-1)各2 μL,25 μL 2×Taq Master Mix(诺唯赞生物科技有限公司,南京),蒸馏水补充至50 μL。PCR反应程序为:95 ℃ 4 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 90 s,35个循环;72 ℃ 10 min。PCR产物经过凝胶电泳鉴定,将目的条带用TaKaRa Mini BEST agarose gel DNA extraction kit进行回收,然后经连接、转化、克隆至pMD19-T vector。稗为六倍体植物,我们推测ALS基因具有多个拷贝。因此,每个种群选取5个单株DNA样本,每个DNA样本至少选取8个单克隆菌株。新鲜菌液PCR鉴定后送至南京金斯瑞生物科技有限公司进行双向测序并拼接。序列比对使用Bio Edit Sequence Alignment Editor 7.2.5软件进行,并使用NCBI数据库里的BLAST工具验证所得DNA片段是否为稗ALS基因。
1.4 HYYJ-1种群离体ALS活性测定采用测定粗酶液的方法测定不同稗种群离体ALS活性。根据Yu等[14]的方法略作修改。每个种群取3~4叶期叶片3 g于液氮中研磨成粉,加入4.5 mL酶提取液(pH7.5的100 mmol·L-1磷酸钾缓冲液中溶解10 mmol·L-1的丙酮酸钠、1 mmol·L-1氯化镁、1 mmol·L-1焦磷酸硫胺素、10 mmol·L-1黄素腺嘌呤二核苷酸)。过滤后,4 ℃下27 000 g离心20 min,然后于1.5 mL离心管中进行暗反应,每100 μL粗酶液分别加入200 μL酶反应液(pH7.5的100 mmol·L-1磷酸钾缓冲液中溶解200 mmol·L-1的丙酮酸钠、20 mmol·L-1氯化镁、2 mmol·L-1焦磷酸硫胺素、20 mmol·L-1黄素腺嘌呤二核苷酸)和各浓度的100 μL ALS抑制剂(五氟磺草胺原药配制成0.005、0.05、0.5、5和50 μmol·L-1)于37 ℃下反应1 h。再加入新配制的肌酸溶液(0.55 g无水肌酸溶于100 mL纯水)和α-萘酚(5 g α-萘酚溶于100 mL浓度为5 mol·L-1的氢氧化钠溶液)各190 μL,60 ℃反应30 min。冷却后低速离心,每处理取200 μL上清液于96孔酶标板中,测定530 nm下吸光值(A530)。标准曲线用乙偶姻梯度稀释制作,据此将酶活性换算为乙偶姻生成量,并计算各种群抑制中浓度(IC50)。试验重复2次,每个药剂处理3个重复。
1.5 HYYJ-1种群ALS基因表达量研究按1.2节方法培养稗,根据试剂盒说明书提取RNA, 反转录生成cDNA。以稗ALS全长基因为模板设计荧光定量PCR引物(上游引物:3′-CCCAGTGAAGGTCTTTGTGC-5′,下游引物:3′-CCTGGAGTCTCGAGCATCTT-5′),以肌动蛋白β-actin基因(上游引物:3′-CACACTGGTGTCATGGTAGG-5′,下游引物:3′-AGAAAGTGTGATGCCAGAT-5′)为内参基因,使用7500实时荧光定量PCR仪(Applied Biosystems)进行荧光PCR。相对定量参照基因的ΔCT法计算:ΔCT=CT目的基因-CT内参基因,表达差异等于2-ΔΔCT。技术重复和生物学重复各2次。
1.6 数据处理试验原始数据经ANOVA分析发现2次重复试验间无显著差异,采用Sigma Plot 10.0软件计算各处理的ED50和IC50值。试验数据采用Log-Logistic模型进行分析[15],拟合方程如下:
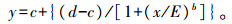
|
式中:y为处理相对于对照的百分比;c为抑制率的下限;d为抑制率的上限;b为斜率;x为除草剂剂量;E为ED50或IC50值。相对抗性倍数(resistance indexes,RIs)=抗性稗种群的ED50(或IC50)/敏感稗种群ED50(或IC50)。
2 结果与分析 2.1 P450抑制剂对抗五氟磺草胺稗HYYJ-1种群敏感性的影响通过计算,抗性种群HYYJ-1对五氟磺草胺的ED50值为27.16 g·hm-2,接近田间推荐剂量30 g·hm-2,敏感种群JLGY-3则为2.68 g·hm-2,远低于田间推荐剂量,相对抗性倍数达到了10.13,说明HYYJ-1对五氟磺草胺产生较高的抗性(表 1);但在ABT、PBO和马拉硫磷的处理下,抗性种群的ED50值显著变小,相对抗性倍数分别为3.03、1.62和1.46。据此推测,抗性种群HYYJ-1存在P450介导的代谢抗性。
| 处理 Treatment |
各种群抑制中剂量/(g·hm-2)ED50 of tested populations | 相对抗性倍数 Resistance indexes |
|
| HYYJ-1 | JLGY-3 | ||
| 五氟磺草胺Penoxsulam | 27.16±4.63a | 2.68±0.57a | 10.13 |
| ABT+五氟磺草胺ABT+penoxsulam | 6.06±0.56b | 2.00±0.26a | 3.03 |
| PBO+五氟磺草胺PBO+penoxsulam | 3.44±0.47b | 2.12±0.14a | 1.62 |
| 马拉硫磷+五氟磺草胺Malathion+penoxsulam | 3.23±0.69b | 2.21±0.75a | 1.46 |
| 注:同一种群数据上标不同小写字母表示在不同处理下ED50值差异显著(P < 0.05)。ABT:1-氨基苯并三唑;PBO:胡椒基丁醚。 Note:Different uppercase letters in the data indicate that the ED50 values of the same population are significantly different under different treatments(P < 0.05). ABT:1-aminobenzotriazole;PBO:Piperonyl butoxide. |
|||
稗为六倍体植物,我们推测ALS基因具有多个拷贝,因此将ALS基因进行亚克隆得到序列的准确信息。将获得的基因序列进行BLAST,发现与已知水稗ALS序列AB636580.1的碱基相似度均在97%以上,说明所得序列为稗的ALS全长序列。抗性种群和敏感种群的片段长度均为2 341 bp,编码643个氨基酸。通过氨基酸序列比对,发现2个种群在3个位点均存在单核苷酸多态性(single nucleotide polymorphisms,SNP)(表 2),说明2个种群均存在2个拷贝,但并没有发现能导致抗性的氨基酸突变(图 1),说明抗性种群对五氟磺草胺的抗药性并不是由靶标酶氨基酸突变引起的。
| 基因名称 Gene name |
235位235 position | 318位318 position | 441位441 position | |||||
| 密码子Codon | 氨基酸Amino acid | 密码子Codon | 氨基酸Amino acid | 密码子Codon | 氨基酸Amino acid | |||
| JLGY-3 ALS1;2 | ATA | Met | CGC | Arg | CAA | Gln | ||
| JLGY-3 ALS2;2 | GTG | Val | TGC | Cys | CAC | His | ||
| HYYJ-1 ALS1;2 | ATA | Met | CGC | Arg | CAA | Gln | ||
| HYYJ-1 ALS2;2 | GTG | Val | TGC | Cys | CAC | His | ||
|
图 1 HYYJ-1和JLGY-3种群ALS氨基酸比对示意图 Figure 1 Comparison of ALS amino acid sequences in the HYYJ-1 and JLGY-3 population 氨基酸位点以拟南芥ALS为标准。A-D分别为JLGY-3 ALS1;2、JLGY-3 ALS2;2、HYYJ-1 ALS1;2和HYYJ-1 ALS2;2基因的氨基酸序列。方框内为8个导致抗性的ALS氨基酸位点;红色椭圆框为具有SNP的位点。 Amino acid positions are numbered relative to the ALS of A.thaliana. A-D represent the amino acid of JLGY-3 ALS1; 2, JLGY-3 ALS2;2, HYYJ-1 ALS1; 2 and HYYJ-1 ALS2; 2, respectively. Boxed codons indicate the eight known positions of ALS that confer resistance; the red ovals indicate the sites with SNPs. |
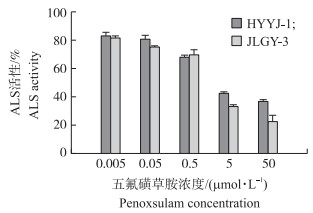
从图 2可以看出:在五氟磺草胺处理下,抗性和敏感种群ALS活性变化表现出相同趋势,但差异并不显著,只是敏感种群的活性在高剂量处理下被抑制较明显。通过计算,HYYJ-1种群和JLGY-3种群的IC50值分别为4.53和1.85 μmol·L-1,差异不明显,相对抗性倍数为2.49,远低于用ED50值计算出的相对抗性倍数(10.13)。因此靶标酶活性的差异并不能完全解释抗性种群对五氟磺草胺产生10倍以上的抗性,说明这种差异在HYYJ-1种群对五氟磺草胺的抗药性上不起主导作用。
|
图 2 五氟磺草胺处理下抗性和敏感种群的离体ALS活性 Figure 2 In vitro ALS activity of the resistant and sensitive populations treated by penoxsulam |
由图 3可以看出:2个种群的ALS基因表达量先上调后下降,在处理3 d达到最大值,抗性种群HYYJ-1为对照的4.01倍,敏感种群JLGY-3为对照的5.31倍,这种差异可能是由于种群间的差异造成的。因此,ALS基因表达量差异不是HYYJ-1种群对五氟磺草胺产生抗性的原因。

|
图 3 五氟磺草胺处理后HYYJ-1和JLGY-3种群ALS基因的相对表达量 Figure 3 The expression level of ALS in HYYJ-1 and JLGY-3 population with the treatment of penoxsulam 不同字母表示不同处理时间下同一种群的表达量在0.05水平差异显著;星号表示同一处理时间下2个种群之间的表达量在0.05水平差异显著。 The different letters indicate significant difference at 0.05 level between the same population at different time after treated, and the asterisks indicate significant differences at 0.05 level between the two populations at the same time after treated. |
ALS基因发生突变是杂草对ALS抑制剂抗性产生的最主要原因[16],能够导致杂草对ALS抑制剂产生抗性的氨基酸位点有8个,分别为122位丙氨酸(Ala 122)、197位脯氨酸(Pro 197)、205位丙氨酸(Ala 205)、376位天冬氨酸(Asp 376)、377位精氨酸(Arg 377)、574位色氨酸(Trp 574)、653位丝氨酸(Ser 653)和654位甘氨酸(Gly 654)[16]。在稗属杂草中,已经有报道122位丙氨酸、574位色氨酸和653位丝氨酸发生氨基酸替换,导致稗对ALS抑制剂产生了抗药性[17-20],但以上研究中都没有通过克隆明确ALS基因的拷贝数。因为每一个拷贝都可能携带突变基因并得到表达,从而使杂草表现出抗性[21],这也给寻找多倍体杂草靶标酶基因突变增加了难度。本研究通过扩增稗ALS全长基因并克隆,明确了HYYJ-1抗性种群和敏感种群各有2个拷贝,虽然没有发现能导致抗性的氨基酸突变,但为研究多倍体杂草抗性提供了思路,即需要明确每一个拷贝的基因序列才可说明是否发生了基因突变,从而解释清楚对相应除草剂的抗药性机制。
通常来说,ALS基因发生氨基酸的替换,导致其构象改变或者与ALS抑制剂的结合能力降低,使杂草对ALS抑制剂不敏感,从整株生物测定上表现出对ALS抑制剂产生抗性,从酶活性上来看抗性种群表现出较高的活性。本研究中抗性种群和敏感种群的ALS离体活性差异不大,与ALS基因序列研究呼应。同时本研究还发现ALS基因表达量差异不大且敏感种群的表达量高于抗性种群,可能是由于2个种群间的差异造成的,说明ALS基因表达量变化不是抗性机制。综上所述,抗性种群HYYJ-1对五氟磺草胺产生抗药性并不是靶标酶机制引起的。
非靶标抗性一般可以分为3种机制,其中主要以细胞色素P450介导的代谢抗性机制研究较深入。因此本研究在明确了靶标酶机制并不是HYYJ-1种群对五氟磺草胺产生高水平抗性的原因之后,考虑细胞色素P450是否参与了抗性的产生。研究结果表明:在P450抑制剂的参与下,抗性种群HYYJ-1对五氟磺草胺的ED50值明显下降,对五氟磺草胺的敏感性显著提高,即抗性稗体内P450代谢五氟磺草胺的过程被抑制之后,稗对五氟磺草胺更加敏感,而敏感种群对五氟磺草胺的敏感性变化很小。这是因为在接触到除草剂以后,杂草体内的某些细胞色素P450基因的表达量诱导性上调或者在除草剂持续胁迫下发生基因突变,引起一系列生理生化反应,减少除草剂的伤害,能够存活下来的即为抗性植株,而本研究所用的敏感种群从未使用过除草剂,这种代谢机制并未表现出来,故敏感种群在施用P450抑制剂后,对五氟磺草胺的敏感性变化很小。综上所述,我们推测细胞色素P450介导的代谢抗性可能是抗性种群HYYJ-1对五氟磺草胺产生抗性的重要机制。但由于稗体内细胞色素P450基因数量多达几百个,哪些基因起作用及作用方式仍需进一步试验确定。
| [1] | Heap I. The International Survey of Herbicide Resistant Weeds[EB/OL].[2017-11-02]. http://www.weedscience.org. |
| [2] | Chen G Q, Wang Q, Yao Z W, et al. Penoxsulam-resistant barnyardgrass(Echinochloa crus-galli)in rice fields in China[J]. Weed Biology and Management, 2016, 16(1): 16-23. DOI: 10.1111/wbm.2016.16.issue-1 |
| [3] | Powles S B, Yu Q. Evolution in action:plants resistant to herbicides[J]. Annu Rev Plant Biol, 2010, 61: 317-347. DOI: 10.1146/annurev-arplant-042809-112119 |
| [4] | Delye C. Unravelling the genetic bases of non-target-site-based resistance(NTSR)to herbicides:a major challenge for weed science in the forthcoming decade[J]. Pest Management Science, 2013, 69(2): 176-187. DOI: 10.1002/ps.2013.69.issue-2 |
| [5] | Preston C. Herbicide resistance in weeds endowed by enhanced detoxification:complications for management[J]. Weed Science, 2004, 52(3): 448-453. DOI: 10.1614/P2002-168B |
| [6] |
孙兰兰.安全剂对玉米烟嘧磺隆药害的缓解作用及其机制研究[D].沈阳: 沈阳农业大学, 2017.
Sun L L. The mechanism of isoxadifen-ethyl induced maize resistance to nicosulfuron[D]. Shenyang: Shenyang Agricultural University, 2017(in Chinese with English abstract). |
| [7] | Veldhuis L J, Hall L M, O'Donovan J T, et al. Metabolism-based resistance of a wild mustard(Sinapis arvensis L.)biotype to ethametsulfuron-methyl[J]. Journal of Agricultural and Food Chemistry, 2000, 48(7): 2986-2990. DOI: 10.1021/jf990752g |
| [8] | Feng Y, Gao Y, Zhang Y, et al. Mechanisms of resistance to pyroxsulam and ACCase inhibitors in Japanese foxtail(Alopecurus japonicus)[J]. Weed Science, 2017, 64(4): 695-704. |
| [9] | Iwakami S, Endo M, Saika H, et al. Cytochrome P450CYP81A12 and CYP81A21 are associated with resistance to two acetolactate synthase inhibitors in Echinochloa phyllopogon[J]. Plant Physiology, 2014, 165(2): 618-629. DOI: 10.1104/pp.113.232843 |
| [10] | Iwakami S, Uchino A, Kataoka Y, et al. Cytochrome P450 genes induced by bispyribac-sodium treatment in amultiple-herbicide-resistant biotype of Echinochloa phyllopogon[J]. Pest Management Science, 2014, 70(4): 549-558. DOI: 10.1002/ps.2014.70.issue-4 |
| [11] | Burnet M W M, Loveys B R, Holtum J A M, et al. Increased detoxification is a mechanism of simazine resistance in Lolium rigidum[J]. Pesticide Biochemistry and Physiology, 1993, 46(3): 207-218. DOI: 10.1006/pest.1993.1052 |
| [12] | Cabanne F, Huby D, Gaillardon P, et al. Effect of the cytochrome P-450 inactivator 1-aminobenzotriazole on the metabolism of chlortoluron andisoproturon in wheat[J]. Pesticide Biochemistry and Physiology, 1987, 28(3): 371-380. DOI: 10.1016/0048-3575(87)90133-7 |
| [13] |
王红春.早熟禾(Poa annua L.)生物学生态学特性及对精(口恶)唑禾草灵耐药性的研究[D].南京: 南京农业大学, 2009: 115-117.
Wang H C.Study on the biology and ecology of annual bluegrass(Poa annua L.)and mechanisms of tolerance to fenoxaprop-p-ethyl[D]. Nanjing: Nanjing Agricultural University, 2009: 115-117(in Chinese with English abstract). |
| [14] | Yu Q, Friesen L J S, Zhang X Q, et al. Tolerance to acetolactate synthase and acetyl-coenzyme a carboxylase inhibiting herbicides in Vulpia bromoides is conferred by two co-existing resistance mechanisms[J]. Pesticide Biochemistry and Physiology, 2004, 78(1): 21-30. DOI: 10.1016/j.pestbp.2003.07.004 |
| [15] | Seefeldt S S, Jensen J E, Fuerst E P. Log-logistic analysis of herbicide dose-response relationships[J]. Weed Technology, 1995, 9(2): 218-227. DOI: 10.1017/S0890037X00023253 |
| [16] | Yu Q, Powles S B. Resistance to AHAS inhibitor herbicides:current understanding[J]. Pest Management Science, 2014, 70(9): 1340-1350. DOI: 10.1002/ps.2014.70.issue-9 |
| [17] | Riar D S, Norsworthy J K, Srivastava V, et al. Physiological and molecular basis of acetolactate synthase-inhibiting herbicide resistance in barnyardgrass(Echinochloa crus-galli)[J]. J Agric Food Chem, 2013, 61(2): 278-289. DOI: 10.1021/jf304675j |
| [18] | Panozzo S, Scarabel L, Tranel P J, et al. Target-site resistance to ALS inhibitors in the polyploid species Echinochloa crus-galli[J]. Pesticide Biochemistry and Physiology, 2013, 105(2): 93-101. DOI: 10.1016/j.pestbp.2012.12.003 |
| [19] | Kaloumenos N S, Chatzilazaridou S L, Mylona P V, et al. Target-site mutation associated with cross-resistance to ALS-inhibiting herbicides in late watergrass(Echinochloa oryzicola Vasing.)[J]. Pest Management Science, 2013, 69(7): 865-873. DOI: 10.1002/ps.2013.69.issue-7 |
| [20] | Matzenbacher F O, Bortoly E D, Kalsing A, et al. Distribution and analysis of the mechanisms of resistance of barnyardgrass(Echinochloa crus-galli)to imidazolinone and quinclorac herbicides[J]. Journal of Agricultural Science, 2015, 153(6): 1044-1058. DOI: 10.1017/S0021859614000768 |
| [21] | Yu Q, Ahmad-Hamdani M S, Han H, et al. Herbicide resistance-endowing ACCase gene mutations in hexaploid wild oat(Avena fatua):insights into resistance evolution in a hexaploid species[J]. Heredity, 2013, 110(3): 220-231. DOI: 10.1038/hdy.2012.69 |




