文章信息
- 戴均涛, 张慎璞, 王暄, 丁修恒, 李红梅
- DAI Juntao, ZHANG Shenpu, WANG Xuan, DING Xiuheng, LI Hongmei
- 3种检测番茄抗根结线虫Mi基因分子标记法的比较
- Comparison of three molecular markers for detecting Mi gene of resistance to root-knot nematode in tomato cultivars
- 南京农业大学学报, 2018, 41(5): 848-853
- Journal of Nanjing Agricultural University, 2018, 41(5): 848-853.
- http://dx.doi.org/10.7685/jnau.201712027
-
文章历史
- 收稿日期: 2017-12-21
2. 河南农业职业学院, 河南 郑州 451450
2. Henan Vocational College of Agriculture, Zhengzhou 451450, China
根结线虫(Meloidogyne spp.)是威胁世界农业生产的一类植物病原线虫,每年造成全球农作物高达千亿美元的经济损失[1]。目前已报道近百种根结线虫种,能够寄生的植物种类超过3 000种,最常见的种类是南方根结线虫(M.incognita)、爪哇根结线虫(M. javanica)、花生根结线虫(M.arenaria)和北方根结线虫(M.hapla)[2]。根结线虫的防治主要采用化学防治、生物防治、农业措施以及种植抗性品种等策略[3],考虑到化学杀线虫剂残留对环境的影响,生物防治的效率和成本以及农业措施的局限性等多方面的因素,种植抗性品种是目前防治根结线虫最为经济有效的措施。
目前已报道的根结线虫抗性基因非常有限[4],用于商业化生产的更是寥寥无几,其中应用最成功的是Mi基因,该基因来自于野生秘鲁番茄(Lycopersicon peruvianum),通过种间杂交和胚胎挽救技术转入栽培品种[5]。Mi基因对南方根结线虫、爪哇根结线虫和花生根结线虫均具有较强的抗性,是番茄抗根结线虫遗传育种的主要选育靶标。鉴定番茄品种中Mi基因介导的根结线虫抗性,通常利用人工接种线虫于番茄根部来测定其侵染和繁殖的能力,然而这种方法需要培育番茄苗、接种线虫以及统计根结和雌虫数量,过程复杂, 周期长, 费时费力,极大地延长了番茄遗传育种的周期。因此, 近50年来,为了提高抗线虫材料分离鉴定的效率,利用各种不同的分子标记检测Mi基因的研究相继报道。最早开发的同工酶标记Aps-1,后被证实该位点易发生遗传重组且与Mi基因连锁不稳定[6]。Williamson等[7]开发出了基于酶切扩增多态性序列(cleaved amplified polymorphic sequences,CAPS)检测Mi基因的方法,即利用引物对REXF1/REXR2扩增与Mi基因紧密连锁的REX-1位点,结合TaqⅠ酶切图谱分析Mi基因型;El Mehrach等[8]设计了引物组合PM3Fb/PM3Rb与PMiF3/PMiR3可分别扩增Mi基因3′端的一段序列以及启动子的部分区域;Devran等[9]和Garcia等[10]利用1对共显性序列特征扩增区(sequence characterized amplified regions,SCAR)引物对Mi23F/Mi23R能够特异性扩增番茄品种Mi基因下游的一段序列。
尽管分子标记在Mi基因抗性材料的检测鉴定中具有一定的优势,但是也有报道证实其存在不足,例如,基于REX-1位点的CAPS标记对特定的番茄材料易出现假阳性[11]。为了评估上述CAPS、引物对组合和SCAR标记这3种方法检测Mi基因番茄材料的准确性,本研究以收集自国内外的16个番茄品种为研究对象,利用这3种分子标记法检测番茄品种中的Mi基因及其基因型,并结合人工接种根结线虫抗性测定结果,评价3种方法检测Mi基因的准确性,旨在为今后Mi抗性番茄的遗传育种提供技术指导。
1 材料与方法 1.1 供试材料供试南方根结线虫群体采自江苏省淮安市丁集镇黄瓜根部,经单卵块纯化及种类鉴定后,将该群体接种于感病番茄品种‘合作903’,置于25 ℃日光温室扩繁,收集根结线虫的卵块并孵化2龄幼虫[12],制备2龄幼虫悬浮液用于番茄苗接种。
‘牟番1号’‘双抗38’‘双抗228’‘双抗265’‘线虫绝3号’和‘线虫绝39号’6个番茄品种由河南农业职业学院选育;‘苏红2003’‘苏粉8号’‘红金宝’‘夏钻石’‘一串红’‘世纪粉冠王’‘合作903’和‘仙客1号’8个品种购自江苏省农业科学院;‘Sparta’和‘VFN’由比利时国家农业渔业研究所(ILVO)Nancy de Sutter女士惠赠。
1.2 番茄品种的Mi基因检测参照Williamson等[7]用CTAB法提取各番茄种子的DNA,获得的DNA样品直接用于PCR扩增或置于-20 ℃冰箱中备用。
用4对引物REXF1/REXR2、PM3Fb/PM3Rb、PMiF3/PMiR3和Mi23F/Mi23R(表 1)分别扩增各番茄品种的DNA。PCR反应体系为:2×Ex Taq Mix 25 μL,5 μmol · L-1引物各1 μL,模板DNA 1 μL,加水补足至50 μL。反应程序为:94 ℃ 4 min;94 ℃ 1 min,退火温度52~56 ℃(表 1),72 ℃ 1 min,35个循环;72 ℃ 10 min。扩增产物于4 ℃保存。其中,REXF1/REXR2扩增产物经切胶回收、纯化后,用TaqⅠ酶进行酶切。酶切反应体系为:纯化后产物15 μL,TaqⅠ酶(2 000 U)1 μL,10×Buffer 2 μL,0.1%BSA 2 μL。以上所有扩增产物或酶切产物,均于20 g · L-1琼脂糖凝胶电泳30 min(电压100 V),用EB染色后在凝胶成像系统拍照保存。
| 引物名称 Primer name |
序列(5′→3′) Primer sequences(5′→3′) |
产物大小/bp Size of product |
退火温度/℃ Annealing temperature |
| REXF1/REXR2 [7] | TCGGAGCCTTGGTCTGAATT/GGCAGAGATGATTCGTGAGA | 740 | 55 |
| PM3Fb/PM3Rb [8] | CACACATGAGGTATGTTCGTATTATGG/TCACAGCCTAGCTTTTGAATCAGTACC | 500 | 54 |
| PMiF3/PMiR3 [8] | GGTATGAGCATGCTTAATCAGAGCTCTC/CCTACAAGAAATTATTGTGCGTGTGAATG | 550/350 | 56 |
| Mi23F/Mi23R [10] | TGGAAAAATGTTGAATTTCTTTTG/GCATACTATATGGCTTGTTTACCC | 430/380 | 52 |
供试番茄种子于5.32×10-5 mol · L-1NaClO消毒3 min,用灭菌水冲洗3次后,置于无菌培养皿中,在25 ℃光照培养箱中催芽[13];待胚根长至0.5 cm时,将发芽的种子播种于装有消毒土(土、细沙、营养土的体积比为5 : 4 : 1)的塑料杯(直径7 cm,高度12 cm)中,在25 ℃温室培育。待番茄幼苗长至6叶期时,用于根结线虫的接种。
接种线虫时,在距离番茄根部2 cm处打4~6 cm深的孔,每株番茄根围接种2龄幼虫250条,每个品种番茄各接种5株。将接种后的番茄幼苗置于20~25 ℃温室,正常光照,定期浇施营养液。6周后,拔出番茄植株并洗净根部,统计根系上的根结数量并计算根结指数[14]。试验所得数据用DPS 7.5软件进行分析。
番茄抗根结线虫的评价分级标准,参照王新荣等[15]的方法,即根据番茄形成根结的根数占整个根系的百分比(根结率),将番茄抗根结线虫等级分为6个级别:0级免疫(Ⅰ,根结率为0),1级高抗(HR,根结率为1%~5%),2级抗病(R,根结率为6%~25%),3级感病(S,根结率为26%~50%),4级中度感病(MS,根结率为51%~80%),5级高度感病(HS,根结率>81%)。根结指数的计算公式为:根结指数=∑(各级病株数×各级代表值)×100/(调查总株数×最高严重度代表值)。
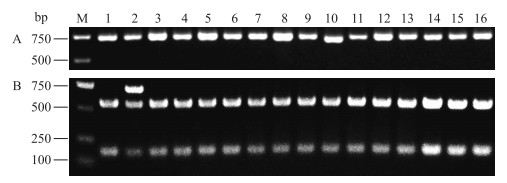
2 结果与分析 2.1 不同分子标记方法检测番茄品种的Mi基因 2.1.1 CAPS法检测Mi基因采用引物REXF1/REXR2扩增各番茄品种基因组DNA的REX-1位点,结果显示:所有供试番茄品种都能扩增出1条约740 bp的特异条带(图 1-A),用TaqⅠ进一步酶切后,显示只有‘线虫绝39号’的REX-1产物酶切后产生了740、560和180 bp共3条特异性条带,表现为Mi/mi杂合基因型,而其他15个番茄品种的扩增产物经酶切后均产生560和180 bp的2条特异性条带,即表现为Mi/Mi纯合基因型(图 1-B,表 2)。
|
图 1 16个番茄品种REX-1位点的PCR扩增(A)以及TaqⅠ酶切(B)图谱 Figure 1 PCR products of REX-1 locus(A)amplified from 16 tomato cultivars and restriction fragments digested by TaqⅠ(B) M. DL2000 marker;1. VFN;2.线虫绝39号;3.线虫绝3号;4.双抗265;5.双抗228;6.双抗38;7.牟番1号;8. Sparta;9.仙客1号;10.合作903;11.苏粉8号;12.苏红2003;13.世纪粉冠王;14.一串红;15.夏钻石;16.红金宝。下同。 M. DL2000 marker; 1. VFN; 2. Xianchongjue 39;3. Xianchongjue 3;4. Shuangkang 265;5. Shuangkang 228;6. Shuangkang 38;7. Moufan 1;8. Sparta; 9. Xianke 1;10. Hezuo 903;11. Sufen 8;12. Suhong 2003;13. Shijifenguanwang; 14. Yichuanhong; 15. Xiazuanshi; 16. Hongjinbao. The same as follows. |
| 品种 Cultivars |
基因型 Genotype |
分子标记检测 Molecular marker test |
人工接种测定 Artificial inoculation |
|||||
| 酶切扩增多态性序列 CAPS |
引物对组合 Primer pairscombination |
序列特征扩增区 SCAR |
根结率/% Root knotrate |
根结指数 Root knotindex |
抗性评价 Resistanceevaluation |
|||
| 1 | Mi/Mi | HO | HO | HO | 0 | 0 | I | |
| 2 | Mi/Mi | HE | -- | HO | 4.18±2.16 | 28 | HR | |
| 3 | Mi/Mi | HO | HE | HE | 0 | 0 | I | |
| 4 | Mi/Mi | HO | HO | HE | 5.71±2.69 | 28 | R | |
| 5 | Mi/Mi | HO | HO | HE | 1.34±0.06 | 8 | HR | |
| 6 | Mi/Mi | HO | HE | HE | 38.94±4.07 | 60 | S | |
| 7 | Mi/Mi | HO | HE | HE | 5.31±1.29 | 32 | R | |
| 8 | Mi/Mi | HO | HE | HE | 1.62±0.74 | 20 | HR | |
| 9 | Mi/Mi | HO | HE | HE | 1.67±0.75 | 20 | HR | |
| 10 | mi/mi | HO | — | — | 46.18±5.67 | 64 | S | |
| 11 | mi/mi | HO | — | — | 53.86±7.10 | 76 | MS | |
| 12 | mi/mi | HO | — | — | 60.35±13.79 | 80 | MS | |
| 13 | mi/mi | HO | — | — | 55.68±9.43 | 72 | MS | |
| 14 | mi/mi | HO | — | — | 80.14±9.05 | 84 | HS | |
| 15 | mi/mi | HO | — | — | 67.31±7.87 | 80 | MS | |
| 16 | mi/mi | HO | — | — | 63.31±3.03 | 80 | MS | |
| 注:Mi/Mi:纯合型;Mi/mi:杂合型;mi/mi:不含Mi基因;HO:纯合型;HE:杂合型;--:基因型未知;—:未检测到Mi基因;Ⅰ:免疫;HR:高抗;R:抗病;S:感病;MS:中度感病;HS:高度感病。 Note:Mi/Mi:Homozygous genotype;Mi/mi:Heterozygous genotype;mi/mi:Without Mi gene;HO:Homozygous genotype;HE:Heterozygous genotype;--:Genotype unknown;—:Mi gene undetected;Ⅰ:Immune;HR:High resistant;R:Resistant;S:Susceptible;MS:Medium susceptible;HS:High susceptible. |
||||||||
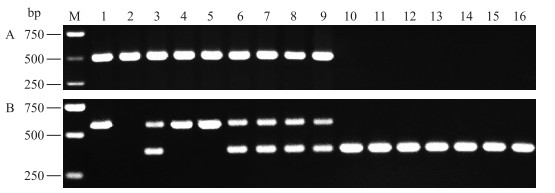
用引物对PM3Fb/PM3Rb扩增16个番茄品种的基因组DNA,结果显示:‘VFN’‘线虫绝39号’‘仙客1号’‘双抗265’‘牟番1号’‘双抗228’‘线虫绝3号’‘双抗38’和‘Sparta’9个品种,均能扩增出1条约500 bp的条带(图 2-A),表明它们均含有Mi基因,而其余7个品种均无扩增条带,表明不含Mi基因。进一步用引物对PMiF3/PMiR3扩增16个番茄品种,结果表明,在上述含有Mi基因的9个品种中,有5个品种均能扩增出约550和350 bp的2个条带,显示为Mi/mi杂合基因型,‘VFN’‘双抗265’和‘双抗228’只能扩增出1条约550 bp的条带,显示为Mi/Mi纯合基因型,而‘线虫绝39号’无扩增条带,基因型无法确定;上述不含Mi基因的7个品种均产生了350 bp的特异性条带(图 2-B,表 2)。
|
图 2 16个番茄品种的引物对组合PM3Fb/PM3Rb(A)以及PMiF3/PMiR3(B)扩增结果 Figure 2 PCR products of 16 tomato cultivars amplified with primers pairs combination PM3Fb/PM3Rb(A)and PMiF3/PMiR3(B) |
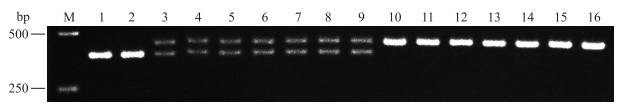
用引物对Mi23F/Mi23R扩增16个番茄品种的基因组DNA,结果显示:只有‘线虫绝39号’和‘VFN’扩增出1条380 bp的条带,表明它们为Mi/Mi纯合基因型,而‘仙客1号’‘双抗265’‘牟番1号’‘双抗228’‘线虫绝3号’‘双抗38’和‘Sparta’均扩增出430和380 bp的2条带,即为Mi/mi杂合基因型,其余的7个品种均扩增出430 bp的1条带,显示其均不含Mi基因(图 3,表 2)。
|
图 3 由引物Mi23F/Mi23R扩增的16个番茄品种结果 Figure 3 PCR products of 16 tomato cultivars amplified with primers Mi23F/Mi23R |
接种测定结果(表 2)显示:16个供试番茄品种中,‘VFN’与‘线虫绝3号’的根结率及根结指数均为0,对南方根结线虫免疫;‘Sparta’‘仙客1号’‘双抗228’和‘线虫绝39号’的根结率为1%~5%,根结指数为8~28,对南方根结线虫高抗;‘双抗265’和‘牟番1号’的根结率为6%~25%,根结指数为28和32,对南方根结线虫抗病;‘双抗38’和‘合作903’的根结率为26%~50%,根结指数分别为60和64,对南方根结线虫感病;‘苏粉8号’‘苏红2003’‘世纪粉冠王’‘夏钻石’‘红金宝’的根结率为51%~80%,根结指数为61~80,对南方根结线虫中度感病;‘一串红’的根结率为80.14%,根结指数为84,对南方根结线虫高度感病。
通过与室内人工接种线虫测定结果比较可以看出,CAPS、引物对组合与SCAR这3种分子标记检测番茄Mi基因的结果存在一定差异,其中多个CAPS检测显示为Mi纯合基因型的番茄品种并未表现出对南方根结线虫的抗性,而另外2种标记的检测结果则与抗性测定结果较为一致。
3 讨论为了比较不同分子标记检测番茄Mi基因的准确性,本研究以6个对根结线虫具有潜在抗性的人工选育品种、9个商业化销售品种及1个Mi基因纯合番茄材料作为研究对象,首先采用3种分子标记法检测了所有供试番茄品种的Mi基因及其基因型,发现3种标记检测结果存在着明显的差异,通过人工接种根结线虫来进一步评价所有供试番茄品种的抗性,对番茄品种的已知基因型和接种测定结果进行分析,发现CAPS虽然广泛用于Mi基因的分子检测[16-18],但是该方法存在明显的假阳性。CAPS检测出15个品种均为Mi/Mi纯合基因型,只有‘线虫绝39号’为Mi/mi杂合基因型,这一结果与人工接种测定结果以及番茄品种的已知遗传背景存在明显的差异。此前有报道指出,起源于摩洛哥和危地马拉的含有抗菜豆金色黄花叶病毒属(Begomovirus)基因的一些番茄品种,用REX-1标记鉴定时会出现假阳性,而PMiF3/PMiR3能够鉴定番茄材料中是否含有这类基因[8],但本研究中PMiF3/PMiR3扩增结果显示,所有供试的感病番茄品种中均不含上述抗病毒基因,因此造成本试验中CAPS假阳性的遗传学因素仍有待今后进一步研究。相比之下,用PM3Fb/PM3Rb与PMiF3/PMiR3的引物对组合法以及SCAR标记法检测Mi基因的结果,与人工接种测定结果较为一致。对于所有感病品种,2种标记的检测结果均显示其不含Mi基因,反之所有抗病品种均能检测到Mi基因,但是,2种标记鉴定Mi基因型的结果存在着一定的差异,例如:‘双抗228’和‘双抗265’,引物对组合法鉴定为Mi/Mi纯合基因型,但SCAR标记法则鉴定为Mi/mi杂合基因型;此外,利用PM3Fb/PM3Rb鉴定‘线虫绝39号’显示虽然含有Mi基因,但鉴定基因型时无扩增条带,而SCAR标记法则显示该品种为Mi/Mi纯合基因型。结合本试验所用番茄材料的已知基因型,可以证实PM3Fb/PM3Rb与PMiF3/PMiR3的引物对组合法以及SCAR标记法在鉴定Mi基因型时同样可出现假阳性。
尽管本试验中用3种分子标记均检测到‘双抗38’含有Mi基因,然而人工接种测定结果却显示其为感病品种,我们认为这种差异的出现可能是由于所采用的根结线虫抗感性评价方法造成的。在统计根结数过程中,我们发现虽然‘双抗38’能形成较多的根结,但几乎没有产生卵块。由于现有的抗感评价标准以根结率为主要参数,因此认定该品种为感病品种。但事实上,生物抗性可以表现为抗侵入、抗发育和抗繁殖等不同方式[19-20]。虽然根结线虫的侵染会对当季植物根系生长发育造成一定的影响,但是如果南方根结线虫在‘双抗38’根系上无法形成卵块继而不能完成生活史,在植物的下一个生长季中线虫种群数量将会明显下降,因此某种程度上同样可以认为‘双抗38’对南方根结线虫具有抗性。
比较不同分子标记方法的测定结果可以发现,不同品种即使均为Mi/mi杂合基因型,但人工接种测定显示它们对南方根结线虫的抗性也存在着明显的差异。例如:‘线虫绝3号’为免疫,‘Sparta’和‘仙客1号’为高抗,‘牟番1号’为抗病,推测其可能原因如下:1)不同品种中的Mi基因拷贝数存在差异;2)个别品种中虽然成功导入Mi基因,但基因无法正常表达或者表达量较低,甚至表达产物蛋白折叠构象不正确导致没有活性从而无法发挥正常功能。
综上所述,本试验用于检测番茄Mi基因的3种分子标记方法,其中,基于REX-1位点的CAPS方法存在大量的假阳性结果,不适用于番茄Mi基因的检测,而双引物组合和SCAR标记2种方法的检测准确率相对较高,但在鉴定番茄Mi基因型时会出现假阳性;相比之下,SCAR标记法为相对稳定的检测方法,比PM3Fb/PM3Rb和PMiF3/PMiR3的引物对组合法应用更为便捷。
| [1] | Abad P, Gouzy J, Aury J M, et al. Genome sequence of the metazoan plant-parasitic nematode Meloidogyne incognita[J]. Nature Biotechnology, 2008, 26(8): 909-915. DOI: 10.1038/nbt.1482 |
| [2] | Jones J T, Haegeman A, Danchin E G J, et al. Top 10 plant-parasitic nematodes in molecular plant pathology[J]. Molecular Plant Pathology, 2013, 14(9): 946-961. DOI: 10.1111/mpp.2013.14.issue-9 |
| [3] |
秦公伟, 李文丽, 王富. 番茄根结线虫的危害与防治[J].
北方园艺, 2006(2): 132-133.
Qin G W, Li W L, Wang F. The damage and control of tomato root knot nematode[J]. Northern Horticulture, 2006(2): 132-133. DOI: 10.3969/j.issn.1001-0009.2006.02.070 (in Chinese with English abstract) |
| [4] | Williamson V M. Plant nematode resistance genes[J]. Current Opinion in Plant Biology, 1999, 2(4): 327-331. DOI: 10.1016/S1369-5266(99)80057-0 |
| [5] |
彭德良, 唐文华. 番茄抗根结线虫Mi基因研究进展[J].
沈阳农业大学学报, 2001, 32(3): 220-223.
Peng D L, Tang W H. Advance of resistance gene Mi to root-knot nematodes in tomato[J]. Journal of Shenyang Agricultural University, 2001, 32(3): 220-223. DOI: 10.3969/j.issn.1000-1700.2001.03.017 (in Chinese with English abstract) |
| [6] | Messeguer R, Ganal M, de Vicente M C, et al. High resolution RFLP map around the root knot nematode resistance gene(Mi)in tomato[J]. Theoretical and Applied Genetics, 1991, 82(5): 529-536. DOI: 10.1007/BF00226787 |
| [7] | Williamson V M, Ho J Y, Wu F F, et al. A PCR-based marker tightly linked to the nematode resistance gene, Mi, in tomato[J]. Theoretical and Applied Genetics, 1994, 87(7): 757-763. |
| [8] | El Mehrach K, Gharsallah Chouchane S, Mejia L, et al. PCR-based methods for tagging the Mi1 locus for resistance to root-knot nematode in begomovirus-resistant tomato germplasm[J]. ISHS Acta Horticulture, 2005, 695: 263-270. |
| [9] | Devran Z, Göknur A, Mesci L. Development of molecular markers for the Mi-1 gene in tomato using the KASP genotyping assay[J]. Horticulture Environment and Biotechnology, 2016, 57(2): 156-160. DOI: 10.1007/s13580-016-0028-6 |
| [10] | Garcia B E, Mejia L, Salus M S, et al. A co-dominant SCAR marker, Mi23, for detection of the Mi-1.2 gene for resistance to root-knot nematode in tomato germplasm[J]. Applied Mechanics and Materials, 2013, 486: 323-326. DOI: 10.4028/www.scientific.net/AMM.486 |
| [11] | Devran Z, Başköylü B, Taner A, et al. Comparison of PCR-based molecular markers for identification of Mi gene[J]. Acta Agriculturae Scandinavica Section B:Soil and Plant Science, 2013, 63(5): 395-402. |
| [12] |
杨树军, 夏振远, 李天飞, 等. 两种生防菌剂对南方根结线虫卵孵化的影响[J].
西南农业大学学报, 2001, 23(3): 247-248.
Yang S J, Xia Z Y, Li T F, et al. Influence of two biocontrol fungus preparations on hatching of rhizosphere nematode eggs[J]. Journal of Southwest Agricultural University, 2001, 23(3): 247-248. DOI: 10.3969/j.issn.1673-9868.2001.03.019 (in Chinese with English abstract) |
| [13] | Guan T, Shen J, Fa Y, et al. Resistance-breaking population of Meloidogyne incognita utilizes plant peroxidase to scavenge reactive oxygen species, thereby promoting parasitism on tomato carrying Mi-1 gene[J]. Biochemical and Biophysical Research Communications, 2017, 482(1): 1-7. DOI: 10.1016/j.bbrc.2016.11.040 |
| [14] |
韩娜, 卓侃, 王彬, 等. 番茄品种Mi基因对根结线虫抗性的检测[J].
华南农业大学学报, 2011, 32(1): 19-23.
Han N, Zhuo K, Wang B, et al. The detection of resistance of the tomato cultivars with Mi gene to root knot nematodes[J]. Journal of South China Agricultural University, 2011, 32(1): 19-23. (in Chinese with English abstract) |
| [15] |
王新荣, 郑静君, 汪国平, 等. 华南地区主要番茄品种对南方根结线虫的抗性评价[J].
植物保护, 2009, 35(1): 124-126.
Wang X R, Zheng J J, Wang G P, et al. Resistance evaluation of tomato varieties to Meloidogyne incognita in Southern China[J]. Plant Protection, 2009, 35(1): 124-126. DOI: 10.3969/j.issn.0529-1542.2009.01.030 (in Chinese with English abstract) |
| [16] | Li Q, Xie Q G, Smith-Becker J, et al. Mi-1-mediated aphid resistance involves salicylic acid and mitogen-activated protein kinase signaling cascades[J]. Molecular Plant-Microbe Interactions, 2006, 19(6): 655-664. DOI: 10.1094/MPMI-19-0655 |
| [17] | Bhattarai K K, Xie Q G, Pourshalimi D, et al. Coi1-dependent signaling pathway is not required for Mi-1-mediated potato aphid resistance[J]. Molecular Plant-Microbe Interactions, 2007, 20(3): 276-282. DOI: 10.1094/MPMI-20-3-0276 |
| [18] | Hu C, Zhao W, Fan J, et al. Protective enzymes and genes related to the JA pathway are involved in the response to root-knot nematodes at high soil temperatures in tomatoes carrying Mi-1[J]. Horticulture Environment and Biotechnology, 2015, 56(4): 546-554. DOI: 10.1007/s13580-015-0146-6 |
| [19] |
高莹梅, 胡靖康, 赵婷婷, 等. 番茄抗根结线虫Mi-1基因研究进展[J].
分子植物育种, 2017, 15(8): 3010-3015.
Gao Y M, Hu J K, Zhao T T, et al. The progress of studies on Mi-1 gene with resistance to root-knot nematode in tomato(Solanum lycopersicum)[J]. Molecular Plant Breeding, 2017, 15(8): 3010-3015. (in Chinese with English abstract) |
| [20] |
阙友雄, 宋弦弦, 许莉萍, 等. 植物与病原真菌互作机制研究进展[J].
生物技术通讯, 2009, 20(2): 282-285.
Kan Y X, Song X X, Xu L P, et al. Research progress on the interaction mechanism between plant and fungi[J]. Letters in Biotechnology, 2009, 20(2): 282-285. DOI: 10.3969/j.issn.1009-0002.2009.02.037 (in Chinese with English abstract) |




