文章信息
- 李林, 陈丽, 吴小婷, 邵帅旭, 李英, 侯喜林, 刘同坤
- LI Lin, CHEN Li, WU Xiaoting, SHAO Shuaixu, LI Ying, HOU Xilin, LIU Tongkun
- 不结球白菜BrCDF1的功能研究
- Functional research of BrCDF1 in non-heading Chinese cabbage
- 南京农业大学学报, 2018, 41(5): 832-838
- Journal of Nanjing Agricultural University, 2018, 41(5): 832-838.
- http://dx.doi.org/10.7685/jnau.201712008
-
文章历史
- 收稿日期: 2017-12-06
不结球白菜(Brassica campestris ssp. chinensis Makino)是十字花科芸薹属白菜亚种蔬菜[1],这个亚种由普通白菜类、塌菜类、菜薹类、分蘖菜类、薹菜类5个变种组成[2]。不结球白菜营养丰富、生长周期短、适应性强,是我国长江中下游地区普遍种植的绿叶蔬菜,现在北方地区也在进行大量的引种栽培,在蔬菜周年生产供应中占据着重要的地位[3]。但是在实际生产中,先期抽薹开花造成了不结球白菜产量下降和品质低下,成为困扰生产的一大难题。为了解决这一问题,需要对不结球白菜的开花调控机制进行深入研究[4]。
开花是植物从营养生长向生殖生长转变的重要过程,这一过程是受内源发育信号和外部各种环境因子共同调控的结果[5]。不结球白菜和模式植物拟南芥(Arabidopsis thaliana)都属于十字花科,所以拟南芥开花途径的研究结果对不结球白菜开花机制的研究具有一定的借鉴意义。前人通过对拟南芥开花遗传机制的研究,发现拟南芥有4个主要开花途径,分别为春化途径[6]、光周期途径[7]、自主途径[8]以及赤霉素途径[9],后来又提出了另外2条路径,即年龄途径和环境温度途径[10]。其中光周期途径是植物开花的主要环境响应途径,植物通过叶片中的光受体感受光信号,然后把光信号传递给生物节律钟,用来检测日长的变化,并且将节律输出给下游的节律调节基因,最后通过周期性表达CO(COSTANTS)将光信号传递给下游的FT(FLOWERING LOCUST)开花基因,从而控制拟南芥的开花过程[11]。
CDF1是Dof(DNA binding with one finger)转录因子,它参与光周期反应调控过程[12]。Dof家族是植物特有的转录因子[13],属于单锌指蛋白超家族,一般由200~400个氨基酸构成,具有2个功能域:一个是位于N末端的DNA结合域,另一个是位于C末端的转录调控域[14]。CO是光周期途径中的关键基因[15]。研究表明,CO基因是连接光感知和开花时间的转录因子,它编码的蛋白质具有2个高度保守的结构域:N端的类锌指B-box结构域和C端植物特有的CCT结构域[16]。CDF1能够结合到成花基因FT的调控因子CO的启动子区域,抑制CO的表达,进而抑制FT的表达,最终延迟拟南芥的开花[17-18]。吴小婷等[12]研究表明BrCDF1 基因有876 bp开放阅读框,共编码292个氨基酸,且与拟南芥氨基酸序列比对结果为72.06%,保守性较高。不结球白菜与拟南芥同属于十字花科长日照植物,但在进化过程中,不结球白菜是由拟南芥基因组的三倍体进化而来的[19],因此借鉴拟南芥开花途径中CDF1-CO-FT的相互作用来研究不结球白菜中开花机制是可行的。
本研究采用酵母单杂交技术验证BrCDF 1转录因子和CO启动子之间的调控关系,同时将BrCDF1基因导入拟南芥植株中进行转基因功能验证,确定BrCDF1基因在不结球白菜开花的光周期途径中所起的作用,旨在为不结球白菜育种提供理论依据。
1 材料与方法 1.1 不结球白菜RNA的提取和BrCDF1 基因的克隆以不结球白菜‘苏州青’作为试验材料。采用RNA simple Total RNA Kit提取不结球白菜总RNA,采用PrimeScriptTMRT reagent Kit将总RNA反转录成基因组cDNA。
在GenBank上查得拟南芥CDF1 基因序列,利用NCBI的BLAST检索不结球白菜的EST数据库,得到了与拟南芥CDF1 基因高度同源的EST序列,用软件Primer Premier 6.0设计特异引物对BrCDF1 -F/R(表 1)。以不结球白菜cDNA为模板进行克隆。PCR产物用10 g · L-1琼脂糖凝胶电泳进行检测,然后用琼脂糖凝胶DNA回收试剂盒对目的片段进行切胶回收。连接pMD18-T载体并使用热激法转化至大肠杆菌DH5α,提取质粒进行PCR鉴定后,送南京金斯瑞生物科技有限公司测序。
| 引物名称Primer name | 引物序列(5′→3′)Primer sequence |
| BrCDF1-F/R | ATGCTAGAAAGTAAAGATCC/TCACATCTGTTCATGGAAAT |
| gateway-BrCDF1-F/R | GGGGACAAGTTTGTACAAAAAAGCAGGCTATGCTAGAAAGTAAAGATCC/GGGGACCACTTTGTACAAGAAAGCTGGGTATCACATCTGTTCATGGAAT |
| BrCDF1-qRT-F/R | CTTCTTCGCCTTATTCAACTC/GCTTCATTAGGATCATCAACTC |
| qCO-F/R | CTACAACGACAATGGTTCCATTAAC/CAGGGTCAGGTTGTTGC |
| qFT-F/R | CTGGAACAACCTTTGGCAAT/TACACTGTTTGCCTGCCAAG |
| qIPP2-F/R | GTATGAGTTGCTTCTCCAGCAAAG/GAGGATGGCTGCAACAAGTGT |
采用gateway技术构建BrCDF1 载体。分别在正向引物和反向引物两端加上attB1和attB2位点序列,设计gateway引物对gateway-BrCDF1 -F/R(表 1)。使用Phusion超保真酶进行PCR扩增,反应程序为:98 ℃ 30 s;98 ℃ 30 s,57 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 10 min,4 ℃保温。PCR产物用10 g · L-1琼脂糖凝胶电泳检测,用琼脂糖凝胶DNA回收试剂盒对目的片段进行切胶回收。
1.2.2 BP重组反应将上一步的PCR回收产物与入门载体pdonr221进行BP重组反应。BP反应体系(5 μL):含目的基因PCR产物2.7 μL,pdonr221载体1.0 μL,BP酶混合物0.3 μL,5×BP反应缓冲液1.0 μL。瞬时离心后将混合体系于25 ℃水浴4 h,加入1.0 μL蛋白酶K溶液(100 μmol · L-1),37 ℃反应10 min终止BP反应。将反应产物用热激法转化大肠杆菌DH5α感受态细胞,均匀涂布于含50 mg · L-1卡那霉素LB平板培养。37 ℃倒置培养16 h后,挑取单克隆在LB液体培养基(含50 mg · L-1卡那霉素)于37 ℃的摇床中250 r · min-1振荡培养过夜,提取质粒进行菌落PCR检测,并送至公司进行测序。测序正确后即获得重组质粒(入门载体)pdonr221-BrCDF1 。
1.3 酵母单杂交通过LR反应,将入门载体pdonr221-BrCDF1 转化成酵母表达载体pACT-BrCDF1 。LR反应体系(5 μL):入门质粒3 μL,目的载体pACT-GW 1 μL,LR酶混合物1 μL。瞬时离心后将混合体系于25 ℃水浴4 h,随后分别加入1.0 μL蛋白酶K溶液(100 μmol · L-1),37 ℃反应10 min终止LR反应。取3 μL反应产物用热激法转化大肠杆菌DH5α感受态细胞,涂布于含100 mg · L-1氨苄青霉素的LB平板上筛选。37 ℃倒置培养16 h后,挑取单克隆在LB液体培养基(含100 mg · L-1氨苄青霉素)于37 ℃摇床中250 r · min-1振荡培养过夜,提取质粒进行菌落PCR检测并送至公司测序,测序正确后即获得目的载体pACT-BrCDF1 。
采用PEG/LiAc法将pACT-GW空载和重组载体pACT-BrCDF1分别转化含有CO启动子的酵母菌株YM4271[20],转化后均匀涂于SD/-Trp-Ura固体培养基上,30 ℃倒置培养3~5 d。利用X-gal检测BrCDF1蛋白与CO启动子结合情况,并采用曾婷等[21]的方法进行β-半乳糖苷酶试验定量分析。
1.4 过表达载体构建通过LR反应,将入门载体pdonr221-BrCDF1 转化成过表达载体pEarlyGate101-BrCDF1 。由于质粒pdonr221和pEarlyGate101均可筛选卡那霉素抗性基因,因此在LR重组反应前先用限制性内切酶MluⅠ对入门载体pdonr221-BrCDF1 进行单酶切,然后与目的载体pEarlyGate101进行LR重组反应。LR反应体系(5 μL):线性化的pdonr221-BrCDF1 3 μL,目的载体pEarlyGate101 1 μL,LR酶混合物1 μL。瞬时离心后将混合体系于25 ℃水浴4 h,随后加入1.0 μL蛋白酶K溶液(100 μmol · L-1),37 ℃反应10 min终止LR反应。取3 μL反应产物用热激法转化大肠杆菌DH5α感受态细胞,均匀涂布于含50 mg · L-1卡那霉素的LB平板筛选。37 ℃倒置培养16 h后,挑取单克隆在LB液体培养基(含50 mg · L-1卡那霉素)于37 ℃摇床中250 r · min-1振荡培养过夜。然后提取质粒进行菌落PCR检测,将有扩增产物送至公司进行测序。测序正确后即获得重组质粒(过表达载体)pEarlyGate101-BrCDF1 。
1.5 过表达载体导入农杆菌取出冻存在-70 ℃的农杆菌GV3101感受态细胞,冰上解冻。将5 μL重组质粒DNA加到感受态细胞GV3101中,冰浴30 min。液氮速冻1.5 min后迅速转移至37 ℃水浴中温浴5 min,然后冰上放置3 min,再加入LB液体培养基(无抗性)1 mL,28 ℃ 250 r · min-1振荡培养4 h复苏菌株。4 000 r · min-1离心5 min,弃去上清液,然后在超净台上吸打混匀,均匀涂布于含50 mg · L-1卡那霉素的LB平板筛选。28 ℃暗培养2~3 d后挑取单克隆,在LB液体培养基(含50 mg · L-1卡那霉素)中28 ℃、250 r · min-1振荡培养过夜,将所得的农杆菌进行菌落PCR检测和质粒酶切,筛选阳性克隆。
1.6 转基因阳性苗筛选利用农杆菌侵染的方法,将过表达载体转入拟南芥植株中,待拟南芥角果大部分变枯黄后将其角果剪下,收取全部种子进行保存,将这些种子记为T0代。T0代种子经消毒后,在含除草剂Basta和特美汀的MS培养基中播种,2周后,转基因阳性苗T1代植株长出3片真叶,而没有转基因的幼苗则不具备Basta抗性,不能生长,将筛选出的转基因阳性苗移栽至人工气候室。
1.7 Western blot验证选取T2代中生长旺盛的拟南芥植株,提取植物总蛋白,经SDS-PAGE电泳后,使用湿转法电转移至NC膜上,转膜结束后用丽春红染色液对硝酸纤维素膜染色,观察条带。将NC膜取出后放入50 g · L-1脱脂奶粉中,在室温下封闭1 h后,再加入YFP抗体稀释液(1 : 2 000),室温孵育1 h。用TBST洗涤3次,每次10 min,再加入带有HRP标记的兔抗鼠免疫球蛋白G稀释液(1 : 10 000),室温孵育1 h后用TBST洗涤3次,每次10 min,进行ECL化学发光反应。用底物Pico与膜反应5 min,去尽残液,用VersaDocMP4000凝胶成像仪拍照,检测BrCDF1-YFP蛋白在拟南芥植株中的表达。
1.8 开花相关基因的RT-qPCR分析以野生型和转基因T2代为材料,种植于长日照(16 h光照,8 h黑暗)、22 ℃环境下的人工气候室。在15 d苗龄时,按照光照不同时间点进行取样。以光周期24 h为例,记16 h光照刚开始时为0 h(ZT0),光照1 h为ZT1,以此类推至ZT24。在一天内,从光照1 h(ZT1)开始,每3 h取1次样,用总RNA试剂盒提取总RNA。用反转录试剂盒合成第1链cDNA,以稀释10倍的cDNA为模板。采用IPP2 作为内参基因,并设计荧光定量试验的特异引物(表 1)。荧光定量PCR(qPCR)体系(20 μL):正、反向引物各0.4 μL,SYBR Premix Ex Taq 10 μL,cDNA 2 μL,加ddH2O补至20 μL。扩增程序采用两步:94 ℃ 30 s;94 ℃ 20 s,52 ℃ 20 s,72 ℃ 20 s,35个循环;设置65 ℃到94 ℃的熔解曲线。3次生物学重复和3次技术重复。用2-ΔΔCT法分析BrCDF1、CO、FT的相对表达量,并计算标准差。
1.9 转基因植株表型分析为了统计野生型和转基因拟南芥的开花时间差异,以野生型和转基因T2代为材料,在长日照(16 h光照,8 h黑暗)、22 ℃的环境下种植于人工气候室。以播种时的日期记为0 d,统计野生型和转基因拟南芥开花时所用的时间,并统计开花时的基叶数。
2 结果与分析 2.1 不结球白菜酵母单杂交分析不结球白菜BrCDF1蛋白与CO启动子的酵母单杂交结果表明,含有pACT-BrCDF1 重组质粒的酵母菌株YM4271能在SD/-Trp-Ura培养基上正常生长,并在含有X-gal的培养基上显色(图 1),表明BrCDF1蛋白能与CO启动子结合,在酵母中具有转录激活活性,能激活下游LacZ报告基因的表达。以邻硝基苯β-D-半乳吡喃糖苷(ONPG)为底物进行β-半乳糖苷酶活性测定,结果表明pACT-BrCDF1的β-半乳糖苷酶活性是pACT-GW空载活性的8 666倍。

|
图 1 BrCDF1酵母单杂交活性 Figure 1 Yeast one-hybrid activity of BrCDF1 |
如图 2所示:在 35S : BrCDF1 -YFP转基因拟南芥植株中观察到BrCDF1-YFP蛋白印迹,而在野生型植株中没有看到,这表明在转基因拟南芥植株中BrCDF1蛋白成功表达。
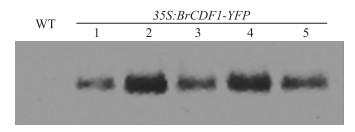
|
图 2 拟南芥野生型和转基因植株Western blot检测 Figure 2 The detection of wild type and transgenic plants in Arabidopsis thaliana by Western blot WT:野生型Wild type;35S : BrCDF1-YFP(1-5):转基因植株Transgenic plants.下同。The same as follows. |
由图 3可见:转基因植株中的BrCDF1 基因的相对表达量明显比野生型植株高,且一直保持在较高的水平,无生物节律变化。野生型植株中BrCDF1 基因的表达量先下调,并在光照16 h达到最低值,然后基因表达量开始上调,具有生物节律变化。

|
图 3 CDF1 基因在拟南芥野生型和转基因植株的表达量 Figure 3 The expression levels of CDF1 gene in wild type and transgenic plants of A. thaliana |
如图 4所示:CO和FT 2个基因均呈现出明显的昼夜节律变化,在长日照条件下CO基因的表达水平高峰在黎明和黄昏阶段,FT基因的表达水平高峰在光照16 h。RT-qPCR结果显示:CO和FT基因在转基因植株中的表达量变化明显比野生型植株低,这说明了BrCDF1基因对CO和FT基因起抑制作用。

|
图 4 CO和FT基因在拟南芥野生型和转基因植株中的表达量 Figure 4 The expression levels of CO and FT genes in wild type and transgenic plants of A. thaliana |
由图 5可见:转基因拟南芥植株相对于野生型植株开花较迟,且在抽薹时转基因植株相对于野生型叶片数更多(图 6)。
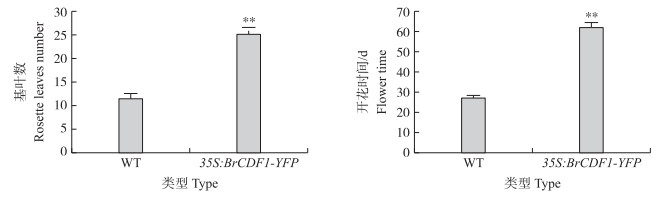
|
图 5 拟南芥转基因与野生型植株开花时的总叶片数与开花时间的比较 Figure 5 Comparison of total leaf number and flowering time in wild type and transgenic plants of A. thaliana * *P < 0.01. |

|
图 6 拟南芥野生型植株与转基因植株生长状态对比 Figure 6 Comparison of growth status between wild type and transgenic plants of A. thaliana |
植物开花是一个多基因控制的复杂生理过程。本研究通过克隆技术,从不结球白菜中得到BrCDF1基因序列。对拟南芥AtCDF1转录因子的研究发现,在长日照条件下,AtCDF1基因的表达量从黎明开始逐渐减少到接近黄昏时并保持在一个较低的水平,到第2天黎明前快速增加,这种以24 h为单位有规律变化的基因被称为生物节律基因[22-23]。胡娟等[24]研究发现茶树CsCDF1 具有内生昼夜节律,在黑暗条件下其表达受到强烈抑制。本研究中,不结球白菜BrCDF1 基因具有昼夜节律变化,这与前人对其同源基因的研究结果一致[22-24],可以推测其属于生物昼夜节律基因。
在长日照条件下,CO-FT作用机制在拟南芥光周期调控开花途径中起主导作用。CO-FT作用模式的机制主要是:当叶片感受到光时,把光信号传递给CO,然后CO蛋白激活植物韧皮部的FT基因表达,FT蛋白就会从植物韧皮部输送到顶端分生组织,与锌指转录因子FD蛋白在顶端分生组织互作,进而促进花分生组织特异性基因SOC1、AP1、LFY等的表达,引起开花[25-26]。本试验使用酵母单杂交试验证实了BrCDF1转录因子能与CO启动子结合,具有转录激活活性。通过RT-qPCR技术,发现BrCDF1基因对CO、FT基因起抑制作用。在拟南芥中,AtCDF1蛋白通过结合到CO基因启动子上抑制CO的表达[27]。表明不结球白菜BrCDF1基因与拟南芥中的AtCDF1基因有相似功能。在拟南芥[27]、水稻[28]、大豆[29]等的研究中发现,FKF1和GI分别与CDF1互作形成FKF1-GI-CDF1复合体分布在CO的启动子上,调控CO mRNA的表达,进而通过CO-FT调节元件调控开花。吴小婷等[12]研究发现,不结球白菜BrCDF1蛋白能够与BrFKF1蛋白发生互作。通过以上的研究,推测FKF1-CDF1-CO-FT途径在不结球白菜中同样适用。
本研究使用酵母单杂交和实时定量PCR技术,发现不结球白菜中的BrCDF1转录因子能够与CO启动子结合并对CO、FT的表达起抑制作用,该结论对于研究不结球白菜抽薹开花具有较大的参考价值。
| [1] |
刘同坤.不结球白菜BcHSP81-4基因在Po1CMS中的表达分析及BcFLC基因的功能验证[D].南京: 南京农业大学, 2012.
Liu T K. Expression of BcHSP81-4 gene in Po1CMS and validation of BcFLC gene function[D]. Nanjing: Nanjing Agricultural University, 2012(in Chinese with English abstract). |
| [2] |
侯喜林, 宋小明. 不结球白菜种质资源的研究与利用[J].
南京农业大学学报, 2012, 35(5): 35-42.
Hou X L, Song X M. Study and utilization of germplasm resources of non-heading Chinese cabbage[J]. Journal of Nanjing Agricultural University, 2012, 35(5): 35-42. DOI: 10.7685/j.issn.1000-2030.2012.05.005 (in Chinese with English abstract) |
| [3] |
侯喜林. 不结球白菜育种研究新进展[J].
南京农业大学学报, 2003, 26(4): 111-115.
Hou X L. Non-heading Chinese cabbage breeding research new progress[J]. Journal of Nanjing Agricultural University, 2003, 26(4): 111-115. DOI: 10.7685/j.issn.1000-2030.2003.04.026 (in Chinese with English abstract) |
| [4] |
张学铭.白菜类作物抽薹开花的遗传分析[D].北京: 中国农业科学院, 2014.
Zhang X M. Genetic analysis of cabbage crops bolting and flowering[D]. Beijing: Chinese Academy of Agricultural Sciences, 2014(in Chinese with English abstract). |
| [5] |
原玉香.白菜类作物抽薹开花的分子遗传分析[D].北京: 中国农业科学院, 2008.
Yuan Y X. Chinese cabbage crop bolting and flowering molecular genetic analysis[D]. Beijing: Chinese Academy of Agricultural Sciences, 2008(in Chinese with English abstract). |
| [6] | Zhu D, Rosa S, Dean C. Nuclear organization changes and the epigenetic silencing of FLC during vernalization[J]. Journal of Molecular Biology, 2014, 427(3): 659-669. |
| [7] | Fernandez V, Takahashi Y, Le G J, et al. Photoperiodic and thermosensory pathways interact through CONSTANS to promote flowering at high temperature under short days[J]. The Plant Journal, 2016, 86(5): 426-440. DOI: 10.1111/tpj.2016.86.issue-5 |
| [8] | Simpson G G. The autonomous pathway:epigenetic and post-transcriptional gene regulation in the control of Arabidopsis flowering time[J]. Current Opinion in Plant Biology, 2004, 7(5): 570-574. DOI: 10.1016/j.pbi.2004.07.002 |
| [9] | Galvao V C, Collani S, Horrer D, et al. Gibberellic acid signaling is required for ambient temperature-mediated induction of flowering in Arabidopsis thaliana[J]. The Plant Journal, 2015, 84(5): 949-962. DOI: 10.1111/tpj.13051 |
| [10] | Fornara F, Amaury D M, George C. SnapShot:control of flowering in Arabidopsis[J]. Cell, 2010, 141: 550. DOI: 10.1016/j.cell.2010.04.024 |
| [11] |
赵淑清, 罗志鹏, 李昱. 拟南芥光周期调控开花的研究进展[J].
山西大学学报(自然科学版), 2009, 32(2): 308-314.
Zhao S Q, Luo Z P, Li Y. Study on photoperiodic regulation of flowering in Arabidopsis thaliana[J]. Journal of Shanxi University(Natural Science Edition), 2009, 32(2): 308-314. (in Chinese with English abstract) |
| [12] |
吴小婷, 邵帅旭, 李英, 等. 不结球白菜BrCDF1的克隆和蛋白亚细胞定位及其与BrFKF1蛋白的验证[J].
南京农业大学学报, 2017, 40(5): 812-819.
Wu X T, Shao S X, Li Y, et al. Cloning and protein subcellular localization of BrCDF1 in non-heading Chinese cabbage and its validation with BrFKF1 protein[J]. Journal of Nanjing Agricultural University, 2017, 40(5): 812-819. DOI: 10.7685/jnau.201612049 (in Chinese with English abstract) |
| [13] |
张雪, 尹悦佳, 范贝, 等. 植物Dof转录因子的结构特点及功能研究进展[J].
作物杂志, 2016(2): 14-20.
Zhang X, Yin Y J, Fan B, et al. Studies on the structural characteristics and functions of plant Dof transcription factors[J]. Acta Agronomica Sinica, 2016(2): 14-20. (in Chinese with English abstract) |
| [14] | Gupta S, Malviya N, Kushwaha H, et al. Insights into structural and functional diversity of Dof(DNA binding with one finger)transcription factor[J]. Planta, 2015, 241(3): 549-562. DOI: 10.1007/s00425-014-2239-3 |
| [15] |
樊丽娜, 邓海华, 齐永文. 植物CO基因研究进展[J].
西北植物学报, 2008, 28(6): 1281-1287.
Fan L N, Deng H H, Qi Y W. Studies on plant CO gene[J]. Northwest Botanic Gardens, 2008, 28(6): 1281-1287. (in Chinese with English abstract) |
| [16] |
吴连成, 常丽丽, 陈晓, 等. CO基因的调控表达与植物光周期反应[J].
中国农学通报, 2010, 26(2): 116-121.
Wu L C, Chang L L, Chen X, et al. Regulation of CO gene expression and plant photoperiod response[J]. Chinese Agricultural Science Bulletin, 2010, 26(2): 116-121. (in Chinese with English abstract) |
| [17] |
付建新, 王翊, 戴思兰. 高等植物CO基因研究进展[J].
分子植物育种, 2010, 8(5): 1008-1016.
Fu J X, Wang Y, Dai S L. Studies on CO genes in higher plants[J]. Molecular Plant Breeding, 2010, 8(5): 1008-1016. DOI: 10.3969/mpb.008.001008 (in Chinese with English abstract) |
| [18] |
陈福禄, 傅永福, 林辰涛. CO/FT调节元件与植物开花时间调节研究进展[J].
中国农业科技导报, 2009, 11(2): 17-22.
Chen F L, Fu Y F, Lin C T. Research progress of CO/FT regulating element and plant flowering time regulation[J]. Chinese Journal of Agricultural Science and Technology, 2009, 11(2): 17-22. DOI: 10.3969/j.issn.1008-0864.2009.02.004 (in Chinese with English abstract) |
| [19] |
孙思龙.白菜、甘蓝与拟南芥比较基因组分析[D].北京: 中国农业科学院, 2011.
Sun S L. Comparative genomic analysis of Chinese cabbage, cabbage and Arabidopsis[D]. Beijing: Chinese Academy of Agricultural Sciences, 2011(in Chinese with English abstract). |
| [20] | Greg S G, Tong K L, Lin Z, et al. CYCLING DOF FACTOR 1 represses transcription through the TOPLESS co-repressor to control photoperiodic flowering in Arabidopsis[J]. The Plant Journal, 2017, 92(2): 244-266. DOI: 10.1111/tpj.2017.92.issue-2 |
| [21] |
曾婷, 何志敏, 段桂芳, 等. 拟南芥转录因子HB22与CRY1相互作用研究[J].
生命科学研究, 2013, 17(3): 223-229.
Zeng T, He Z M, Duan G F, et al. Studies on the interaction between Arabidopsis transcription factor HB22 and CRY1[J]. Acta Physiologica Sinica, 2013, 17(3): 223-229. DOI: 10.3969/j.issn.1007-7847.2013.03.008 (in Chinese with English abstract) |
| [22] |
杨静, 沈世华. 植物Dof转录因子[J].
植物生理学通讯, 2010, 46(3): 301-308.
Yang J, Shen S H. Plant Dof transcription factor[J]. Chinese Journal of Plant Physiology, 2010, 46(3): 301-308. (in Chinese with English abstract) |
| [23] |
蔡晓锋, 张余洋, 张俊红, 等. 植物Dof基因家族功能研究进展[J].
植物生理学报, 2013, 49(1): 1-12.
Cai X F, Zhang Y Y, Zhang J H, et al. Progress in family function of plant Dof gene[J]. Chinese Journal of Plant Physiology, 2013, 49(1): 1-12. (in Chinese with English abstract) |
| [24] |
胡娟, 王丽鸳, 韦康, 等. 茶树CsCDF1基因克隆及表达分析[J].
茶叶科学, 2015, 35(5): 501-511.
Hu J, Wang L Y, Wei K, et al. Cloning and expression analysis of CsCDF1 gene in tea tree[J]. Tea Science, 2015, 35(5): 501-511. DOI: 10.3969/j.issn.1000-369X.2015.05.019 (in Chinese with English abstract) |
| [25] | Michaels S D, Amasino R M. FLOWERING LOCUS C encodes a novel MADS domain protein that acts as a repressor of flowering[J]. Plant Cell, 1999, 11(5): 949-956. DOI: 10.1105/tpc.11.5.949 |
| [26] |
张蓓, 刘同坤, 黄菲艺, 等. 不结球白菜开花基因BcFT的亚细胞定位及其互作蛋白的筛选[J].
南京农业大学学报, 2017, 40(4): 592-600.
Zhang B, Liu T K, Huang F Y, et al. Subcellular localization of BcFT and its interaction protein in flowering gene of non-heading Chinese cabbage[J]. Journal of Nanjing Agricultural Sciences, 2017, 40(4): 592-600. DOI: 10.7685/jnau.201612034 (in Chinese with English abstract) |
| [27] | Imaizumi T, Schultz T F, Harmon F G, et al. FKF1 F-box protein mediates cyclic degradation of a repressor of CONSTANS in Arabidopsis[J]. Science, 2005, 309: 293-297. DOI: 10.1126/science.1110586 |
| [28] |
彭凌涛. 控制拟南芥和水稻开花时间光周期途径的分子机制[J].
植物生理学通讯, 2006, 42(6): 1021-1031.
Peng L T. Molecular mechanism for controlling photoperiodic pathway in flowering time in Arabidopsis thaliana and in rice[J]. Acta Philosophica Sinica, 2006, 42(6): 1021-1031. (in Chinese with English abstract) |
| [29] |
李芳.大豆FKF1和GI基因克隆、表达模式及功能分析[D].北京: 中国农业科学院, 2012.
Li F. Molecular cloning, expression profiles and founctional analysis of FKF1 and GI genes in soybean(Glycine max)[D]. Beijing: Chinese Academy of Agricultural Sciences, 2012(in Chinese with English abstract). |




