文章信息
- 厉成敏, 朱乐乐, 李莲, 王根林
- LI Chengmin, ZHU Lele, LI Lian, WANG Genlin
- 重组牛脂多糖结合蛋白对脂多糖诱导的奶牛乳腺炎症反应指标的影响
- Effect of recombinant bovine lipopolysaccharide(rbLBP) on indicators of inflammation in lipopolysaccharide induced dairy cows
- 南京农业大学学报, 2018, 41(4): 715-721
- Journal of Nanjing Agricultural University, 2018, 41(4): 715-721.
- http://dx.doi.org/10.7685/jnau.201711022
-
文章历史
- 收稿日期: 2017-11-13
奶牛乳腺炎通常是指病原微生物在乳腺内感染所引起的一系列炎症反应。乳腺炎在奶牛的所有疾病中发病率最高并且难以治愈, 造成牛奶质和量的急剧下降, 甚至会危及奶牛的成活, 对奶业造成严重的危害。该病的防治在临床上严重依赖抗生素[1-2]的同时, 乳腺炎疫苗也应运而生, 但由于引起乳腺炎的微生物种类繁多, 使该方法应用前景受到很大限制[3]。因此加强奶牛乳腺炎抗病育种研究尤为迫切。
临床上30%~50%的奶牛乳腺炎是由革兰氏阴性菌引起的, 脂多糖(LPS)是革兰氏阴性菌胞壁高度保守的致病组分, 因此识别LPS是介导炎症和抗炎反应的首要环节。脂多糖结合蛋白(LBP)作为机体应对细菌入侵固有免疫反应的急性期蛋白, 在免疫反应中起关键作用。它既可将LPS多聚体转换为单体, 加速其与受体结合, 放大LPS的致炎作用; 也可催化LPS与高密度脂蛋白(HDI)结合, 中和LPS的生物学活性, 加速LPS的清除, 从而缓解炎症反应。有证据表明LBP在人免疫系统中具有浓度依赖性的双向作用, 在低剂量下, LBP增强LPS诱导的mCD14阳性细胞促炎症因子的表达, 如白介素1β(IL-1β)和肿瘤坏死因子α(TNF-α), 或者激活mCD14阴性细胞促炎性因子如白介素6(IL-6)和白介素8(IL-8)的表达; 而在高剂量情况下, LBP可以中和细菌内毒素产生的生物学效应, 反而下调某些促炎细胞因子的表达, 如TNF-α[4-5]。
在LPS诱导奶牛乳腺炎的信号通路中, Toll样受体4(TLR4)介导是必不可少的, LPS与TLR4相互作用, 通过CD14/LBP/TLR4复合物产生复杂的生化级联激活作用, 引起NF-κB抑制因子激酶(IKK-β和IKKγ)对抑制因子IκBs(主要是IκBα)磷酸化水解, NF-κB二聚体(通常是p65)被释放进入细胞核内。活化的NF-κB(通常是磷酸化的p65)参与先天免疫, 并转录调控相关炎性因子的表达, 从而促进炎症反应的发生。研究发现, 乳腺是LBP形成和发挥作用的重要部位[6-7], 奶牛患有乳腺炎时, LBP表达水平显著变化[8], 但关于LBP在乳腺炎中的具体作用及其调控TLR4/NF-κB信号的分子机制尚不清楚。
因此, 本研究采用不同剂量的重组LBP(rbLBP)处理LPS诱导的奶牛乳腺炎模型, 通过体细胞数检测、组织病理学观察、炎性因子及TLR4/NF-κB信号通路相关基因的表达来探讨rbLBP对奶牛乳腺炎症反应的影响及作用机制, 为奶牛乳腺炎抗炎药物的开发及其抗病育种研究提供依据。
1 材料与方法 1.1 主要试剂和仪器大肠杆菌LPS(O55:B5)(Sigma公司), 重组牛脂多糖结合蛋白(rbLBP)(R & D公司), IL-1β、IL-6、TNF-α的ELISA试剂盒(上海丽臣生物技术有限公司), β-actin抗体、兔源p65单克隆抗体、兔源磷酸化p65单克隆抗体、鼠源TLR4多克隆抗体、HRP-羊抗兔抗体、HRP-羊抗鼠抗体购自CST, BCA蛋白浓度试剂盒(碧云天生物技术有限公司), 反转录试剂盒、实时定量试剂盒(TaKaRa), RNA提取试剂盒(Omega Biotec)。石蜡切片机(Leica RM2235), KD-P展片机(浙江省金华市科迪仪器设备制造厂), 烘片机(LeicaHI1220), 光学显微镜(Nikon YS100), 光学成像系统(Nikon 80i), 凝胶成像系统(Las-4000), 荧光定量PCR仪(ABI StepOnePlusTM)。
1.2 试验动物试验在江苏省宿迁市泗洪县卫岗爱德牧业奶牛场进行。选4头泌乳中后期、体质量为(500±25)kg的健康经产荷斯坦奶牛。以玉米、豆粕、麦麸、青贮、苜蓿干草及羊草为主要原料配制基础饲粮, 日粮养分满足我国农业行业标准(奶牛饲养标准:NY/T 34—2004)推荐的营养需求。试验奶牛采用拴饲, 每日07:00和17:00进行饲喂, 自由饮水。
1.3 试验设计与分组试验采用4×4拉丁方设计, 分4期进行, 每期15 d。其中1 d为试验期, 后14 d为恢复期。在正式试验前预试15 d。试验分为4组:①LPS模型组, 75%乙醇消毒乳房, 沿乳头管插入通乳针, 分别向各乳区灌注剂量为0.2 μg·kg-1 LPS; ②低剂量rbLBP处理组, 分别经过乳头管灌注0.2 μg·kg-1 LPS以及1 μg rbLBP; ③高剂量rbLBP处理组, 分别经过乳头管灌注0.2 μg·kg-1 LPS以及20 μg rbLBP; ④对照组仅灌注等量灭菌生理盐水。LPS、rbLBP采用无热源生理盐水溶解。
1.4 样品采集 1.4.1 乳样和血样采集分别于灌注0、3、6、12、24 h后采集乳汁和血液样品, 用于后续试验分析。
1.4.2 乳腺组织样品采集在每次乳腺灌注24 h后乳腺活体取样。术前牛尾静脉注射盐酸甲苯噻嗪, 在牛乳腺后乳区正后方上1/3处, 剃毛后消毒。拨开乳区术部中心点皮肤和皮下筋膜, 插入取样器取样。样品置于液氮后转存-80 ℃冰箱中用于后续分析。
1.5 试验方法 1.5.1 体温测定测量前甩体温计至35 ℃以下, 用75%乙醇棉球消毒, 一手持体温计, 旋转插入直肠约2/3后固定。测量前体温计后端用棉线拴系一个夹子, 体温计插入直肠后用夹子夹住奶牛皮肤固定。分别测定灌注后0、3、6、12、24 h的奶牛直肠温度。
1.5.2 体细胞数的测定分别于灌注0、3、6、12、24 h后采集乳汁, 4 ℃保存, 在江苏省奶牛生产性能测定中心DHI实验室检测体细胞数(SCC)。
1.5.3 血液中白细胞数的测定分别采集灌注后0、3、6、12、24 h的血样置于4 ℃保温盒中并立即送往宿迁市人民医院进行血常规分析, 自动血液分析仪型号为MEK-6318K型(日本Nihon Kohden)。
1.5.4 髓过氧化物酶(MPO)活性测定通过MPO试剂盒(上海酶联生物科技有限公司)检测灌注后24 h的奶牛血清及乳腺组织中MPO活性。MPO活性单位以U·L-1和U·g-1表示。
1.5.5 实时荧光定量(qPCR)测定提取灌注后24 h的乳腺组织总RNA, 反转录成cDNA, 再进行qPCR反应, 测定炎症相关细胞因子(以下简称炎性因子) IL-6、TNF-α、IL-1β、NF-κB和TLR4的mRNA表达量。引物合成由南京金斯瑞生物科技有限公司完成, 引物见表 1。qPCR利用TaKaRa的试剂盒, 25 μL体系如下:Premix Ex TaqTM Ⅱ(2×)12.5 μL, 上、下游引物(10 μmol·L-1)各1 μL, 模板cDNA 2 μL; 灭菌蒸馏水8.5 μL。反应条件:95 ℃ 30 s; 95 ℃ 5 s, 60 ℃ 1 min, 40个循环; 95 ℃ 15 s, 60 ℃ 30 s, 95 ℃ 15 s。用2-ΔΔCT法计算各基因的相对表达量。
| 基因名称 Gene name |
登录号 Accession No. |
预期产物长度/bp Product size |
引物对序列(5′→ 3′) Primer pairs sequence |
| IL-6 | NM_173923.2 | 153 | TGCTGGTCTTCTGGAGTATC/GTGGCTGGAGTGGTTATTG |
| IL-1β | NM_174093.1 | 264 | CGTCTTCCTGGGACATTTTCG/GTCTGAGGATGGGCTCTGGG |
| TNF-α | NM_173966 | 175 | ACCCAGCCAACAGAAGC/CCAGACGGGAGACAGGA |
| NF-κB | XM_005226181.1 | 249 | AAGAGAAGATGGGGAAAGGCTG/CGTCGGCAAATGAGAAGTAGTG |
| TLR4 | NW_003103900.1 | 166 | TCCCACATCCTCGGTTCCC/TCCATCCCAAGCCATCCCT |
| GAPDH | NM_001034034.2 | 232 | CCAGACGGGAGACAGGA/CCATCCACAGTCTTCTGGGT |
将灌注后24 h的乳腺组织匀浆, 收集上清液, 用ELISA试剂盒测定IL-1β、IL-6及TNF-α含量。
1.5.7 Western blot法测定组织中TLR4及NF-κB的表达提取灌注后24 h的各组乳腺组织的总蛋白, 测定蛋白浓度(碧云天BCA试剂盒), 均一化蛋白浓度后, 变性, 点样, 将蛋白转到聚偏二氟乙烯膜(PVDF), 先用50 g·L-1牛血清白蛋白(BSA)封闭2 h, 然后加β-actin、p65、磷酸化的p65及TLR4抗体(1:1 000稀释)4 ℃孵育过夜, 再用TBST洗3次后, 用HRP-羊抗兔抗体、HRP-羊抗鼠抗体(1:5 000)孵育2 h, TBST洗3次, 用ECL化学发光试剂盒在WB检测系统中进行显影。
1.6 数据统计处理试验数据以平均值±标准误(x±SE)表示, 用SPSS 20.0软件对数据进行处理, 并进行单因素方差分析(One-way ANOVA)。
2 结果与分析 2.1 不同剂量rbLBP处理对奶牛直肠温度的影响如图 1所示:与对照组相比, LPS模型组在灌注LPS后, 奶牛的直肠温度升高, 并在灌注3 h后达最高(P < 0.01), 随后逐渐降低。但是相较于LPS模型组, 低剂量rbLBP处理组奶牛直肠温度较高, 差异不显著; 高剂量rbLBP处理组奶牛直肠温度较低, 并在LPS灌注3、6 h后差异显著。
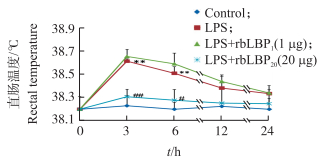
|
图 1 rbLBP对奶牛直肠温度的影响(n=4)
Figure 1 Effect of rbLBP on rectal temperature in dairy cows
*和**分别表示在0.05和0.01水平与对照组相比差异显著和极显著; #和##分别表示在0.05和0.01水平与LPS模型组相比差异显著和极显著。下同。
The results are represented as the x±SE(n=4).*P < 0.05 and**P < 0.01 compared to the control group, # P < 0.05 and ## P < 0.01 compared to the LPS model group. The same as follows. Control:对照组Control group; LPS:LPS模型组LPS model group; LPS+rbLBP1:低剂量rbLBP处理组Low dose of rbLBP(1 μg); LPS+rbLBP20:高剂量rbLBP处理组High dose of rbLBP(20 μg). |
如图 2所示:与对照组相比, LPS模型组奶牛乳汁中体细胞数在灌注6 h后极显著增加(P < 0.01), 随后逐渐下降, 但LPS模型组的体细胞数仍显著高于对照组。与LPS模型组相比, 低剂量rbLBP处理组体细胞数增加, 高剂量rbLBP处理组体细胞数下降, 并在LPS灌注6 h后差异显著。
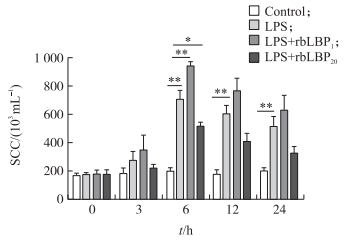
|
图 2 rbLBP对乳汁中体细胞数(SCC)的影响(n=4) Figure 2 Effects of rbLBP on somatic cellcount(SCC)in dairy cows |
如图 3所示:与对照组相比, LPS模型组奶牛血液中白细胞数在灌注LPS 6 h后降到最低(P < 0.01), 随后逐渐上升, 但在灌注24 h后, LPS模型组的白细胞数仍显著低于对照组。与LPS模型组相比, 低剂量rbLBP处理组白细胞数下降, 并在LPS灌注12 h后差异极显著(P < 0.01), 高剂量rbLBP处理组白细胞数上升, 并在LPS灌注6、12 h后差异显著。
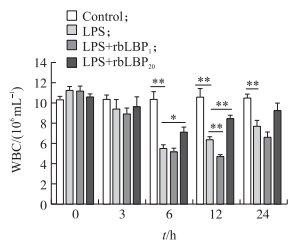
|
图 3 rbLBP对奶牛血液中白细胞(WBC)数的影响 Figure 3 Effects of rbLBP on white blood cells(WBC) number in dairy cows |
图 4结果显示:与正常对照组相比, 灌注LPS后, LPS模型组乳腺组织中MPO活性显著增加(P < 0.05)。与模型组相比, 低剂量rbLBP处理组乳腺组织中MPO活性显著增加, 高剂量rbLBP处理组MPO活性显著下降。而血清中MPO活性变化趋势与之相反。

|
图 4 rbLBP对奶牛血清及乳腺组织中MPO活性的影响 Figure 4 Effects of rbLBP on MPO activity in mammary gland tissue and serum of dairy cows |
图 5结果显示:与对照组相比, LPS模型组奶牛组织中炎性因子TNF-α、IL-1β、IL-6的mRNA及蛋白表达量均极显著升高(P < 0.01)。与LPS模型组相比, 低剂量rbLBP处理组乳腺组织中炎性因子TNF-α、IL-1β、IL-6的表达量均明显升高(P < 0.05), 而高剂量rbLBP处理组乳腺组织中炎性因子TNF-α、IL-1β、IL-6的表达量均显著(P < 0.05)或极显著(P < 0.01)下降。

|
图 5 rbLBP对奶牛乳腺组织中炎性因子mRNA及蛋白表达量的影响 Figure 5 Effects of rbLBP on mRNA and protein expression level of inflammatory factors in mammary gland of dairy cows |
图 6结果显示:与对照组相比, LPS模型组奶牛组织中炎性因子TLR4及NF-κB的mRNA及蛋白表达量均极显著升高(P < 0.01)。与LPS模型组相比, 低剂量rbLBP处理组乳腺组织中TLR4及NF-κB的mRNA表达水平均显著升高(P < 0.05), 蛋白的表达水平均极显著升高(P < 0.01)。而高剂量rbLBP处理组乳腺组织中炎性因子TLR4及NF-κB的mRNA表达水平显著(P < 0.05)或极显著(P < 0.01)下降, 蛋白表达水平均极显著下降(P < 0.01)。

|
图 6 rbLBP对奶牛乳腺组织中TLR4及NF-κB mRNA和蛋白表达量的影响 Figure 6 Effects of rbLBP on mRNA and protein expression level of TLR4 and NF-κB in mammary gland of dairy cows |
LBP作为机体应对细菌入侵固有免疫反应的急性期反应蛋白, 在机体发生炎症反应时, 能够发挥促炎和抗炎的双重作用, 并具有浓度依赖性。低剂量LBP能够增强宿主对LPS的免疫应答, 放大LPS的致炎作用; 而高剂量LBP能够抑制LPS的生物学活性, 加速LPS的清除, 从而发挥抗炎作用[9]。本试验以LPS诱导的奶牛乳腺炎模型为研究对象, 探讨不同剂量rbLBP对奶牛乳腺炎症反应的影响及其可能的作用机制。试验结果表明, 不同剂量rbLBP对LPS诱导的奶牛乳腺炎症反应发挥着增敏和抗炎的双重作用。
众所周知发热是LPS诱导炎症反应的主要特征之一, 本试验中灌注LPS后奶牛的直肠温度升高, 该反应与国外相关报道一致[10-11]。但是相较于LPS模型组, 低剂量LBP组奶牛直肠温度较高; 高剂量LBP组奶牛直肠温度较低。SCC是衡量奶牛乳房健康状况及泌乳遗传潜力性能发挥的重要指标之一, 患乳腺炎的奶牛SCC会明显大量增加, 并且其患病程度与乳中SCC呈正相关[12-13]。在本试验中, LPS模型组在灌注LPS后, 乳汁中的SCC呈先升髙后降低的趋势, 并在灌注6 h后达到最高, 这与Zarrin等[11]的研究结果相一致。但与LPS模型组相比, 低剂量rbLBP处理组体细胞数增加, 高剂量rbLBP处理组体细胞数下降。血液中白细胞数是体现免疫功能和机体状况的重要指标。奶牛受到LPS刺激后, 血液中白细胞很快从血液进入到乳腺组织中, 从而参与机体免疫反应, 用于消灭病原菌和修复损伤的组织。本试验中LPS模型组奶牛血液中白细胞数在灌注LPS后6~24 h一直显著低于对照组, 这与Vels等[14]的结论一致。但是相较于LPS模型组, 低剂量rbLBP处理组白细胞数较低, 高剂量rbLBP处理组的白细胞数较高。这表明低剂量rbLBP加剧了LPS诱导的奶牛乳腺炎的临床反应, 而高剂量rbLBP组奶牛乳腺炎的临床反应程度明显缓解。
髓过氧化物酶(MPO)是中性粒细胞的活化标志物, 其水平及活性变化代表着嗜中性多形核白细胞(PMN)的功能和活性状态, 中性粒细胞从血液向感染部位的迁移速度决定了乳腺炎的严重程度[15]。本试验结果显示, 与模型组相比, 低剂量rbLBP处理组乳腺组织中MPO活性明显上升, 高剂量rbLBP处理组MPO活性明显下降, 血清中MPO活性变化趋势与之相反。这说明低剂量的rbLBP能够加速中性粒细胞从血液向感染乳腺部位的迁移, 从而加剧炎症反应; 而高剂量rbLBP抑制了中性粒细胞向乳腺感染部位的迁移募集, 从而缓解炎症反应。
研究表明, 当LPS诱导机体时, 机体先天免疫系统会作出反应, 主要表现为产生大量的炎性细胞因子, 如TNF-α、IL-1β和IL-6表达水平升高[8, 16]。TNF-α是最早产生的炎性细胞因子, 能够启动炎症级联反应, 可以刺激其他炎性细胞因子如IL-1β及IL-6的产生, 通过启动这些细胞因子, 可以放大及延续炎症反应, 使炎症反应持续扩散, 从而对机体造成严重损伤[17]。本试验结果显示, 低剂量rbLBP能够显著上调乳腺组织中炎性因子TNF-α、IL-1β、IL-6表达量, 而高剂量rbLBP则明显抑制了乳腺组织中炎性因子TNF-α、IL-1β、IL-6的表达。该结果表明, 低剂量rbLBP加剧了LPS诱导的奶牛乳腺组织炎性损伤, 而高剂量rbLBP能够减轻LPS诱导的奶牛乳腺组织炎性损伤。
TLR4在先天性免疫中发挥主导作用, 它能够识别革兰氏阴性菌LPS, 介导多种免疫细胞表达免疫调节相关蛋白, 诱导促炎细胞因子的产生, 从而发挥免疫调节作用[18]。LPS-LBP结合通过TLR4信号通路激活NF-κB信号通路, 进而调控大量下游基因的表达, 如多种炎性细胞因子IL-1β、L-6、TNF-α等, 从而促进炎症发应的发生[19]。本试验结果表明, 低剂量的rbLBP能够上调乳腺组织中TLR4及NF-κB的表达, 促进LPS诱导的NF-κB激活, 从而产生过量的促炎细胞因子, 造成乳腺组织炎性损伤加重。而高剂量的LBP能够抑制TLR4/NF-κB信号通路的激活, 从而抑制炎性因子的表达, 减轻LPS造成的乳腺组织损伤。有研究表明, 高剂量的LBP能够诱导LPS与血液中高密度脂蛋白以及低密度脂蛋白相结合, 从而中和LPS的毒性作用, 这应该是高剂量LBP的抗炎作用[20]。其他相关分子机制仍需进一步的研究。
综上所述, rbLBP对LPS诱导的奶牛乳腺炎症反应具有浓度依赖性的双向作用。低剂量的rbLBP能够促进TLR4/NF-κB信号通路的激活, 上调炎性细胞因子的表达, 从而加剧了乳腺组织炎性损伤。而高剂量rbLBP能够抑制TLR4/NF-κB信号通路的激活, 抑制其下游炎性因子的转录表达, 从而缓解了LPS诱导的奶牛乳腺的炎性损伤。
| [1] | Bannerman D D, Goldblum S E. Mechanisms of bacterial lipopolysaccharide-induced endothelial apoptosis[J]. Am J Physiol Lung Cell Mol Physiol, 2003, 284(6): 899-914. DOI: 10.1152/ajplung.00338.2002 |
| [2] |
王亨, 孟霞, 邱昌伟, 等. 脂多糖诱导奶牛乳腺上皮细胞先天性免疫反应[J].
中国兽医学报, 2010, 30(3): 398-401.
Wang H, Meng X, Qiu C W, et al. The innate immune responses of bovine mammary epithelial cells stimulated by lipopolysaccharide[J]. Chinese Journal of Veterinary Science, 2010, 30(3): 398-401. (in Chinese with English abstract) |
| [3] | Wang Y, Zarlenga D S, Paape M J, et al. Recombinant bovine soluble CD14 sensitizes the mammary gland to lipopolysaccharide[J]. Vet Immunol Immunopathol, 2002, 86(1/2): 115-124. |
| [4] | Huang X, Zeng Y, Jiang Y, et al. Lipopolysaccharide-binding protein downregulates fractalkine through activation of p38 MAPK and NF-kappaB[J]. Mediators Inflamm, 2017. DOI: 10.1155/2017/9734837 |
| [5] |
余盼, 孙宇, 王根林, 等. 乳房炎奶牛乳腺组织中TLR4/p38的表达差异分析[J].
南京农业大学学报, 2015, 38(6): 967-972.
Yu P, Sun Y, Wang G L, et al. Alteredexpressions of TLR4/p38 singaling pathway in mammary tissue of Chinese Holstein cows with mastitis[J]. Journal of Nanjing Agricultural University, 2015, 38(6): 967-972. DOI: 10.7685/j.issn.1000-2030.2015.06.014 (in Chinese with English abstract) |
| [6] | Strandberg Y, Grgay C, Vuocolo T, et al. Lipopolysaccharide and lipoteichoic acid induce different innate immune responses in bovine mammary epithelial cells[J]. Cytokine, 2005, 31(1): 72-86. DOI: 10.1016/j.cyto.2005.02.010 |
| [7] | Reyad Y A, Berbar M A, Hussain M. Comparison of statistical, LBP, and multi-resolution analysis features for breast mass classification[J]. J Med Syst, 2014, 38(9): 100. DOI: 10.1007/s10916-014-0100-7 |
| [8] | Gilbert F B, Cunha P, Jensen K, et al. Differential response of bovine mammary epithelial cells to Staphylococcus aureus or Escherichia coli agonists of the innate immune system[J]. Vet Res, 2013, 44: 40. DOI: 10.1186/1297-9716-44-40 |
| [9] | Sun Y, Li L, Wu J, et al. Bovine recombinant lipopolysaccharide binding protein(BRLBP)regulated apoptosis and inflammation response in lipopolysaccharide-challenged bovine mammary epithelial cells(BMEC)[J]. Mol Immunol, 2015, 65(2): 205-214. DOI: 10.1016/j.molimm.2015.01.026 |
| [10] | Reid E D, Fried K, Velasco J M, et al. Correlation of rectal temperature and peripheral temperature from implantable radio-frequency microchips in Holstein steers challenged with lipopolysaccharide under thermoneutral and high ambient temperatures[J]. J Dairy Sci, 2012, 90(13): 4788-4794. |
| [11] | Zarrin M, Wellnttz O, van Dorland H A, et al. Induced hyperketonemia affects the mammary immune response during lipopolysaccharide challenge in dairy cows[J]. J Dairy Sci, 2014, 97(1): 330-339. DOI: 10.3168/jds.2013-7222 |
| [12] |
甘宗辉, 杨章平, 李云龙, 等. 奶牛乳房炎的细菌感染与奶中体细胞数及乳成分的关系[J].
畜牧兽医学报, 2013, 44(6): 972-979.
Gan Z H, Yang Z P, Li Y L, et al. Relationship of bacterial infection with somatic cell count and milk composition in dairy cows with mastitis[J]. Acta Veterinara et Zootechnica Sinica, 2013, 44(6): 972-979. DOI: 10.11843/j.issn.0366-6964.2013.06.021 (in Chinese with English abstract) |
| [13] |
汪悦, 王炳, 苏汉书, 等. 牛奶体细胞生成与乳品质量和安全的关系[J].
动物营养学报, 2017, 29(7): 2269-2277.
Wang Y, Wang B, Su H S, et al. Relationship between milk somatic cell formation and milk quality and safety[J]. Chinese Journal of Animal Nutrition, 2017, 29(7): 2269-2277. (in Chinese with English abstract) |
| [14] | Vels L, Rontved C M, Bjerring M, et al. Cytokine and acute phase protein gene expression in repeated liver biopsies of dairy cows with a lipopolysaccharide-induced mastitis[J]. J Dairy Sci, 2009, 92(3): 922-934. DOI: 10.3168/jds.2008-1209 |
| [15] | Zhang Z, Wang X, Li R, et al. Genetic mutations potentially cause two novel NCF1 splice variants up-regulated in the mammary gland, blood and neutrophil of cows infected by Escherichia coli[J]. Microbiol Res, 2015, 174: 24-32. DOI: 10.1016/j.micres.2015.03.005 |
| [16] | Cronin J G, Turner M L, Goetze L, et al. Toll-like receptor 4 and MYD88-dependent signaling mechanisms of the innate immune system are essential for the response to lipopolysaccharide by epithelial and stromal cells of the bovine endometrium[J]. Biol Reprod, 2012, 86(2): 51. |
| [17] | Liu M, Song S, Li H, et al. The protective effect of caffeic acid against inflammation injury of primary bovine mammary epithelial cells induced by lipopolysaccharide[J]. J Dairy Sci, 2014, 97(5): 2856-2865. DOI: 10.3168/jds.2013-7600 |
| [18] | Brightbill H D, Mondlin R L. Toll-like receptors:molecular mechanisms of the mammalian immune response[J]. Immunology, 2000, 101(1): 1-10. DOI: 10.1046/j.1365-2567.2000.00093.x |
| [19] | Ghosh S, Febin J. Non-canonical pathway network modelling and ubiquitination site prediction through homology modelling of NF-kappaB[J]. Gene, 2016, 581(1): 48-56. DOI: 10.1016/j.gene.2016.01.025 |
| [20] | WurfelL M M, Kunitake S T, Lichenatein H, et al. Lipopolysaccharide(LPS)-binding protein is carried on lipoproteins and acts as a cofactor in the neutralization of LPS[J]. J Exp Med, 1994, 180(3): 1025-1035. DOI: 10.1084/jem.180.3.1025 |




