文章信息
- 冯楠楠, 王冰洁, 朱启航, 郑王龙, 邹辉, 顾建红, 袁燕, 刘学忠, 刘宗平, 卞建春
- FENG Nannan, WANG Bingjie, ZHU Qihang, ZHENG Wanglong, ZOU Hui, GU Jianhong, YUAN Yan, LIU Xuezhong, LIU Zongping, BIAN Jianchun
- 玉米赤霉烯酮通过PI3K/Akt/mTOR通路诱导大鼠睾丸支持细胞自噬及对细胞周期分布的影响
- Effects of zearalenone on the autophagy and cell cycle of sertoli cells by PI3K/Akt/mTOR pathway
- 南京农业大学学报, 2018, 41(4): 708-714
- Journal of Nanjing Agricultural University, 2018, 41(4): 708-714.
- http://dx.doi.org/10.7685/jnau.201712033
-
文章历史
- 收稿日期: 2017-12-25
2. 江苏省动物重要疫病与人兽共患病防控协同创新中心, 江苏 扬州 225009
2. Jiangsu Co-innovation Center for Prevention and Control of Important Animal Infectious Diseases and Zoonoses, Yangzhou 225009, China
玉米赤霉烯酮(zeralenone, ZEA)又称F-2毒素, 是从污染的玉米、小麦、高粱等谷物中检测出来的一种由多种镰刀菌属产生的非甾体类霉菌毒素, 具有类雌激素样作用[1-2]。ZEA具有多种毒性作用, 包括生殖毒性、遗传毒性、免疫毒性等, 其中影响最为严重的是生殖毒性。大量的动物研究结果表明, ZEA及其衍生物具有强烈的雌激素样作用和代谢性活性, 并能够引起生殖道的改变[3]。目前国内外ZEA的研究方向主要集中在对雌性动物内分泌和雄性动物睾丸间质细胞的影响, 关于ZEA对睾丸支持细胞(sertoli cell, SC)的毒性及机制的研究报道不多。近年来研究表明, 睾丸支持细胞功能的改变会影响生精细胞功能障碍。因此, 搞清ZEA对睾丸支持细胞的毒性影响对揭示ZEA的雄性生殖毒性机制具有重要意义。
细胞周期调控是一个复杂和精细的过程, 与多种信号通路和周期蛋白、调控因子密切相关[4]。徐琛玮等[5]发现脱氧雪腐镰刀菌烯醇介导的G2/M阻滞是通过细胞外调节蛋白激酶1/2(extracellular regulated protein kinases 1/2, ERK1/2)信号通路增强p21水平实现的。有文献报道, 高浓度的ZEA可以使小鼠的胸腺上皮细胞周期显著阻滞在G2/M期[6]。本试验前期研究已经表明, ZEA可以诱导睾丸支持细胞自噬的发生[7], 但其具体分子机制仍不清楚。PI3K/Akt/mTOR信号通路是影响细胞自噬的重要通路[8], 以mTOR为靶点的PI3K/Akt介导细胞增殖、分化、迁移、凋亡、自噬等多种生理功能[9]。本试验以雄性Wistar大鼠原代睾丸支持细胞为材料, 探究了ZEA对支持细胞周期分布的影响, 以及自噬相关通路PI3K/Akt/mTOR的活化在ZEA对SC细胞周期分布影响中的作用, 旨在为揭示ZEA雄性生殖毒性机制及ZEA中毒的防控提供理论依据。
1 材料与方法 1.1 试验动物18~21 d健康雄性Wistar大鼠, 由扬州大学比较医学中心提供。
1.2 主要试剂玉米赤霉烯酮(zearalenone, ZEA)(美国Sigma公司); F-12培养基、胎牛血清(美国Gibco公司); PI3K抑制剂(Medchem Express, MCE); 细胞周期检测试剂盒(BD公司); RIPA裂解液、蛋白酶抑制剂复合物(北京普利莱基因技术有限公司); LC3、PI3K、磷酸化PI3K(p-PI3K)、Akt、p-Akt、GAPDH等抗体(美国CST公司); 其余试剂均为国产分析纯。
1.3 Western blot法检测PI3K/Akt/mTOR通路和细胞周期相关蛋白表达将对数期的SC培养在100 mm培养皿中, 分别设立0、5、10、20 μmol·L-1 ZEA及对照组、20 μmol·L-1 ZEA组、PI3K抑制剂LY294002组、LY294002+ZEA组, 均处理24 h。处理结束后, 弃去培养皿内培养液, 用预冷PBS漂洗2次后加入200 μL含有蛋白酶抑制剂的RIPA裂解液, 刮下细胞, 转移至1.5 mL离心管中, 于冰上裂解30 min后, 超声波细胞破碎仪将细胞间歇裂解30 s。12 000 r·min-1离心10 min后收集上清液, 采用BCA蛋白分析试剂盒检测蛋白质浓度, 调整各组蛋白浓度一致, 按1:5的比例加入6倍蛋白上样缓冲液, 煮沸10 min后存放于-80 ℃备用。将上述蛋白样品室温溶解, 取10 μL加入Western blot的浓缩胶中进行电泳, 电泳分离后将蛋白转膜至硝酸纤维素膜(NC)膜或聚偏二氟乙烯膜(PVDF)膜上, 用5%的脱脂乳奶粉室温封闭处理2 h, 4 ℃孵育一抗过夜。次日用TBST 110 r·min-1振荡培养, 洗涤5次, 孵育二抗2 h; 用TBST洗涤, 用发光液显影检测PI3K/Akt/mTOR通路相关蛋白PI3K、p-PI3K、Akt、p-Akt、mTOR、p-mTOR、P7056K、p-7056K和周期蛋白Cdc2、CyclinB1、p-Cdc2、Cd25B、p-histone H3的表达水平。
1.4 免疫荧光法检测PI3K抑制剂处理后SC自噬中LC3聚点将睾丸支持细胞接种于含有爬片的24孔板, 并设对照组、ZEA(20 μmol·L-1)处理组、PI3K抑制剂(10 μmol·L-1)处理组以及ZEA+PI3K处理组。在处理SC 24 h后, 弃去培养液, 预冷的PBS清洗2次后用4%(体积分数)多聚甲醛在4 ℃下固定30 min; 再用PBS漂洗3次, 室温下用0.5% Triton X-100进行透膜20 min, 再次用PBS漂洗2次后加入5% BSA室温下封闭20 min; 弃掉多余液体, 加入LC3一抗在4 ℃下孵育过夜; 用PBS洗涤3次, 再加入FITC标记的二抗于室温避光作用1 h, 用PBS清洗后加入10 mg·mL-1的DIPA作用15 min, 再用PBS洗涤2次后封片, 在荧光显微镜下观察。
1.5 流式细胞术法分析ZEA对细胞周期的影响用不同浓度的ZEA处理睾丸支持细胞24 h后, 用胰酶消化细胞, 1 500 r·min-1离心8 min, 弃去上清液后加入预冷的PBS再次离心, 弃去上清液, 再缓慢滴加预冷的75%(体积分数)乙醇后吹悬, 置于-20 ℃保存。检测前, 1 200 r·min-1离心5 min收集细胞, 每管细胞样品中加入0.4 mL碘化丙啶染色液, 并将细胞缓慢充分重悬, 于37 ℃避光静置30 min。染色完成后1 h内用流式细胞仪检测红色荧光, 激发波长为488 nm。
1.6 免疫荧光法检测磷酸化组蛋白H3(p-histone H3)的表达情况用0、5、10、20 μmol·L-1的ZEA处理对数期的SC 24 h, 免疫荧光法检测p-histone H3蛋白的表达, 步骤同1.4节。
1.7 流式细胞术分析PI3K/Akt/mTOR通路对细胞周期的影响将处于对数期的睾丸支持细胞分别设对照组、ZEA(20 μmol·L-1)组、PI3K抑制剂(LY294002, 10 μmol·L-1)组、LY294002+ZEA组, 处理24 h后, 流式细胞术分析PI3K/Akt/mTOR通路对细胞周期的影响, 步骤同1.5节。
1.8 数据的统计与分析所有数据采用SPSS 22.0统计软件进行单因素方差分析(one-way ANOVA), 用LSD法进行多重比较, 数据结果均以x±SD表示。
2 结果与分析 2.1 ZEA对SC中PI3K/Akt/mTOR通路相关蛋白表达的影响不同浓度的ZEA(0、5、10、20 μmol·L-1)处理细胞24 h后, 利用Western blot检测信号通路关键蛋白PI3K、Akt、mTOR、P70S6K的表达。结果如图 1所示:在一定浓度范围内, 随着ZEA浓度的升高, PI3K、Akt、mTOR、P70S6K蛋白磷酸化水平逐渐下降。与对照相比, PI3K蛋白磷酸化水平在5 μmol·L-1时显著下降(P < 0.01), 而P70S6K、Akt、mTOR蛋白磷酸化水平变化无显著性差异; 当ZEA浓度大于10 μmol·L-1时PI3K、Akt、P70S6K蛋白磷酸化水平极显著下降(P < 0.01), 而mTOR蛋白的磷酸化水平显著下降(P < 0.05), 表明ZEA可以通过激活PI3K/Akt/mTOR信号通路诱导自噬的发生。
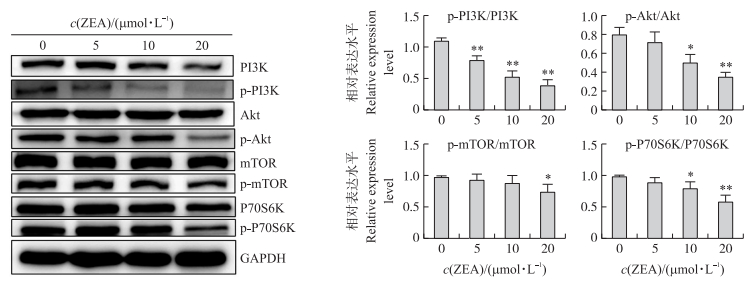
|
图 1 不同浓度ZEA对支持细胞(SC)中PI3K/Akt/mTOR信号通路相关蛋白磷酸化水平的影响 Figure 1 Effects of different concentrations of ZEA on the PI3K/Akt/mTOR signaling pathway phosphorylated protein in sertoli cells(SC) *和**分别表示与对照组相比差异显著(P < 0.05)和差异极显著(P < 0.01)。图 4和图 5同此。 *shows significant difference compared with control group(P < 0.05);**shows highly significant difference(P < 0.01)compared with control group. The same as in Fig. 4 and Fig. 5. |
为了进一步明确PI3K/Akt/mTOR信号通路在自噬中的作用, 加入PI3K抑制剂LY294002后, 在荧光显微镜(FCM)下观察。结果如图 2所示:与对照组相比, ZEA处理组LC3荧光信号的细胞数增加, 而且单个细胞的荧光强度增强; 与ZEA处理组相比, LY294002+ZEA共处理组LC3的荧光信号极显著增强(P < 0.01), 带有荧光信号的细胞数也明显增多(P < 0.05), 荧光聚点更加明显。
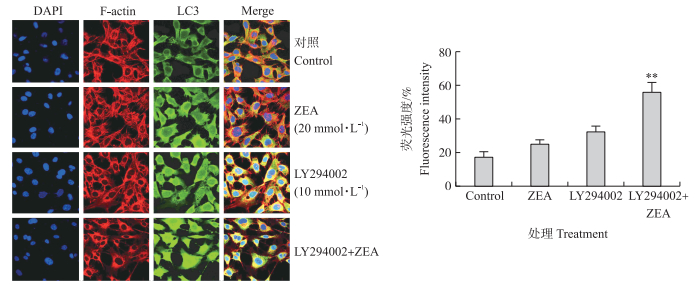
|
图 2 PI3K抑制剂LY294002对ZEA诱导SC中LC3聚点的影响 Figure 2 Effects of PI3K inhibitor LY294002 on ZEA induced LC3 fluorescence in SC *和**分别表示与处理组(ZEA)相比差异显著(P < 0.05)和差异极显著(P < 0.01)。图 3、图 6和图 7同此。 *shows significant difference compared with treatment(ZEA)group(P < 0.05);**shows highly significant difference(P < 0.01)compared with treatment(ZEA)group. The same as in Fig. 3, Fig. 6 and Fig. 7. |
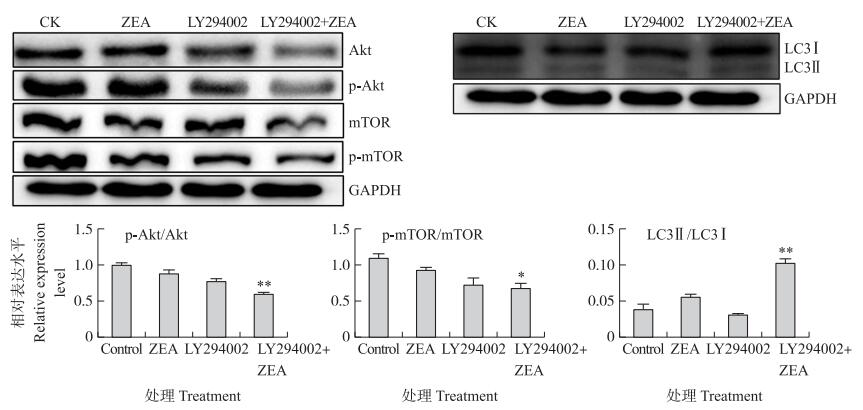
为了进一步验证PI3K/Akt/mTOR信号通路在自噬中的作用, 使用PI3K抑制剂LY294002处理细胞, Western blot检测蛋白p-Akt/Akt、p-mTOR/mTOR、LC3Ⅱ/LC3Ⅰ的表达。结果(图 3)显示:LY294002+ZEA处理组与ZEA处理组相比, Akt蛋白的磷酸化水平极显著下降(P < 0.01), mTOR蛋白的磷酸化水平显著下降(P < 0.05), LC3Ⅱ/LC3Ⅰ表达量极显著升高(P < 0.01), 表明PI3K/Akt/mTOR信号通路在ZEA诱导睾丸支持细胞自噬中起负调控作用。
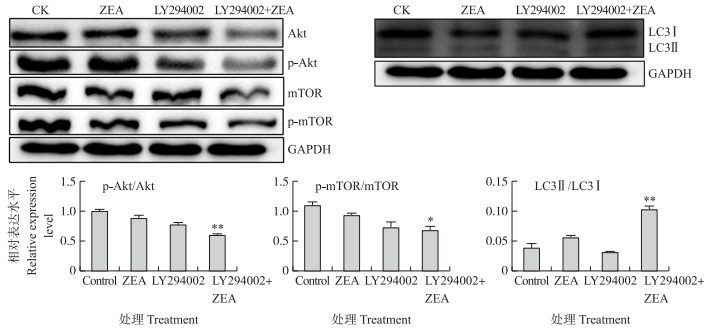
|
图 3 PI3K抑制剂对ZEA诱导SC中AKT、mTOR、LC3蛋白表达的影响 Figure 3 Effects of PI3K inhibitor on ZEA induced AKT, mTOR, LC3 protein expression in SC |
分别用不同浓度的ZEA处理SC 24 h, 通过Western-blot检测G2/M期细胞相关蛋白的表达情况。结果(图 4)显示:与对照组相比, ZEA浓度大于5 μmol·L-1剂量组Cdc2、CyclinB1、Cdc25B蛋白表达水平均极显著下调(P < 0.01), 细胞有丝分裂期的标志蛋白p-histone H3的表达量也逐渐降低, 并呈剂量依赖性(P < 0.01)。说明ZEA在一定浓度范围内能显著抑制睾丸支持细胞的增殖, 并将细胞阻滞在G2/M期。

|
图 4 ZEA对睾丸支持细胞周期蛋白表达的影响 Figure 4 Effect of ZEA on the expression of cell cycle protein in sertoli cells |
p-histone H3是细胞有丝分裂期的标志蛋白。荧光共聚焦显微镜(FCM)观察FITC标记的p-histone H3的阳性表达(绿色荧光), 定位于处于分裂期的SC核内, 而用DIPA标记的细胞核呈现绿色荧光。免疫荧光结果(图 5)显示:20 μmol·L-1 ZEA处理后表达p-histone H3的细胞数与对照组相比明显减少, 进一步证实给予ZEA处理可以减少M期细胞数。综合FCM、Western blot法和免疫荧光法检测结果, ZEA处理可以诱导SC细胞周期发生G2期阻滞。
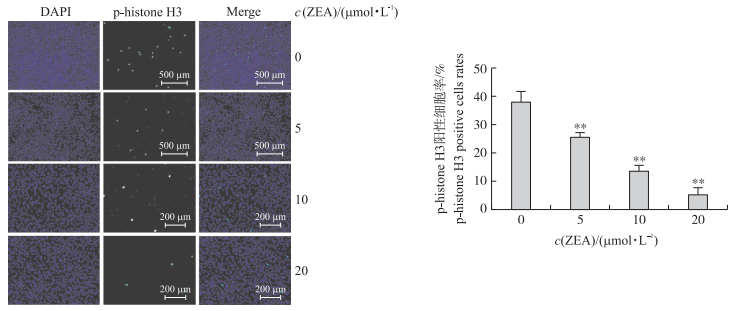
|
图 5 免疫荧光分析ZEA处理后标记的p-histone H3阳性细胞数量 Figure 5 Immunofluorescence analysis of the number sensitive mitotic cell marker p-histone H3 positive cells after ZEA treatment |
将处于对数期的SC进行预处理, 加入PI3K抑制剂LY294002, 处理24 h后, 用流式细胞仪分别检测对照组、ZEA组、PI3K抑制剂LY294002组、LY294002+ZEA组细胞周期变化情况。结果如图 6所示:与单独ZEA处理组相比, 加入LY294002后, SC的G2/M期细胞的比例显著降低(P < 0.05), 表明自噬的发生可以部分逆转ZEA诱导睾丸支持细胞周期G2/M期的阻滞, 并可以通过PI3K/Akt/mTOR信号通路进行调控。
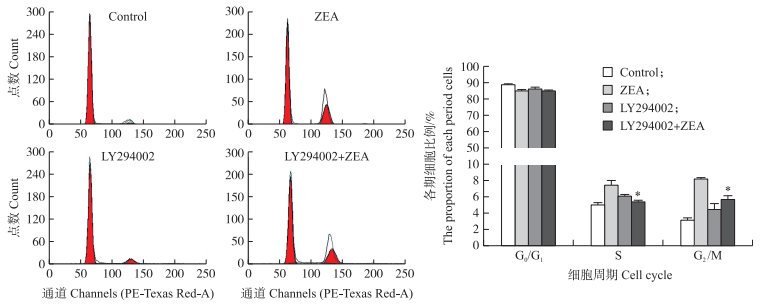
|
图 6 PI3K/Akt/mTOR通路对ZEA诱导SC细胞周期分布的影响 Figure 6 Effects of the PI3K/Akt/mTOR signaling pathway on ZEA induced the distribution of cycle in sertoli cells |
用PI3K的特异性抑制剂LY294002处理SC 24 h后, 通过Western blot检测G2/M期相关蛋白的表达情况。结果(图 7)显示:LY294002+ZEA共处理组的G2/M期关键激酶Cdc2的表达水平极显著升高(P < 0.01);Cdc25B的表达水平显著增加(P < 0.05), CyclinB1表达有差异, 但不显著(P>0.05)。表明激活PI3K/Akt/mTOR信号通路后, 可以通过调控周期蛋白激酶Cdc2的活性逆转ZEA诱导SC细胞G2/M期的阻滞。
|
图 7 PI3K抑制剂对Cdc2、Cdc25B和CyclinB1表达的影响 Figure 7 Effects of PI3K inhibitors on the expression of Cdc2, Cdc25B and CyclinB1 in sertoli cells |
研究证明, ZEA具有雌激素活性, 通过与雌激素受体结合而作用于动物的生殖系统, 引起各种雌激素样作用[10-11]。ZEA也具有很强的细胞毒性, 可引起睾丸细胞损伤。Zheng等[12]报道, ZEA可以破坏支持细胞骨架蛋白α-tubulin和F-actin的结构, 破坏睾丸血睾屏障的结构从而引起雄性动物生殖障碍。ZEA可以干扰支持细胞对ABP、FSHR、Transferrin和Inhibin-β功能性蛋白的分泌, 影响支持细胞对生精过程的调节和营养的供给。王亚军等[10]研究表明, ZEA能诱导SD大鼠睾丸生殖细胞发生凋亡, 促使生殖细胞耗竭和睾丸萎缩。那么ZEA是否通过对细胞周期的改变来影响细胞的增殖。细胞周期稳定是细胞生命活动的基础, 其进程受Cyclins、CDK和CDKI等调控因子及其之间的相互作用来调节。当其正常表达可促进细胞周期, 而当超常表达时则可诱导CDKI的表达进而导致细胞周期阻滞。王冰洁等[11]研究报道, ZEA可以影响SC的周期分布, 抑制细胞的增殖。本试验通过对G2/M期相关蛋白表达水平的研究, 进一步表明了ZEA抑制SC增殖效应与G2/M期阻滞有密切关系。
mTOR是自噬重要的调控因子之一, 可感知细胞的营养状况和细胞应激[13-14]。PI3K和Akt是mTOR重要的上游调控因子, Ⅰ型PI3K可以激活Akt, 活化的Akt进一步磷酸化mTOR。伴刀豆凝集素A可降低Akt和P70S6K蛋白的磷酸化水平, 下调PI3K/Akt/mTOR通路, 诱导HeLa细胞自噬水平上升[15]。因此, PI3K/Akt/mTOR信号通路是调控自噬的重要通路。但关于ZEA对PI3K/Akt/mTOR通路的影响及该通路在ZEA致睾丸支持细胞自噬中的作用未见报道。本研究结果表明, 随着ZEA浓度的升高, PI3K/Akt/mTOR信号通路中的关键蛋白磷酸化水平下降, 表明ZEA可以激活PI3K/Akt/mTOR信号通路。在加入PI3K抑制剂LY294002(10 μmol·L-1)后发现, 自噬蛋白表达量增多, PI3K/Akt/mTOR信号通路蛋白表达量显著减少, 因此该信号通路在ZEA诱导睾丸支持细胞自噬中起负调控作用。这与前人[15]关于PI3K/Akt/mTOR信号通路具有调控自噬作用的研究结果相一致。
Akt蛋白调控细胞内的多个生理过程, 当Akt被PDK1磷酸化后激活, 作用于其下游的mTOR, 使其磷酸化缩短细胞周期, 促进细胞分裂增殖[16]。PI3K/Akt/mTOR信号通路活化可以诱导细胞抗凋亡及细胞分化异常等现象, 并且可以导致细胞失控性增殖, 在细胞周期调控过程中起重要作用[17]。本研究发现, 加入PI3K抑制剂LY294002后, 与单独ZEA处理组相比, 睾丸支持细胞周期的G2/M期细胞的比例显著降低, 且G2/M期的关键激酶Cdc2的活性极显著升高。表明在激活PI3K/Akt/mTOR信号通路后, 可以通过调控周期蛋白激酶Cdc2的活性逆转ZEA诱导的SC细胞G2/M期阻滞。
综上所述, ZEA在一定浓度范围内, 可以通过激活PI3K/Akt/mTOR信号通路诱导细胞自噬的发生, 并且该信号通路的激活对自噬发生起负调控作用; ZEA影响SC的周期分布, 发生G2期阻滞, 并抑制细胞增殖。在激活PI3K/Akt/mTOR信号通路后, 可以部分逆转ZEA诱导的SC G2/M期阻滞, 表明调控自噬的信号通路PI3K/Akt/mTOR的激活在这一过程中起保护作用。而调控自噬的其他通路对ZEA诱导SC周期阻滞的具体机制需进一步研究。
| [1] | Kim I H, Son H Y, Cho S W, et al. Zearalenone induces male germ cell apoptosis in rats[J]. Toxicology Letters, 2003, 138(3): 185. DOI: 10.1016/S0378-4274(02)00405-8 |
| [2] | Zinedine A, Soriano J M, Molto J C, et al. Review on the toxicity, occurrence, metabolism, detoxinfication, regulations and intake of zearalenone:an oestrogenic mycotoxin[J]. Food and Chemical Toxicology, 2007, 45(1): 1-18. DOI: 10.1016/j.fct.2006.07.030 |
| [3] | Chang H, Kim W, Park J H, et al. The occurrence of zearalenone in South Korean feedstuffs between 2009 and 2016[J]. Toxins, 2017, 9(7): 223. DOI: 10.3390/toxins9070223 |
| [4] |
朱虹, 缪泽鸿, 丁健. ATM、ATR和DNA损伤介导的细胞周期阻滞[J].
生命科学, 2007, 19(2): 139-148.
Zhu H, Miao Z H, Ding J. ATM, ATR and DNA damage-induced cell cycle arrest[J]. Biological Sciences, 2007, 19(2): 139-148. (in Chinese with English abstract) |
| [5] |
徐琛玮, 沈颖卓, 龚清海, 等. DHA诱导3T3-L1前脂肪细胞G2/M期阻滞及ERK1/2通路的作用[J].
营养学报, 2011, 33(4): 354-357.
Xu C W, Shen Y Z, Gong Q H, et al. DHA induced G2/M arrest of 3T3-L1 preadipocyte via activation of ERK1/2 pathway[J]. Acta Nutrimenta Sinica, 2011, 33(4): 354-357. (in Chinese with English abstract) |
| [6] |
梁梓森, 许利娜, 马勇江, 等. 玉米赤霉烯酮对小鼠胸腺上皮细胞的毒性作用[J].
中国兽医学报, 2009, 29(7): 894-897.
Liang Z S, Xu L N, Ma Y J, et al. Cytotoxicity of zearalenone for thymic epithelial cells in mice[J]. Chinese Journal of Veterinary Science, 2009, 29(7): 894-897. (in Chinese with English abstract) |
| [7] |
王冰洁, 冯楠楠, 郑王龙, 等. ERK信号在玉米赤霉烯酮诱导睾丸支持细胞自噬中的作用[J].
中国兽医科学, 2017, 47(6): 798-804.
Wang B J, Feng N N, Zheng W L, et al. Study on functions of ERK signal pathways in ZEA-induced autophagy of sertoli cells[J]. Chinese Veterinary Science, 2017, 47(6): 798-804. (in Chinese with English abstract) |
| [8] | Levine B, Kroemer G. Autophagy in the pathogenesis of disease[J]. Cell, 2008, 132(1): 27-42. DOI: 10.1016/j.cell.2007.12.018 |
| [9] | Martelli A M, Evangelisti C, Follo M Y, et al. Targeting the phosphatidylinositol 3-kinase/Akt/mammalian target of rapamycin signaling network in cancer stem cells[J]. Current Medicinal Chemistry, 2011, 18(18): 2715-2726. DOI: 10.2174/092986711796011201 |
| [10] |
王亚军, 刘青, 郑王龙, 等. 玉米赤霉烯酮对Leydig细胞凋亡及caspase-9、caspase-3蛋白表达的影响[J].
中国兽医学报, 2014, 34(1): 131-135.
Wang Y J, Liu Q, Zheng W L, et al. Effect of zearalenone on apoptosis and expression of caspase-3 and caspase-9 in Leydig cells[J]. Chinese Journal of Veterinary Science, 2014, 34(1): 131-135. (in Chinese with English abstract) |
| [11] |
王冰洁, 郑王龙, 司梦雪, 等. 自噬在ZEA对睾丸支持细胞细胞周期影响中的作用[J].
中国兽医学报, 2017, 37(7): 1327-1333.
Wang B J, Zheng W L, Si M X, et al. The role of autophagy in ZEA effects on sertoli cells in the cell cycle[J]. Chinese Journal of Veterinary Science, 2017, 37(7): 1327-1333. (in Chinese with English abstract) |
| [12] | Zheng W L, Pan S Y, Wang G G, et al. Zearalenone impairs the male reproductive system functions via inducing structural and functional alterations of sertoli cells[J]. Environmental Toxicology and Pharmacology, 2016, 46: 146-155. |
| [13] | Mendelsohn A R, Larrick J W. Rapamycin as an antiaging therapeutic:targeting mammalian target of rapamycin to treat Hutchinson-Gilford progeria and neurodegenerative diseases[J]. Rejuvenation Research, 2011, 14(4): 437-441. DOI: 10.1089/rej.2011.1238 |
| [14] | Jung C H, Ro S H, Cao J, et al. mTOR regulation of autophagy[J]. FEBS Letters, 2010, 584(7): 1287-1295. DOI: 10.1016/j.febslet.2010.01.017 |
| [15] | Roy B, Pattanaik A K, Das J, et al. Role of PI3K/Akt/mTOR and MEK/ERK pathway in Concanavalin A induced autophagy in HeLa cells[J]. Chemico-Biological Interactions, 2014, 210(1): 96. |
| [16] | Follo M Y, Manzoli L, Poli A, et al. PLC and PI3K/Akt/mTOR signalling in disease and cancer[J]. Advances in Biological Regulation, 2015, 57: 10-16. DOI: 10.1016/j.jbior.2014.10.004 |
| [17] | Asnaghi L, Bruno P, Priulla M, et al. mTOR a protein kinase switching between life and death[J]. Pharmacological Research, 2004, 50(6): 545. DOI: 10.1016/j.phrs.2004.03.007 |




