文章信息
- 吴潇, 陈杨杨, 石新杰, 齐开杰, 曹鹏, 殷豪, 张绍铃
- WU Xiao, CHEN Yangyang, SHI Xinjie, QI Kaijie, CAO Peng, YIN Hao, ZHANG Shaoling
- 喷施外源激素对‘玉露香’梨叶片表皮蜡质组分、结构及渗透性的影响
- Effects of spraying exogenous hormones on cuticular wax composition, structure and permeability of the leaves in 'Yuluxiang' pear
- 南京农业大学学报, 2018, 41(4): 647-654
- Journal of Nanjing Agricultural University, 2018, 41(4): 647-654.
- http://dx.doi.org/10.7685/jnau.201710007
-
文章历史
- 收稿日期: 2017-10-05
大多数陆生植物的地上部表面都覆盖有一层蜡质。表皮蜡质是一类易溶于三氯甲烷、甲醇等有机溶剂且极为疏水的长链酰基脂类物质的复杂混合物, 在植物防御方面扮演重要角色。大量研究表明植物蜡质主要由超长链脂肪族的复杂化合物(不小于C16)及其含氧衍生物组成, 主要包括脂肪酸、烷烃、醛类、伯醇、酮类以及萜类化合物[1]。不同物种之间蜡质成分差异很大, 例如柳树、小麦叶片蜡质主要成分是伯醇, 而烷烃是蓖麻叶片表皮蜡质的主要成分[2-4]。同一个物种不同品种之间蜡质组分也存在较大差异, 例如在柑橘果实中, ‘纽荷尔’脐橙果皮蜡质主要由醛类组成, 而‘温州蜜柑’的主要蜡质成分是脂肪酸[5]。甚至同一植株不同组织器官蜡质含量和成分也不相同, 有研究表明黄瓜茎的蜡质成分中烷烃含量是果实的2.17倍[6]。
植物表面常形成片状、线装、管状和棒状等23种三维晶状体结构的蜡质[7]。蜡质结构与其功能密切相关, 三维晶状体结构可以提高蜡质层粗糙程度, 防止与附着水分大面积接触, 增强其疏水性[8]。Wu等[1]研究表明‘玉露香’梨比‘库尔勒香梨’和‘雪花梨’表皮蜡质结构更致密, 可显著降低黑斑病发病率。此外, 研究表明植物蜡质能够有效抵御外界环境的变化, 在干旱胁迫下, 水稻[9]、玉米[10]和小麦[11]叶片蜡质的含量显著提高, 抗旱能力明显增强。因此, 通过提高植物表层蜡质含量来增强植物的抗逆性已成为研究热点。
植物激素在植物整个抗逆防御网络中起着重要作用。已有研究表明植物角质层蜡质的沉积可受植物激素以及一些类似于激素或者调控激素合成的生长调节物质调控。例如, 外源水杨酸(SA)、茉莉酸甲酯(MeJA)及1-氨基环丙烷-1-羧酸(ACC)处理能够诱导油菜叶片蜡质的沉积, 降低角质层渗透性, 减缓叶片的水分散失[12]; 乙烯可增加脐橙表皮蜡质含量, 同时改变其结构, 从而阻止绿霉病菌入侵[13]。Yu等[10]发现乙烯利能够诱导玉米表皮蜡质合成, 进而维持细胞膜和水分的稳定性, 提高抗旱能力。研究表明, 利用2, 4-D和1-MCP处理柑橘和苹果梨果实, 发现二者均能改变果实表皮蜡质组分和微观结构, 并且1-MCP可以防止苹果梨果皮油渍化和病菌入侵, 从而延长贮藏期[14-15]。但是外源激素处理梨叶片, 研究其表皮蜡质变化的研究还尚未见报道。因此, 本研究分析了ALA、SA和MeJA处理对‘玉露香’梨叶片表皮蜡质组分含量、结构以及蜡质层渗透性的影响, 旨在揭示这些信号分子与植物蜡质层沉积的关系, 为植物抗逆研究和蜡质合成机制提供理论依据。
1 材料与方法 1.1 试验材料试验于2015年12月至2016年3月在南京农业大学梨工程技术研究中心组培实验室进行。供试材料为梨工程技术研究中心湖熟试验基地一年生‘玉露香’梨枝条, ‘杜梨’砧木嫁接。每个营养钵(18 cm×18 cm)装满营养土, 在组培室中常规管理, 待幼苗长出10片真叶时进行处理。
1.2 试验设计选取长势一致, 没有病虫害的健康幼苗, 分别用100 mg·L-1 ALA、200 μmol·L-1 SA和100 μmol·L-1 MeJA各30 mL喷洒在叶片正、反表面。MeJA+SA处理为二者溶液各15 mL混合均匀后喷洒, 对照为清水。每个处理3株, 每处理3个重复。每2 d喷施1次, 共喷3次。激素处理7和14 d时, 每株分别取1片相同部位(基部向上第5片叶)的叶片分析蜡质含量、组分和结构。在14 d时各处理取1片相同部位(基部向上第6片叶)的叶片测定渗透性。
1.3 叶片蜡质含量测定将采集的叶片浸入装有100 mL氯仿的培养皿中60 s, 然后将提取溶液装入预先称质量的蒸馏瓶中, 利用氮吹仪(上海极恒实业有限责任公司)在40 ℃条件下进行蒸发, 除去溶剂。蒸干后再次称质量, 并记录数据。叶片表面积(Sa):选取纸质均匀的称量纸(10 cm×10 cm)称质量, 记为M1, 在称量纸上画出叶片轮廓然后剪下, 记录与叶片形状一致的称量纸质量M2, 则叶片表面积为Sa=(100×M2)/M1。蜡质含量=(W1-W0)/Sa, 其中:W0为蒸馏瓶的质量(g); W1为蒸馏瓶和蜡质总质量(g); Sa为叶片表面积(cm2)。
1.4 叶片蜡质组分、晶体结构及水分损失的测定叶片蜡质组分和晶体结构的测定采用Wu等[1]的方法。叶片水分损失的测定采用李帅等[12]的方法。水分损失率=(N1-N2)/(N1-N3)×100%, 其中:N1为饱和质量(g); N2为每个时间点的质量(g); N3为干质量(g)。
1.5 数据统计与分析蜡质成分通过NIST 2013数据库进行比对分析。试验数据采用Microsoft Excel 2016和SPSS 20软件进行分析。
2 结果与分析 2.1 喷施外源激素对‘玉露香’梨叶片蜡质总量及组分含量的影响由表 1可知:喷施清水(对照)‘玉露香’梨叶片蜡质总量为3.87~5.54 mg·cm-2, 主要由烷烃、脂肪酸、伯醇、酯类、萜类物质组成。7 d时, ALA处理的叶片蜡质总量为6.11 mg·cm-2, 比对照增加了10.29%, 伯醇含量比对照增加, 而酯类含量比对照减少。MeJA处理的蜡质总量比对照增加了42.24%, 烷烃和脂肪酸含量均比对照增加。SA处理的‘玉露香’梨叶片蜡质总量和组分与对照差异不大, 表明其影响较小。MeJA+SA处理叶片蜡质总量和酯类含量均比对照减少。
| mg·cm-2 | ||||||||
| t/d | 处理 Treatment |
烷烃 Alkanes |
脂肪酸 Fatty acids |
伯醇 Primary alcohols |
酯类 Esters |
萜类 Terpenoids |
其他 Others |
蜡质总量 Total wax |
| 7 | CK | 3.07±0.25 | 0.15±0.03 | 0.67±0.05 | 0.76±0.09 | 0.71±0.14 | 0.18±0.03 | 5.54±0.68 |
| ALA | 3.13±0.27 | 0.25±0.04 | 1.38±0.31 | 0.48±0.14 | 0.65±0.05 | 0.21±0.07 | 6.11±0.10 | |
| MeJA | 5.16±0.14** | 0.31±0.06** | 0.66±0.10 | 0.74±0.07 | 0.69±0.07 | 0.31±0.09 | 7.88±0.17* | |
| SA | 3.05±0.07 | 0.23±0.04 | 0.64±0.02 | 0.62±0.04 | 0.52±0.05 | 0.26±0.04 | 5.32±0.64 | |
| MeJA+SA | 2.41±0.04 | 0.14±0.03 | 0.64±0.04 | 0.38±0.01* | 0.71±0.04 | 0.20±0.03 | 4.47±0.11 | |
| 14 | CK | 2.00±0.33 | 0.55±0.12 | 0.31±0.02 | 0.19±0.04 | 0.48±0.11 | 0.34±0.09 | 3.87±0.48 |
| ALA | 1.07±0.10 | 0.56±0.06 | 1.32±0.08** | 0.64±0.10* | 1.13±0.06** | 0.40±0.11 | 5.13±0.13* | |
| MeJA | 0.90±0.11* | 0.33±0.07 | 2.02±0.13** | 1.16±0.04** | 1.91±0.09** | 0.53±0.04 | 6.84±0.97* | |
| SA | 2.01±0.05 | 0.47±0.06 | 0.55±0.06* | 0.25±0.02* | 0.68±0.03 | 0.37±0.07 | 4.33±0.24 | |
| MeJA+SA | 0.41±0.04* | 0.17±0.01* | 1.44±0.08** | 0.15±0.02 | 1.11±0.13* | 0.37±0.05 | 3.65±0.11 | |
| 注:1)CK:对照Control; ALA:100 mg·L-1 ALA(aminolevulinic acid); MeJA:100 μmol·L-1 MeJA(methyl jasmonate); SA:200 μmol·L-1 SA(salicylic acid); MeJA+SA:100 μmol·L-1 MeJA+200 μmol·L-1 SA; 2)* P < 0.05, ** P < 0.01。下同。The same as follows. | ||||||||
14 d时, 喷施不同激素和对照叶片蜡质总量均比7 d时减少, ALA、MeJA以及MeJA+SA处理组分发生了明显变化。ALA和MeJA处理叶片蜡质总量、伯醇、酯类、萜类含量均比对照增加, 但MeJA处理叶片的烷烃含量比对照减少; SA处理叶片蜡质总量、伯醇、酯类含量均比对照增加; MeJA+SA处理叶片蜡质总量、烷烃和脂肪酸含量均比对照减少, 而伯醇、萜类含量均比对照增加。在所有处理中, MeJA处理对‘玉露香’梨叶片蜡质总量提高效果最显著。
2.2 喷施外源激素对‘玉露香’梨叶片蜡质脂肪族化合物碳链分布及含量的影响由图 1可知:‘玉露香’梨叶片表皮蜡质成分主要是超长链脂肪族化合物, 主要由烷烃、伯醇和脂肪酸组成。处理7和14 d时, 对照叶片烷烃和伯醇含量最高的组分分别为C27和C26; 脂肪酸中含量最高的是C16和C18。7 d时, 与对照相比, ALA处理叶片C27烷烃, C26、C28、C30伯醇, C16、C18脂肪酸含量均明显增加; MeJA处理叶片C27、C30、C31烷烃含量显著增加; SA处理叶片C27烷烃含量显著减少, 而C30、C31烷烃和C16脂肪酸含量均明显增加; MeJA+SA处理叶片C27烷烃和C18脂肪酸含量明显减少。
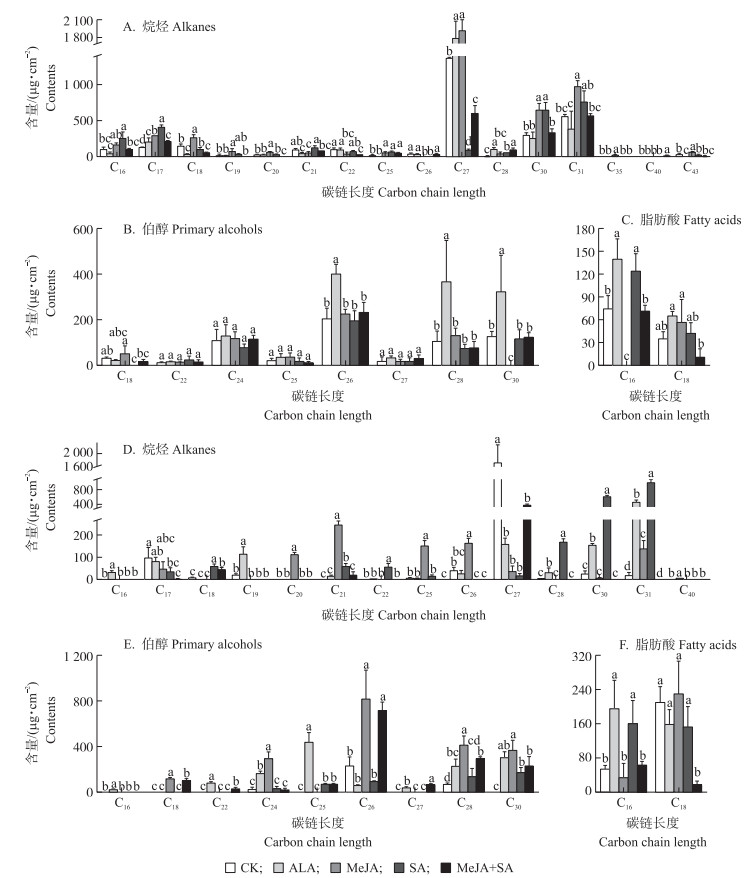
|
图 1 喷施外源激素对‘玉露香’梨叶片蜡质超长链脂肪族化合物含量的影响
Figure 1 Effects of spraying exogenous hormones on contents of main very long chain aliphatic
compounds of leaf cuticular wax in'Yuluxiang'pear
A—C.处理7 d 7 days after treatment; D—F.处理14 d 14 days after treatment. 不同小写字母表示不同处理间在0.05水平上差异显著。下同。 Different letters above each bar indicate significant difference at 0.05 level among different treatments. The same as follows. |
14 d时, 与对照相比, ALA处理叶片C27烷烃和C26伯醇含量明显减少, 而C19、C30、C31烷烃, C22、C25、C30伯醇和C16脂肪酸含量显著增加; MeJA处理叶片C21、C26、C31烷烃和C18、C24、C26、C28、C30伯醇含量均显著增加, 而C27烷烃含量显著减少, 此外, C20烷烃仅在此处理中检测到; SA处理叶片C17、C27烷烃含量显著减少, C18、C22、C28、C30、C31烷烃和C30伯醇含量显著增加; MeJA+SA处理叶片C18烷烃和C18、C25、C26、C27、C28、C30伯醇含量均显著增加, C27烷烃和C18脂肪酸含量显著减少。
2.3 喷施外源激素对‘玉露香’梨叶片蜡质萜类化合物的影响由表 2可知:除了超长链脂肪酸化合物之外, 在‘玉露香’梨叶片蜡质中还检测到12种萜类化合物。处理7 d时, MeJA+SA处理萜类化合物数量显著增加。14 d时, 与对照相比, 各处理样品的蜡质中萜类化合物总量增加(表 1)。进一步分析发现, 处理7和14 d时, 所有样品中都检测到了δ-生育酚、γ-生育酚和3, 5-二烯豆甾烷3种萜类化合物, 且含量差异较大(16.51~740.17 μg·cm-2)。此外, 有些处理可以产生特异的萜类物质, 例如MeJA+SA处理7 d时样品中检测到了特异性的α-香树精、β-谷甾醇乙酸酯和孕甾-5-烯-20-酮, 3(乙酰氧基)-17-羟基, 3β。
| μg·cm-2 | |||||||||||
| 成分 Components |
7 d | 14 d | |||||||||
| CK | ALA | MeJA | SA | MeJA+SA | CK | ALA | MeJA | SA | MeJA+SA | ||
| δ-生育酚 δ-tocopherol |
78.26±28.69 | 51.07±21.14 | 393.27±32.95* | 31.53±21.10 | 71.40±5.57 | 97.98±40.42 | 161.50±42.21 | 203.85±53.98* | 188.62±19.42* | 119.44±35.37 | |
| β-生育酚 β-tocopherol |
12.55±5.56 | 19.14±9.86 | 0 | 0 | 19.81±12.88 | 0 | 70.52±10.98* | 7.57±4.54* | 0 | 0 | |
| γ-生育酚 γ-tocopherol |
273.20±97.66 | 313.25±94.59 | 232.00±63.71 | 176.06±36.87 | 198.37±27.55 | 108.03±25.37 | 160.08±51.65 | 512.90±69.79* | 221.43±18.71* | 262.54±49.63* | |
| α-香树精 α-amyrin |
0 | 0 | 0 | 0 | 54.15±10.40* | 0 | 0 | 0 | 0 | 70.73±8.01* | |
| β-香树精 β-amyrin |
0 | 22.59±7.58* | 6.96±4.96* | 0 | 49.70±1.49* | 0 | 0 | 0 | 0 | 93.52±10.97* | |
| β-谷甾醇 β-sitosterol |
83.60±15.03 | 62.31±21.03 | 0 | 71.78±6.10 | 65.28±4.14 | 27.70±17.36 | 184.68±40.08* | 436.16±121.66* | 115.24±12.91* | 212.58±20.21* | |
| β-谷甾醇乙酸酯 β-sitosterol acetate |
0 | 0 | 0 | 0 | 162.17±31.34 | 0 | 0 | 0 | 0 | 0 | |
| 3, 5-二烯豆甾烷 Stigmastan-3, 5-diene |
134.21±40.28 | 177.58±23.16 | 57.22±23.02 | 165.90±28.60 | 16.51±0.10* | 234.40±40.79 | 556.42±87.52 | 740.17±102.30* | 153.65±49.15 | 265.97±36.78 | |
| 熊果-12-烯-28-醛 Urs-12-en-28-al |
66.39±26.60 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 81.22±22.60* | |
| 熊果-12-烯-28-醛, 3-乙酰氧基, 3β Urs-12-en-28-al, 3-(acetyloxy)-, (3β)- |
0 | 0 | 0 | 37.82±22.52* | 55.09±5.49 | 0 | 0 | 0 | 0 | 0 | |
| 孕甾-5-烯-20-酮, 3(乙酰氧基)-17-羟基, 3β Pregn-5-en-20-one, 3-(acetyloxy)-17-hydroxy, (3β)- |
0 | 0 | 0 | 0 | 20.98±14.82 | 0 | 0 | 0 | 0 | 0 | |
| 雌甾-1, 3, 5(10)-三烯-6-酮, 3, 17-双(乙酰氧基)-2-甲氧基 Estra-1, 3, 5(10)-trien-6-one, 3, 17-bis(acetyloxy)-2-methoxy- |
0 | 0 | 0 | 29.94±17.44* | 0 | 0 | 0 | 0 | 0 | 0 | |
由图 2可见:通过扫描电镜观察对照及各处理‘玉露香’梨叶片表皮蜡质的超微结构, 发现对照叶片表面为薄膜状蜡质层, 表面较平滑, 有褶皱, 无裂纹, 且未发现有蜡质晶体覆盖, 14 d的蜡质褶皱变长, 纹理更密集。ALA处理叶片表皮褶皱减少; MeJA处理叶片表面褶皱明显增多、密集, 出现较多蜡质晶体; SA处理对蜡质结构影响较小; MeJA+SA处理在7 d时有少数的蜡质晶体, 而在14 d褶皱明显减少。

|
图 2 喷施外源激素对‘玉露香’梨叶片表皮蜡质微观结构的影响 Figure 2 Effects of spraying exogenous hormones on microstructure of leaf cuticular wax in'Yuluxiang' pear A—E.处理7 d 7 days after treatment; F—J.处理14 d 14 days after treatment; A, F.对照Control; B, G. ALA处理ALA treatment; C, H. MeJA处理MeJA treatment; D, I. SA处理SA treatment; E, J. MeJA+SA处理MeJA+SA treatment. |
由图 3可见:与对照相比, ALA、MeJA和SA处理叶片水分损失速率均降低。在150 min时, ALA、MeJA和SA处理叶片水分损失率比对照分别减少了26.07%、44.07%和26.83%, 表明这3种处理均减缓了‘玉露香’梨叶片的水分散失, 角质层渗透性降低。而MeJA+SA处理在150 min时水分损失率比对照增加了11.60%, 说明MeJA+SA处理加快了‘玉露香’梨叶片的水分散失, 角质层渗透性增高。
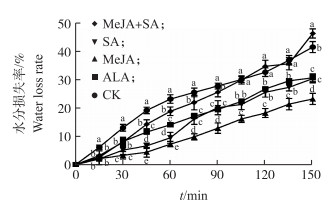
|
图 3 喷施外源激素对‘玉露香’梨叶片角质层水分损失的影响 Figure 3 Effects of spraying exogenous hormones on water loss rate of leaf cuticular wax in'Yuluxiang'pear |
在很多物种中烷烃是蜡质主要成分, 包括苹果梨[16]、黄瓜[6]、蓖麻[3]、油菜[12]、烟草[17]、月桂樱[18]、拟南芥[6]。本研究中, ‘玉露香’梨叶片主要由脂肪酸、烷烃、醛类、醇类以及萜类化合物组成, 其中烷烃含量最高, 且外源激素处理7和14 d‘玉露香’梨叶片的成分变化较大, 已有研究也指出植物角质层蜡质的组分会随着植物组织器官及发育时期的变化而改变[12, 16, 18-19]。本研究中, 处理14 d时‘玉露香’梨叶片总蜡质含量比处理7 d时下降, 可能是因为蜡质合成积累与植物表面的扩展速度不同步造成的, 这与Li等[16]的研究结果相一致。
对玉米[10]和小麦[11]的研究发现叶片蜡质含量与其失水率成反比, 与其耐旱能力成正比。本研究中, 外源SA、MeJA和ALA处理使‘玉露香’梨叶片角质层蜡质沉积和晶体结构变密, 降低角质层渗透性, 而MeJA+SA处理使‘玉露香’梨叶片角质层蜡质含量减少, 角质层渗透性增强。这与蜡质含量与植株抗逆性成正相关的研究结果一致[10-11]。近年来, 也有研究表明蜡质组分含量与失水率也存在一定相关性。例如:C29烷烃含量与油菜叶失水呈负相关关系[12]; 蒺藜苜蓿WXP1(乙烯响应类型转录因子)促进C29、C31和C33烷烃合成, WXP1超表达可提高植株耐旱性[20]; 过表达CER1基因的拟南芥植株叶片蜡质C27、C29和C31烷烃含量显著增加, 渗透率降低, 抗旱能力增强[21]。本研究中, SA、MeJA和ALA处理叶片C27烷烃含量明显减少, 长链烷烃(C28、C30和C31)含量不同程度增加, 而MeJA+SA处理C27烷烃含量减少, 长链烷烃(大于C27)没有检测到, 表明SA、MeJA和ALA处理可能通过提高长链烷烃(大于C27)的含量, 以降低叶片的失水率, 缺失长链烷烃(大于C27)导致MeJA+SA处理失水率较高。Niki等[22]在烟草中发现MeJA能够抑制SA的沉积及SA诱导的酸性PR基因的表达, 而SA处理对MeJA诱导的碱性PR基因的表达同样具有明显的抑制作用。本研究中发现MeJA+SA处理使‘玉露香’梨叶片角质层蜡质含量减少, 角质层渗透性增强, 可能是由于MeJA和SA的拮抗调控引起的。
Wu等[1]研究发现, ‘玉露香’梨果实表皮蜡质的主要成分是烷烃(20.70%)与伯醇(31.54%), 蜡质晶体结构为不规则的卵圆形或片状蜡质。而本研究中我们发现‘玉露香’梨叶片蜡质中的主要成分是烷烃(51.64%~55.54%), 覆盖着薄膜状蜡质层, 表明‘玉露香’梨果实和叶片中蜡质成分与晶体结构类型差异较大。这与Baker等[23]研究结果相一致。另外, 本研究还发现, 不同处理不仅改变了叶片中蜡质组分的含量, 而且蜡质晶体结构也发生了不同程度的变化, 表明梨叶片中表皮蜡质成分与其蜡质晶体结构关系密切。这与在蓝莓[24]和柑橘[5]上的研究结果相一致。‘玉露香’梨叶片表皮蜡质层平滑、无裂纹、无晶体状蜡质覆盖, 薄膜状蜡质层, 与烟草蜡质层结构相似[17]。烷烃类物质是‘玉露香’梨叶片蜡质的主要成分, 所以较高含量的烷烃很可能是薄膜状蜡质层结构形成的主要因素。由于蜡质成分与其晶体结构关系复杂, 对于‘玉露香’梨叶片蜡质成分对其蜡质晶体结构的影响, 还有待于进一步研究。
| [1] | Wu X, Yin H, Chen Y Y, et al. Chemical composition, crystal morphology and key gene expression of cuticular waxes of Asian pears at harvest and after storage[J]. Postharvest Biology and Technology, 2017, 132: 71-80. DOI: 10.1016/j.postharvbio.2017.05.007 |
| [2] | Teece M A, Zengeya T, Volk T A, et al. Cuticular wax composition of Salix varieties in relation to biomass productivity[J]. Phytochemistry, 2008, 69(2): 396-402. DOI: 10.1016/j.phytochem.2007.08.015 |
| [3] | de Araújo Silva M M, dos Santos D Y A C, Melo-de-Pinna G F A, et al. Chemical composition and ultrastructure of the foliar cuticular wax of two Brazilian cultivars of castor bean(Ricinus communis L.)[J]. Industrial Crops and Products, 2017, 95: 558-563. DOI: 10.1016/j.indcrop.2016.11.010 |
| [4] | Wang Y, Wang J, Chai G, et al. Developmental changes in composition and morphology of cuticular waxes on leaves and spikes of glossy and glaucous wheat(Triticum aestivum L.)[J]. PLoS One, 2015, 10(10): e0141239. DOI: 10.1371/journal.pone.0141239 |
| [5] | Wang J Q, Hao H H, Liu R S, et al. Comparative analysis of surface wax in mature fruits between Satsuma mandarin(Citrus unshiu)and 'Newhall' navel orange(Citrus sinensis)from the perspective of crystal morphology, chemical composition and key gene expression[J]. Food Chemistry, 2014, 153: 177-185. DOI: 10.1016/j.foodchem.2013.12.021 |
| [6] | Wang W J, Liu X W, Gai X S, et al. Cucumis sativus L. WAX2 plays a pivotal role in wax biosynthesis, influencing pollen fertility and plant biotic and abiotic stress responses[J]. Plant and Cell Physiology, 2015, 56(7): 1337-1354. |
| [7] | Post-Beittenmiller D. Biochemistry and molecular biology of wax production in plants[J]. Annual Review of Plant Biology, 1996, 47(1): 405-430. DOI: 10.1146/annurev.arplant.47.1.405 |
| [8] |
朱双艳, 齐军仓, 惠宏杉, 等. 大麦幼苗叶片表皮蜡质组分及含量对外源ABA的响应及其对表皮透性的影响[J].
西南农业学报, 2015, 25(5): 1965-1971.
Zhu S Y, Qi J C, Hui H S, et al. Responses of epicuticular wax components and contents of barley seedling leaves to exogenous abscisic acid treatment and its impact on epidermal permeability[J]. Southwest China Journal of Agricultural Sciences, 2015, 25(5): 1965-1971. (in Chinese with English abstract) |
| [9] | Zhu X, Xiong L. Putative megaenzyme DWA1 plays essential roles in drought resistance by regulating stress-induced wax deposition in rice[J]. Proc Natl Acad Sci USA, 2013, 110(44): 17790-17795. DOI: 10.1073/pnas.1316412110 |
| [10] | Yu H, Zhang Y, Xie Y, et al. Ethephon improved drought tolerance in maize seedlings by modulating cuticular wax biosynthesis and membrane stability[J]. Journal of Plant Physiology, 2017, 214: 123-133. DOI: 10.1016/j.jplph.2017.04.008 |
| [11] | Zhang Z, Wei W, Zhu H, et al. W3 is a new wax locus that is essential for biosynthesis of β-diketone, development of glaucousness, and reduction of cuticle permeability in common wheat[J]. PLoS One, 2015, 10(10): e0140524. DOI: 10.1371/journal.pone.0140524 |
| [12] |
李帅, 赵秋棱, 彭阳, 等. SA、MeJA和ACC处理对甘蓝型油菜叶角质层蜡质组分、结构及渗透性的影响[J].
作物学报, 2016, 42(12): 1827-1833.
Li S, Zhao Q L, Peng Y, et al. Effects of SA, MeJA, and ACC on leaf cuticular wax constituents, structure and permeability in Brassica napus[J]. Acta Agronomica Sinica, 2016, 42(12): 1827-1833. (in Chinese with English abstract) |
| [13] | Cajuste J F, González-Candelas L, Veyrat A, et al. Epicuticular wax content and morphology as related to ethylene and storage performance of 'Navelate' orange fruit[J]. Postharvest Biology and Technology, 2010, 55(1): 29-35. DOI: 10.1016/j.postharvbio.2009.07.005 |
| [14] |
马巧利. 2, 4-二氯苯氧乙酸保鲜柑橘果实采后品质机理[D]. 武汉: 华中农业大学, 2014.
Ma Q L. Mechanism underlying 2, 4-dichlorophenoxyacetic acid maintain citrus fruit postharvest quality[D]. Wuhan: Huazhong Agricultural University, 2014(in Chinese with English abstract). |
| [15] |
唐瑛, 王文娟, 李永才, 等. 采后乙烯利、1-MCP处理对苹果梨蜡质组分的影响[J].
食品科学, 2016, 37(18): 223-229.
Tang Y, Wang W J, Li Y C, et al. Effect of postharvest ethephon and 1-MCP ereatments on the chemical composition of cuticular wax in Pingguoli pear fruit[J]. Food Science, 2016, 37(18): 223-229. DOI: 10.7506/spkx1002-6630-201618036 (in Chinese with English abstract) |
| [16] | Li Y C, Yin Y, Chen S J, et al. Chemical composition of cuticular waxes during fruit development of Pingguoli pear and their potential role on early events of Alternaria alternata infection[J]. Functional Plant Biology, 2014, 41: 313-320. DOI: 10.1071/FP13184 |
| [17] |
徐静, 王美玲, 李婷婷, 等. 烟草叶片表面蜡质成分及含量研究[J].
西北农业学报, 2014, 23(4): 140-145.
Xu J, Wang M L, Li T T, et al. Composition and content of tobacco(Nicotiana tabacum L.)leaf cuticular waxes[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2014, 23(4): 140-145. DOI: 10.7606/j.issn.1004-1389.2014.04.023 (in Chinese with English abstract) |
| [18] | Jetter R, Schäffer S. Chemical composition of the Prunus laurocerasus leaf surface. Dynamic changes of the epicuticular wax film during leaf development[J]. Plant Physiology, 2001, 126(4): 1725-1737. DOI: 10.1104/pp.126.4.1725 |
| [19] |
张海禄, 齐军仓, 韦鹏飞. 大麦叶片表皮蜡质含量的动态变化[J].
西北农业学报, 2013, 22(4): 49-53.
Zhang H L, Qi J C, Wei P F. Dynamics of epidermal wax content of leaves in barley[J]. Acta Agriculturae Boreali-Occidentalis Sinica, 2013, 22(4): 49-53. DOI: 10.7606/j.issn.1004-1389.2013.04.010 (in Chinese with English abstract) |
| [20] | Zhang J Y, Broeckling C D, Sumner L W, et al. Heterologous expression of two Medicago truncatula putative ERF transcription factor genes, WXP1 and WXP2, in Arabidopsis led to increased leaf wax accumulation and improved drought tolerance, but differential response in freezing tolerance[J]. Plant Molecular Biology, 2007, 64(3): 265-278. DOI: 10.1007/s11103-007-9150-2 |
| [21] | Bourdenx B, Bernard A, Domergue F, et al. Overexpression of Arabidopsis ECERIFERUM1 promotes wax very-long-chain alkane biosynthesis and influences plant response to biotic and abiotic stresses[J]. Plant Physiology, 2011, 156: 29-45. DOI: 10.1104/pp.111.172320 |
| [22] | Niki T, Mitsuhara I, Seo S, et al. Antagonistic effect of salicylic acid and jasmonic acid on the expression of pathogenesis-related(PR)protein genes in wounded mature tobacco leaves[J]. Plant and Cell Physiology, 1998, 39(5): 500-507. DOI: 10.1093/oxfordjournals.pcp.a029397 |
| [23] | Baker E A, Procopiou J, Hunt G M. The cuticles of Citrus species. Composition of leaf and fruit waxes[J]. Journal of the Science of Food and Agriculture, 1975, 26(8): 1093-1101. DOI: 10.1002/(ISSN)1097-0010 |
| [24] | Chu W J, Gao H Y, Cao S F, et al. Composition and morphology of cuticular wax in blueberry(Vaccinium spp.)fruits[J]. Food Chemistry, 2017, 219: 436-442. DOI: 10.1016/j.foodchem.2016.09.186 |




