文章信息
- 王玮, 朱旭东, 梁丽姣, 舒蕊华, 范巧君
- WANG Wei, ZHU Xudong, LIANG Lijiao, SHU Ruihua, FAN Qiaojun
- 60Co-γ辐照对猪血清白蛋白免疫原性及构象的影响
- Effects of 60Co-γ irradiation on immunogenicity and conformation of porcine serum albumin
- 南京农业大学学报, 2018, 41(3): 542-546
- Journal of Nanjing Agricultural University, 2018, 41(3): 542-546.
- http://dx.doi.org/10.7685/jnau.201707100
-
文章历史
- 收稿日期: 2017-08-17
食物过敏已成为全世界关注的公共卫生热点问题, 并呈现出逐渐增多的趋势。肉类食物引发的食物过敏虽鲜有报道, 但最近研究证实, 肉类过敏已成为一种不容忽视的食品安全问题, 其过敏人群在食物过敏总人群中约占0.5%~8%[1]。目前, 猪血清白蛋白(porcine serum albumin, PSA)已被确认为猪肉中主要过敏原之一[2], 其引发的猪肉过敏患病率为3%~10%[3], 还与牛、羊等血清白蛋白之间存在交叉反应[4]。为降低食物过敏对公众健康的危害, 研究者通过高温[5]、超声波[6]和酶解[7]等技术来降低或消除过敏原的免疫原性, 但均存在脱敏效果不理想、破坏食物的营养价值和破坏食物的感官特性等问题。辐照技术作为一种新兴的综合性食品加工技术, 现已广泛应用于食品的杀菌保鲜, 可有效抑制或消灭致病致腐微生物, 防止食源性疾病。据报道, 辐照还可通过不同程度地改变过敏原蛋白的空间结构, 使其免疫原性发生变化甚至失活[8]。
为预防因食物过敏导致的不良健康风险, 当前食物过敏的研究热点主要集中在过敏原分析检测上[9-12], 深入解析过敏原的构象稳定性对于揭示其致敏性、致敏稳定性以及在IgE介导的过敏反应中抗原表位的确定至关重要。因此, 本试验以猪肉过敏原猪血清白蛋白为研究对象, 应用表面等离子共振(SPR)技术、圆二色(CD)光谱、紫外光谱和荧光光谱等技术, 系统分析辐照诱导下过敏原猪血清白蛋白免疫原性及蛋白构象变化等情况, 旨在阐明过敏原猪血清白蛋白免疫原性改变的蛋白构象变化机制, 以期为低敏或脱敏食品的研发提供理论依据。
1 材料与方法 1.1 试验材料猪血清白蛋白(PSA)(纯度≥98%)购自美国Sigma公司; 羊抗猪PSA多克隆抗体(IgG)购自美国Bethyl laboratories公司; N-羟基琥珀酰亚胺(NHS)、1-(3-二甲基丙基)-3-乙基碳二亚胺(EDC)均购自美国Sigma公司; 羧甲基化葡聚糖CM5传感芯片、甘氨酸盐酸(Glycine-HCl, 10 mmol·L-1, pH1.5)、盐酸乙醇胺(1 mol·L-1, pH8.5)均购自美国GE Healthcare公司。其他试剂均为分析纯。所有溶液均采用超纯去离子水(18.2 MΩ·cm)配制; 用于BiacoreTM T200生物大分子相互作用分析仪(美国GE Healthcare公司)测定的溶液需经过0.22 μm滤膜过滤和真空抽气。
Chriascan数字式圆二色光谱仪购自英国Applied Photophysics公司; UV/VIS Spectrometer Lambda25紫外光谱仪、Luminescence Spectrometer LS50B荧光光谱仪购自美国PerkinElmer公司; PHS-2C精密酸度计购自上海雷磁仪器厂。
1.2 试验方法 1.2.1 辐照处理称取500 mg过敏原PSA标准品, 加入100 mL去离子水中混合均匀, 用尼龙真空袋密封包装后, 在(10±0.5)℃条件下立即进行辐照处理。在南京航空航天大学辐照中心进行辐照, 辐照源为60Co-γ射线, 剂量率为0.75 kGy·h-1, 辐照累计总剂量分别设定为0(对照组)、1、3、5、7、10 kGy 6个水平。辐照处理后的样品立即真空冷冻干燥后备用。
1.2.2 SPR生物传感器芯片制备试验过程设定进样流速为10 μL·min-1。将CM5芯片置于BiacoreTM T200生物大分子相互作用分析仪中, 待基线平稳后, 依次进行以下3个步骤即可制备直接用于检测PSA的芯片:1)将50 μL 0.4 mol·L-1 EDC和50 μL 0.1 mol·L-1NHS混合, 注入70 μL混合物以活化芯片; 2)注入100 μL 100 μg·mL-1 IgG[用0.01 mmol·L-1 PBS缓冲液(pH5.0)配制]; 3)用100 μL 1 mo·L-1盐酸乙醇胺封闭未结合抗体的位点。
1.2.3 样品检测与芯片再生1) 样品检测:先通入含0.5 g·L-1吐温-20的0.01 mmol·L-1 PBST缓冲液(pH7.4), 待基线稳定后通入待测样品。进样检测时, 待测液体积为50 μL, 整个试验样流速为10 μL·min-1, 进样时间为5 min。试验数据扣除缓冲溶液背景, 每个待测样品及空白对照均检测3次。2)芯片再生:为提高生物传感器芯片的使用率, 对检测样品后的芯片用10 mmol·L-1Glycine-HCl溶液(pH1.5)进行再生。注入再生溶液的流速为10 μL·min-1, 再生时间为30 s, 进行抗原、抗体的解离。
1.2.4 免疫原性测定基于1.2.3节方法测定60Co-γ辐照处理前、后PSA与抗体相互作用的动力学参数, 以此表征过敏原的抗原性变化情况。将PSA标准样品用10 mmol·L-1 PBS缓冲液(pH7.4)分别稀释为25、50、100、200和400 nmol·L-1。反应温度设定为25 ℃, 以10 mmol·L-1 Glycine-HCl溶液(pH1.5)作为再生液, 并采用BiacoreTM T200控制软件中的动力学分析Wizard模板进行动力学试验。根据BiacoreTM T200分析软件进行拟合, 以时间为横坐标, 响应值的变化量为纵坐标, 获得抗原与抗体相互作用的结合常数(ka)和解离常数(kd), 并计算出平衡解离常数(KD)=kd/ka。KD值可显示出处于平衡状态时抗原抗体的解离程度, KD值越大说明抗原与抗体解离越多, 两者间的亲和力变弱[13]。
1.2.5 圆二色(CD)光谱分析在(25±1)℃条件下, 分别将待测样品溶解在10 mmol·L-1 PBS(pH7.4)中, 蛋白终质量浓度为0.05 mg·mL-1。测试条件:样品池厚度1 cm, 光谱狭缝带宽1 nm, 扫描波长范围190~260 nm, 扫描速度1 nm·s-1, 光谱累计扫描3次, 并扫描缓冲液, 扣除缓冲液信号, 试验结果取平均值。CD数据用CDNN 4.1软件计算, 氨基酸残基的平均相对分子质量按583计算。
1.2.6 紫外光谱分析在(25±1)℃条件下, 分别将待测样品溶解在10 mmol·L-1 PBS(pH7.4)中, 蛋白终质量浓度为0.5 mg·mL-1。测试条件:样品池厚度1 cm, 光谱狭缝带宽1 nm, 扫描波长范围220~350 nm, 扫描速度240 nm·min-1, 重复扫描3次后取平均值。
1.2.7 荧光光谱分析在(25±1)℃条件下, 分别将待测样品溶解在10 mmol·L-1 PBS(pH7.4)中, 蛋白终质量浓度为0.5 mg·mL-1。测试条件:样品池厚度1 cm, 激发波长295 nm, 光谱狭缝带宽10 nm, 发射波长300~550 nm, 扫描速度1 200 nm·min-1, 重复扫描3次后取平均值。
1.3 数据分析采用Origin Pro v7.5软件分析数据并制图, 对数据进行方差分析(ANOVA)。试验均为3次重复, 数据以x±SD表示。
2 结果与分析 2.1 辐照对过敏原猪血清白蛋白免疫原性的影响采用1:1 Langmuir结合模型, 对试验结果拟合, 计算得出平衡解离常数(KD)值, 以此表征辐照处理对过敏原PSA免疫原性的影响。如图 1所示:过敏原PSA和抗体相互作用的KD值在辐照剂量为1、3 kGy时呈缓慢上升趋势, 与对照组相比无显著差异(P > 0.05), 而当辐照剂量为5、7和10 kGy时, 其KD值随着辐照剂量的增加而升高, 与对照组相比差异显著(P < 0.05)。这表明辐照处理可有效降低过敏原PSA的免疫原性。由此推测, 辐照处理能够改变过敏原PSA构象, 促使抗原与抗体复合物发生解离。
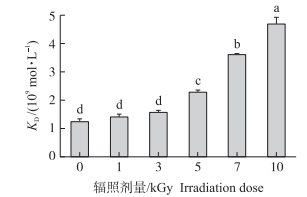
|
图 1 辐照处理对过敏原猪血清白蛋白抗原性的影响 Figure 1 Effect of gamma irradiation on the allergenicity of allergen porcine serum albumin(PSA) 不同小写字母表示处理间差异显著(P < 0.05)。下同。 The different letters mean significant difference among treatments at 0.05 level. The same as follows. |
如图 2所示:天然过敏原PSA的CD光谱在208和222 nm处出现α-螺旋结构的2个负特征吸收峰, 而在辐照剂量为1~10 kGy时, CD光谱中的过敏原PSA 2个负峰强度随着辐照剂量的增加而减弱, 这表明辐照处理可改变过敏原PSA的二级结构。

|
图 2 辐照对过敏原猪血清白蛋白圆二色(CD)光谱的影响 Figure 2 Effect of gamma irradiation on circular dichroism(CD) spectra of allergen PSA |
采用CDNN4.1软件拟合计算出过敏原PSA中各种二级结构的含量, 结果(表 1)表明:天然过敏原PSA的二级结构分别由α-螺旋(53.8%)、β-折叠(6.8%)、β-转角(13.6%)和无规则卷曲(25.8%)组成, 以α-螺旋为主。而在辐照剂量为1~10 kGy时, 其二级结构与对照组相比发生了较大的变化, 主要表现为α-螺旋含量随着辐照剂量的增加而显著减少(P < 0.05), 而β-折叠、β-转角和无规则卷曲等结构含量呈增加趋势, 这表明过敏原PSA经辐照处理后其蛋白质分子展开程度增加, 内部疏水基团暴露, 表面疏水性提高。此外, α-螺旋构象的减少还会影响蛋白质的氢键结构或其他结构而使蛋白质结构发生不可逆破坏。
| 辐照剂量/kGy Irradiation dose | α-螺旋/% α-helix | β-折叠/% β-sheet | β-转角/% β-turn | 无规则卷曲/% Random coil |
| 0 | 53.8±0.9a | 6.8±0.2f | 13.6±0.1f | 25.8±0.6d |
| 1 | 51.0±1.5b | 7.5±0.4e | 14.1±0.2e | 27.4±1.0c |
| 3 | 45.3±0.3c | 9.5±0.2d | 14.9±0.2d | 30.3±0.4b |
| 5 | 40.9±0.2d | 11.7±0.2c | 15.8±0.1c | 31.6±0.2ab |
| 7 | 36.6±0.3e | 14.8±0.2b | 16.6±0.2b | 32.0±0.4a |
| 10 | 32.6±0.3f | 18.6±0.2a | 17.3±0.2a | 31.5±0.2ab |
由图 3可见:过敏原猪血清白蛋白经1、3、5、7和10 kGy辐照剂量处理后其在280 nm处的紫外吸光值分别是天然过敏原猪血清白蛋白的1.06、1.15、1.25、1.29和1.39倍。过敏原PSA紫外吸光值增大, 表明立体结构紧密的蛋白质变得松散, 蛋白质分子展开, 原先包埋在分子内部的分子内部的芳香族氨基酸残基暴露出来; 且随着辐照剂量的增加, 引起过敏原PSA的蛋白质分子展开程度越大。
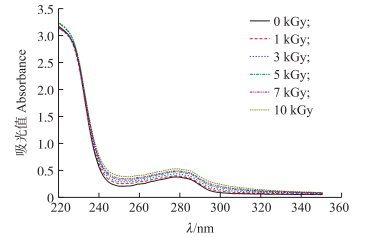
|
图 3 辐照对过敏原猪血清白蛋白紫外光谱的影响 Figure 3 Effect of gamma irradiation on UV spectra of allergen PSA |
由图 4可见:与对照组相比, 过敏原猪血清白蛋白经1~10 kGy辐照剂量处理后其荧光强度发生改变, 且随着辐照剂量的增加而降低。此外, 过敏原猪血清白蛋白的最大荧光发射峰还随着辐照剂量的增加发生了不同程度的蓝移。荧光强度的下降表明辐照处理使过敏原PSA蛋白质分子伸展, 部分芳香族氨基酸暴露到分子表面, 与极性溶液接触后, 其发出的荧光被极性环境淬灭。最大发射峰的蓝移表明过敏原猪血清白蛋白分子中一些色氨酸残基周围的疏水性增加。这些变化都表明辐照处理使过敏原猪血清白蛋白的三级结构发生了改变。
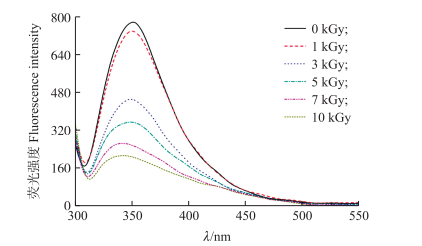
|
图 4 辐照对过敏原猪血清白蛋白荧光光谱的影响 Figure 4 Effect of gamma irradiation on fluorescence spectra of allergen PSA |
过敏原蛋白的结构稳定性与其免疫原性之间具有重要的联系, 尤其是蛋白质的高级构象对维系其免疫原性起着关键作用[14-15]。科学研究证实, 辐照可促进过敏原蛋白的降解、交联以及空间结构和分子构象的改变, 降低蛋白质的稳定性, 破坏其抗原决定簇, 从而改变食物过敏原免疫原性[16-19]。本试验为能更好地模拟体内液相环境中的蛋白质动态相互作用, 采用SPR方法分析1~10 kGy辐照剂量处理后过敏原猪血清白蛋白与抗体的动力学反应。结果表明:过敏原猪血清白蛋白与抗体的解离程度随着辐照剂量的增加而增强。由此推测, 辐照可以改变抗原决定簇的空间构象, 从而影响过敏原猪血清白蛋白的免疫原性。
为进一步印证上述推论, 本研究基于多光谱学技术来研究不同辐照剂量处理前、后过敏原猪血清白蛋白的构象变化, 采用CD光谱探讨过敏原猪血清白蛋白经辐照处理后其二级结构的变化情况。CD光谱分析表明:天然过敏原猪血清白蛋白的二级结构中含有大量的α-螺旋, 而辐照处理可显著降低过敏原猪血清白蛋白的α-螺旋含量, 使其二级结构发生改变。这表明辐照处理导致的α-螺旋含量下降等情况能引发过敏原蛋白分子立体构象的改变。本试验还采用紫外和荧光光谱研究辐照处理对过敏原PSA高级构象的影响。试验结果表明:过敏原猪血清白蛋白在280 nm附近有特征吸收峰, 其原因主要是由其肽链上的色氨酸和酪氨酸等残基的芳香杂环π→π*跃迁引起[20], 而过敏原猪血清白蛋白因含有色氨酸和酪氨酸等残基而能发射较强的内源性荧光, 以λex=295 nm波长激发, 过敏原猪血清白蛋白在295 nm附近有很强的荧光峰。此外, 紫外和荧光光谱还表明:过敏原猪血清白蛋白经辐照处理后其紫外光谱的强度升高; 荧光光谱的强度降低, 最大发射峰发生了蓝移。这些变化显示出:辐照处理改变了过敏原猪血清白蛋白分子的高级构象。由此推测, 辐照处理可改变过敏原猪血清白蛋白的蛋白构象, 掩盖或破坏其抗原决定簇, 而这可能是导致其免疫原性降低的重要原因。因此, 辐照技术在降低或消除食物过敏原免疫原性方面的优势会得到不断显现和开发, 有望为采用新技术、新工艺降低或消除食物过敏原的致敏性提供理论依据, 从而为最终生产出低敏或脱敏食物奠定基础。
| [1] | Klug C, Focke M, Hemmer W, et al. Identification and characterization of meat allergens for improved diagnosis of meat allergy[J]. Clinical and Translational Allergy, 2013, 3(Suppl 3): 174. DOI: 10.1186/2045-7022-3-S3-P174 |
| [2] | Domínguez-Ortega J, Rodríguez-Jiménez B, Ledesma A, et al. Selective allergy to raw pork[J]. Journal of Investigational Allergology and Clinical Immunology, 2009, 19(3): 244-245. |
| [3] | Kim K B W R, Song E J, Lee S Y, et al. Changes in antigenicity of porcine serum albumin in gamma-irradiated sausage extract by treatment with pepsin and trypsin[J]. Radiation Physics and Chemistry, 2011, 80(11): 1258-1262. DOI: 10.1016/j.radphyschem.2011.05.014 |
| [4] | Fuentes A V, Sanchez M I, Perez M A, et al. Allergy to mammal's meat in adult life:immunologic and follow-up study[J]. Journal of Investigational Allergology and Clinical Immunology, 2005, 15(3): 228-231. |
| [5] | Kim K B, Lee S Y, Song E J, et al. Effect of heat and autoclave on allergenicity of porcine serum albumin[J]. Food Science and Biotechnology, 2011, 20(2): 455-459. DOI: 10.1007/s10068-011-0063-0 |
| [6] | Li X, Li Z, Lin H, et al. Effect of power ultrasound on the immunoactivity and texture changes of shrimp(Penaeus vannamei)[J]. Czech Journal of Food Sciences, 2011, 29(5): 508-514. DOI: 10.17221/CJFS |
| [7] |
张微, 满朝新, 迟涛, 等. 酶解作用对牛乳乳清蛋白抗原性影响的研究[J].
中国乳品工业, 2013, 41(3): 17-20.
Zhang W, Man C X, Chi T, et al. Enzymatic hydrolysis effects on whey protein antigenicity[J]. China Dairy Industry, 2013, 41(3): 17-20. (in Chinese with English abstract) |
| [8] |
顾可飞, 高美须, 李春红, 等. 辐照降低食物致敏性的研究进展[J].
核农学报, 2006, 20(6): 524-526.
Gu K F, Gao M X, Li C H, et al. Progress in the study of reducing food allergenicity by irradiation[J]. Journal of Nuclear Agricultural Sciences, 2006, 20(6): 524-526. (in Chinese with English abstract) |
| [9] | Wang W, Qi C, Kang T F, et al. Analysis of interaction between tropomyosin allergen and antibody using a biosensor based on imaging ellipsometry[J]. Analytical Chemistry, 2013, 85(9): 4446-4452. DOI: 10.1021/ac303783j |
| [10] | Wang W, Han J X, Wu Y J, et al. Simultaneous detection of eight food allergens using optical thin-film biosensor chips[J]. Journal of Agricultural and Food Chemistry, 2011, 59(13): 6889-6894. DOI: 10.1021/jf200933b |
| [11] |
朱业培, 王玮, 吕青骎, 等. 动物过敏原牛血清白蛋白间接竞争ELISA检测方法的建立[J].
南京农业大学学报, 2016, 39(2): 305-311.
Zhu Y P, Wang W, Lü Q Q, et al. Development of an indirect competitive ELISA for detection of animal allergen bovine serum albumin[J]. Journal of Nanjing Agricultural University, 2016, 39(2): 305-311. DOI: 10.7685/jnau.20150814 (in Chinese with English abstract) |
| [12] |
王玮, 滕爽, 朱业培, 等. 动物过敏原牛血清白蛋白表面等离子共振传感器检测方法的建立[J].
南京农业大学学报, 2017, 40(4): 739-743.
Wang W, Teng S, Zhu Y P, et al. Development of a surface plasmon resonance sensor for detection of animal allergen bovine serum albumin[J]. Journal of Nanjing Agricultural University, 2017, 40(4): 739-743. DOI: 10.7685/jnau.201612009 (in Chinese with English abstract) |
| [13] |
杨帆, 崔小强, 杨秀荣, 等. 利用表面等离子共振技术进行TNF免疫复合物的动力学分析[J].
高等学校化学学报, 2002, 23(2): 382-384.
Yang F, Cui X Q, Yang X R, et al. Kinetic analysis of TNF immune complex by using surface plasmon resonance[J]. Chemical Journal of Chinese University, 2002, 23(2): 382-384. (in Chinese with English abstract) |
| [14] |
李欣, 陈红兵. 食物过敏原构象性表位鉴别的研究进展[J].
食品科学, 2012, 33(17): 279-283.
Li X, Chen H B. Research progress in conformational epitopemapping approaches for food allergens[J]. Food Science, 2012, 33(17): 279-283. (in Chinese with English abstract) |
| [15] |
王玮, 朱业培, 范巧君, 等. 高静压降低食物致敏性的研究进展[J].
南京农业大学学报, 2015, 38(4): 525-531.
Wang W, Zhu Y P, Fan Q J, et al. Research progress of reducing food allergenicity by high hydrostatic pressure[J]. Journal of Nanjing Agricultural University, 2015, 38(4): 525-531. DOI: 10.7685/j.issn.1000-2030.2015.04.001 (in Chinese with English abstract) |
| [16] | Cho Y, Song K B. Effect of γ-irradiation on the molecular properties of bovine serum albumin[J]. Journal of Bioscience and Bioengineering, 2005, 100(2): 203-206. DOI: 10.1263/jbb.100.203 |
| [17] | Lee J W, Seo J H, Kim J H, et al. Comparison of the changes of the antigenicities of a hen's egg albumin by a gamma and an electron beam irradiation[J]. Radiation Physics and Chemistry, 2007, 76(5): 879-885. DOI: 10.1016/j.radphyschem.2006.06.010 |
| [18] | Gomma A, Boye J. Impact of irradiation and thermal processing on the immunochemical detection of milk and egg allergens in foods[J]. Food Research International, 2015, 74: 275-283. DOI: 10.1016/j.foodres.2015.05.023 |
| [19] | Rahaman T, Vasiljevic T, Ramchandran L. Effect of processing on conformational changes of food proteins related to allergenicity[J]. Trends in Food Science & Technology, 2016, 49: 24-34. |
| [20] |
白雨鑫, 李欣, 赵丽霞, 等. 食物过敏原结构变化的光谱学研究进展[J].
食品科学, 2012, 33(17): 284-289.
Bai Y X, Li X, Zhao L X, et al. Progress in spectroscopic research on structural changes of food allergens[J]. Food Science, 2012, 33(17): 284-289. (in Chinese with English abstract) |



