文章信息
- 王利宏, 王庆增, 鲍建军, 于嘉瑞, 陈玲, 方明, 袁文龙, 孙伟
- WANG Lihong, WANG Qingzeng, BAO Jianjun, YU Jiarui, CHEN Ling, FANG Ming, YUAN Wenlong, SUN Wei
- Hippo信号通道中Lats2基因表达与湖羊肌肉生长发育的关系
- Relationship between Lats2 gene in Hippo signaling pathway and Hu sheep muscles growth traits
- 南京农业大学学报, 2018, 41(3): 519-525
- Journal of Nanjing Agricultural University, 2018, 41(3): 519-525.
- http://dx.doi.org/10.7685/jnau.201705035
-
文章历史
- 收稿日期: 2017-07-23
2. 苏州市畜牧兽医站, 江苏 苏州 215200;
3. 徐州市睢宁县科技局, 江苏 睢宁 221200;
4. 徐州天雨牧业有限公司, 江苏 睢宁 221200
2. Animal Science and Veterinary Medicine Bureau of Suzhou, Suzhou 215200, China;
3. Technology Bureau of Suining County of Xuzhou, Suining 221200, China;
4. Xuzhou Tianyu Sheep Industry Co. Ltd., Suining 221200, China
湖羊因其肉质细嫩鲜美、营养丰富而广受消费者青睐。寻找、发现影响肌肉生长发育的候选基因, 并将其用于提高湖羊产肉性能研发, 在提高经济效益的同时, 又推动畜禽养殖业的发展。大肿瘤抑制基因2(Lats2)和Lats1、Yes相关蛋白基因(YAP1)同属于Hippo信号通路成员, Hippo通路是一个高度保守的信号传导通路, 能够对细胞的增殖、分化和死亡起到调控作用, 进而调控器官的发育。1995年, Xu等[1]首先在果蝇中发现Hippo信号通路的第一个成员肿瘤抑制因子Warts(也称Wts), Wts基因的突变能够引起果蝇眼睛和翅膀的过度生长。在2002年发现了Hippo信号通路的第二个成员Salvador(Sav)基因, Sav和Wts的同时突变能够协同促进细胞增殖和抑制细胞凋亡[2]。Hippo信号通路的其他几个成员包括Hippo(Hpo)、Mats、Yorkie(Yki)[3]。Lats2与Lats1两个基因在人类中分别定位于染色体13q11-12和6q24-51, 能够编码一种苏氨酸蛋白激酶/丝氨酸。Lats2蛋白定位于中心体, 在细胞的各个时期都起到一定作用, 在形成Aurora-a和Ajuba蛋白中起到重要作用, 同时它还能够负责积累γ-微管蛋白从而促进纺锤体的形成。此外, Lats2还参与p53的功能调控, 在与p53功能作用中起到正反馈调节作用[4]。目前, Lats2基因的研究主要集中在人类肿瘤疾病上, 如乳腺癌[5]、肺癌[6]、食管鳞状细胞癌[7]等。此外, 也有研究表明Lats2基因具有对脂肪发育和雄激素应答的调控作用[8-9], 但国内外鲜有研究Lats2基因在调控肌肉生长发育上的相关报道。本课题组前期采用Affymetrix基因芯片技术在双肌臀羊和正常表型羊肌肉组织中发现了差异表达的基因YAP1, YAP1基因与湖羊的肌肉生长发育存在一定关联性[10-11]。Lats1基因已经被证明具有将YAP磷酸化[12]与降低YAP介导的上皮细胞间质化(epithelial-mesenchymal transition, EMT)和细胞迁移[13]的能力, 对Lats1基因进一步研究, 发现Lats1基因同样与湖羊的肌肉生长发育存在一定的关系[14]。Lats2基因作为YAP1基因的上游基因, 参与调控YAP1, 因此, 我们推测Lats2基因与湖羊的肌肉生长发育也存在一定的关系。本研究通过分析Lats2基因在肌肉中的表达规律, 及其与YAP1、Lats1基因和肌肉生长发育相关基因的关联性, 探究Lats2基因在湖羊生长发育过程中的作用。
1 材料与方法 1.1 试验材料从苏州种羊场选取18只试验用湖羊, 分为3个年龄段:2、60和180日龄(各日龄公、母羊均各3只)。每个阶段的羊生长发育良好且质量相近, 进行屠宰, 采集趾长伸肌、比目鱼肌、背最长肌和腓肠肌后迅速放入液氮保存并带回实验室备用。
1.2 主要试剂PrimeScript RT试剂盒、SYBR Premix Ex Taq Ⅱ(Tli RNaseH Plus)酶购自大连TaKaRa公司; Trizol Reagent(RNA提取液)、DEPC处理水均购自上海生工生物公司。
1.3 总RNA提取与RT-qPCR引物设计和合成取100 mg肌肉组织用Trizol法提取总RNA, 并使用Oligo 7软件设计RT-qPCR引物(表 1)。
| 基因 Genes |
参考序列 Reference sequence |
引物对序列(5′→3′) Primer pairs sequences |
产物长度/bp Product length |
| GAPDH | HM043737.1 | GATGATATTGCTGCGCTCGT/CTTGCTCTGAGCCTCATCCC | 177 |
| Lats2 | KP203814 | GTTACACCCAGCTCTGCGACT/GCGTGCTCTCCCAGTTAATCACC | 129 |
| Lats1 | JQ714252 | CACTATCAACCAAAGCACCCT/CTTCTTGCAGGCTCGGCATC | 149 |
| MSTN | AF019622 | GATGACTACCACGTTACGAC/CAGTATACCTTGTACCGTCT | 238 |
| MyoG | AF433651 | GAATGCAGCTCCCATAGTGCCTC/TCCACTGTGATGGCTGTCCACGA | 152 |
| MyHC Ⅰ | AB058898 | TGCGCAAGTCAGAGAAGGAG/GCCACCCTCTCGAGACAAAA | 125 |
| MyHC Ⅱ A | AB058896 | GAGCGCATTGAAGCCCAGAA/TCTTCACCGTCACTTTCCCAC | 124 |
| MyHC Ⅱ X | AB058897 | AAGGTGACAGCCAAGACCGAAG/CCATGTCCTCGATCTTGTCAAACTT | 106 |
按照PrimeScript RT试剂盒说明书进行操作, 对总RNA进行反转录。反应体系为10 μL:总RNA 0.5 μL(100 ng·μL-1), Buffer 2 μL, Oligo dT 0.5 μL, 随机6核苷酸引物0.5 μL, RT Enzyme Mix Ⅰ 0.5 μL, ddH2O补至10 μL。37 ℃ 15 min, 85 ℃ 5 s。
1.5 实时荧光定量PCR(qPCR)以提取的骨骼肌RNA合成的cDNA为模版, 根据设计好的Lats2、Lats1、YAP1、MSTN、MyoG、MyHC Ⅰ、MyHC Ⅱ A、MyHC Ⅱ X和GAPDH qPCR引物, 检测Lats2在骨骼肌中相对表达情况。在冰上配制下列反应溶液:10 μL Premix Ex Taq(2×), 上、下游引物(10 μmol·L-1)各0.4 μL, 0.4 μL ROX Reference Dye(50×), 2 μL DNA模版, 最后用ddH2O补至20 μL。
1.6 数据处理与分析各个试验均重复3次, 利用SPSS 20.0统计分析软件对所有数据进行统计学处理。试验结果均表示为x±SD。
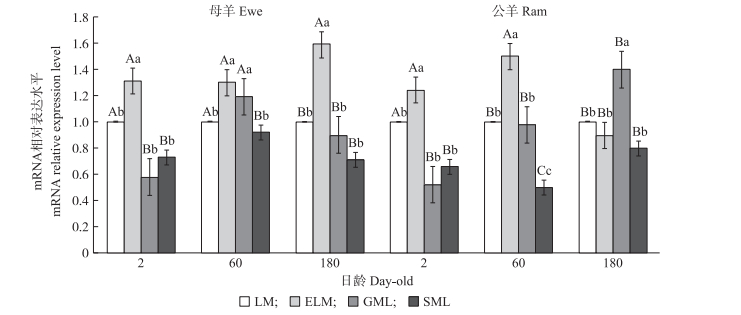
2 结果与分析 2.1 Lats2基因在湖羊肌肉中的时空表达 2.1.1 Lats2基因在不同肌肉组织中的表达由图 1可以看出:Lats2基因在趾长伸肌中的相对表达量最高, 在比目鱼肌中相对表达量最低。在2日龄公、母羊中背最长肌和趾长伸肌与其他肌肉组织存在显著或极显著差异。在各年龄阶段, 母羊的趾长伸肌与其他肌肉组织存在显著或极显著差异。
|
图 1 湖羊Lats2基因在不同肌肉组织中表达的比较 Figure 1 The comparison of Hu sheep Lats2 expression level in different muscles 不同大、小写字母分别表示同日龄同性别不同肌肉组织间的差异极显著和差异显著。LM、ELM、GML与SML分别表示背最长肌、趾长伸肌、腓肠肌与比目鱼肌。下同。 The values with different capitals and small letters mean multiple comparison of same sex, same growth stages at different muscles are extremely significantly different(P < 0.01)and significantly different(P < 0.05). LM, ELM, GML and SML mean longissimus doris muscle, extensor digitorum longus, gastrocnemius muscle and soleus muscle, respectively. The same as follows. |
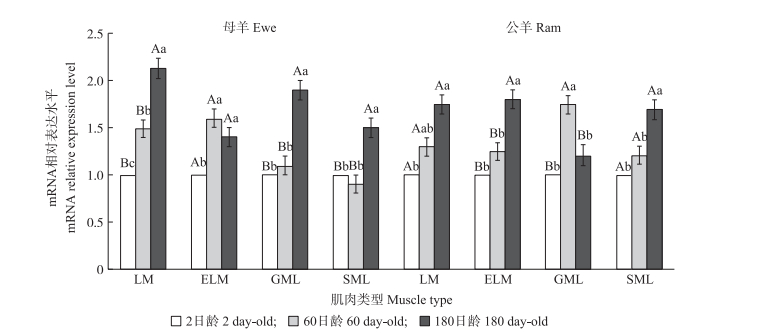
由图 2可知:在2日龄时, 除母羊比目鱼肌外, Lats2基因在各肌肉表达量最低。在180日龄时, 除母羊趾伸长肌和公羊腓肠肌外, Lats2基因在各肌肉表达量最高。在母羊趾长伸肌和公羊腓肠肌中, Lats2基因60日龄的表达量最高。在180日龄公母羊的比目鱼肌中, Lats2基因表达量与其他日龄阶段存在显著或极显著差异。
|
图 2 湖羊Lats2基因在不同生长阶段表达的差异比较 Figure 2 The comparison of Hu sheep Lats2 expression level in different growth stages 不同大、小写字母分别表示同性别同肌肉组织不同日龄间的差异极显著(P < 0.01)和差异显著(P < 0.05)。 The values with different capitals and letters means multiple comparison of same sex, same muscles at different growth stages are extremely significantly different(P < 0.01)and significantly different(P < 0.05). |
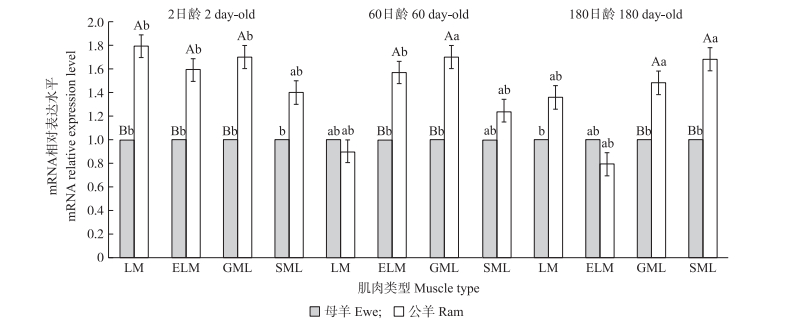
由图 3可知:除在60日龄背最长肌和180日龄趾长伸肌中, 各日龄肌肉组织中公羊的Lats2基因表达量均高于母羊, 且在2日龄背最长肌、趾长伸肌、腓肠肌, 60日龄趾长伸肌, 180日龄腓肠肌和比目鱼肌中, 公、母羊之间的表达量均存在极显著差异。
|
图 3 湖羊Lats2基因在不同性别间表达的差异比较 Figure 3 The comparison of Hu sheep Lats2 expression level in different genders |
由表 2可知:在2日龄的肌肉组织中, Lats2基因的表达与Lats1、YAP1基因相关性不显著(P > 0.05);在60日龄的肌肉组织中, Lats2基因的表达与Lats1基因存在显著正相关(P < 0.05);在180日龄的肌肉组织中, Lats2基因的表达与YAP1基因存在显著负相关(P < 0.05)。
| 基因 Gene |
2日龄2 day-old | 60日龄60 day-old | 180日龄180 day-old | |||||||||
| Lats2 | Lats1 | YAP1 | Lats2 | Lats1 | YAP1 | Lats2 | Lats1 | YAP1 | ||||
| Lats2 | 1 | 1 | 1 | |||||||||
| Lats1 | -0.053 | 1 | 0.314* | 1 | 0.159 | 1 | ||||||
| Lats1 | 0.066 | -0.164 | 1 | 0.024 | -0.175 | 1 | -0.344* | -0.147 | 1 | |||
| Note:*P < 0.05. | ||||||||||||
由表 3可知:在2日龄的肌肉组织中, Lats2基因的表达与MSTN基因之间存在显著正相关(P < 0.05);在60日龄的肌肉组织中, Lats2基因的表达与肌肉生长相关基因相关不显著(P > 0.05);在180日龄肌肉组织中, Lats2基因的表达与MyoG基因之间存在极显著正相关(P < 0.01)。
| 日龄 Day-old |
基因 Gene |
基因 Gene | |||||
| Lats2 | MSTN | MyoG | MyHC Ⅰ | MyHC Ⅱ A | MyHC Ⅱ X | ||
| 2 | Lats2 | 1 | |||||
| MSTN | 0.290* | 1 | |||||
| MyoG | -0.091 | 0.129 | 1 | ||||
| MyHC Ⅰ | -0.005 | -0.070 | -0.225 | 1 | |||
| MyHC Ⅱ A | 0.138 | 0.360* | 0.307* | -0.092 | 1 | ||
| MyHC Ⅱ X | 0.092 | 0.372** | 0.214 | -0.070 | 0.837** | 1 | |
| 60 | Lats2 | 1 | |||||
| MSTN | -0.110 | 1 | |||||
| MyoG | 0.093 | -0.013 | 1 | ||||
| MyHC Ⅰ | 0.213 | -0.068 | 0.247 | 1 | |||
| MyHC Ⅱ A | -0.063 | 0.840** | 0.081 | -0.119 | 1 | ||
| MyHC Ⅱ X | -0.107 | 0.783** | 0.158 | -0.063 | 0.908** | 1 | |
| 180 | Lats2 | 1 | |||||
| MSTN | -0.056 | 1 | |||||
| MyoG | 0.363** | -0.167 | 1 | ||||
| MyHC Ⅰ | -0.107 | 0.202 | 0.011 | 1 | |||
| MyHC Ⅱ A | 0.172 | 0.221 | 0.115 | 0.042 | 1 | ||
| MyHC Ⅱ X | -0.110 | -0.001 | -0.121 | -0.078 | -0.249 | 1 | |
| Note:*P < 0.05, **P < 0.01. | |||||||
在Hippo信号通路中, YAP1作为下游的转录激活因子, 通过YAP影响细胞增殖和凋亡的平衡, 在体外可以介导细胞接触抑制, 在体内可以调控器官发育[15]。在肌肉发育期间, MSTN首次被检测到是在胚胎E9.5的体节中, 之后一直存在于体内[16]。MSTN在哺乳动物中主要在骨骼肌中表达[17], 通过Rb依赖途径调节成肌细胞G1到S期的转换, 来控制细胞的周期进程, 其还可以通过抑制MyoD活性来调控成肌细胞分化[18-19]。MyoG在肌肉发育中起到重要作用, MyoG基因是MRF基因家族中唯一在所有骨骼肌细胞系中均可表达的基因[20]。研究发现在小鼠中靶向沉默MyoG基因, 造成成肌细胞分化失败, 导致小鼠死亡[21]。近年来, 肌球蛋白重链(MyHC)亚型已被用于测定骨骼肌纤维类型的组成。在绵羊中, 成年羊主要表达的MyHC类型为Ⅰ型、ⅡA型和ⅡX型, 而MyHC Ⅱ B亚型表达很少, 几乎检测不到[22]。本研究通过分析Lats2基因在肌肉中的表达变化规律, 及其与肌肉生长发育相关基因的关联性, 探究Lats2基因对湖羊生长发育的影响。
3.1 Lats2基因在肌肉中的时空表达规律Lats2基因通过介导心肌细胞Mst 1来负调节心肌细胞生长[23]。Zhao等[24]研究发现敲除Lats1/2将引起未被磷酸化的YAP1从细胞质迁移到细胞核中, 促进下游目标基因的表达, 从而促进细胞增殖。综合本试验结果, Lats2基因可能通过抑制YAP1基因的表达, 阻止成肌细胞的形成, 随湖羊日龄增加Lats2基因表达量的增加, 逐渐抑制肌肉的生长, 最终达到一个生长发育的平衡点。此外, 趾长伸肌具有伸趾、助足背屈的作用, Lats2基因的高表达可能参与趾和足背的正常发育; 在不同性别中, Lats2基因的表达整体表现为公羊高于母羊, 且普遍存在显著或极显著差异, 这表明Lats2基因的表达可能受性腺组织发育的影响, 在不同性别间存在一定差异。Aragona等[25]发现敲除Lats1/2后, YAP1的活性增强, 并且促进肌动蛋白的聚合。初生幼畜在2日龄后开始快速生长, 生长早期Lats2基因的低表达量可能尚不能抑制湖羊幼畜肌肉的生长发育; 在180日龄的肌肉组织中, 幼畜处于快速生长阶段后期, YAP1基因可能受到Lats2基因的抑制, 肌动蛋白的聚合减少, 促使幼畜生长发育逐渐趋于平衡, 这完全符合Zhao等[24]、Aragona等[25]以及本试验“Lats2基因可能通过抑制YAP1的活性, 调控肌肉生长发育”的观点。
3.2 Lats2基因与MSTN、MyoG、MyHC Ⅰ、MyHC Ⅱ A和MyHC Ⅱ X基因表达的相关性MSTN基因具有抑制成肌细胞的增殖功能[26]。姚力丹等[27]对新疆5个品种不同日龄羊的MSTN基因mRNA表达水平进行分析后发现:初生时, 阿勒泰羊、哈萨克羊、巴什拜羊MSTN基因mRNA表达水平均明显低于其他各日龄; 吐来力江·哈木太[28]对阿勒泰羊的研究也得出相同结论。两者的研究结果进一步说明本试验结果的准确性, Lats2基因与MSTN在湖羊幼畜生长早期的表达量较低, 且可能具有同样的负调控肌细胞增殖的作用; MyoG基因具有促进细胞分化的功能[22], 180日龄幼畜处于快速生长后期, Lats2基因对细胞增殖活性的抑制作用与MyoG基因对细胞分化的促进作用可能形成一个动态平衡, 促使幼畜生长发育逐步趋向相对稳定, 也进一步表明Lats2基因可能对肌肉生长发育具有下调作用, 可作为肌肉生长发育的候选基因。
总之, Hippo信号通道中Lats2基因的表达受性别、生长阶段和不同肌肉组织的影响, 通过抑制YAP1基因的表达而下调肌肉生长发育, 可作为肌肉生长发育的候选基因。
| [1] | Xu T, Wang W, Zhang S, et al. Identifying tumor suppressors in genetic mosaics:the Drosophila lats gene encodes a putative protein kinase[J]. Development, 1995, 121(4): 1053-1063. |
| [2] | Tapon N, Harvey K F, Bell D W, et al. Salvador, promotes both cell cycle exit and apoptosis in Drosophila, and is mutated in human cancer cell lines[J]. Cell, 2002, 110(4): 467-478. DOI: 10.1016/S0092-8674(02)00824-3 |
| [3] | Harvey K F, Pfleger C M, Hariharan I K. The Drosophila, Mst Ortholog, hippo, restricts growth and cell proliferation and promotes apoptosis[J]. Cell, 2003, 114(4): 457-467. DOI: 10.1016/S0092-8674(03)00557-9 |
| [4] | Aylon Y, Nbesserglick Y. Silencing of the Lats2 tumor suppressor overrides a p53-dependent oncogenic stresscheckpoint and enables mutant H-Ras-driven cell transformation[J]. Oncogene, 2009, 28(50): 4469-4479. DOI: 10.1038/onc.2009.270 |
| [5] | Takahashi Y, Miyoshi Y, Takahata C, et al. Down-regulation of Lats1 and Lats2 mRNA expression by promoter hyper-methylation and its association with biologically aggressive phenotype in human breast cancers[J]. Clin Cancer Res, 2005, 11(4): 1380-1385. DOI: 10.1158/1078-0432.CCR-04-1773 |
| [6] | Wang Y, Dong Q, Zhang Q, et al. Over expression of yes-associated protein contributes to progression and poor prognosis of non-small-cell lung cancer[J]. Cancer Sci, 2010, 101(5): 1279-1285. DOI: 10.1111/cas.2010.101.issue-5 |
| [7] | Mura M T, Imoto I, Matsui T, et al. YAP is a candidate oncogene for esophageal squamous cell carcinoma[J]. Carcino-genesis, 2011, 32(3): 389-398. DOI: 10.1093/carcin/bgq254 |
| [8] |
安杨. Lats2通过Hippo信号通路调控脂肪细胞增殖和分化的分子机制研究[D]. 北京: 中国农业大学, 2013.
An Y. Research on the molecular mechanisms of Lats2 modulates adipocyte proliferation and differentiation via Hippo signaling[D]. Beijing: China Agricultural University, 2013(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-10019-1014111812.htm |
| [9] | Powzaniuk M, McElwee W S, Vogel R L, et al. The Lats2/KPM tumor suppressor is a negative regulator of the androgen receptor[J]. Mol Endocrinol, 2004, 18(8): 2011-2023. DOI: 10.1210/me.2004-0065 |
| [10] |
李达. 绵羊YAP1基因与肌肉生长相关基因表达相关分析以及载体构建的研究[D]. 扬州: 扬州大学, 2013.
Li D. Research on expression correlation analysis between sheep YAP1 and other genes related with muscle growth and the construction of YAP1 eukaryotic expression vector[D]. Yangzhou: Yangzhou University, 2013(in Chinese with English abstract). http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=y2419751 |
| [11] |
鲍建军, 苏锐, 王庆增, 等. Smads与Hippo通道中YAP1基因在湖羊肌肉组织中时空表达研究及关联分析[J].
中国农业科学, 2016, 49(11): 2203-2213.
Bao J J, Su R, Wang Q Z, et al. Study on the temporal and spatial expression and correlation analysis of smads and YAP1 gene in the hippo pathway in sheep muscle tissue[J]. Scientia Agricultura Sinica, 2016, 49(11): 2203-2213. DOI: 10.3864/j.issn.0578-1752.2016.11.016 (in Chinese with English abstract) |
| [12] | Hao Y, Chun A, Cheung K, et al. Tumor suppressor Lats1 is a negative regulator of oncogene YAP[J]. J Biol Chem, 2008, 283: 5496-5509. DOI: 10.1074/jbc.M709037200 |
| [13] | Zhang J, Ji J Y, Yu M, et al. YAP-dependent induction of amphiregulin identifies a non-cell-autonomous component of the Hippo pathway[J]. Nat Cell Biol, 2009, 11: 1444-1450. DOI: 10.1038/ncb1993 |
| [14] |
张玉龙. Hippo信号通道中Lats1基因对湖羊肌肉生长性状遗传调控的初步研究[D]. 扬州: 扬州大学2013.
Zhang Y L. Preliminary study of the genetic regulation of Hu sheep muscle growth traits in Lats1 gene in Hippo signal channel[D]. Yangzhou: Yangzhou University, 2013(in Chinese with English abstract). http://cdmd.cnki.com.cn/Article/CDMD-11117-1014356015.htm |
| [15] | Dong J, Feldmann G, Huang J, et al. Elucidation of a universal size-control mechanism in drosophila, and mammals[J]. Cell, 2007, 130(6): 1120-1133. DOI: 10.1016/j.cell.2007.07.019 |
| [16] | Mcpherron A C, Lawler A M, Lee S J. Regulation of skeletal muscle mass in mice by a new TGF-beta superfamily member[J]. Nature, 1997, 387(6628): 83-90. DOI: 10.1038/387083a0 |
| [17] | Kocamis H, Mcfarland D C, Killefer J, et al. Temporal expression of growth the factor genes during myogenesis of satellite cells derived from the biceps femoris and pectoralis major muscles of the chicken[J]. J Cell Physiol, 2001, 186(1): 146-152. DOI: 10.1002/(ISSN)1097-4652 |
| [18] | Langley B, Thomas M, Bishop A, et al. Myostatin inhibits myoblast differentiation by down-regulating MyoD expression[J]. Journal of Biological Chemistry, 2002, 277(51): 49831-49840. DOI: 10.1074/jbc.M204291200 |
| [19] | Thomas M, Langley B, Berry C, et al. Myostatin, a negative regulator of muscle growth, functions by inhibiting myoblast proliferation[J]. Journal of Biological Chemistry, 2000, 275(51): 40235-40243. DOI: 10.1074/jbc.M004356200 |
| [20] | Hasty P, Bradley A, Morris J H, et al. Muscle deficiency and neonatal death in mice with a targeted mutation in the myogenin gene[J]. Nature, 1993, 364: 501-506. DOI: 10.1038/364501a0 |
| [21] | Rescan P Y, Ralliere C, Lebret V, et al. Analysis of muscle fibre input dynamics using a myog:GFP transgenic trout model[J]. Journal of Experimental Biology, 2015, 218(8): 1137-1142. DOI: 10.1242/jeb.113704 |
| [22] | Hemmings K M, Parr T, Daniel Z C, et al. Examination of myosin heavy chain isoform expression in ovine skeletal muscles[J]. Journal of Animal Science, 2009, 87(12): 3915-3922. DOI: 10.2527/jas.2009-2067 |
| [23] | Matsui Y, Nakano N, Shao D, et al. Lats2 is a negative regulator of myocyte size in the heart[J]. Circulation Research, 2008, 103(11): 1309-1318. DOI: 10.1161/CIRCRESAHA.108.180042 |
| [24] | Zhao B X, Wei X M, Li W Q, et al. Inactivation of YAP oncoprotein by the Hippo pathway is involved in cell contact inhibition and tissue growth[J]. Genes Dev, 2007, 21(21): 2747-2761. DOI: 10.1101/gad.1602907 |
| [25] | Aragona M, Panciera T, Manfrin A, et al. A mechanical checkpoint controls multicellular growth through YAP/TAZ regulation by actin-processing factors[J]. Cell, 2013, 154(5): 1047-1059. DOI: 10.1016/j.cell.2013.07.042 |
| [26] | Lee S J, Mcpherron A C. Myostatin and the control of skeletal muscle mass[J]. Curr Opin Genet Dev, 1999, 9(5): 604-607. DOI: 10.1016/S0959-437X(99)00004-0 |
| [27] |
姚力丹, 祖玲玲, 马晓燕, 等. 新疆5个品种羊不同日龄MSTN基因mRNA表达水平及其与生长性状相关性分析[J].
中国畜牧兽医, 2016, 433(2): 462-470.
Yao L D, Zu L L, Ma X Y, et al. Different months of MSTN gene mRNA expression levels and their correlation with growth traits in five Xinjiang local sheep[J]. China Husbandry and Veterinary Medicine, 2016, 433(2): 462-470. (in Chinese with English abstract) |
| [28] |
吐来力江·哈木太. MSTN/Smad信号通路与阿勒泰羊肌肉生长发育、产肉性能关联性的研究[D]. 乌鲁木齐: 新疆农业大学, 2014.
Tulailijiang Hamutai. MSTN3/Smad signaling pathways and Altai sheep muscle growth and comparative study of meat performance relevance[D]. Urumqi: Xinjiang Agricultural University, 2014(in Chinese with English abstract). http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2697979 |




